52例小肠间质瘤的临床、病理及影像学特征
龚 程, 谭诗云, 丁一娟, 孙 军, 赵 亮, 王则胜
武汉大学人民医院1.消化内科;2.病理科,湖北 武汉 430060
52例小肠间质瘤的临床、病理及影像学特征
龚 程1, 谭诗云1, 丁一娟1, 孙 军1, 赵 亮1, 王则胜2
武汉大学人民医院1.消化内科;2.病理科,湖北 武汉 430060
目的 探讨小肠间质瘤(small intestinal stromal tumor, SIST)的临床、病理及影像学特征,为SIST的临床诊治提供经验。方法 回顾性分析2010年3月-2014年3月武汉大学人民医院消化内科收治的经手术病理及免疫组化确诊的52例SIST患者的临床资料,总结其诊断及治疗的临床特征。结果 术后6例患者出现消化道出血、伤口感染、电解质紊乱等并发症,经抗炎、止血及补液等对症支持治疗后均好转出院,无围手术期死亡病例。术后病理显示,肿瘤生长方式为腔内型或腔外型,组织形态均为小肠梭形细胞肿瘤;免疫组化显示,DOG-1及CD117阳性率最高。结合术后病理结果进行生物学危险度分级显示,中-低度危险性有20例,高度危险性有32例。42例中、低度危险性及部分高度危险性患者因个人原因术后未接受进一步药物治疗,未见肿瘤复发及转移。10例高度危险性患者术后给予口服甲磺酸伊马替尼IM辅助治疗,4例因病程较长、瘤体直径大、肿瘤出现破裂出血或坏死等原因于术后6~36个月出现复发转移;余6例患者随访未见肿瘤复发及转移。另22例高度危险性患者因经济原因仅行术后动态CT观察。结论 SIST临床上以消化道出血和腹痛为首发症状;双气囊小肠镜检查诊断是术前不可缺少的检查方法,如术前合理选择联合腹部CT小肠造影(CTE)或胶囊内镜,能够降低小肠镜操作难度,提供其发现率;DOG-1、CD117、CD34均为特异性病理标志物;外科手术切除为首选治疗方法,术后病理及免疫组化可对生物危险度进行分级,高度危险者应追加分子靶向治疗。
小肠;间质瘤;双气囊小肠镜;临床病理
胃肠间质瘤(gastrointestinal stromal tumor, GIST)是消化系统常见的间叶源性肿瘤,最常发生于胃(60%),其次是小肠(35%)[1]。小肠间质瘤(small intestinal stromal tumor, SIST)恶性倾向相对其他部位高,临床起病隐匿,症状缺乏特异性,且由于小肠解剖位置的特殊性,使得各项检查难度较大,早期诊断困难,出现症状时往往肿瘤较大或已侵犯周围器官发生转移,尤其是合并其他疾病时,易误诊漏诊,甚至可出现消化道大出血、肠梗阻、穿孔及坏死等情况而危及生命。本研究回顾性分析2010年3月-2014年3月武汉大学人民医院消化内科收治的经手术病理及免疫组化确诊的52例SIST患者的临床资料,总结SIST的临床、病理及影像学特征,为SIST的临床诊治提供参考。
1 资料与方法
1.1 一般资料 2010年3月-2014年3月武汉大学人民医院消化内科收治的52例SIST患者,男32例,女20例,男女比例1.6∶1;年龄18~73岁(中位年龄53岁);经手术切除病理及免疫组化确诊51例,经手术活检确诊1例。SIST发生于空肠24例(46.2%),回肠17例(32.7%),十二指肠8例(15.4%),空回肠交界处2例(3.8%),肠道多发1例(1.9%)。
1.2 方法 回顾性分析52例SIST患者的临床诊断及治疗资料、影像和病理特征。
2 结果
2.1 临床表现 52例SIST患者中以消化道出血为首发症状35例(67.3%),黑便居多,仅1例呕血;血红蛋白(Hb)<60 g/L 16例(30.8%),其中Hb为30~40 g/L者4例(7.7%),1例出现晕厥。腹痛18例(34.6%),以脐周腹痛为主10例(19.2%)。肠梗阻表现者17例(呕吐9例,17.3%;腹胀8例,15.4%);腹部包块4例(7.7%)。合并其他疾病检查发现2例(3.8%),体检发现2例(3.8%)。全组患者2例表现为盆腔包块,而误诊为妇科肿瘤。
2.2 影像学及内镜检查结果
2.2.1 胃镜及双气囊小肠镜检查结果:5例患者行胃镜检查均提示占位性病变,病变部位位于十二指肠球部、降部或水平部,均表现为黏膜下隆起,表面可见溃疡,2例表现为胃黏膜贫血像,1例为隆起病变,表面形成巨大溃疡(见图1)。22例患者行双气囊小肠镜检查,21例提示黏膜下隆起或占位性病变,1例提示小肠重复畸形;16例黏膜表面出现溃疡,6例表现为黏膜出血肿胀;15例位于空肠,6例位于回肠,1例位于空回肠交界处(见图2)。
2.2.2 超声内镜检查结果:3例进行了超声内镜检查,超声内镜下表现为起源于固有肌层的间质瘤,典型病例见图3。

图1 小肠镜示距Treitz韧带约1.5 cm处一大小约2.0 cm×2.0 cm的隆起病灶,中央可见凹陷,表面可见血管网丰富;图2 胃镜示十二指肠球部前壁一大小约2.5 cm×3.0 cm巨大溃疡,隐约可见瘘口;图3 超声胃镜示病灶处一大小约3.0 cm×3.0 cm的无回声病灶,起源于固有肌层
Fig 1 According to the endoscopy, an apophysis lesion about 2.0 cm×2.0 cm was seen about 1.5 cm distance from Treitz ligament, some hollows in the center and rich vascular network were seen on the surface; Fig 2 According to the gastroscopy, a huge ulcer about 2.5 cm×3.0 cm was seen on the duodenal bulb front wall, the fistula was faintly visible; Fig 3 According to the ultrasound gastroscopy, an anechoic lesion about 3.0 cm×3.0 cm was seen, originated from the inherent muscular layer
2.2.3 胶囊内镜检查结果:3例患者行胶囊内镜检查发现2例空肠处大小约3 cm×4 cm的球形隆起样病灶,1例回肠处大小约2 cm×3 cm菜花样病灶,间质瘤表面有溃疡,可见新鲜出血,均未发生胶囊内镜嵌顿。
2.2.4 腹部CT小肠造影(CT enterography, CTE)检查结果:28例患者行腹部小肠CTE检查,12例提示SIST,14例提示小肠占位性病变,1例提示肠扭转,1例提示十二指肠胰头区结构模糊、十二指肠空肠套叠及空肠套空肠,其中6例可见肿瘤侵犯周围组织器官,3例可见腹腔转移灶,1例可见肝脏转移灶,2例可见囊性坏死或破裂出血灶。
2.3 手术治疗结果 52例SIST患者中,51例行手术治疗,1例仅行手术活检。手术方式:1例巨大十二指肠球部溃疡伴病灶周边广泛转移粘连,无法切除,仅行腹腔镜检查加取活检术,病理证实后直接口服甲磺酸伊马替尼(IM,格列卫)并随访;1例十二指肠降段巨大间质瘤因肿瘤较大,手术治疗风险高,给予口服IM 400 mg/d辅助化疗4个月后行剖腹探查术+小肠肿瘤切除术+肠套叠复位术+腹腔引流术;4例行十二指肠肿瘤切除术;2例分别行腹腔镜和开腹胃远端大部分切除术;32例行剖腹探查术+小肠肿瘤切除术+肠吻合术,其中2例可见SIST破裂出血,1例因小肠重复畸形另行小肠重复畸形切除术,1例因合并乙状结肠癌另行结肠癌根治术;4例行腹腔镜探查+小肠肿瘤切除术+肠吻合术;4例因侵润周围器官行周围脏器联合切除术;4例因腹膜种植行姑息切除+剖腹探查术+腹腔包块切除术+肠切除肠吻合术。术中发现肠梗阻7例,肠套叠4例,肠扭转1例,肠坏死1例。另外发现肝转移1例,腹腔及盆腔广泛转移5例,术后病理证实淋巴结累及2例。此外,2例术前误诊为妇科肿瘤的患者,行剖腹探查时发现子宫及双侧附件未见明显异常。
2.4 术后并发症及术后病理结果 术后6例(11.5%)患者出现消化道出血、伤口感染、电解质紊乱等并发症,经抗炎、止血及补液等对症支持治疗后均好转出院,平均住院时间21.4(10~40)d,无围手术期死亡病例。52例SIST均由手术病理及免疫组化确诊,大体形态上生长方式为腔内型或腔外型(见图4),组织形态上均为小肠梭形细胞肿瘤(见图5)。

图4 大体标本为一大的实性肿块,切面为新鲜鱼肉样,可见出血、坏死及囊性变
Fig 4 Gross photo was a large solid masses in resected small bowel, the cut surface of the tumor was fish-fresh with hemorrhage, necrosis, and cystic softening

图5 小肠黏膜下梭形细胞肿瘤(HE染色 100×); 图6 免疫组化染色示CD117阳性(100×); 图7 免疫组化染色示DOG-1阳性(100×)
Fig 5 Small intestine submucosal spindle cell tumor (HE staining 100×); Fig 6 Immunohistochemical staining showed CD117(+)(100×); Fig 7 Immunohistochemical staining showed DOG-1(+)(100×)
2.5 免疫组化结果 52例行免疫组化结果显示,其中DOG-1及CD117阳性率最高,分别为96.2%、82.7%,其次为CD34(67.3%),SMA阳性率为26.9%,S-100阳性率仅3.8%,Desmin均为阴性(见图6、图7,表1)。
表1 52例SIST免疫组化
Tab 1 The immunohistochemical markers of 52 cases of SIST

受检项目例数阳性例数阳性率(%)DOG-1525096.2CD117524382.7CD34523567.3SMA521426.9S-1005223.8Desmin5200
2.6 生物学危险度分级 既往采用美国国立卫生署(NIH)的生物学危险度分级[2],根据肿瘤的最大直径及每50个高倍镜视野下的核分裂数进行生物学危险度分级,2008年,Joensuu[3]对NIH危险度分级系统进行了修改,将原发肿瘤部位和肿瘤破裂也作为预后的基本评估指标。本组52例病理及免疫组化分析中,肿瘤直径≤5 cm者26例(50.0%),>5 cm者26例(50.0%),其中>10 cm者3例,最大直径15 cm;核分裂相≤5/50 HPF 41例(78.8%),核分裂相>5/50 HPF 11例(21.2%);中、低度危险性20例(38.5%),高度危险性32例(61.5%)(见表2)。
表2 52例SIST生物危险度分级
Tab 2 The biological risk assessment stratification of 52 cases of SIST
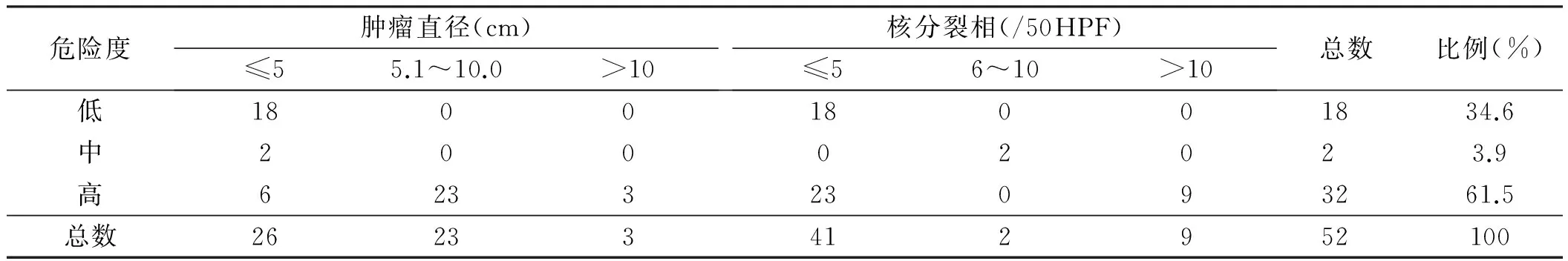
危险度肿瘤直径(cm)≤55.1~10.0>10核分裂相(/50HPF)≤56~10>10总数比例(%)低18001800 1834.6中200020 23.9高62332309 3261.5总数262334129 52100
2.7 随访 42例中、低度危险性及部分高度危险性患者因个人原因术后未接受进一步药物治疗,仅进行动态影像学观察,中位随访23(1~48)个月,未见肿瘤复发及转移。10例高度危险性SIST患者术后给予口服IM辅助治疗,由于病程较长、瘤体直径大、肿瘤出现破裂出血或坏死等原因,1例术后半年出现肝转移,2例术后2年出现复发,1例术后3年出现肝转移;余6例患者中位随访14(5~46)个月,未见肿瘤复发及转移。另22例高度危险性SIST患者由于经济原因仅行术后动态CT观察。所有病例均存活至今。
3 讨论
SIST的好发年龄为50~60岁,以中老年人为主,且无性别上的明显差异,好发部位是空肠,其次是十二指肠及回肠,本组病例的一般资料特征符合文献报道[4]。SIST与肿瘤的大小、位置及性质密切相关,最常见的临床表现为消化道出血,主要是因为肿瘤位于肌层,向内可至黏膜下层或固有层,向外可至浆膜下层,由此可导致黏膜表面溃疡形成,引起出血,破溃出血速度较小,多表现为黑便,极少呕血[5]。出血量较大时贫血可表现为头晕、乏力、全身皮肤黏膜及巩膜苍白、甚至晕厥休克。腹痛多呈脐周间断隐痛,无规律性,可因肿瘤破裂出血、坏死或肠梗阻穿孔而出现局限性或全腹部弥漫性持续性疼痛,同时伴发热、全身感染中毒休克等症状。肿瘤较大时可于体格检查时直接触及腹部包块。
SIST早期诊断主要依赖于内镜及相关影像学检查,但小肠解剖位置特殊,普通胃镜及结肠镜难以到达,双气囊小肠镜操作难度、检查风险相对较大,所以早期诊断较困难。SIST最主要检查方法有消化道造影、小肠CTE、胶囊内镜及双气囊小肠镜等,本组资料以双气囊小肠镜检查最多,其优势在于内镜下能直视病灶大小,联合病理活检有助于明确诊断,准确率高,经口和经肛进镜方式相结合可以完成全消化道完整、彻底、无盲区的检查[6],具有清晰、直视、可靠、可控、可重复性等特点,能清楚显示肿瘤部位、大小、黏膜表面情况等,对小肠肿瘤有较高的检出率,可达75%~90%,是诊断黏膜或黏膜下肿瘤的良好方法[7],小肠镜还可用染色剂进行标记,对术中定位有指导意义,但操作难度大,部分患者难以耐受,文献报道[8-9]双气囊小肠镜检查上下会师率约86%,本院上下会师率约83%,与之相当。胶囊内镜是一项安全、简便、无创、舒适的小肠疾病检查方法,但由于胶囊移动的不可控性,肠道内气体、液体对其的干扰,清晰度及视野有限等,使得胶囊内镜的整体阳性率约为50%~65%,其最大的缺点就是重复性差以及无法获取病检,不能对可疑病灶反复观察,目前被认为是小肠疾病的一种筛选性手段[10]。小肠CTE是近几年发展起来的新技术,不仅可以清楚显示肿瘤的整体情况,且定位准确[11],尤其是对腔外生长型的SIST有明显的优势,同时可为双气囊小肠镜进镜方式的选择提供很大的帮助,可参照Fletcher及Miettinen等[12]的标准对SIST的良恶性进行初步判断。本组28例行小肠CTE检查结果,与Sandrasegaran等[13]报道邻近器官受侵或出现转移(肝脏、网膜及肠系膜)是SIST的CT诊断中最确定的恶性征象的观点相符。小肠CTE优点:(1)操作简便,风险相对低;(2)患者依从性好,大部分患者均能耐受;(3)受基础疾病影响小。缺点:(1)一次性大量饮水,部分患者难以耐受,特别是有小肠梗阻患者,要适量控制饮水量;(2)假阳性率高。因小肠CTE假阳性率高,故最终确诊还有赖于双气囊小肠镜[14]。由于双气囊小肠镜检查需要相应设备,且有一定操作难度和风险,不是每家医院都能开展,因此应根据患者病情和医院条件来选择检查方法。通常术前可先行小肠CTE或胶囊内镜检查,一方面,上述检查风险相对较低且患者耐受性好,检查明确后可直接手术治疗;另一方面,通过上述初步检查,对病变部位有基本提示后,可降低双气囊小肠镜操作难度和风险,进一步提高小肠镜诊断水平。当出现明显临床症状疑诊小肠疾病时,应根据患者基本情况、耐受程度和医院的检查条件,选择合适检查手段,临床上常常联合多种影像学检查方法,提高临床诊断水平。
SIST的最终确诊依赖病理及免疫组化结果。大体肉眼观通常为有一完整较薄包膜的实性肿块,形态大小均不一,肿瘤较大时可出现囊性变、黏液变、钙化,也可出现出血、坏死。组织形态上一般以梭形细胞为主。本组病例免疫组化检查示,CD117和CD34在GIST中呈弥漫性强阳性表达,是最具特征的标志物,而SMA和Demsin是两项肌源性标志物,S-100作为神经源性标志物,在GIST中呈阴性或低表达,临床上常联合应用CD117和CD34这两项指标,同时结合SMA、Demsin及S-100等标志物以辅助SIST的鉴别诊断,分别用于鉴别平滑肌瘤、平滑肌肉瘤及神经鞘膜瘤[15]。近年来,有研究[16]发现DOG-1是一种新型的更具有特异性和敏感性的诊断标志物,在GIST中特异高表达。本组病例DOG-1阳性率高达96.2%,高于CD117阳性率82.7%。但这些免疫组化标志物与生物学危险性无关,而肿瘤大小和核分裂数目则为主要因素。
目前,外科手术是公认的最有效的唯一有可能治愈SIST的首选方法,为防止局部复发和转移,完整的肿块切除和切缘阴性是手术的基本原则,如有周围脏器浸润,可行联合脏器切除术,因SIST主要经血行转移至肝脏及腹腔种植转移,极少侵犯淋巴结,故无需常规淋巴结清扫[17]。由于SIST包膜较薄,且有一定张力,手术中一旦破裂,可引起腹腔广泛播散,所以手术过程应该特别小心避免肿瘤包膜的破溃,否则便失去了根治性治疗意义。双镜联合或腹腔镜手术具有创伤小、术后恢复快及切口美观等优点,适用于游离、没有累及周围脏器、直径≤5 cm的GIST[18]。但操作不成熟容易引起肿瘤破裂造成腹腔种植转移。
SIST恶性倾向高,术后复发或转移率高,据统计术后复发转移率可高达85%[19],对传统的放、化疗均不敏感,IM作为新一代的分子靶向治疗药物,为无法切除、复发或转移的GIST患者带来希望[20]。目前已经公认,GIST患者术后长期口服IM可取得良好的远期疗效,对于肿瘤较大难以手术切除的SIST,还可口服IM待肿瘤降期后再行手术治疗[21]。尽管分子靶向药物治疗疗效显著,但其重大不良反应和耐药问题仍是临床医生亟待解决的问题,且由于其费用高,难以普及,多数患者因此放弃术后靶向治疗。SIST患者5年总体存活率约为50%[22],总体来说,预后不佳,影响其预后的主要因素:肿瘤大小、核分裂数目、有无侵犯周围器官及远处转移、是否手术完整切除及IM辅助治疗等,其中肿瘤大小和核分裂数目与其预后密切相关。本组患者中42例接受术后动态观察,仅有10例恶性SIST患者术后给予IM辅助治疗。虽然大部分患者随访过程中暂无病情变化,对于高危患者应劝其手术后接受IM治疗。密切随访和IM治疗应该是更有效的方法之一。
综上,SIST临床发病率不低,恶性倾向高,临床症状不典型,解剖位置特殊,缺乏有效的影像学及内镜检查方法,早期诊断困难,应避免漏诊误诊,双气囊小肠镜检查诊断是术前不可缺少的检查方法,如术前合理选择联合小肠CTE或胶囊内镜,能减少小肠镜操作难度,提高其发现率;病理及免疫组化技术是确诊SIST的金标准,其中DOG-1、CD34、CD117均为特异性病理标志物;外科手术切除为首先治疗方法,术后病理及免疫组化可对生物危险度进行分级,高度危险者应追加分子靶向治疗;临床医师应及时选择合理影像学检测手段和治疗方法,做到早发现、早诊断、早治疗,以提高患者的生存率和生存质量。
[1]Miettinen M, Lasota J. Gastrointestinal stromal tumors: review on morphology. molecular pathology, prognosis, and differential diagnosis [J]. Arch Pathol Lab Med, 2006, 130(10): 1466-1478.
[2]Flecher CD, Berman JJ, Corless C, et al. Diagnosis of gastrointestinal stromal tumors: a consensus approach [J]. Hum Pathol, 2002, 33(5): 459-465.
[3]Joensuu H. Risk stratification of patients with gastrointestinal stromal tumor [J]. Hum Pathol, 2008, 39(10): 1411-1419.
[4]Miettinen M. Sobin LH, Lasota J. Gastrointestinal stromal tumors of the stomach: a clinicopathologic, immunohistochemical, and molecular genetic study of 1765 cases with long-term follow-up [J]. Am J Surg Pathol, 2005, 29(1): 52-68.
[5]Miettinen M, Makhlouf H, Sobin LH, et al. Gastrointestinal stromal tumors of the jejunum and ileum: a clinicopathologic,immunohistochemical, and molecular genetic study of 906 cases before imatinib with long-term follow-up [J]. Am J Surg Pathol, 2006, 30(4): 477-489.
[6]Yamamoto H, Sekine Y, Sato Y, et al. Total enteroscopy with a nonsurgical steerable double-balloon method [J]. Gastrointest Endosc, 2001, 53(2): 216-220.
[7]Zhong J, Ma T, Zhang C, et al. A retrospective study of the application on double-balloon enteroscopy in 378 patients with suspected small-bowel diseases [J]. Endoscopy, 2007, 39(3): 208-215.
[8]Ekbom A. The epidemiology of IBD: a lot of data but little knowledge. How shall we proceed? [J]. Inflamm Bowel Dis, 2004, 10(Suppl 1): S32-S34.
[9]Sun B, Shen R, Cheng S, et al. The role of double-balloon enteroscopy in diagnosis and management of incomplete small-bowel obstruction [J]. Endoscopy, 2007, 39(6): 511-515.
[10]Lewis BS. How to read wireless capsule endoscopic images: tips of the trade [J]. Gastrointest Endosc Clin N Am, 2004, 14(1): 11-16.
[11]Ulusan S, Koc Z, Kayaselcuk F. Gastrointestinal stromal tumour: CT findings [J]. Br J Radiol, 2008, 81(968): 618-623.
[12]Anzidei M, Napoli A, Zini C, et al. Malignant tumours of the small intestjne: a revjew of histopathology, multidetector CT and MRI aspects [J]. Br J Radiol, 2011, 84(1004): 677-690.
[13]Sandrasegaran K,Rajesh A, Rydberg J, et al. Gastrointestinal stromal tumors:clinical,radiologic, and pathologic features [J]. AJR, 2005, 184(3): 803-811.
[14]Yamamoto H, Kita H, Sunada K, et al. Clinical outcomes of double balloon enteroscopy for the diagnosis and treatment of small intestinal diseases [J]. Clin Gastroenterolol Hepatol, 2004, 2(11): 1010-1016.
[15]Chirieac LR, Trent JC, Steinert DM, et al. Correlation of immunophenotype with progression-free survival in patients with gastrointestinal stromal tumor treated with imatinib mesylate [J]. Cancer, 2006, 107(9): 2237-2244.
[16]West RB, Corless CL, Chen X, et al. The novel marker,DOG1,is expressed ubiquitously in gastrointestinal stromal tumor irrespective of C-KIT or PDGFRA mutation status [J]. Am J Pathol, 2004, 165(1): 107-113.
[17]Reichardt P, Reichardt A. Gastrointestinal stromal tumour(GIST):current standards in multimodal management [J]. Zentralbl Chir, 20l1, 136(4): 359-363.
[18]Tarcoveanu E, Dimofte G, Vasilescu A, et al. Laparoscopic management of gastrointestinak stromal tumours [J]. Acta Chir Belg, 2010, 110(3): 295-302.
[19]Neuhaus SJ, Clark MA, Hayes AJ, et al. Surgery for gastrointestinal stromal tumour in the post-imatinib era [J]. ANZ J Surg, 2005, 75(3): 165-172.
[20]Grignol VP, Termuhlen PM. Gastrointestinal stromal tumor surgery and adjuvant therapy [J]. Surg Clin North Am, 2011, 91(5): 1079-1087.
[21]Cassier PA, Blay JY. Imatinib mesylate for the treatment of gastrointestinal stromal tumor [J]. Expert Rev Anticancer Ther, 2010, 10(5): 623-634.
[22]Rubin BP, Heinrich MC, Corlrss CL. Gastrointestinal stromal tumour [J]. Lancet, 2007, 369(9574): 1731-1741.
(责任编辑:李 健)
Clinical, pathological and imaging characteristics of 52 cases of small intestinal stromal tumor
GONG Cheng1, TAN Shiyun2, DING Yijuan1, SUN Jun1, ZHAO Liang1, WANG Zesheng2
1.Department of Gastroenterology;2.Department of Pathology, Renmin Hospital of Wuhan University, Wuhan 430060, China
Objective To discuss the clinical, pathological, and imaging characteristics of small intestinal stromal tumor (SIST), so as to provide experience for the clinical diagnosis and treatment. Methods Fifty two cases of SIST in Department of Gastroenterology, Renmin Hospital of Wuhan University from Mar. 2010 to Mar. 2014 were analyzed retrospectively, all patients were confirmed by surgical pathology and immunohistochemistry, the clinical characteristics of diagnosis and treatment were summarized. Results After operation, 6 cases appeared postoperative complications such as gastrointestinal hemorrhage, wound infection, electrolyte disturbance and so on, but after the supportive treatments of anti-inflammatory, hemostasis, fluid infusion, all the patients were recovered and discharged, there was no perioperative deaths. Postoperative pathology showed that the growth pattern of these tumors was intracavity type or extra-cavity type and all of them were small intestine spindle cell tumor on tissue morphology; Immunohistochemical studies displayed that the positive rates of DOG-1 and CD117 were the highest. Combined with postoperative pathologic results, biological risk assessment stratification indicated that there were 20 cases of low to medium risk and 32 cases of high risk. Forty two cases of low to medium risk and some high risk patients didn’t accept further drug therapy after surgery for personal reasons, there was no tumor recurrence and metastasis. Ten cases of high risk SIST were given oral imatinib mesylate IM adjuvant therapy after surgery, among them, 4 cases appeared postoperative recurrence or metastasis in 6~36 months due to long duration, large diameter tumor and tumor rupture hemorrhage or necrosis etc; the other 6 cases had no tumor recurrence and metastasis during follow-up. The other 22 cases of high risk SIST only did postoperative dynamic CT observation for economic reason. Conclusion Gastrointestinal bleeding and abdominal pain are the first symptoms of SIST; Double balloon endoscopy examination diagnosis is indispensable to pre-operation, if having reasonable choice before operation to combine with CT enterography (CTE) or capsule endoscopy, it can reduce the operative difficulty of double balloon endoscopy and improve the discovery rate; DOG-1, CD34 and CD117 are all the specific immunohistochemical markers; surgical resection is the first choice of all treatments, postoperative pathology and immunohistochemistry can rank biological risk, the high risk paitients should receive additional molecular targeting treatment.
Small intestine; Stromal tumor; Double balloon endoscopy; Clinical pathology
10.3969/j.issn.1006-5709.2016.03.005
龚程,硕士,研究方向:小肠肿瘤的诊断与治疗。E-mail: 827413667@qq.com
谭诗云,博士研究生,教授,研究方向:内镜超声的临床应用。E-mail: tanshiyun@medmail.com.cn
R735.3+2
A
1006-5709(2016)03-0251-06
2015-03-30

