芪归糖痛宁颗粒对糖尿病大鼠坐骨神经糖基化终末产物、聚ADP核糖聚合酶基因表达的影响
崔李群 方朝晖 罗 云
芪归糖痛宁颗粒对糖尿病大鼠坐骨神经糖基化终末产物、聚ADP核糖聚合酶基因表达的影响
崔李群1方朝晖2罗 云1
目的探讨芪归糖痛宁颗粒对糖尿病周围神经病变(DPN)的作用机制。方法SD大鼠65只,随机留取10只为空白对照组,其余55只给予高脂饲料喂养4周后,空腹12h链脲佐菌素(STZ)60mg/kg一次性腹腔注射复制DPN大鼠模型,将42只成模大鼠分为模型组(M组)9只、芪归糖痛宁颗粒高剂量组(QTG高组)、芪归糖痛宁颗粒低剂量组(QTG低组)和甲钴胺片组(J组)组各11只,分别予以相应药物灌胃,空白对照组(Con组)和模型组实验期间予以生理盐水灌胃,疗程12周,实验结束后,分别对大鼠空腹血糖(FPG)、神经传导速度、血清超氧化物歧化酶(SOD)、丙二醛(MDA)、神经生长因子(NGF)水平及坐骨神经糖基化终末产物(AGEs)、聚ADP核糖聚合酶(PARP)基因的表达进行检测。结果治疗后,与模型组(M组)比较,芪归糖痛宁颗粒高(QTG高组)、低剂量(QTG低组)组均能降低糖尿病大鼠血糖[(14.08±3.54)mmol/L、(16.11±2.95)mmol/L比(20.41±2.25)mmol/L,P<0.01或P<0.05)],改善神经传导速度(49.16±5.37)m/s、(43.76± 3.93)m/s比(39.66±3.65)m/s,P<0.01或P<0.05)],降低血清MDA水平(14.91±1.23)nmol/L、(15.22± 0.55)nmol/L比(16.75±1.67)nmol/L,P均<0.05)],降低坐骨神经AGEs mRNA的表达(0.572± 0.021,0.983±0.013比1.088±0.032,P均<0.01),降低PARP mRNA的表达(0.677±0.035、0.829± 0.015比1.113±0.024,P<0.01);与模型组(M组)比较,芪归糖痛宁颗粒高剂量组升高血清SOD水平(112.87±4.98)U/mL比(97.55±4.93)U/mL,P<0.01),升高血清NGF水平[(37.38±4.51)ng/L比(26.06±4.41)ng/L,P<0.01)]。结论芪归糖痛宁颗粒通过抑制氧化应激与AGEs、PARP途径的相互作用,从而防治和延缓大鼠糖尿病周围神经病变的发生。
大鼠;糖尿病周围神经病变;芪归糖痛宁颗粒;AGEs;PARP
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病(diabetes mellitus,DM)患者常见且致残性较高的慢性并发症之一。由于缺乏统一的诊断标准和检测方法,其患病率有较大差异,在10%~96%[1]。芪归糖痛宁颗粒是在临床经验的基础上开发的中药复合制剂,初步研究表明其对治疗DPN安全有效[2]。本研究以链脲佐菌素诱发实验性DPN大鼠模型,以神经营养药甲钴胺作为对照,观察芪归糖痛宁颗粒对氧化应激及糖基化终末产物(advanced glycationend products,AGEs)、聚ADP核糖聚合酶(Poly ADP-Ribose Polymerase,PARP)基因表达的影响,为其临床治疗DPN提供理论依据。
1 实验材料
1.1 实验动物SD雄性大鼠65只,清洁级,体质量180~220g,安徽省实验动物中心提供,许可证号:SCXK(皖)2011-002。
1.2 药品与试剂芪归糖痛宁颗粒(安徽中医药大学第一附属医院制剂中心,批号20110809);甲钴胺片[卫材(中国)药业有限公司,批号1309007];盐酸二甲双胍片(上海施贵宝制药有限公司,批号1208091);大鼠血清超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、神经生长因子(nerve growth factor,NGF)、AGEs、PARP试剂盒(南京建成科技有限公司)。
1.3 仪器血糖仪、试纸(美国强生公司);普通PCR仪(杭州晶格科学仪器有限公司);UV-754紫外分光光度计(上海第三分析仪器厂);紫外凝胶成像分析仪(北京科创锐新生物科技有限公司);温度梯度基因扩增仪(德国MIONETRA);ELX808及EKX-50酶标仪、洗板机(美国BIO-TEK,EKX-50);计算机MS2000多媒体化生物信号记录分析系统。
2 实验方法
2.1 模型建立及分组65只大鼠适应性喂养1周后,随机分为空白对照组10只和造模组55只。空白对照组喂养方式不变,其余大鼠进行4周的高脂饲料喂养后,禁食12h予链脲佐菌素(STZ)60mg/kg一次性腹腔注射,诱发DPN大鼠模型[3]。空白对照组注入等容量柠檬酸缓冲液。于72h后测尾静脉采血随机血糖,以血糖≥16.7mmol/L列入观察对象。42只成模大鼠随机分为模型组(M组)9只、芪归糖痛宁颗粒高剂量组(QTG高组)、芪归糖痛宁颗粒低剂量组(QTG低组)、甲钴胺片组(J组)各11只。实验期间空白对照组(Con组)喂以基础饲料至实验结束,余四组均喂以高脂饲料。
2.2 给药方法给药剂量参考《药理实验方法学》[4],大鼠等效剂量相当于人的6.3倍。根据每只大鼠体质量不同,计算大鼠每日给予芪归糖痛宁颗粒灌胃剂量,其中QTG高组为等效剂量的2倍[12g/(kg·d)],QTG低组为等效剂量的0.5倍[3g/(kg·d)]。甲钴胺片剂量参照文献[5]按照0.3(mg/kg·d)给药,根据大鼠体质量计算每天灌胃量。以上各组,实验全程均以盐酸二甲双胍,使用剂量为临床成人剂量10倍,用其混悬液灌胃,作为基础降糖治疗。Con组与M组实验期间予以生理盐水5mL/(kg·d)灌胃。以上药物混悬液均以蒸馏水配制,每2周称体质量调药量。各组均每日灌胃1次,连续12周。
2.3 检测指标及方法
2.3.1 大鼠坐骨神经传导速度测定用药12周末,大鼠予以戊巴比妥钠30mg/kg腹腔注射进行麻醉,在左坐骨切迹插入电极,在踝部(远端)和左足底第二趾间分别插入记录电极并连接计算机MS2000多媒体化生物信号记录分析系统,记录远近端坐骨神经产生动作电位的潜伏期,测定两记录电极间的距离,并计算MNCV(m/s)。MNCV=电极之间的距离/动作电位潜伏期,比较各组大鼠神经传导速度的变化。
2.3.2 大鼠血清SOD、MDA、NGF水平测定采用黄嘌呤氧化酶法检测血清SOD水平,硫代巴比妥酸法检测血清MDA水平,双抗体夹心ELISA法测定大鼠血清NGF水平。试剂盒购自南京建成科技有限公司,具体方法严格按说明书进行。
2.3.3 大鼠坐骨神经AGEs、PARP mRNA表达的检测取大鼠坐骨神经,提取总RNA后进行逆转录反应,qPCR扩增,以GAPDH作为内参照。AGEs引物上游:5'-CAACCCAGACTCGAGGAGAG-3',下游:5'-AGAAAGTGGCTCGAGGTTGA-3',产物片段223bp;PARP引物上游:5'-CTGGAGTCCGACAAGGAGAG-3',下游:5'-TCACCGCCAGCTTCTTTACT-3',产物片段250 bp;GAPDH引物上游:5'-CAAGGTCATCCATGACAACTTTG-3',产物片段496bp。采用自动电泳凝胶成像分析仪分析。
2.4 统计学方法应用SPSS17.0软件包,正态分布计量资料以均数±标准差(x±s) 表示,非正态分布的数据可通过对数变换等使其接近正态分布;多个均数间比较采用方差分析,两样本比较采用t检验;计数资料用χ2检验;P<0.05为差异有统计学意义。
3 实验结果
实验造模时,DM大鼠造模有13只未达到高血糖标准予以剔除;实验过程中,因大鼠血糖过高、灌胃过程中操作不当、大鼠自身打斗等原因,J组死亡2只,Con组死亡1只;M组死亡1只;QTG高组死亡1只,QTG低组死亡1只。至实验结束时,各组剩余大鼠数分别为Con组9只:M组8只、J组9只、QTG高组10只、QTG低组10只。
3.1 各组大鼠空腹血糖(fasting plasma glucose,FPG)比较治疗前M组、QTG高、低组和J组大鼠FPG均高于Con组(P<0.01)。治疗后,M组、QTG高、低组和J组大鼠FPG均高于Con组(P<0.01)。QTG高、低组和J组大鼠均低于M组(P<0.01或P<0.05),但此三组之间FPG比较差异无统计学意义(P>0.05)。见表1。
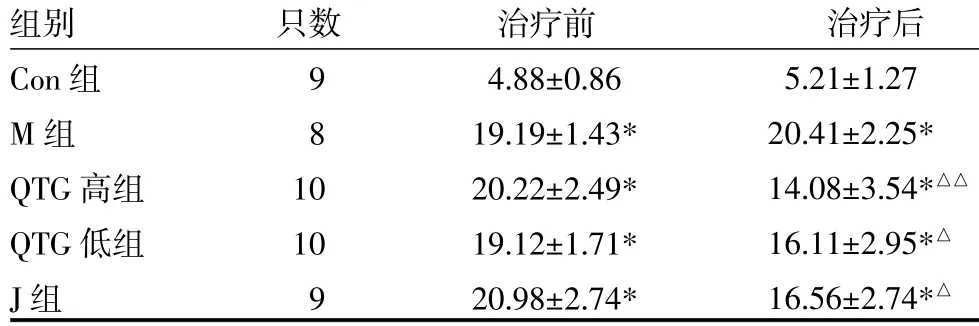
表1 各组大鼠空腹血糖(FPG)比较(mmol/L,x±s)
3.2 各组大鼠坐骨神经传导速度比较治疗后,M组、QTG高、低组和J组大鼠坐骨神经传导速度均低于Con组(P<0.01);QTG低组和J组大鼠均高于M组(P<0.05),QTG高组与M组比较,升高明显(P<0.01)。见表2。
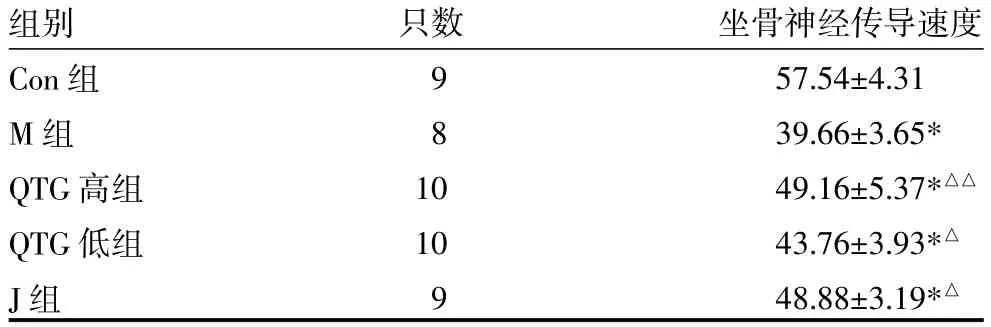
表2 各组大鼠坐骨神经传导速度比较(m/s,x±s)
3.3 各组大鼠血清SOD、MDA、NGF比较治疗后,M组、QTG高、低组和J组大鼠血清SOD水平均低于Con组(P<0.01);与M组比较,QTG高组和J组大鼠血清SOD水平均有升高(P<0.01或P<0.05);QTG高组与J组比较有所升高(P<0.05);QTG高组与QTG低组比较有所上升(P<0.01)。J组与QTG低组比较有所升高,但差异无统计学意义(P>0.05)。治疗后,M组、QTG高、低组和J组大鼠血清MDA水平均高于Con组(P<0.01);QTG高、低组和J组大鼠血清MDA水平与M组比较均有下降(P<0.05),但此三组间比较差异无统计学意义(P>0.05)。M组、QTG低组和J组大鼠血清NGF水平均低于Con组(P<0.01),QTG高组虽低于Con组,但差异无统计学意义(P>0.05);QTG高组和J组大鼠血清NGF水平与M组比较均有升高(P<0.01或P<0.05)。QTG低组大鼠血清NGF水平与M组比较虽有升高,但无统计学意义(P>0.05)。见表3。
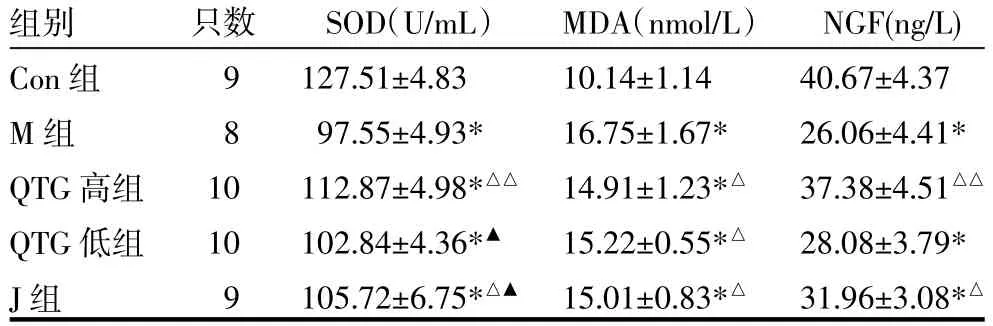
表3 各组大鼠血清血清超氧化物歧化酶(SOD)、丙二醛(MDA)、神经生长因子(NGF)比较(x±s)
3.4 各组大鼠坐骨神经AGEs、PARP mRNA表达比较QTG高、低组和J组大鼠AGEs、PARP mRNA表达均高于Con组,低于M组(P<0.01);大鼠AGEs mR-NA表达,QTG高组低于J组(P<0.05),QTG低组高于J组(P<0.01)。大鼠PARP mRNA表达,QTG高、低组均低于J组(P<0.01)。见表4,图1(插页)。
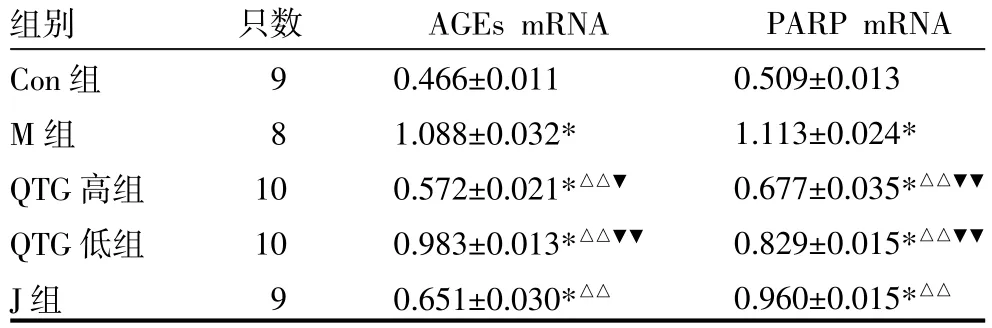
表4 各组大鼠坐骨神经糖基化终末产物(AGEs)、聚ADP核糖聚合酶(PARP)基因表达比较(x±s)
4 讨论
DPN发病机制尚未完全明确。目前认为氧化应激效应和氧自由基直接损伤在DPN发病过程中起着重要作用。MDA是细胞内脂质过氧化反应的最终产物,其含量能够体现组织细胞中氧自由基的含量;SOD通过一系列化学反应缓冲及清除自由基而显示出抗氧化损伤的作用,是机体内抗氧化系统的重要组成部分。氧化应激与糖基化终末产物AGEs形成途径在DPN发病中相互促进、相互影响。AGEs与糖基化终末产物受体(receptor for advanced glycation end products,RAGE)结合产生大量活性氧簇(reactive oxygen series,ROS),ROS使氧化还原敏感性转录因子活化和糖酵解过程中间产物增加,进而促进AGEs的生成。高血糖状态时,AGEs生成明显增加,AGEs结合一氧化氮(nitrogenoxide,NO)后可产生抑制作用,导致神经缺血改变。在外周神经组织中,AGE的产生及AGE-RAGE系统的作用可进一步刺激炎基因的转录和氧化应激的发生,最终出现糖尿病外周神经结构异常和神经功能的障碍[6]。研究[6]证明,AGEs可以引起微管蛋白和神经丝的改变,从而影响轴突的运输,而轴突运输的中断可促使神经纤维发生萎缩和退化。PARP途径在DPN发生发展过程中也与氧化应激有一定的联合作用。高血糖时,游离基团及氧化剂刺激了PARP活化,而被激活的PARP也会引起氧化应激。最近的研究已表明,DM患者高血糖状态可诱导周围神经系统产生氧化应激效应,激活PARP-1,影响细胞能量代谢、信号转导和神经轴突转运,导致神经细胞代谢障碍或死亡,是DPN的进展的重要因素之一[7]。
DPN属中医“消渴”兼症,是由消渴日久,内热伤阴耗气,气虚无力运行血脉,阴虚脉络不荣瘀滞,阴损及阳,阳虚寒凝,血液凝滞,脉络瘀阻所导致。治疗上常将益气养阴与活血通络相结合,标本兼治。本研究所用益气养阴通络复方芪归糖痛宁颗粒,主要由黄芪、当归、生地黄、延胡索、葛根、鸡血藤、威灵仙等组成。以黄芪大补脾胃之气,旨在令气旺血行而瘀去络通;当归药性甘缓,补血行血,祛邪而不伤正,二者同用,共为君药;葛根升阳、生津止渴,生地清热凉血,养阴生津,助黄芪、当归益气活血生津为臣药;鸡血藤活血补血,延胡索辛散活血、行气、止痛共为佐药。威灵仙祛风通络而止痛,使十二经脉通行顺畅,药性直趋病所,为使药。诸药合用,气血同治,标本兼顾,具有益气养阴、活血通络之功,防治和延缓DPN,改善DPN临床症状,标本同治,诸药共济[2]。
本研究结果显示,干预12周后,芪归糖痛宁颗粒能够降低糖尿病大鼠血糖,改善神经传导速度,升高血清SOD、NGF水平,降低MDA水平,下调坐骨神经AGEs、PARP mRNA表达水平,提示芪归糖痛宁颗粒能够综合控制氧化应激与AGEs生成途径及PARP途径的联合作用对DPN的影响,保护神经系统,从而有效防治DPN。
[1]管凌志.前列地尔联合甲钴胺治疗糖尿病周围神经病变37例[J].临床医学,2015,24(1):76-78.
[2]方朝晖,赵进东.芪归糖痛宁颗粒治疗糖尿病周围神经病变的临床观察[J].中医药临床杂志,2012,24(2):126-128.
[3]贲莹,张风华,梁文杰,等.不同黄芪剂量补阳还五汤对糖尿病大鼠神经功能及氧化应激的作用[J].中成药,2015,37(1):199-201.
[4]魏伟,吴希美,李元建.药理实验方法学[M].第4版.北京:人民卫生出版社,2010:212.
[5]季文博,高家荣,姜辉,等.芪归糖痛宁颗粒对糖尿病周围神经病变大鼠的保护作用[J].中药药理与临床,2012,28(6):113-115.
[6]鲍伟杰,张文健,许世清,等.AGE-RAGE系统在糖尿病神经病变中的作用[J].生理科学进展,2014,45(2):137-138.
[7]陈静芬,李强.聚腺苷二磷酸核糖聚合酶1与糖尿病慢性并发症[J].临床荟萃,2014,29(2):238.
(收稿:2016-07-11修回:2016-10-20)
Effect of Qigui Tangtongning Granules(QTG)on the Expression of Advanced Glycation End Products and Poly ADP-ribose Polymerase mRNA in Sciatic Nerve of Diabetic Rats
CUI Liqun1,FANG Zhaohui2,LUO Yun1.1 Department of Endocrinology,Chinese Medical Hospital of Yuhang,Hangzhou,Hangzhou(311106),China; 2 Department of Endocrinology,First Affiliated Hospital of Anhui University of Chinese Medicine,Hefei(230031), China
Objective To investigate the effect of Qigui Tangtongning Granules(QTG)on diabetic peripheral neuropathy(DPN).Methods Sixty-five SD rats were used in this study.Fifty-five of those were fed with high fat diet for 4 weeks,then fasted for 12 h before intraperitoneal injection of 60 mg/kg STZ to induce the model of type 2 diabetis.Forty-two models were successfully established and random ly divided into model group(n=9),highdose QTG group(n=11),low-dose QTG group(n=11),and mecobalamine group(n=11).The corresponding drugs were administered by gavage.The rest 10 rats serviced as controls.Control group and model group were given citric acid buffer solution.The course of treatment was 12 weeks.At the end of the experiment,fasting plasma glucose was detected,the nerve conduction velocity was measured,serum superoxide dismutase(SOD),malondialdehyde(MDA)and nerve growth factor(NGF)were determined,and the expression of advanced glycation end products(AGEs)and poly ADP-ribose polymerase(PARP)mRNA in sciatic nerve was assessed.Results Compared withmodel group,high-dose and low-dose QTG groups decreased levels of FPG(14.08±3.54mmol/L and 16.11±2.95mmol/ L vs 20.41±2.25mmol/L,P<0.01 or P<0.05),improved the nerve conduction velocity in diabetic rats(49.16±5.37m/s and 43.76±3.93m/s vs 39.66±3.65m/s,P<0.01 or P<0.05),reduced serum MDA(14.91±1.23nmol/L and 15.22±0.55nmol/L vs 16.75±1.67nmol/L,P<0.05),AGEs mRNA(0.572±0.021 and 0.983±0.013 vs 1.088±0.032;P<0.01),and PARP mRNA(0.677±0.035 and 0.829±0.015 vs 1.113±0.024,P<0.01),meanwhile high-dose QTG group increased serum SOD(112.87±4.98U/mL vs 97.55±4.93U/mL,P<0.01)and serum NGF(37.38±4.51ng/L vs 26.06±4.41ng/L,P<0.01). Conclusion QTG can inhibit the interaction of oxidative stress and the pathway of AGEs and PARP to improve the structure and function injury of nerves,so as to prevent and treat diabetic peripheral neuropathy.
rats;diabetic peripheral neuropathy;Qigui Tangtongning Granule;AGEs;PARP
国家中医药管理局中医药重点学科——内分泌学(No.20091221)
1杭州市余杭区中医院内分泌科(杭州311106);2安徽中医药大学第一附属医院内分泌科(合肥230031)
崔李群,Tel:18157187919;E-mail:779557148@qq.com

