色胺酮在食管癌化疗耐药过程中的作用
黄 彬,苏燕青,林晓岚,王颖峥
(福建中医药大学康复技术工程研究中心,福建福州350122)
色胺酮在食管癌化疗耐药过程中的作用
黄彬*,苏燕青,林晓岚,王颖峥
(福建中医药大学康复技术工程研究中心,福建福州350122)
摘要:为研究色胺酮对食管癌化疗药物顺铂耐药性的抑制作用及其作用机制,设计食管癌Eca109细胞及其顺铂耐药株Eca109/cDDP细胞的顺铂及色胺酮不同处理组,根据实验目的选择不同的处理方式.利用实时荧光定量PCR检测Eca109和Eca109/cDDP细胞中多药耐药基因1(MDR1)及谷胱甘肽-巯基-转移酶-pi基因(GST-pi)的mRNA表达水平;免疫印迹和免疫荧光技术检测Eca109细胞和Eca109/cDDP细胞中MDR1和GST-pi蛋白的表达水平;细胞计数试剂盒(cell counting kit,CCK-8)法检测细胞增殖以及基因敲降后的回补效果.结果表明:色胺酮不仅显著抑制了食管癌细胞顺铂耐药株Eca109/cDDP细胞中MDR1基因的表达,而且MDR1和GST-pi蛋白的表达也受到了显著的抑制;色胺酮不但能抑制Eca109细胞的增殖能力,对耐药株Eca109/cDDP细胞增殖也存在抑制作用;色胺酮逆转耐药性的能力依赖于对MDR1和GST-pi的表达抑制.综上分析,色胺酮能够通过抑制MDR1和GST-pi蛋白的表达来逆转食管癌细胞顺铂耐药株的耐药性,是一种潜在的化疗辅助药物.
关键词:色胺酮;联合用药;食管癌;顺铂;耐药性
食管癌是常见的消化道肿瘤[1-2],手术治疗是其主要治疗手段,但是大多数患者会由于术后发生远处转移而死亡[3].手术和放疗并不能解决远处转移的问题,所以化疗成为术后治疗的重要手段.顺铂(顺氯氨铂,cDDP)是第一代铂类抗肿瘤药物,是众多食管癌化疗药物的一种,疗效确切[4].研究发现在两药或者三药联合化疗时,加与不加顺铂,在疗效上存在着显著差别[5].因此,顺铂成为食管癌后期化疗的主要药物.但是耐药性的产生极大地影响了顺铂的化疗效果.
MDR1(multidrugresistance1)基因编码多药耐药蛋白,是定位于细胞膜上具有ATP依赖性的药物外排泵[6].GST-pi(glutathione-s-transferase-pi)基因编码多功能的二聚体蛋白,能通过增强药物和谷胱甘肽的结合加大其水溶性,使之排出细胞[7].这二者的过度表达是导致肿瘤具有多药耐药性的重要原因,因此抑制MDR1及GST-pi蛋白表达是逆转多药耐药性的有效途径.
色胺酮(tryptanthrin)及其衍生物属于吲哚喹唑啉类生物碱,具有抗炎、抗菌、抗白血病等生物活性[8-9],其成药安全性良好,对生物体的毒副作用小[10].最近的研究表明色胺酮及其衍生物对多药耐药性的癌细胞有抑制作用,对乳腺癌细胞阿霉素的耐药性有逆转作用[11],表明其在抗癌药方面将有广泛的用途.但是,食管癌细胞对顺铂的耐药性是否能通过色胺酮进行逆转还没有明确的研究.本研究通过分析MDR1基因与GST-pi基因及其表达蛋白的水平变化,来探讨色胺酮在食管癌治疗中的作用.
1材料和方法
1.1材料
1.1.1试剂
色胺酮和顺铂购自Sigma公司(货号:SML0310和1134357);细胞培养用胎牛血清、RPMI1640培养基、trypsin-EDTA溶液选购自Hyclone公司;Lipofectamine 2000购自Invitrogen公司;Tripure 总RNA提取试剂盒购自Roche公司;RNA反转录试剂盒及实时荧光定量 PCR(qRT-PCR)试剂盒购自康为世纪公司;细胞计数试剂盒(cell counting kit,CCK-8)购自日本同仁化学研究所(Donjindo);MDR1、GST-pi和甘油醛-3-磷酸脱氢酶(GAPDH,内参)抗体购自Abcam公司(货号:ab129450、ab170323和ab128915);MDR1基因和GST-pi基因的siRNA-pool敲降序列购自Santa-Cruz公司(货号:sc-29395和sc-72091).
1.1.2细胞样本
食管癌Eca109细胞及其顺铂耐药株Eca109/cDDP细胞购自上海凯基生物科技有限公司,二者针对顺铂的耐药指数为10.8(即顺铂针对耐药株的半数抑制剂量是针对其亲本细胞株的10.8倍).
表1 qRT-PCR的引物
Tab.1 Primers for qRT-PCR
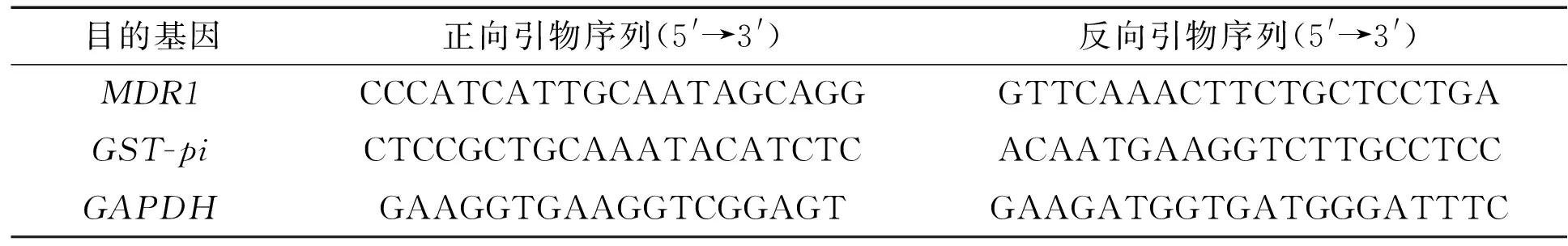
目的基因正向引物序列(5'→3')反向引物序列(5'→3')MDR1CCCATCATTGCAATAGCAGGGTTCAAACTTCTGCTCCTGAGST-piCTCCGCTGCAAATACATCTCACAATGAAGGTCTTGCCTCCGAPDHGAAGGTGAAGGTCGGAGTGAAGATGGTGATGGGATTTC
1.2方法
1.2.1细胞培养
Eca109和Eca109/cDDP细胞的培养条件如下:含10%(体积分数)胎牛血清的RPMI1640培养基,37 ℃,5%(体积分数,下同)CO2,饱和湿度;耐药株的顺铂维持质量浓度为0.75 mg/L.
1.2.2基因敲降
采用脂质体转染方法,当贴壁生长的细胞汇合度达到70%时,更换细胞培养液为无血清的RPMI1640培养基;分别用无血清培养基按比例稀释Lipofectamine 2000及siRNA,混匀二者后静置20 min,滴入细胞培养上清中,5 h后更换为含血清的培养基;正常培养48 h后,利用qRT-PCR方法检查转染效率.
1.2.3qRT-PCR检测
取出待收集细胞,用真空泵吸去培养基后加入预冷的磷酸盐缓冲液(PBS)清洗2遍,再次去上清后加入1 mL Tripure试剂,按照操作说明提取总RNA.按照 RNA反转录试剂盒说明书操作,首先42 ℃孵育50 min,然后70 ℃孵育15 min,当反应结束后保持4 ℃,最后置于-20 ℃冰箱贮存备用.反转录后的cDNA作为模板进行qRT-PCR扩增,反应体系:cDNA 1 μL,正、反向引物(表1)各0.6 μL,SYBR Green荧光染料mix 10 μL,无菌蒸馏水8 μL,ROX荧光参比染料 0.4 μL.反应条件:94 ℃预变性2 min;95 ℃变性5 s,60 ℃退火延伸20 s,循环40次;72 ℃延伸5 min.实验数据分析借助Rotorgene 4.6软件采用2-△△CT法处理,以GAPDH基因作为内参.
1.2.4免疫印迹检测
用蛋白裂解液提取样品蛋白,BCA法测定蛋白浓度,将制备好的蛋白加入5×上样缓冲液,沸水浴5 min使蛋白变性,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,转印至聚偏二氟乙烯(PVDF)膜;将转印膜浸入含5%(质量分数)脱脂奶粉的TBST(20 mmol/L pH 7.5 Tris-HCl,0.8%(质量分数)NaCl,0.1%(体积分数)Tween-20)中室温封闭1 h,分别将稀释后的抗体浸润转印膜,室温孵育2 h,TBST洗膜后浸润于辣根过氧化物酶(HRP)标记的二抗中室温孵1 h,再次洗膜后使用增强化学发光(ECL)方法进行显影、曝光,胶片晾干后,扫描并分析.使用ImageJ(V2.1)软件对目的蛋白与内参进行灰度对比.
1.2.5免疫荧光检测
在盖玻片上接种细胞培养36 h,除去培养基后PBS清洗3×5 min(3次,每次5 min,下同),用4%(质量分数)甲醛溶液固定30 min,吸去固定液后PBS清洗3×5 min;用0.75% (体积分数)Triton-X100溶液进行透明化后,PBS清洗3×5 min,5%(质量分数,下同)牛血清白蛋白(BSA)室温封闭30 min;加入含有一抗(MDR1抗体,1∶200)的1%BSA,置于4 ℃湿盒中杂交过夜,PBS清洗3×5 min,加入含有二抗(羊抗兔Alexa488,1∶400)的1%BSA,室温避光孵育30 min;PBS清洗3×5 min(避光),置于1 μg/mL的核酸染料4′,6-二脒基-2-苯基吲哚(DAPI)溶液中室温孵育5 min(避光),PBS清洗3×5 min(避光),用95%(体积分数)甘油封片后,拍照分析,4 ℃避光保存.
1.2.6CCK-8法检测细胞增殖
获得细胞悬液经细胞计数后,按5×104mL-1接种于96孔板中,将培养板置于培养箱中,在37 ℃,5%CO2的条件下培养24~36 h;每孔加入10 μL试剂盒中的CCK-8溶液,轻轻震荡摇匀,将培养板置于培养箱内继续孵育2 h;细胞到达测量时间点后,用酶标仪测定在450 nm处的吸光度,记录数据.
1.2.7统计学分析
采用GraphPad统计分析软件对实验数据进行配对t-检验或单因素方差分析,p<0.05视为有显著差异,p<0.001视为有极显著差异.
2结果和分析
2.1MDR1基因在Eca109和Eca109/cDDP细胞中的表达
采用qRT-PCR的方法检测MDR1基因在食管癌Eca109和Eca109/cDDP细胞中不同药物浓度处理下的表达,以GAPDH基因为内参.结果(图1)显示:MDR1基因在Eca109细胞中的表达水平很低,Eca109/cDDP细胞中其表达显著上调(配对t-检验,p<0.001);而在Eca109/cDDP细胞中添加色胺酮能显著抑制MDR1基因的表达,并呈剂量依赖关系(单因素方差分析,p<0.001).
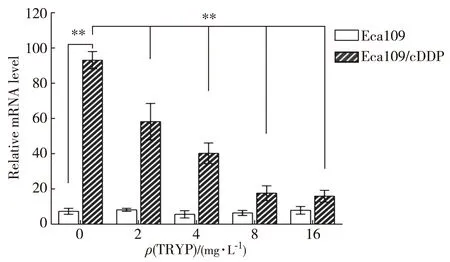
TRYP为色胺酮,下同.**p<0.001.图1 不同浓度色胺酮处理下Eca109细胞和 Eca109/cDDP细胞中MDR1基因的转录水平Fig.1Transcriptional level of MDR1 gene in Eca109 and Eca109/cDDP under treatment with tryptanthin of different concentrations
2.2MDR1蛋白在Eca109和Eca109/cDDP细胞中的表达
为了进一步探索色胺酮影响Eca109/cDDP细胞株顺铂耐药性的机制,利用免疫印迹和免疫荧光的方法检测了色胺酮对MDR1蛋白表达的影响.免疫印迹实验结果(图2(a))显示:在Eca109细胞中MDR1蛋白表达量很低,Eca109/cDDP细胞中表达上升;而在Eca109/cDDP细胞中添加色胺酮能明显抑制MDR1的表达,并呈剂量依赖关系.免疫荧光实验结果(图2(b))同样显示,色胺酮能明显抑制Eca109/cDDP细胞中MDR1蛋白在细胞膜上的表达.

图2 免疫印迹(a)与免疫荧光(b)法检测Eca109细胞 和Eca109/cDDP细胞中MDR1蛋白的表达Fig.2Detection of MDR1 expression level in Eca109 and Eca109/cDDP by Western blot (a) and immunofluorescence (b)
2.3GST-pi在Eca109和Eca109/cDDP细胞中的表达
为了研究食管癌中色胺酮逆转Eca109/cDDP细胞株顺铂耐药性的机制,进一步检测了色胺酮处理对GST-pi蛋白表达的影响.结果显示:GST-pi在Eca109细胞中表达量很低,在Eca109/cDDP细胞中表达上升,而在Eca109/cDDP细胞中添加色胺酮能显著抑制GST-pi蛋白的表达,并呈剂量依赖关系(图3(a));同时,如图3(b)所示,GST-pi基因的mRNA水平也有相似的变化趋势(单因素方差分析,p<0.05),但其变化水平不如蛋白水平变化显著也预示着色胺酮对其表达的影响未必局限于基因转录水平.

*p<0.05;**p<0.001.图3 Eca109和Eca109/cDDP中GST-pi表达水平的变化Fig.3Changes of GST-pi expression level in Eca109 and Eca109/cDDP
2.4CCK-8法检测色胺酮对细胞增殖的影响

*p<0.05;**p<0.001.图4 色胺酮对细胞增殖能力(a)及顺铂敏感度(b)的影响Fig.4Effect of tryptanthrin on cell proliferation (a) and sensitivity of cDDP (b)
利用CCK-8法检测色胺酮对食管癌顺铂耐药株Eca109/cDDP细胞增殖能力的影响.结果显示:不同时间梯度和药物浓度的色胺酮处理对Eca109/cDDP细胞增殖能力呈现不同的抑制效果(图4(a)),24,48,72 h处理下,色胺酮对Eca109/cDDP细胞(顺铂维持质量浓度为0.75 mg/L)的半数抑制质量浓度(IC50)依次为19.2,5.9,3.5 mg/L;同时,色胺酮存在的情况下,Eca109细胞及耐药株Eca109/cDDP细胞对顺铂的敏感度均有显著上升(图4(b))(配对t-检验,p<0.05和p<0.001),其中Eca109细胞对顺铂的IC50由0.34 mg/L降至0.21 mg/L,Eca109/cDDP细胞对顺铂的IC50由3.75 mg/L降至0.55 mg/L.
2.5敲降MDR1和GST-pi基因后的回补实验
利用siRNA技术分别敲降Eca109/cDDP细胞中的MDR1和GST-pi基因(图5(a)),采用CCK-8法检测顺铂及色胺酮对其增殖能力的影响.结果显示:基因敲降后色胺酮对Eca109/cDDP细胞增殖的抑制能力下降(配对t-检验,p<0.001),即说明色胺酮逆转Eca109/cDDP细胞耐药性的能力依赖于MDR1和GST-pi的表达(图5(b)).如图5(c)所示,色胺酮处理情况下Eca109/cDDP细胞IC50的显著变化结果(配对t-检验,p<0.05或p<0.001)也体现了基因敲降后对其抑制能力的回补效果.
3讨论
现今对于食管癌患者主要采用手术治疗辅以放疗、化疗等综合治疗手段,但其临床治疗效果及远期预后仍不理想,复发率及病死率较高[12].化疗药物耐药性的出现是化疗失败的主要因素.顺铂作为一种比较有效的食管癌化疗药物,在长期使用后也不可避免地出现耐药性.很多研究都在致力于寻找能够抑制MDR1基因及其蛋白表达的药物[13-16].有关色胺酮及其衍生物在乳腺癌方面的研究发现色胺酮能够逆转乳腺癌细胞阿霉素耐药株的耐药性[11],而在食管癌方面还未见相关报道.本研究在分子和细胞层次阐明了色胺酮对食管癌耐药性的逆转调控.
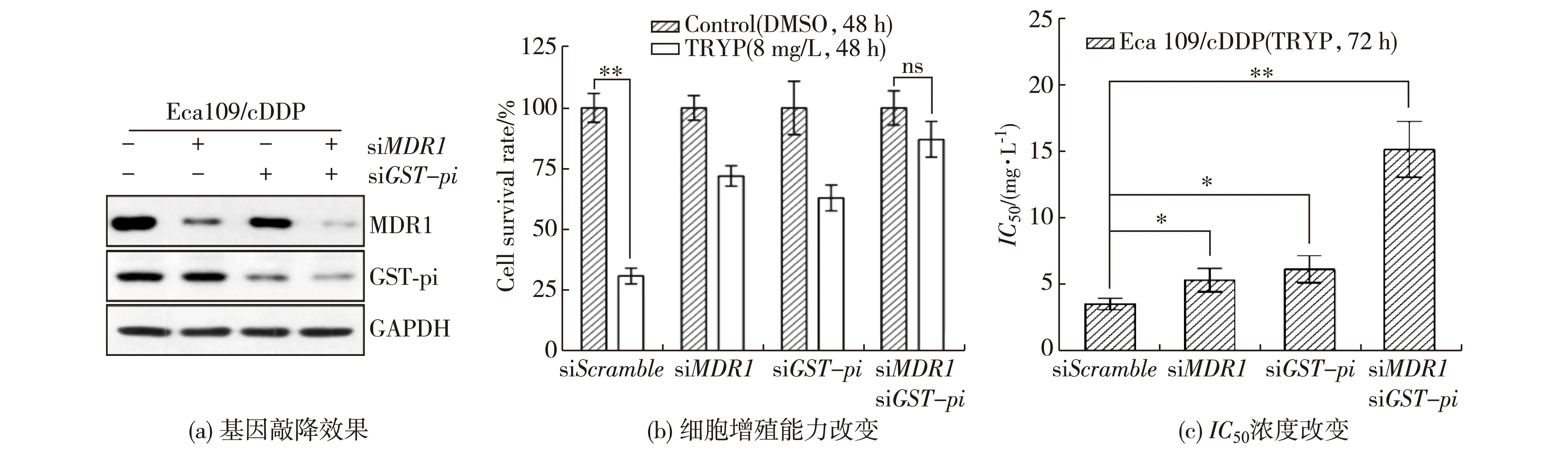
ns.无显著差异;*p<0.05;**p<0.001.图5 Eca109/cDDP中敲降MDR1和GST-pi基因后色胺酮对其细胞增殖能力的抑制效果变化Fig.5Alteration of inhibitory effect of tryptanthrin on proliferation of Eca109/cDDP after knockdown of MDR1 and GST-pi genes
本研究发现色胺酮对MDR1和GST-pi基因及其蛋白表达均有显著的抑制效果.基因敲降的回补实验及其相应的增殖能力检测结果显示,色胺酮抑制Eca109/cDDP细胞增殖依赖于MDR1和GST-pi基因的表达,表明色胺酮能通过调控MDR1及GST-pi来逆转食管癌细胞顺铂耐药株的耐药性,从而抑制食管癌细胞的增殖.
吲哚胺2,3-双加氧酶(IDO)是肝脏以外唯一催化色氨酸沿犬尿氨酸途径代谢的限速酶[17],研究证实IDO在很多实体肿瘤中表达明显增强[18],而色胺酮及其衍生物在细胞水平上都有极强的IDO抑制活性[19].因此,色胺酮及其衍生物抑制肿瘤在体内免疫逃脱方面也拥有强大的潜在药用价值.
色胺酮的天然含量很低,导致其提取分离成本高且操作难,而色胺酮及其衍生物的化学合成方法已经日趋成熟[20].但由于色胺酮不溶于水,导致其难以进入细胞,从而有研究借助于纳米材料把色胺酮送进细胞内,但是这一技术还处于研发阶段[21].因此,色胺酮在临床应用上有很大的前景,但是也面临着很大的挑战.
综上所述,色胺酮是一种潜在的辅助化疗药物,有望对现行化疗方案尤其是在耐药性产生后发挥重要作用.
参考文献:
[1]CHEN W,ZHENG R,BAADE P D,et al.Cancer statistics in China,2015[J].CA:A Cancer Journal for Clinicians,2016,66(2):115-132.
[2]LIN Y,TOTSUKA Y,HE Y,et al.Epidemiology of esophageal cancer in Japan and China[J].Journal of Epi-demiology,2013,23(4):233-242.
[3]RUBENSTEIN J H,SHAHEEN N J.Epidemiology,diagnosis,and management of esophageal adenocarcinoma[J].Gastroenterology,2015,149(2):302-317.
[4]OYANAGI H,ICHIKAWA H,KOSUGI S,et al.Three cases of esophageal carcinoma achieved a pathological complete response after neoadjuvant chemotherapy with cisplatin and 5-fluo-rouracil[J].Gan To Kagaku Ryoho Cancer & Chemotherapy,2015,42(4):497-501.
[5]TEPPER J,KRASNA M J,NIEDZWIECKI D,et al.Phase Ⅲ trial of trimodality therapy with cisplatin,fluo-rouracil,radiotherapy,and surgery compared with surgery alone for esophageal cancer:CALGB 9781[J].Journal of Clinical Oncology,2008,26(7):1086-1092.
[6]HEGEWISCH-BECKER S.MDR1 reversal:criteria for clinical trials designed to overcome the multidrug resis-tance phenotype[J].Leukemia,1996,10(Sup. 3):S32-S38.
[7]JEDLITSCHKY G,LEIER I,BUCHHOLZ U,et al.ATP-dependent transport of glutathione S-conjugates by the multidrug resistance-associated protein[J].Cancer Research,1994,54(18):4833-4836.
[8]ZHU X,ZHANG X,MA G,et al.Transport characteristics of tryptanthrin and its inhibitory effect on P-gp and MRP2 in Caco-2 cells[J].Journal of Pharmacy & Pharmaceutical Sciences,2011,14(3):325-335.
[9]JUN K Y,PARK S E,LIANG J L,et al.Benzo[b]tryptanthrin inhibits MDR1,topoisomerase activity,and reverses adriamycin resistance in breast cancer cells[J].Chem Med Chem,2015,10(5):827-835.
[10]李捷,缪珊,王四旺,等.色胺酮对小鼠急性和亚急性毒性实验研究[J].中国医药导报,2012,9(32):13-14.
[11]YU S T,CHEN T M,TSENG S Y,et al.Tryptanthrin inhibits MDR1 and reverses doxorubicin resistance in breast cancer cells[J].Biochemical and Biophysical Research Communications,2007,358(1):79-84.
[12]DI PIETRO M,FITZGERALD R C.Research advances in esophageal diseases:bench to bedside[J].F1000 Prime Reports,2013,5(44):1-11.
[13]SAABY L,HELMS H C,BRODIN B.IPEC-J2 MDR1,a novel high-resistance cell line with functional expression of human P-glycoprotein (ABCB1) for drug screening studies[J].Molecular Pharmaceutics,2016,13 (2):640-652.
[14]HABIBOLLAHI P,GHAHREMANI M H,AZIZI E,et al.Multi drug resistance-1 (MDR1) expression in response to chronic diazinon exposure:aninvitrostudy on Caco-2 cells[J].Bulletin of Environmental Contamination and Toxicology,2011,86(1):105-109.
[15]KRECH T,SCHEUERER E,GEFFERS R,et al.ABCB1/MDR1 contributes to the anticancer drug-resis-tant phenotype of IPH-926 human lobular breast cancer cells[J].Cancer Letters,2012,315(2):153-160.
[16]FANELLI M,HATTINGER C M,VELLA S,et al.Targeting ABCB1 and ABCC1 with their specific inhibitor CBT-1 can overcome drug resistance in osteosarcoma[J].Current Cancer Drug Targets,2016,16(3):261-274.
[17]TAKIKAWA O,YOSHIDA R,KIDO R,et al.Tryptophan degradation in mice initiated by indoleamine 2,3-dioxygenase[J].The Journal of Biological Chemistry,1986,261(8):3648-3653.
[18]UYTTENHOVE C,PILOTTE L,THEATE I,et al.Evidence for a tumoral immune resistance mechanism based on tryptophan degradation by indoleamine 2,3-dioxygenase[J].Nature Medicine,2003,9(10):1269-1274.
[19]YANG S,LI X,HU F,et al.Discovery of tryptanthrin derivatives as potent inhibitors of indoleamine 2,3-di-oxygenase with therapeutic activity in Lewis lung cancer (LLC) tumor-bearing mice[J].Journal of Medicinal Chemistry,2013,56(21):8321-8331.
[20]ONAMBELE L A,RIEPL H,FISCHER R,et al.Synthesis and evaluation of the antiplasmodial activity of tryptanthrin derivatives[J].International Journal for Parasitology Drugs and Drug Resistance,2015,5(2):48-57.
[21]FANG Y P,LIN Y K,SU Y H,et al.Tryptanthrin-loaded nanoparticles for delivery into cultured human breast cancer cells,MCF7:the effects of solid lipid/liquid lipid ratios in the inner core[J].Chemical & Pharmaceutical Bulletin,2011,59(2):266-271.
doi:10.6043/j.issn.0438-0479.201603033
收稿日期:2016-03-22录用日期:2016-05-04
基金项目:国家自然科学基金(81373709);福建中医药大学重点学科专项(X2014126)
*通信作者:skybound.hb@163.com
中图分类号:R 735.1
文献标志码:A
文章编号:0438-0479(2016)04-0495-06
Effect of Tryptanthrin on Drug Resistance During Chemotherapy of Esophageal Cancer
HUANG Bin*,SU Yanqing,LIN Xiaolan,WANG Yingzheng
(Rehabilitation Technical Engineering Research Center,Fujian University of Traditional Chinese Medicine,Fuzhou 350122,China)
Abstract:To study the inhibitory effect of tryptanthrin on drug resistance to cisplatin chemotherapy for esophageal carcinoma and its mechanism,different treatments (blank control,cisplatin treatment,tryptanthrin treatment and cisplatin combined tryptanthrin treatment) of esophageal cancer Eca109 cells and cisplatin-resistant Eca109 cells (Eca109/cDDP) were performed on the basis of the purpose of experiments.Real-time quantitative PCR was used to detect the mRNA levels of multidrug resistance gene 1(MDR1) and glutathione-s-transferase-pi gene (GST-pi) in Eca109 and Eca109/cDDP cells.Western blot and/or immunofluorescence were used to detect the protein levels of MDR1 and GST-pi.The proliferation of cells was tested by cell counting kit (CCK-8).The results showed that tryptanthrin suppressed cell proliferation by inhibition of mRNA and protein levels of MDR1 and GST-pi in Eca109/cDDP cells.In summary,tryptanthrin can reverse the cisplatin resistance in Eca109/cDDP by its inhibition on MDR1 and GST-pi expression.It could be a potential adjuvant agent for chemotherapy.
Key words:tryptanthrin;combination therapy;esophageal cancer;cisplatin;drug resistance
引文格式:黄彬,苏燕青,林晓岚,等.色胺酮在食管癌化疗耐药过程中的作用[J].厦门大学学报(自然科学版),2016,55(4):495-500.
Citation:HUANG B,SU Y Q,LIN X L,et al.Effect of tryptanthrin on drug resistance during chemotherapy of esophageal cancer[J].Journal of Xiamen University(Natural Science),2016,55(4):495-500.(in Chinese)

