胃肝样腺癌的九例临床分析
张峥嵘,武 健
(皖南医学院附属弋矶山医院 胃肠外科,安徽 芜湖 241000)
临床经验交流
胃肝样腺癌的九例临床分析
张峥嵘,武健
(皖南医学院附属弋矶山医院 胃肠外科,安徽 芜湖241000)
[摘要]目的 探讨胃肝样腺癌(hepatoid adenocarinoma of stomach,HAS)的临床特点及诊断治疗和预后。方法 回顾分析2012 年1月至2016年3月我院9例诊断为胃肝样腺癌患者的相关症状体征、术前影像学以及AFP检查情况、手术情况、术后病理及随访预后等相关资料。结果 9例肝样腺癌患者主诉缺乏特异性,症状多样;治疗前血清 AFP 升高7例,8例患者肿瘤均位于胃窦部及胃体部,胃镜病理活检显示低分化腺癌2例、中-低分化腺癌7例;腹部CT均发现局部胃壁增厚,4例患者胃周可见肿大淋巴结;行根治性手术患者8例,大体标本均为溃疡型,临床病理分期III期3例、IV期4例,1例患者术后时间较短无法随访预后,截止到末次随访时1例患者存活12月,另外7例患者在接受手术及化疗后,AFP持续或再次升高,均未能获得长期生存(生存期为5~32个月)。 结论 胃肝样腺癌是一类特殊胃癌,容易发生淋巴结以及肝脏转移,发现时多已是晚期,临床疗效差,外科医师应予以重视。
[关键词]胃肿瘤;肝样腺癌;甲胎蛋白
胃肝样腺癌(hepatoid adenocarcinoma of the stomach,HAS)是一种少见的原发于胃的特殊类型腺癌[1]。当前,HAS的产生机制不明确,此类肿瘤生物学行为怪异,往往同时具有腺癌和肝细胞癌样分化特征,大多数HAS伴有血清甲胎蛋白(AFP)升高,恶性程度较高,预后较差。该肿瘤临床少见,近年来国内外虽可见病例报道,但尚缺乏对HAS的系统研究。本文就2012年1月至2016年3月在本院进行手术的9例诊断为胃肝样腺癌患者的相关资料进行分析,加深对该肿瘤的领会,以提高临床诊治水平。
1资料与方法
1.1一般资料回顾整理 2012 年 1 月至 2016年 3月在本院手术并经过病理学诊断为胃肝样腺癌患者的相关资料,共计9例,其中男性患者8例,女性患者1例,年龄分布51~74岁,平均年龄61.6岁。在此期间我院共收治胃癌患者1 856例。HAS诊断标准以病理形态学特征作为诊断依据,凡胃癌病理检出包含肝样分化区的,诊断为HAS,而不论其是否出现AFP 水平的升高。
1.2方法患者入院后都经过详细的病史采集及体格检查,并完善胃镜、腹部CT、AFP水平以及其他肿瘤标记物检测等术前检查,手术方式根据患者肿瘤的侵犯情况实施根治性或姑息性手术,手术标本行常规病理及免疫组化检查。大多数病人术后接受了化疗、定期检测肿瘤标记物水平并进行了长期随访。
2结果
2.1主诉及临床表现9例患者的主诉缺乏特异性,症状多样,5例患者有腹胀、反酸等主诉,2例患者主诉伴有腹痛、黑便等症状,2例患者因体检发现AFP升高而入院。起病至就诊时间1~12个月不等,平均7个月。1例患者有肝炎病史,1例患者饮酒30年余,每天白酒约半斤。2例患者直系亲属有胃癌家族史。
2.2术前检查情况9例患者中2例患者血清AFP正常,7例患者AFP明显增高,AFP水平在43.2~1 656.5 ng/mL间不等,其中1例患者AFP超过2 000 ng/mL;2例患者癌胚抗原(carcino-embryonic antigen,CEA)水平高于正常上限,CA-199、CA-125等肿瘤标记物未见明显异常。9例患者术前胃镜检查均报胃癌,除1例患者肿瘤位于贲门附近,其他8例患者肿瘤均位于胃窦部及胃体部,胃镜病理活检显示,低分化腺癌2例、中-低分化腺癌7例;腹部CT均发现胃壁异常增厚,4名患者发现其胃周可见肿大淋巴结。
2.3治疗及病理情况9例患者住院并经过外科手术治疗,8例行根治性手术,1例为姑息手术,围手术期未出现严重并发症,术后病理提示,7例患者手术时已有淋巴结转移。根据《NCCN胃癌临床实践指南》2015年第3版,9例患者的术后临床病理分期为II期2例、III期3例、IV期4例,所有患者病理证实为HAS,并行免疫组化检测(见图1~2)。术后有7例患者经过了不同疗程的化疗。
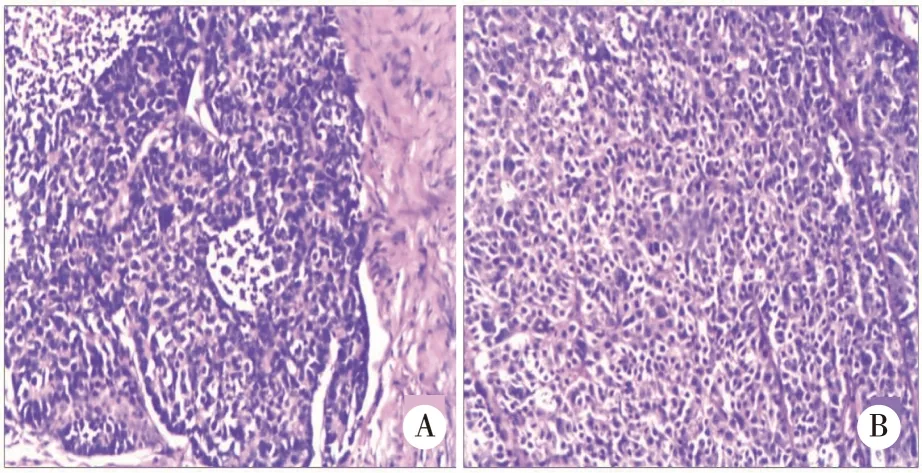
A:肝样分化区;B:肿瘤细胞呈巢状或实团状排列。图1 胃肝样腺癌肝样分化区HE染色结果(×400)

A:AFP(+);B:Hepatocyte(+)。图2 胃肝样腺癌免疫组化检测结果(×400)
2.4预后情况在接受手术及化疗后,除1例患者术后时间较短无法随访预后,其他8例患者均随访至2016年3月,1 例患者存活12月,术后血清AFP 水平降为正常且未出现再次升高,另外7例患者AFP 持续或再次升高,随访至死亡(生存期为5~32个月),其中1例患者术后经过规范化疗1年后,因上腹部不适再次入院,检查发现肝脏巨大占位,AFP达1 656.5 ng/mL,经过介入治疗后,其AFP水平再次下降(见表1)。
表19例胃肝样腺癌临床资料
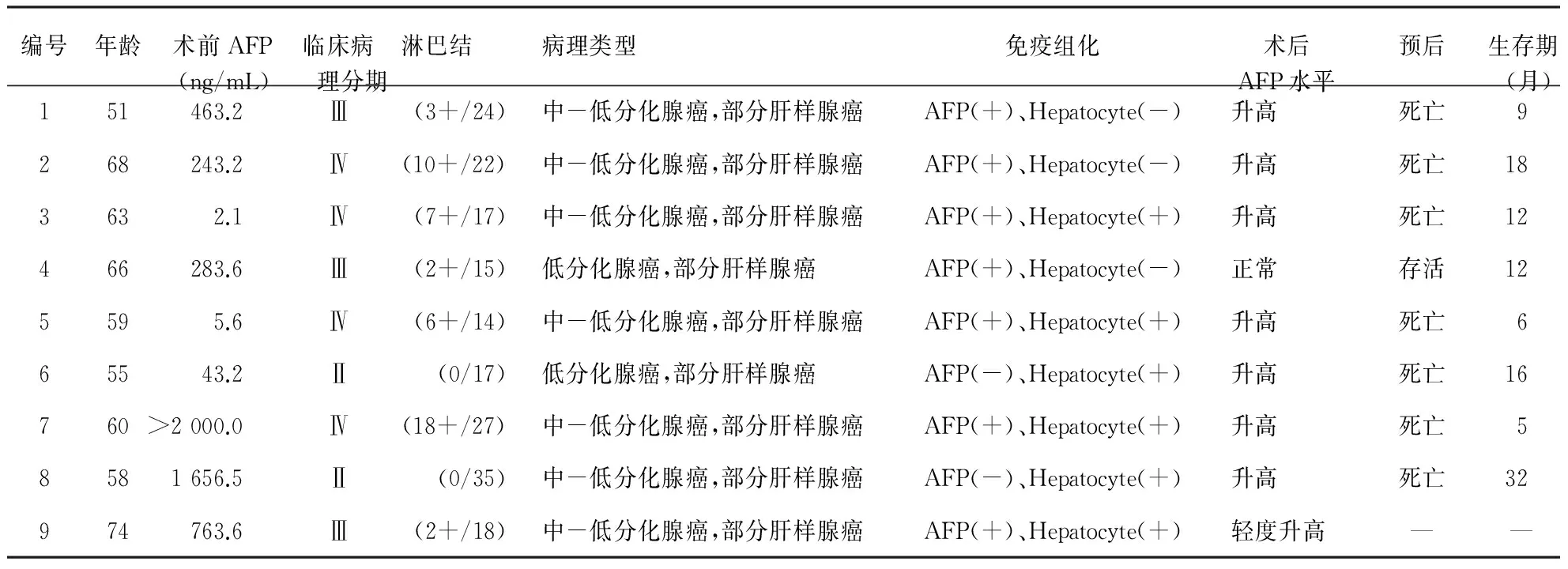
编号年龄术前AFP(ng/mL)临床病 理分期淋巴结病理类型免疫组化术后AFP水平预后生存期(月)151463.2Ⅲ(3+/24)中-低分化腺癌,部分肝样腺癌AFP(+)、Hepatocyte(-)升高死亡9268243.2Ⅳ(10+/22)中-低分化腺癌,部分肝样腺癌AFP(+)、Hepatocyte(-)升高死亡183632.1Ⅳ(7+/17)中-低分化腺癌,部分肝样腺癌AFP(+)、Hepatocyte(+)升高死亡12466283.6Ⅲ(2+/15)低分化腺癌,部分肝样腺癌AFP(+)、Hepatocyte(-)正常存活125595.6Ⅳ(6+/14)中-低分化腺癌,部分肝样腺癌AFP(+)、Hepatocyte(+)升高死亡665543.2Ⅱ (0/17)低分化腺癌,部分肝样腺癌AFP(-)、Hepatocyte(+)升高死亡16760>2000.0Ⅳ(18+/27)中-低分化腺癌,部分肝样腺癌AFP(+)、Hepatocyte(+)升高死亡58581656.5Ⅱ (0/35)中-低分化腺癌,部分肝样腺癌AFP(-)、Hepatocyte(+)升高死亡32974763.6Ⅲ(2+/18)中-低分化腺癌,部分肝样腺癌AFP(+)、Hepatocyte(+)轻度升高——
3讨论
20世纪70年代Bourreille、Ishikura等先后报道了可以产生AFP的胃腺癌并以肝样腺癌命名,目前世界各地陆陆续续仅报道数百例,极为少见。肝样腺癌原发部位以胃部最常见,即HAS,约占全部肝样腺癌的83.9%,少数肝样腺癌还可原发于结肠、食管、肺部、泌尿生殖系统等部位。HAS在胃恶性肿瘤中所占的比例极低,文献报道其只占全部胃腺癌的0.3%~1%[2-3],与本院的数据结果(0.5%)大致相同。胃癌的发生很少直接从正常胃黏膜上皮产生,在癌变之前多经历一段相当长的演变过程,胃黏膜异型增生和肠化生认为是胃癌前病变[4]。到目前为止,对于HAS的产生机制研究尚不完全明了,可能的机制为胃及肝脏在胚胎发育中同起源于内胚层,由原始前肠发生而来,两脏器在组织胚胎学上联系密切,在肿瘤的发生过程中,一些原发性胃癌癌细胞组织分化异常,导致其向肝细胞分化,从而发展成HAS,并产生甲胎蛋白(AFP)[5]。少数HAS患者的血清AFP水平并不增高,本院病历资料显示,7例患者血清AFP明显增高,2例患者血清 AFP 正常。
根据统计,HAS以老年男性多发,男性约占70.0%,男女比例2.3:1,平均发病年龄63.5岁;HAS好发于胃窦部、胃体部,而贲门及胃底部少见;肿瘤以浸润溃疡型为主,占61.7%[6];临床症状主要以腹痛、腹胀、黑便等上消化道症状为主,症状缺乏特异性。本院9例患者统计结果与此相似,除1例为女性外,其他均为男性(88.9%),平均年龄61.6岁,8例患者肿瘤位于胃窦部及胃体部(88.9%);目前对于胃肝样腺癌的术前诊断较为困难,因胃镜活检钳夹的组织少而薄浅,HAS肝样分化区所占比例小且往往位于肿瘤深部,有统计显示,胃镜活检阳性率很低,仅9.3%[7]。临床上大多数患者需要在术后切除标本后,依靠病理及免疫组化结果方能确诊。虽然AFP升高程度在HAS的诊断中有重要意义,然而,仍有小部分HAS患者虽病理结果显示确有肝样分化区,但血清AFP水平并不升高,Inagawa等[6]报道,70%~80%HAS患者血清AFP升高,认为其高低与肿瘤的分化程度有关,部分患者血清AFP在正常水平,说明肿瘤分化程度比较低。因此,血清AFP的水平高低并不能作为确诊依据,不论其是否产生AFP,凡病理学检查出现肝样分化区,即可诊断为HAS。免疫组化染色时,85%~95%病例可表现为AFP(+),30%~83.3%有Hepatocyte(+)[8]。本院9例确诊HAS患者中,术前胃镜活检均未发现HAS,血清AFP检测,除2例患者AFP水平经多次检测并不增高,其他7例患者AFP水平差距悬殊,从稍增高到超过2 000 ng/mL不等。7例患者AFP(+)(77.8%),6例患者Hepatocyte(+)(66.7%)。所有病例病理形态符合 HAS 且免疫组化染色结果典型。
HAS的治疗以手术为主,辅以化疗、介入等综合治疗。根治性手术是HAS 的首选治疗方法,其手术原则与一般胃癌相似,根据NCCN指南,可行D2根治术,术后需要继续行化疗等综合治疗。对于就诊时已无法实行根治性手术者,治疗多采用以氟尿嘧啶、铂类等为主的方案进行化疗,但化疗的效果有限,据文献报道其有效率仅为15.4%~53.8%[9]。HAS常发生肝转移,介入治疗对于HAS的治疗也十分必要,主要采用经腹腔动脉干灌注治疗,可以增加肝脏局部的药物浓度,利于预防肝转移。
由于HAS早期症状缺乏特异性,恶性程度高,术前诊断困难,往往患者就诊时已是中晚期,HAS侵袭性强,文献报道显示其发生肝转移、淋巴结转移的比例较高,20.5%~45.5% HAS会发生肝转移,淋巴结转移者可达43.8%~100%[10]。本院9例手术患者术前CT及术中探查未见肝转移,低于统计比例;7例患者术后病理证实已发生淋巴结转移(77.8%)。HAS患者的预后较差,文献报道其平均生存期为10~18月,1、3、5年生存率分别为 37.5%、12.5%和8.3%[11-12],而血清AFP水平对于检测HAS预后有重要作用,可以用于监测HAS的复发与转移,若术后患者AFP不降反升,或者正常后再次升高,应考虑肿瘤复发或转移。对于HAS患者应密切随诊,内容应包括影像学检测、血清AFP测定等。本院病例中,1例患者术后时间较短无法随访预后,截止到末次随访时1例患者存活12个月,术后血清AFP 水平降为正常且未出现再次升高;另外7例患者在接受手术及化疗后,AFP 持续升高或再次反弹,预后不佳(生存期为5~32个月,平均13.8个月)。
HAS是一种少见的特殊类型胃癌,容易发生淋巴结以及肝脏转移,预后较差。由于其临床表现缺乏特异性、临床医生对其认识不足等多方面原因,往往难以诊断及治疗,导致发现时多已是晚期,临床医师应当提高对HAS的认识,由于大多数HAS具有产生AFP的能力,在早期即可出现AFP水平升高,对于临床疑似胃癌患者,行血清AFP测定或在胃镜检查同时加做血清AFP测定,有利于早期发现HAS;对于体检发现AFP升高的患者,缺乏影像学证据证明病变位于肝脏时,可加做胃镜排除HAS,从而争取早发现早治疗。针对HAS的治疗,主要是施以根治性手术为主,化疗、介入治疗为辅的综合治疗。血清AFP水平同时对于检测HAS预后有重要作用,可以用于监测HAS的复发与转移,对于HAS患者治疗后应密切随诊,内容应包括影像学检查、血清AFP测定等。
[参考文献]
[1] 李楠,冯振中,谷从友,等.胃肝样腺癌的临床病理特征[J]. 中国组织化学与细胞化学杂志,2013,22(1):75-78.
[2] Baek S K,Han S W,Oh D Y,et al.Clinicopathologic characteristics and treatment outcomes of hepatoid adenocarcinoma of the stomach, a rare but unique subtype of gastric cancer[J]. BMC Gastroenterol,2011,11:56.
[3] Liu X,Cheng Y,Sheng W,et al.Analysis of clinicopathologic features and prognostic factors in hepatoid adenocarcinoma of thestomach[J].Am J Surg Pathol,2010,34(10):1465-1471.
[4] 伍冬梅,李春鸣.Bcl-2、Bax在胃癌及胃癌前病变中的表达与细胞凋亡的关系[J]. 遵义医学院学报,2014,37(2):201-203.
[5] Kinjo T,Taniguchi H,Kushima R,et al.Histologic and immunohistochemical analyses of α-fetoprotein-producing cancer of the stomach[J].Am J Surg Pathol,2012,36(1):56-65.
[6] Inagawa S,Shimazaki J,Hori M,et al.Hepatoid adenocarcinoma of the stomach[J].Gastric Cancer,2001,4(1):43-52.
[7] 刘巍,吴志勇.胃肝样腺癌[J].中华外科杂志,2007,45(15):1069-1071.
[8] Metzgeroth G,Strobel P,Baumbusch T,et al.Hepatoid adenocarcinoma-review of the literature illustrated by a rare case originating in the peritoneal cavity[J].Onkologie,2010,33(5):263-269.
[9] Yang J,Wang R,Zhang W,et al.Clinic pathological and prognostic characteristics of hepatoid adenocarcinomaof the stomach[J].Gas-troenterol Re Practice,2014,14(5):2185-2187.
[10] 李小毅,钟定荣,刘洪沨,等.胃肝样腺癌11例分析[J].癌症进展,2012,10(2):182-186,198.
[11] 宋志远,孔棣.胃肝样腺癌的诊治研究进展[J].山西医药杂志,2012,41(8):802-803.
[12] Yao L T,Xu H M.Clinic pathological features,immunohistochemisty and prognosis of gastric hepatoid adenocarcinoma[J].Chin J Gas-trointestinal Surgery,2014,17(2):196-200.
[收稿2016-04-11;修回2016-05-10]
(编辑:陈娅)
[中图法分类号]R735.2
[文献标志码]B
[文章编号]1000-2715(2016)03-0310-04
Hepatoid adenocarcinoma of stomach: A report of 9 cases
ZhangZhengrong,WuJian
(Department of Gastrointestinal Surgery,The First Affiliated Hospital of Wannan Medical College, Wuhu Anhui 241000,China)
[Abstract]Objective To explore the clinical characteristics of hepatoid adenocarcinoma of stomach (HAS) and its diagnosis,treatment and prognosis.Methods Retrospective analysis in January 2012 to March 2016 of 9 cases diagnosed as HAS associated symptoms and signs of patients, preoperative imaging and AFP cases, surgery, postoperative pathological and follow-up data related to prognosis were performed.Results The mean age of the 9 cases was 61. 6 years, in which 8 cases were male. Before treatment the serum AFP rise in 7 cases, 8 cases located in the distal and gastric body,gastroscope pathological results: 2 patients were of low differentiation and 7 patients were of middle low differentiation; Abdominal CT have found local stomach wall thickening, enlarged lymph nodes visible around the stomach in 4 cases. 8 cases were performed surgery, radical surgery, gross specimen were ulcer type, clinical pathologic staging for stage III in 3 cases, stage IV in 4 cases.For follow-ups, 1 patient of shorter postoperative time was unable to follow-up.As of the last follow-up, 1 patient survived for 12 months; The other 7 patients after surgery and chemotherapy, AFP continued or increased again, failed to achieve long-term survival (survival period of 5-32 months).Conclusion HAS is A special kind of cancer of the stomach, prone to lymph node and liver metastasis, HAS is often detected in late stages, the clinical curative effect is poor. Surgeons should take it seriously.
[Key words]stomach cancer;hepatoid adenocarcinoma of stomach;alpha fetoprotein

