非霍奇金淋巴瘤中p16基因微卫星不稳定和杂合性缺失
李龙萍,匡小燕,李化梅,邓 飞
(1.贵阳市公共卫生救治中心 病理科, 贵州 贵阳 550004;2.遵义医药高等专科学校附属医院 病理科, 贵州 遵义 563002; 3.遵义医学院附属医院 病理科,贵州 遵义 563099)
(编辑:王静)
非霍奇金淋巴瘤中p16基因微卫星不稳定和杂合性缺失
李龙萍1,匡小燕2,李化梅2,邓飞3
(1.贵阳市公共卫生救治中心 病理科, 贵州 贵阳550004;2.遵义医药高等专科学校附属医院 病理科, 贵州 遵义 563002; 3.遵义医学院附属医院 病理科,贵州 遵义563099)
[摘要]目的 探讨p16基因微卫星不稳定性(microsatellite instability,MSI)和杂合性缺失(loss of heterozygosity ,LOH)与非霍奇金淋巴瘤(Non-Hodgkin’s lymphoma,NHL)发生发展的关系。方法 选择p16基因内部4个微卫星位点D9S265、D9S161、D9S259、D9S169,从石蜡包埋的存档标本中选取40例NHL组织和其对应的自身正常对照组织,提取DNA进行PCR扩增,应用PCR-SSCP技术进行MSI和LOH分析。结果 NHL组织中p16基因内部4个微卫星位点D9S265、D9S161、D9S259、D9S169。①各位点MSI频率介于12.5%~27.5%,其中D9S259位点MSI频率最高为11/40(27.5%),D9S161位点MSI频率最低为5/40(12.5%);各位点LOH频率介于12.5%~17.5%,其中D9S169位点LOH频率最高为7/40(17.5%),D9S259位点LOH频率最低为5/40(12.5%)。②NK/T细胞淋巴瘤D9S161和D9S259位点MSI阳性组均高于B细胞淋巴瘤MSI阳性组,而D9S265和D9S169则与之相反(P>0.05)。NK/T细胞淋巴瘤D9S265位点LOH阳性组与B细胞淋巴瘤LOH阳性组比较,两者之间差异有显著统计学意义(P<0.01)。结论 ①NHL中p16基因既存在MSI,又存在LOH,p16基因可能是NHL候选抑癌基因之一。②微卫星位点D9S265、D9S169与B细胞淋巴瘤关系较紧密,而D9S161、D9S259与NK/T细胞淋巴瘤关系较紧密。
[关键词]非霍奇金淋巴瘤;p16基因;微卫星不稳定性;杂合性缺失
非霍奇金淋巴瘤(Non-Hodgkin’s lymphomaNHL)是一类侵犯淋巴结或结外淋巴组织的淋巴系统恶性肿瘤。我国NHL约占恶性肿瘤的3%~4%[1],为恶性肿瘤第8位[2]。研究证实,抑癌基因位点附近常频发微卫星DNA不稳定性的改变[3]。p16蛋白是抑制CDK4的重要因子,在人类细胞遗传学中研究发现肿瘤细胞的9号染色体断臂9p21区域有高频率的纯合缺失。有关非霍奇金淋巴瘤p16基因微卫星位点的MSI和LOH的研究国内外报道较少。
1 资料与方法
1.1一般资料所采用的标本均取自2004年4月至2007年12月遵义医学院附属医院病理科已病理确诊的NHL石蜡挡案材料40例:B细胞肿瘤27例(见图1),NK/T细胞肿瘤13例(见图2);所有标本均为4%福尔马林固定,石蜡包埋的组织。其中男30例,女10例,年龄5~75岁,平均年龄40岁。各病例中相对应患者的外周血白细胞或肿瘤旁的正常组织,共40例,作为MSI和LOH分析的对照。
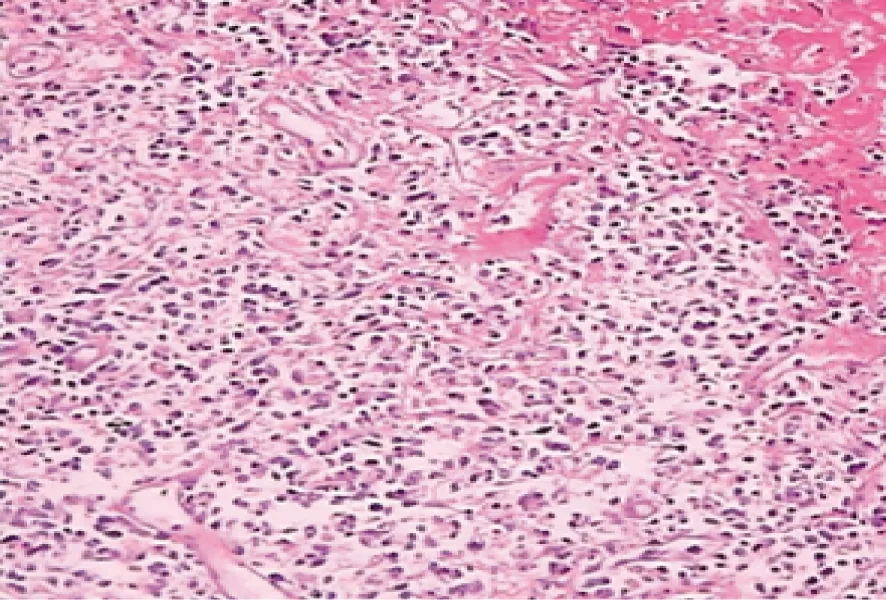
瘤细胞大小不等、形态多样,有核分裂和核碎片散布。图2 NK/T细胞性淋巴瘤HE染色(HE×200)
1.2引物设计选取p16基因内部4个微卫星位点:D9S265、D9S161、D9S259、D9S169,其位点示意图(见图3)。其引物设计参照Gene Bank,PCR所用引物由上海生工公司合成(见表1)。
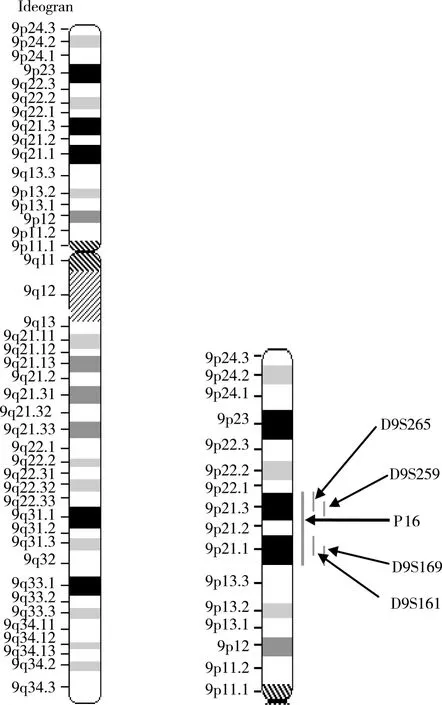
图3 p16基因内部所选4个微卫星位点示意图
表1p16基因内部4个微卫星位点引物序列及扩增片段大小

染色体位点引物序列扩增片段D9S265上游引物:TGGTGAAGCCTATTCTTGGT88~90下游引物:CATTGGCAAAGTGTGCGD9S161上游引物:TGCTGCATAACAAATTAC-CAC121~133下游引物:CATGCCTAGACTCCTGATCCD9S259上游引物:GGCATCATTGCNCCAT138~138下游引物:GGATGGATCTTATGGGTG-GAAD9S169上游引物:AGAGACAGATCCAGATCCCA259~269下游引物:TAACAACTCACTGATTATTTA-AGGC
1.3实验方法
1.3.1DNA提取及浓度判定石蜡包埋组织切片厚度为8 μm,每个标本切3~4块,光镜下微切割分离肿瘤和正常组织。石蜡切片经脱蜡后使用德国qiagen公司DNA提取试剂盒抽提基因组DNA,全血基因组DNA使用BBI公司分离试剂盒提取DNA做对照,-20 ℃冰箱保存备用。
1.3.2MSI位点引物的PCR扩增 PCR反应体系(体积50 μL):10×Buffer 5 μL, MgCl2(25 mmol/L) 4 μL,上游及下游引物0.5 μmmol/L,dNTPS(10 mmol/L) 1 μL,模板DNA 3 μL,Taq酶2 U。PCR仪扩增:预变性:95 ℃,5 min;4 min时加Taq酶;变性:94 ℃,30 s;延伸:72 ℃,30 s,30次循环,72 ℃延伸5 min。
1.3.3 微卫星分析取PCR产物10 μL,加入5 μL变性载样缓冲液混合,95 ℃变性10 min,迅速冰上骤冷;上样于凝胶点样孔中,接通电源,在300 V电压下进行电泳5 min后调至160 V,电泳2~3 h。SSCP分析需放入4度冰箱中电泳至二甲苯青接近下缘时,关闭电源,取下凝胶,银染后观察结果。
1.3.4图像分析及测序采用全自动凝胶成像分析系统,利用Genesnap软件获取图像,Genetools软件(版本3. 0)分析凝胶成像。
1.4结果判定将NHL的肿瘤组织与相对应患者外周血白细胞PCR产物同时上样比较,若肿瘤组织某一等位基因出现条带的增多或位置的改变,即记录为MSI,若肿瘤某一等位基因条带完全缺失或密度降低50%以上,可记录为LOH。
1.5统计学方法采用SPSS 13.0统计软件进行分析。两组间比较采用连续性矫正χ2检验和确切概率法检验(continuity correctionain 2×2table, Fisher’s exact test in 2×2table),P<0.05为对比组间的差异有显著意义,P<0.01为对比组间的差异有显著意义。
2 结果
2.1NHL中p16基因内部4个微卫星位点的MSI和LOH发生率(见表2)。
2.1.1D9S265、D9S161、D9S259、D9S1694个位点MSI的总阳性率为50.0%(20/40),(见图4),各位点MSI频率介于12.5%~27.5%,分别为D9S265(22.5%)、D9S161(12.5%)、D9S259(27.5%)、D9S169(17.5%),其中D9S259位点MSI频率最高为27.5%,D9S161位点MSI频率最低为12.5%。
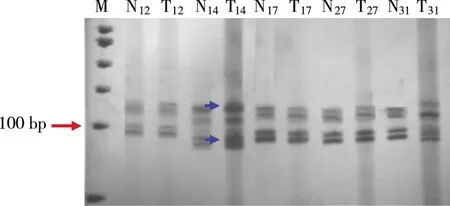
蓝色箭头:14#样本肿瘤组织DNA电泳条带较外周血白细胞DNA电泳条带增加,定为MSI。M:50 bp DNA ladder;T:肿瘤组织;下标:表示样本编号;N:相应对照。 图4 D9S265(90 bp)变性聚丙烯酰胺凝胶电泳图
2.1.2D9S265、D9S161、D9S259、D9S1694个位点LOH的总阳性率为37.5%(15/40),(见图5),各位点LOH频率介于12.5%~17.5%,分别为D9S265(15.0%)、D9S161(15.0%)、D9S259(12.5%)、D9S169(17.5%)。D9S169位点LOH频率最高为17.5%,D9S259位点LOH频率最低为12.5%。
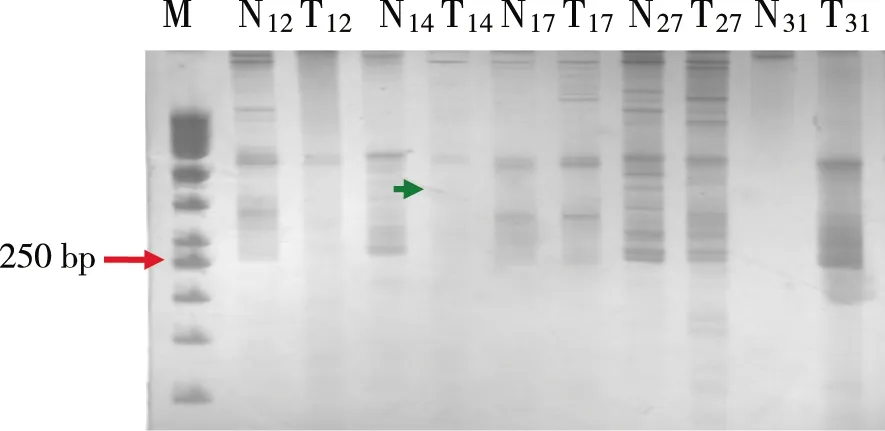
绿色箭头:14#样本肿瘤组织DNA电泳条带 较外周血白细胞DNA条带数量减少,定义为LOH。M:50 bp DNA ladder;T:肿瘤组织;下标:表示样本编号;N:相应对照。 图5 D9S169(260 bp) 变性聚丙烯酰胺凝胶电泳图
表2p16基因内部4个微卫星位点MSI和LOH发生率(%,n=40)

位点MSI阳性率LOH阳性率D9S2659(22.5)6(15.0)D9S1615(12.5)6(15.0)D9S25911(27.5)5(12.5)D9S1697(17.5)7(17.5)
2.2NHL中4个微卫星位点的MSI和LOH阳性率比较
2.2.1NK/T细胞淋巴瘤、B细胞淋巴瘤中4个微卫星位点MSI阳性率分别介于7.7%~23.1%、7.4%~25.9%,其中NK/T细胞淋巴瘤D9S259位点的MSI阳性组最高为23.1%,D9S265位点的MSI阳性组最低为7.7%。B细胞淋巴瘤D9S169位点的MSI阳性组最高为25.9%,D9S259位点的MSI阳性组最低为7.4%。NK/T细胞淋巴瘤D9S161和D9S259位点MSI阳性组的NHL发生率均高于B细胞淋巴瘤MSI阳性组,而D9S265和D9S169则与之相反(P>0.05)(见表3)。
表3NHL 4个微卫星位点的MSI阳性率比较

组别4个微卫星位点MSI阳性率(%)D9S265D9S161D9S259D9S169NK/T细胞淋巴瘤1/13(7.7)2/13(15.4)3/13(23.1)2/13(15.4)B细胞淋巴瘤6/27(22.2)4/27(14.8)2/27(7.4)7/27(25.9)P0.3310.9680.2040.110
分子表示NK/T、B细胞淋巴瘤例数,分母表示4个微卫星位点MSI+例数,括号内数字表示发生率(%),P值采用确切概率法计算。
2.2.2NK/T细胞淋巴瘤、B细胞淋巴瘤中4个微卫星位点LOH阳性率介于7.7%~23.1%、7.4%~25.9%,其中NK/T细胞淋巴瘤D9S259位点的LOH阳性组最高为23.1%,D9S265位点的LOH阳性组最低为7.7%。B细胞淋巴瘤D9S169位点的LOH阳性组最高为25.9%,D9S259位点的LOH阳性组最低为7.4%。NK/T细胞淋巴瘤D9S161、D9S259微卫星位点LOH阳性组均高于B细胞淋巴瘤LOH阳性组,而D9S265、D9S169则与之相反,其中NK/T细胞淋巴瘤D9S265位点LOH阳性组与B细胞淋巴瘤LOH阳性组比较(P<0.01),两者之间差异有显著统计学意义(见表4)。
表4NHL 4个微卫星位点的LOH阳性率比较

组别4个微卫星位点LOH阳性率(%)D9S265D9S161D9S259D9S169NK/T细胞淋巴瘤2/13(7.7)2/13(15.4)1/13(23.1)1/13(15.4)B细胞淋巴瘤3/27(22.2)5/27(14.8)6/27(7.4)3/27(25.9)P0.0010.0110.3410.759
分子表示NK/T、B细胞淋巴瘤例数,分母表示四个微卫星位点MSI+例数,括号内数字表示发生率(%),P值采用确切概率法计算。
3讨论
恶性淋巴瘤是高度异质性的淋巴系统恶性肿瘤,按肿瘤细胞来源可分为NK/T细胞淋巴瘤和B细胞淋巴瘤两大类,其发病率在全球逐年升高。在我国肿瘤登记地区,淋巴瘤的发病率和病死率居恶性肿瘤的第8位和第9位[4]。非霍奇金淋巴瘤治疗效果较低,为20%~40%,研究引起该疾病的相关基因及其途径,可以为增加NHL患者生存率作为新的靶点[5],新分子靶的发现用于治疗的发展。而我们确定的肿瘤抑制基因在这些NHL亚型通用的LOH区域内,牵连到B细胞淋巴瘤[6]。
微卫星(microsatellite, MS)是指一类由2~6个bp重复单位构成的DNA序列,多位于基因编码区附近[7]。微卫星不稳定(MSI)主要表现为DNA结构性等位基因的大小发生改变[8]。杂合性缺失(LOH)是一个位点上两个多态性的等位基因中的一个或两个出现缺失不能抑制恶性状态,细胞就转化为癌细胞。目前新近的LOH研究还牵连到PTPRJ(蛋白酪氨酸磷酸酶受体J型),为新颖肿瘤抑制基因,使用PTPRJ的激动剂肽和PTPRJ表达的微小RNA-328表达[9-10]致癌沉默。
p16基因又叫MTS(multiple tumor suppressor 1)基因,定位于人染色体9p21,由2个内含子和3个外显子组成。p16是比P53更重要的一种新型抗癌基因。有人把它比作细胞周期中的刹车装置,一旦失灵则会最终导致细胞进入恶性增殖,促进肿瘤的发生和发展[11]。徐锦屏等[12]的研究显示在NHL中p16蛋白阳性率43.9%,并与恶性程度相关。
利用微卫星多态性位点与抑癌基因紧密连锁的关系,本研究选取p16基因内部4个微卫星位点:D9S265,D9S259,D9S161,D9S169对40例NHL进行研究发现: 4个微卫星位点可以作为研究NHL的合适位点,MSI和LOH可能在NHL的发生中起一定作用。
本实验结果表明:NHL组织中p16基因内部4个微卫星位点D9S265、D9S161、D9S259、D9S169,各位点MSI频率介于12.5%~27.5%,其中D9S259的MSI发生频率最高为27.5%(11/40),提示此处可能与NHL相关,各位点LOH频率介于12.5%~17.5%,其中D9S169的LOH发生频率最高为17.5%(7/40),提示NHL可能与p16基因密切相关。NK/T细胞淋巴瘤D9S161和D9S259位点MSI阳性组均高于B细胞淋巴瘤MSI阳性组,提示D9S161、D9S259与NK/T细胞淋巴瘤关系紧密。提示NK/T细胞淋巴瘤D9S169和D9S265位点LOH阳性组均高于B细胞淋巴瘤LOH阳性组,D9S169、D9S265与B细胞淋巴瘤关系紧密。进而也提示了D9S169与p16基因及B细胞淋巴瘤发生关系较紧密。
总之,国内外研究发现,人类恶性肿瘤中相当普遍地存在p16基因的突变,微卫星具有高度多态性、稳定性好、突变率低(<0.04%)等特点。微卫星的不稳定增加了整个基因组的不稳定性,从而促进肿瘤的发生。从分子水平探讨NHL中p16基因与MSI与LOH之间的关系,将是判断NHL预后的一组具有重要意义的指标。
[参考文献]
[1] Ferlay J,shin H R,Bray F,et al.Estimates of worldwide burden of Cancer in 2008:GLOBOCAN 2008 [J].Cancer,2010,127(12):2893-2917.
[2] Hodges K B , Vnencak - Jones C L , Larson R S , et al. Rarity of genomic instability in pathogenesis of systemic anaplastic large cell lymphoma (ALCL) in immunocompetent patients [J].Hum Pathol,1999,30(2):173-177.
[3] Yamamoto H, Aawei H, Perucho M. Frameshift somatic mutations in gastrointestinal cancer of the microsatellite mutator phenotype[J].Cancer Res,1997,57(19):4420-4426.
[4] 张思维,雷正龙,李光林,等.中国肿瘤登记地区2006年肿瘤发病和死亡资料分析[J].中国肿瘤,2010,19(6):365.
[5] Federico M, Luminari S, Dondi A, et al. Brugiatelli M:R-CVP Versus R-CHOP Versus R-FM for the initial treatment of patients with advanced-stage follicular lymphoma: results of the FOLL05 trial conducted by the Fondazione Italiana Linfomi[J]. J Clin Oncol,2013,31(12):1506-1513.
[6] Aya-Bonilla C, Green M R, Camilleri E,et al. Griffiths LR:High-resolution loss of heterozygosity screening implicates PTPRJ as a potential tumor suppressor gene that affects Suscept-ibility to non-hodgkin’s lymphoma[J]. Genes Chromosom Cancer,2013, 52(5):467-479.
[7] Catasus L,Machin P,Matjasguju X,et al.Microsatellite in Stability in endonetrial carcinomas clinicopatholoigic Correlations in a series of 42 case[J].Hum Pathol,1998,29(10):1160-1164.
[8] Ionov Y,peinado M A,Malkhoayan S,et al. Ubiquitous somatic mutation in simple repeated sequences reveal a new Mechanism for colonic carcinogenesis[J].Nature,1993,363(184):558-561.
[9] Ortuso F, Paduano F, Carotenuto A, et al. Trapasso F:Discovery of PTPRJ agonist peptides that effectively inhibit in vitro cancer cell proliferation and tube formation.ACS Chem Biol,2013,8(7):1497-1506.
[10] Paduano F, Dattilo V, Narciso D, et al. Iuliano R: Protein tyrosine phosphatase PTPRJ is negatively regulated by microRNA-328. Febs J,2013, 280(2):401-412.
[11] Kamb A,Gruis N A,Weaver-Feldhaus J,et al.A cell cycle regulator potentially involved in genesis of many tumor types[J].Science,1994,264(5157):436-440.
[12] 徐锦屏,陈汉松,王双珠.p16蛋白和PCNA在非霍奇金淋巴瘤中的诊断价值[J].河南肿瘤学杂志,2001,14(1):6-7.
[收稿2015-12-30;修回2016-03-10]
(编辑:王福军)
[基金项目]国家自然科学基金资助项目(NO:30160030)。
[通信作者]邓飞,男,博士,教授,硕士生导师,研究方向:恶性淋巴瘤,E-mail:mdproffeideng@hotmail.com。
[中图法分类号]R733.4
[文献标志码]A
[文章编号]1000-2715(2016)03-0284-05
Non-hodgkin’s lymphoma ofp16 gene microsatellite instability and loss of heterozygosity
LiLongping1,KuangXiaoyan2,LiHuamei2,DengFei3
(1.Department of Pathology,Guiyang Public Health Center, Guiyang Guizhou 550004,China;2.Department of Pathology,Affiliated Hospital of Zunyi City Pharmaceutical College, Zunyi Guizhou 563002,China;3.Department of Pathology,Affiliated Hospital of Zunyi Medical University,Zunyi Guizhou 563099,China)
[Abstract]Objective To study the p16 gene microsatellite instability (MSI) and loss of heterozygosity (LOH) and non-hodgkin's lymphoma (NHL).Methods Choose p16 gene within four microsatellite loci D9S265, D9S161, D9S259, D9S169, archive samples from paraffin embedding of 40 cases of NHL tissues and corresponding normal control group, to extract the DNA for PCR amplification, application of PCR -SSCP technology for MSI and LOH analysis.Results ① p16 gene in NHL organization was within four microsatellite loci D9S265, D9S161, D9S259, D9S169 . MSI frequency was between 12.5% - 27.5%, D9S259 loci MSI frequency up to 11/40 (27.5%), D9S161 loci MSI lowest frequency was 5/40 (12.5%).D9S265, D9S161, D9S259, D9S169 LOH frequency was between 12.5% - 17.5%. Including site D9S169 LOH frequency was up to 7/40 (17.5%), D9S259 loci LOH frequency min. 5/40 (12.5%).② In NK/T cell lymphoma D9S161 and D9S259 loci MSI positive group were higher than that of group B cell lymphoma MSI positive, while D9S265 and D9S169 in contrast (P>0.05). NK/T cell lymphoma D9S265 loci LOH positive group compared with B cell lymphoma LOH positive group (P<0.01), there are significant differences between the two groups.Conclusion ① the p16 gene exists in non-hodgkin's lymphoma microsatellite instability and loss of heterozygosity; p16 gene may be one of NHL candidate tumor suppressor genes.② Microsatellite loci D9S265, D9S169 and B cell lymphoma are closely related, while D9S161, D9S259 and NK/T cell lymphoma are closely related.
[Key words]non-hodgkin's lymphoma; p16 gene; microsatellite instability;loss of heterozygosity
临床医学研究

