细胞自噬与细胞凋亡在细胞中的作用
陈金东
(罗切斯特大学医学中心 泌尿科肾癌研究室,罗切斯特 纽约 14642,美国)
候鸟之窗
细胞自噬与细胞凋亡在细胞中的作用
陈金东
(罗切斯特大学医学中心 泌尿科肾癌研究室,罗切斯特 纽约14642,美国)
[摘要]细胞自噬与细胞凋亡在功能上的关系复杂微妙。细胞自噬,也可说成是自食(self-eating),其结果是导致细胞内一部分受损或多余的老化的蛋白和细胞器被吞噬和降解或消化,使细胞更利于生存;而细胞凋亡,是一种细胞自杀(self-killing)过程,最终导致整个细胞死亡,所有细胞成分均被其它活细胞降解和消化。在受环境条件影响较少时,细胞自噬抑制细胞凋亡。然而,当自噬使细胞内蛋白和细胞器过量消耗,致使细胞无法继续生存下去时,细胞即会转化成凋亡。在个别情况下,自噬也可引起细胞死亡。值得一提的是,自噬和凋亡涉及到很多与凋亡有关的蛋白, 例如p53和BH3-only蛋白等。在癌细胞形成的早期,自噬抑制癌细胞生成;而在癌细胞形成后,癌细胞利用自噬来促进癌细胞生存,抑制细胞凋亡,从而可能导致癌细胞对化疗药物产生抗药性。因此,如果在化疗时,同时对细胞自噬进行抑制,将有利于增强治疗效果。
[关键词]细胞自噬;细胞凋亡;细胞程序化死亡;癌症;p53;BH3-only
近年来细胞自噬和细胞凋亡引起了广大科研工作者的兴趣。细胞自噬涉及细胞自食,即细胞将细胞内多余或受损的蛋白及细胞器清理掉,使细胞继续生存下去。相反,细胞凋亡通过细胞内的遗传机制有序地使细胞走向死亡,最终整个细胞的成分被消化降解。因此,正常情况下,细胞自噬起着保护细胞的作用;而细胞凋亡则负责清除老化受损的或突变的细胞,从而保护个体的健康。细胞自噬和细胞凋亡在细胞内都是有序地进行的遗传机制。
细胞自噬首先形成自噬膜,自噬膜一般由细胞内线粒体或内质网膜脱落形成(见图1)。有时高尔基体和细胞质膜也可形成自噬膜(isolation membrane); 接着自噬膜将细胞内不要的蛋白质和细胞器包裹起来,形成自噬泡(autophagosome); 自噬泡随后与细胞内溶酶体融合,形成自噬溶酶体(autolysosome), 溶酶体内的酶将蛋白和细胞器水解消化,释放出来的小分子营养物质可供细胞利用。
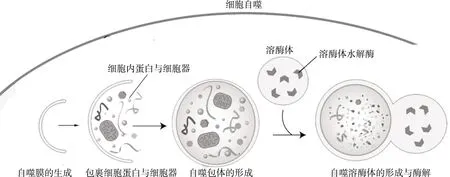
图1 细胞自噬的过程
细胞凋亡是几类细胞程序化死亡之一(见图 2),涉及到一系列的细胞形态学变化如细胞核浓缩(pyknosis)和片段化(karyorrhexis),质膜皱褶泡化(blebbing),并形成凋亡体(apoptotic bodies)而被分解消化。细胞凋亡伴随著一系列的生化改变,包括线粒体外膜透化(mitochondrial outer membrane permeabilization,MOMP), 半胱天冬酶(caspase)3、半胱天冬酶6和半胱天冬酶7的激活,以及分解代谢水解酶的活化。

图2 细胞凋亡的过程
细胞自噬与细胞凋亡的关系复杂,虽然自噬与凋亡可在同一细胞内发生,但自噬与凋亡是相互抑制的。当细胞受环境压力较小时,细胞启动自噬机制克服压力,避免细胞死亡;但当环境压力加大或持续过长时,细胞自噬过度消耗细胞内的蛋白和细胞器而使细胞无法继续生存,这时细胞启动凋亡程序并抑制自噬,使细胞进行程序化死亡。本文就细胞自噬和凋亡在癌细胞中的作用关系作一综述。
1细胞自噬与细胞凋亡之间的相互作用
1.1细胞自噬抑制细胞凋亡尽管自噬和凋亡在同一细胞内受相同上游信号的控制,但二者在细胞内的作用是彼此抑制的。自噬抑制凋亡的一个主要机制是线粒体自噬(mitophagy)。线粒体是决定生存或死亡的场所,MOMP的出现是线粒体受损的主要标志,也是诱导细胞进入凋亡的开始。MOMP会引起代谢水解酶(catabolic hydrolases)和半胱天冬酶激活子从线粒体中释放,并导致线粒体内膜受损。代谢水解酶包括凋亡诱导因子(apoptosis-inducing factor, AIF)和核酸内切酶G(endonuclease G),而半胱天冬酶则包括细胞色素C(cytochrome c)和SMAC(second mitochondria-derived activator of caspase)。这些酶一旦释放到细胞质中,就会降解细胞内的蛋白,造成不可挽回的细胞死亡。因此,受损的线粒体特别容易引起细胞凋亡。然而,当线粒体出现MOMP时,细胞内的自噬激活因子也会同时被激活,致使细胞启动自噬来挽救细胞。自噬就会对受损的线粒体进行捕捉并将其降解消除,以防止细胞进行凋亡。
为了抑制细胞凋亡,自噬会选择性的捕捉并修饰已经被凋亡机制泛素化的蛋白,使其能与一系列自噬受体如SQSTM1(sequesttosome 1)及p62结合,并与自噬相关蛋白LC3反应,同时自噬也会选择性的除去激活的凋亡蛋白caspase 8。此外,自噬还会修饰SRC激酶,使修饰过的SRC与E3泛素蛋白连接酶CBL结合,由于CBL带有LC3结合区,能和自噬相关蛋白LC3作用,从而避免凋亡的进一步发生。
1.2细胞凋亡抑制细胞自噬当外界环境压力远远超过了细胞承受力或承压过长时,自噬已无力挽救细胞,这时细胞自杀机制就会启动。细胞凋亡是常被启动的细胞程序化死亡机制。一旦细胞凋亡启动,半胱天冬酶就被高度激活,并切割多种蛋白,促使细胞凋亡进入程序。同时,半胱天冬酶还会消化几种重要的自噬蛋白,使细胞自噬程序处于瘫痪状态,终止细胞的自我保护功能,加速细胞死亡。为了终止细胞自噬,半胱天冬酶将首先切割降解自噬通路中的ATG3和Beclin-1。这是因为ATG3和Beclin-1是自噬程序中的起始因子。此外,自噬程序中的另一个蛋白AMBRA1(activating molecule in BECN1-regulated autophagy1)也会被降解。这样,细胞自噬就被抑制。另外,几种自噬蛋白被半胱天冬酶降解后,其被降解的蛋白片段被转化具有促细胞凋亡功能的片段。例如,当Beclin-1被半胱天冬酶3、6或9切割后,便成为具有BH3区域的羧基末端片段,和线粒体结合后促使线粒体发生MOMP而释放细胞色素c[1];ATG4D被半胱天冬酶3切割后的片段也具有类似BH3区域,从而也具有促细胞凋亡的功能[2];ATG5被钙蛋白酶(calpain)降解后产生了一个氨基末端片段能转位到线粒体,使细胞对凋亡敏感。ATG5片段还能和BCL-XL相互作用促使细胞发生凋亡[3]。尽管这些片段促细胞凋亡的具体机制尚不明确,但这些现象的出现说明ATG4D、ATG5及Beclin-1不只是细胞自噬所有,而且也可转化为被细胞凋亡所用的蛋白前体(precursors),被细胞凋亡所用时,可加速细胞死亡。
1.3细胞自噬介导的细胞死亡尽管细胞自噬被认为是保护细胞生存的,但在个别情况下,自噬也能引起了两类细胞死亡。一类是自噬细胞死亡(autophagic cell death,ACD)。ACD指的是通过自噬引起的细胞死亡。当ACD发生时,几种可以防止细胞死亡的自噬必需的基因或蛋白被去除,致使细胞自噬被抑制。其细胞死亡过程不是由细胞凋亡或细胞坏死造成的,而是由细胞自噬介导的。另一类是细胞自噬促使细胞凋亡的激活而导致细胞的死亡。一些自噬通路中的蛋白也起着促细胞凋亡的作用。如一些自噬相关的ATG基因不只是参与细胞自噬,还参与诸如细胞内吞(endocytosis)和蛋白分泌[4-5]。那么,自噬是在哪一步激活细胞凋亡的呢?研究表明,是在自噬泡体(autophagosome)形成时激活细胞凋亡的,也就是在自噬的早期阶段,而不是在晚期的降解阶段刺激凋亡发生的。例如,当用盘鞘氨醇激酶抑制剂SKI-I和蛋白酶抑制剂硼替佐米(bortezomib)处理细胞后,自噬体形成导致了半胱天冬酶8(caspase 8)的激活。而用溶酶体抑制剂bafilomycin A 抑制自噬晚期时,并不见明显的caspase 8 激活。目前尚不知自噬体是如何激活caspase 8 的。除了以上提到的蛋白外,还有很多蛋白如p53 和BH3-only蛋白在自噬和凋亡中也起着重要的作用。
2p53和BH3-only蛋白在细胞自噬和凋亡中的作用
2.1p53蛋白在细胞自噬和凋亡中的作用肿瘤抑制蛋白p53在DNA受损和营养缺乏时都会被激活。通常p53存在于细胞质中,但当DNA受损后,p53就会被多种激酶磷酸化而移位到细胞核,参与DNA修复。在正常情况下,p53 在细胞质中是抑制细胞自噬的,p53与自噬相关蛋白FIP200作用,阻断了ULK1-FIP200-ATG13-ATG101复合物的形成,从而抑制了自噬泡体的形成[6-7]。因此,通常情况下,p53在细胞质中是抑制自噬的。可是当细胞内外环境发生变化,DNA受损时,大量p53 蛋白转移至细胞核,解除了对细胞自噬的抑制, 同时,p53在细胞核内转激活很多与细胞自噬有关的基因,如AMPK及mTOR通路相关基因和溶酶体相关的蛋白[8-10],促进自噬的发生。此外,一部分p53 蛋白也转移至线粒体基质中,与亲环蛋白D(cyclophilin D)作用促使线粒体上的渗透孔(permeability transition pore, PTP)打开。在生存压力不大的情况下,PTP的发生可以促使细胞自噬清除功能异常的线粒体[11]。然而,在严重情形下,PTP会导致MOMP的形成,可导致线粒体内大量酶释放,最终引起细胞凋亡。另外,p53也会转激活多个促凋亡基因,包括BCL-2家系成员BAXBIM/BCL2L11等,在必要时促使细胞凋亡。
2.2BH3-only蛋白在细胞自噬和凋亡中的作用BH3-only蛋白包括BAD、BID、BNIP3、NIX、NOXA和PUMA等。BH3-only蛋白有激活自噬和凋亡的双重作用。为了诱导细胞凋亡,BH3-only蛋白会直接与BCL2家系成员结合,消除其抗凋亡的作用,同时激发那些蛋白的促凋亡功能。通过指导这些蛋白在细胞内的定位、磷酸化及相互作用等复杂程序引起凋亡反应。另一方面,BH3-only又可通过解除Beclin-1与促凋亡的BCL-2家系蛋白或MCL1的相互作用引起细胞自噬。例如,当Beclin-1与BCL-2或BCL-XL分开,然后激活自噬相关蛋白VPS34,Beclin-1与VPS34均能激活自噬反应。此外,BH3-only蛋白NIX与自噬蛋白轻链3(LC3)的同源蛋白GABARAP(GABA受体相关蛋白)作用,促进自噬的发生。另一方面,BIM又可直接结合DLC1(dynein light chain 1),抑制Beclin-1及自噬反应[12]。因此, BIM是BH3-only蛋白组中一个抑制自噬并诱导凋亡的蛋白。其实,不只是BIM,还有其它一些与Beclin-1相关的蛋白都在细胞自噬和凋亡中起着双重作用。但BH3-only蛋白在二者中的具体作用机制还有待进一步研究。
3自噬和凋亡在癌症中的作用
3.1肿瘤抑制型自噬自噬和凋亡在癌细胞中的作用相当复杂。自噬像一把双刃剑,即可诱导凋亡抑制肿瘤生成,又可抑制凋亡促进肿瘤生长,这种抑制和促进作用可以根据细胞内情形而相互转化[13]。这种转换取决于以下几个因素:肿瘤所处生长期,细胞所处环境及细胞的组织类型。最近的研究发现,肿瘤抑制型自噬所激活的信号通路会压制致瘤信号的产生,诱导细胞凋亡,防止肿瘤的产生;相反,肿瘤促进性自噬通路会抑制凋亡程序,促使肿瘤生存和生长。我们先讨论一下肿瘤抑制型自噬。
自噬最初被认为是抑制肿瘤起始的。这是因为癌基因和抑癌基因的变异,如AKT扩增,PI3K突变,PTEN缺失都阻碍自噬的激活。也就是自噬防止细胞的癌变。此外,小鼠遗传学研究发现,如果自噬通路中的关键成员如ATG5、ATG7和Beclin-1发生变异致使自噬通路受损,一些与细胞凋亡的基因也受到抑制,自噬这时不能有效诱导凋亡,肿瘤生长就会加速。在大多数情况下,自噬通路受损(如ATG5和ATG7突变)的小鼠产生的肿瘤是良性的。只有Beclin-1敲基因小鼠可生长恶性肿瘤。这些研究结果说明,自噬通路受损后,细胞产生肿瘤的机会增加。因此,细胞自噬具有抑制肿瘤生成。另外,自噬通路受损程度也许和肿瘤的恶性程度有关。例如, 自噬通路中ATG5和ATG7突变只导致良性肿瘤的产生,而Beclin-1的杂合子变异即可引起恶性肿瘤[14-17],这说明Beclin-1是自噬通路中较为重要的成员,它的突变可严重引起自噬和凋亡通路受损,从而导致恶性肿瘤的产生。这一点在人类的乳腺癌和卵巢癌的研究中得到了进一步的证实[18]。此外,自噬受损会导致活性氧类(reactive oxygen species,ROS)在细胞内的积累,使DNA损伤加大,引起线粒体缺陷,这些也和肿瘤生成有关。因此,自噬受损能导致肿瘤产生也就可理解了。另外,p62 是一种泛素结合蛋白,参与泛素蛋白酶体系统(ubiquitin-proteasome system, UPS)和自噬-溶酶体系统两种蛋白降解过程。在自噬缺陷的小鼠模型中去除p62基因可以减少肿瘤的生成,而过表达p62则会促进肿瘤的生长[17]。这说明,自噬可消除p62的聚集,从而抑制肿瘤的生长。
3.2自噬的致肿瘤作用尽管自噬和凋亡在所有组织中都有低度表达,以维持细胞的正常功能。现在越来越多的证据表明,自噬在多类肿瘤中均有高表达现象。例如,胰腺管腺癌(pancreatic ductal adenocarcinoma),Kras和B-raf引起的肺癌[19-20], 黑色素瘤和中枢神经系统肿瘤[21-23]中的自噬均增高,尤其是Ras高表达引起的肿瘤中,自噬表达增高尤其明显[24-27]。为何在正常细胞内自噬能诱导凋亡而抑制肿瘤细胞的产生,而在肿瘤细胞中自噬又如此活跃并促进肿瘤生长呢?这表明自噬是有选择性的。自噬是一个复杂的过程,涉及到多个信号传导通路,不同的信号传导通路及其成员在不同的细胞环境下起着不同的作用。在正常细胞中,自噬为了防止细胞癌变,启动了防癌的自噬通路,清除细胞内老化的、受损的蛋白质及细胞器,维护细胞的正常生理功能。相反,在癌细胞中,细胞的本质已经发生了变化,细胞已经被细胞内各种的肿瘤发生机制控制,细胞凋亡通路也被抑制,且由于肿瘤生长速度快,需要大量营养,很多情况下,细胞会容易处于一种缺氧的状态,低氧会诱导线粒体自噬来维持细胞生存;此外,基因组不稳定也会导致蛋白折叠出现错误,这就需要大量蛋白酶来降解不断聚集的折叠错误的蛋白,并且同时会产生大量泛素-蛋白酶,这些垃圾蛋白的大量聚集,势必威慑到癌细胞的生存,这时细胞为了生存而选择性地激活细胞内自噬受体,启动自噬通路,从而使癌细胞内的自噬十分活跃。
抑制自噬常常能抑制肿瘤的生长。研究已经证明,抑制自噬可以增强细胞凋亡,如用自噬抑制剂氯喹(chloroquine)或羟化氯喹(HCQ)在体外和体内均能有效抑制胰腺癌和肺癌的生长[24,28-30],此外,自噬抑制剂也可抑制肾癌细胞的生长。目前越来越多的研究都趋向于支持抑制自噬可以抑制肿瘤的观点[20,31-33]。由于氯喹和羟化氯喹已用于临床治疗其它疾病多年,将其用于癌症的临床治疗也应该是可行的[34]。氯喹和羟化氯喹主要是抑制溶酶体的功能,也就是阻碍了溶酶体与自噬体的结合,因此是抑制自噬过程的晚期阶段。此外,由于ULK1, VPS34 ,ATG7等激酶和蛋白酶ATG4b均为自噬相关的关键性成员,如果能利用这些成员的抑制剂进行治疗,将会增强治疗效果[35-36]。由于还有新的自噬相关的信号传递通路有待发现,这些通路的发现也将促进自噬抑制剂的鉴定。在癌细胞中,由于自噬涉及到蛋白酶和自噬双重系统,因此,在癌细胞的靶向治疗中,可以根据蛋白酶系统和溶酶体-自噬系统选择相应的靶向药物进行治疗,可以增强治疗效果[37]。
4细胞自噬与凋亡在癌症未来研究中的发展方向
自噬与凋亡是彼此紧密相关的。由自噬单方面引起细胞死亡的情况是很少的。在某些情况下,自噬或自噬通路中的某些成员会诱导细胞凋亡或细胞坏死。然而,在大多数情况下,自噬和凋亡是彼此相互抑制的。当自噬抑制凋亡时,自噬是起着抗凋亡的作用,而不是促进凋亡。在环境压力不利于细胞生存的早期阶段,或者压力较小的情况下,细胞进行自噬反应,而在环境压力过大或者时间过长时,自噬已无法挽救细胞生存时,自噬就会促使细胞进行凋亡。一旦凋亡启动,凋亡半胱氨天冬酶就会降解自噬相关蛋白,从而抑制自噬。在癌症中,癌细胞由于生长快速,导致癌组织中缺氧,在低氧压力下,细胞启动自噬以对抗凋亡来自救。同样化疗药物对癌细胞的杀伤作用所产生的生存压力,致使癌细胞启动自噬程序来抑制细胞凋亡,从而引起癌细胞对化疗药物产生抗性。因此,如果发生这种现象,就可考虑在进行化疗的同时,采用自噬抑制剂对自噬进行抑制,以促进癌细胞凋亡,将会提高化疗效果。因此,进一步研究癌细胞自噬的信号传导通路,鉴定出新的药物靶标,结合已有的自噬抑制剂和促细胞凋亡的化疗药物,将是癌症化疗研究的一个新方向。
[参考文献]
[1] Wirawan E, Vande Walle L, Kersse K, et al. Caspase-mediated cleavage of Beclin-1 inactivates Beclin-1-induced autophagy and enhances apoptosis by promoting the release of proapoptotic factors from mitochondria[J]. Cell Death Dis, 2010, 1: e18.
[2] Betin V M, and Lane J D. Atg4D at the interface between autophagy and apoptosis[J]. Autophagy, 2009,5(7):1057-1059.
[3] Yousefi S, Perozzo R, Schmid I, et al. Calpain-mediated cleavage of Atg5 switches autophagy to apoptosis[J]. Nat Cell Biol, 2006,8(10):1124-1132.
[4] Shravage B V, Hill J H, Powers C M, et al. Atg6 is required for multiple vesicle trafficking pathways and hematopoiesis in Drosophila[J]. Development, 2013,140(6):1321-1329.
[5] Manjithaya R,Subramani S. Autophagy: a broad role in unconventional protein secretion?[J]. Trends Cell Biol, 2011,21(2):67-73.
[6] Morselli E, Shen S, Ruckenstuhl C, et al. p53 inhibits autophagy by interacting with the human ortholog of yeast Atg17, RB1CC1/FIP200[J]. Cell Cycle, 2011,10(16):2763-2769.
[8] Budanov A V, Karin M. p53 target genes sestrin1 and sestrin2 connect genotoxic stress and mTOR signaling[J]. Cell, 2008,134(3):451-460.
[9] Gao W, Shen Z, Shang L,et al.Upregulation of human autophagy-initiation kinase ULK1 by tumor suppressor p53 contributes to DNA-damage-induced cell death[J]. Cell Death Differ, 2011,18(10):1598-1607.
[10] Kenzelmann Broz D, Spano Mello S, Bieging K T, et al. Global genomic profiling reveals an extensive p53-regulated autophagy program contributing to key p53 responses[J]. Genes Dev, 2013,27(9):1016-1031.
[11] Youle R J, Narendra D P. Mechanisms of mitophagy[J]. Nat Rev Mol Cell Biol, 2011,12: 9-14.
[12] Luo S, Garcia-Arencibia M, Zhao R, et al. Bim inhibits autophagy by recruiting Beclin 1 to microtubules[J]. Mol Cell, 2012,47(3):359-370.
[13] Thorburn A. Autophagy and its effects: making sense of double-edged swords[J]. PLos Biol, 2014,12(10): e1001967.
[14] Qu X, Yu J, Bhagat G, et al. Promotion of tumorigenesis by heterozygous disruption of the beclin 1 autophagy gene[J]. J Clin Invest, 2003,112(12):1809-1820.
[15] Yue Z, Jin S, Yang C, et al. Beclin 1, an autophagy gene essential for early embryonic development, is a haploinsufficient tumor suppressor[J]. Proc Natl Acad Sci U S A, 2003,100(25):15077-15082.
[16] Takamura A, Komatsu M, Hara T, et al.Autophagy-deficient mice develop multiple liver tumors[J]. Genes Dev, 2011,25(8):795-800.
[17] Inami Y, Waguri S, Sakamoto A, et al. Persistent activation of Nrf2 through p62 in hepatocellular carcinoma cells[J]. J Cell Biol, 2011,193(2):275-284.
[18] Laddha S V, Ganesan S, Chan C S,et al. Mutational landscape of the essential autophagy gene BECN1 in human cancers[J]. Mol Cancer Res, 2014,12(4):485-490.
[19] Levy J M, Thompson J C, Griesinger A M, et al. Autophagy inhibition improves chemosensitivity in BRAF(V600E) brain tumors[J]. Cancer Discov, 2014,4(7):773-780.
[20] Thorburn A, Thamm D H, Gustafson D L. Autophagy and cancer therapy[J]. Mol Pharmacol, 2014,85(6): 830-838.
[21] White E. The role for autophagy in cancer[J]. J Clin Invest, 2015, 125(1):42-46.
[22] Kimmelman A C. Metabolic Dependencies in RAS-Driven Cancers[J]. Clin Cancer Res,2015, 21(8):1828-1834.
[23] White E.Deconvoluting the context-dependent role for autophagy in cancer[J]. Nat Rev Cancer, 2012, 12(6):401-410.
[24] Yang S, Wang X, Contino G, et al.Pancreatic cancers require autophagy for tumor growth[J]. Genes Dev, 2011, 25(7):717-729.
[25] Lock R, Roy S, Kenific C M, et al. Autophagy facilitates glycolysis during Ras-mediated oncogenic transformation[J]. Mol Biol Cell, 2011,22(2):165-178.
[26] Guo J Y, Chen H Y, Mathew R, et al. Activated Ras requires autophagy to maintain oxidative metabolism and tumorigenesis[J]. Genes Dev, 2011,25(5):460-470.
[27] Kim M J, Woo S J, Yoon C H, et al. Involvement of autophagy in oncogenic K-Ras-induced malignant cell transformation[J]. J Biol Chem, 2011,286(15):12924-12932.
[28] Guo J Y, Xia B,White E. Autophagy-mediated tumor promotion[J]. Cell, 2013,155(6):1216-1219.
[29] Karsli-Uzunbas G, Guo J Y, Price S, et al. Autophagy is required for glucose homeostasis and lung tumor maintenance[J]. Cancer Discov, 2014,4(8):914-927.
[30] Yang A, Rajeshkumar N V, Wang X, et al.Autophagy is critical for pancreatic tumor growth and progression in tumors with p53 alterations[J]. Cancer Discov, 2014,4(8):905-913.
[31] Kimmelman A C. The dynamic nature of autophagy in cancer[J]. Genes Dev, 2011,25(19): 1999-2010.
[32] Kenific C M,Debnath J. Cellular and metabolic functions for autophagy in cancer cells[J]. Trends Cell Biol,2015, 25(1):37-45.
[33] Galluzzi L, Pietrocola F, Bravo-San Pedro, J M, et al. Autophagy in malignant transformation and cancer progression[J]. Embo J, 2015, 34(7):856-880.
[34] Piao S, Amaravadi R K. Targeting the lysosome in cancer[J]. Ann N Y Acad Sci, 2016,1371(1):45-54.
[35] Mancias J D,Kimmelman A C. Targeting autophagy addiction in cancer. Oncotarget, 2011,2(12): 1302-1306.
[36] Klionsky D J, Abdelmohsen K, Abe A, et al. Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition)[J]. Autophagy, 2016,12(1):1-222.
[37] Vogl D T, Stadtmauer E A, Tan K S, et al. Combined autophagy and proteasome inhibition: a phase 1 trial of hydroxychloroquine and bortezomib in patients with relapsed/refractory myeloma[J]. Autophagy, 2014, 10(8):1380-1390.
[收稿2016-03-27;修回2016-05-11]
(编辑:谭秀荣)
[通信作者]陈金东,男,2000年于瑞典卡罗林斯卡医科大学分子医学系获得博士学位,现为美国罗切斯特大学医学中心肾癌研究室副教授和主任,美国癌症研究协会(AACR)资深会员。2003年克隆了NORE1和LSAMP两个肾癌相关基因,并在第94届AACR大会上获得Bristol-Myer Squibb奖。此后致力于肾癌敲基因小鼠模型的建立,现在已经建立了多个肾癌小鼠模型,其中一个Flcn肾近曲小管特异性敲基因小鼠模型是世界上唯一能产生各类肾癌细胞的肾近曲小管敲基因小鼠模型,并再次在第100届AACR大会上获得Sanofi-Aventis奖。至今已发表论文80余篇。
[中图法分类号]R587.2
[文献标志码]A
[文章编号]1000-2715(2016)03-0217-06
The role of autophagy and apoptosis in cells
ChenJindong
(Kidney Cancer Laboratory, Department of Urology, University of Rochester Medical Center, Rochester New York, NY 14642, USA)
[Abstract]Autophagy and apoptosis are functionally related and the relationship is complex. Autophagy, namely self-eating, a process in which a portion of the cytoplasmic proteins and organelles are engulfed and degraded/digested, which is in favor of cell survival. Whereas, apoptosis, is a type of cell self-killing which leads to turnover of entire cell, and all the contents in the cell are degraded or digested.If the level of stress is not lethal, autophagy blocks the induction of apoptosis. In harsh conditions, however, autophagy functions excessively and results in over loss of cell contents, which makes the cell unable to survive further and ultimately leads to apoptosis. Noteworthily, autophagy and apoptosis are linked to many apoptosis-related proteins such as the p53 and BH3-only proteins. At the beginning of carcinogenesis, autophagy inhibits cancer cell formation; once carcinogenesis completed, autophagy favors cancer cell survival, which suppresses apoptosis and leads to chemotherapeutic resistance of cancer cells. Thus, chemotherapy combining with autophagy inhibitors may improve the therapeutic effect.
[Key words]autophagy; apoptosis; programmed cell death; cancer; p53; BH3-only

