IL 12B基因多态性与Graves病相关性的Meta分析
孙玲玲,董博翰,凌烈锋
(皖南医学院 生物化学教研室,安徽 芜湖 241002)
临床经验交流
IL 12B基因多态性与Graves病相关性的Meta分析
孙玲玲,董博翰,凌烈锋
(皖南医学院 生物化学教研室,安徽 芜湖241002)
[摘要]目的 Meta分析评价IL 12B基因3′UTR 1188A/C多态性与Graves病的相关性。方法 设定入选条件,检索PubMed、EMbase、中国知网、重庆维普、万方数据库,收集关于IL12B基因3′UTR 1188A/C多态性与Graves病相关性的文献,对符合入选条件的研究进行异质性检验Meta分析,计算不同遗传模型下1188A/C多态性与Graves病发病的相关性。结果 5篇文献纳入研究,包括747名病例和698名对照。合并分析结果显示,IL12B基因3′UTR 1188A/C多态性与Graves病发病风险性无统计学意义(显性遗传模型:OR=1.18,95% CI=0.24~2.17,P=0.59;隐性遗传模型:OR=1.61,95% CI=0.97~2.67,P=0.06;等位基因模型:OR=1.32,95% CI=0.93~1.87,P=0.12)。对3个日本人群的研究进行亚组分析,结果亦未发现1188A/C多态位点的变异与GD发病有统计学相关性(显性遗传模型:OR=0.78,95% CI=0.45~1.37,P=0.39;隐性遗传模型:OR=1.15,95% CI=0.87~1.52,P=0.31;等位基因模型:OR=0.99,95% CI=0.83~1.18,P=0.92)。结论 IL12B基因1188A/C多态性可能与GD发病相关性无关,但由于研究样本数较少,尚需大样本研究加以证实。
[关键词]Graves病;IL12B;基因多态性;Meta分析
Graves病(Graves’ disease,GD)又称毒性弥漫性甲状腺肿,是一种器官特异性自身免疫性疾病,其发病机制依赖于遗传因素和环境因素的共同作用,属于多基因遗传病。连锁分析研究发现5q31-33区域存在着东亚人群Graves病的易感位点[1-3],白介素(interleukin,IL)12B位于此区域。关于IL12B基因多态性与GD的研究目前已有多篇报道,但均为小样本研究,统计效力较低。本研究收集国内外关于IL12B基因3′非翻译区(3′UTR)1188A/C基因多态性与GD相关性的研究,并进行Meta分析,客观评价IL12B基因1188A/C多态性在GD发病中的作用。
1资料与方法
1.1文献收集及纳入与排除标准以“Graves’ disease”、“GD”、“IL 12B”、“IL12 p40”、“polymorphism”、“Graves病”、“白介素12B”、“多态”作为关键词联合检索PubMed、Embase、Cochrane英文数据库和中国知网、重庆维普、万方等中文数据库(含硕博士学位论文),收集检索入库—2015年3月30日以前有关IL12B基因多态性与GD相关性的文献。文献纳入标准:①原始文献为公开发表关于IL12B 基因多态性与GD关联的病例对照研究;②病例组均为经医院确诊的GD患者,对照组为健康人群,排除甲状腺疾病史及甲状腺疾病家族史;③排除有类风湿性关节炎、哮喘、系统性硬化等自身免疫性疾病;④文献数据完整或根据结果能推算出分析所需数据;⑤纳入文献各组对照基因型均需符合Hardy-Weinberg遗传平衡定律。去除重复报道、无对照文献和数据描述不清无法利用的文献。
1.2资料提取与分析由2名研究者按照纳入和排除标准独立进行文献筛选、资料提取、文献质量评价并交叉核对,如遇有争议的文献则由本小组成员共同讨论决定。分析各个研究发表信息,摘录研究的发表年代、第一作者姓名、研究人群、多态性检测方法、基因型和等位基因频率等文献资料。
1.3统计学分析采用Stata 12.0和Revman 5.2统计软件包进行数据分析。在显性模型、隐性模型和等位基因模型下合并计算比值比(odds ratio,OR)和95%可信区间(confidence interval,CI),评价IL12B 1188A/C多态性与GD的关联性。合并计算前先进行异质性检验, 若P>0.1,I2<50%,表示各研究间没有显著异质性,采用固定效应模型(Mantel-Haenszel法)合并计算效应量;若,P≤0.10,I2≥50%,表示存在异质性,则采用随机效应模型(Dersimonia-Laird法)进行合并分析[4]。采用Egger’s及Begg’s检验观察各研究间是否存在发表偏倚,合并后的检验水准α=0.10。
2结果
2.1文献检索结果初次检索获得中文及英文文献共9篇[5-13],排除2篇未做1188A/C多态位点的文献[5-6],1篇无正常对照的文献[7],2篇数据重复的文献选择1篇[8-9],筛选后最终纳入5篇文献,包括747例病例和698例对照。纳入文献的基本情况及多态位点基因型分布情况(见表1)。
表1纳入文献的基本情况

第一作者年份国别病例AAACCC对照AAACCC哈代平衡PIkeda等[10]Hiromatsu等[11]Yang等[12]孙玲玲等[13]Anvari等[8-9]20042006200620072010日本日本日本中国伊朗223929771629026604254345345320296430391206726612869232726080.2040.9031.3920.5000.4310.8060.3900.8230.9780.613
2.2纳入研究的质量评价采用纽尔斯卡-渥太华量表(the Newcastle-Ottawa Scale, NOS)对病例-对照研究的评价标准对纳入的文献进行质量评价[14]。评价内容包括3方面:研究人群选择4分,组间可比性2分,暴露因素的测量3分,共9分。质量评分结果显示文献中的Graves病临床诊断明确,对照排除了自身免疫性疾病史。3个研究未提及病例-对照匹配,2个给出了病例组合对照组性别频数分布,经χ2检验显示男女分布差异无统计学意义(P>0.05)。纳入的5篇文献4篇得分7分,1篇得分为6分。
2.3Meta分析结果5个研究的异质性检验显示各研究之间存在显著的异质性(P<0.10,I2>50%),因此采用随机效应模型进行Meta分析。结果显示IL12B 1188A/C多态位点在3种遗传模式下,合并OR值经检验均无统计学意义(P>0.05,见图1)。
对纳入文献以研究人群的国别为分层因素进行了亚层分析。其中,对3个日本人群的研究进行亚组分析结果未发现1188A/C多态位点的变异与GD发病有统计学相关性(显性遗传模型:OR=0.78,95% CI=0.45~1.37,P=0.39;隐性遗传模型:OR=1.15,95% CI=0.87~1.52,P=0.31;等位基因模型:OR=0.99,95% CI=0.83~1.18,P=0.92)。
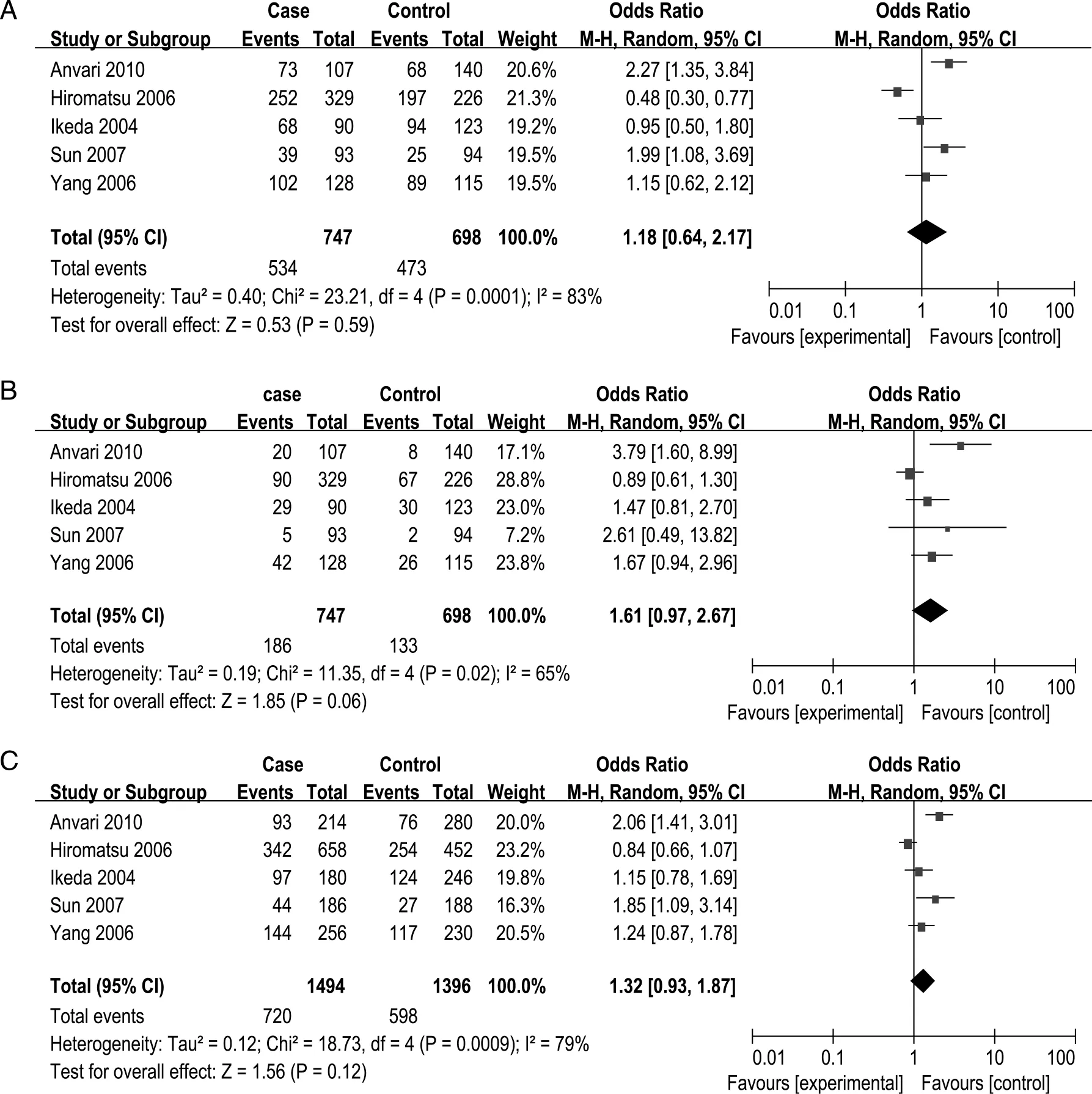
A:显性模型 ;B:隐性模型;C:等位基因模型。图1 IL12B 1188A/C多态性与GD易感森林图
2.4发表偏倚评估发表偏倚产生的主要原因是阴性结果的研究不易发表从而使文献检索向阳性结果的研究偏斜[15],最终影响Meta分析的结果。Egger’s及Begg’s检验提示各研究无统计学意义的发表偏倚(P>0.10)。本研究只有5个研究,故未做漏斗图[16]。
3讨论
研究表明,Th1/Th2细胞失衡在GD发病中具有重要作用,IL12是决定Th细胞分化的重要细胞因子[17]。IL12又称自然杀伤细胞刺激因子(NKSF),是一种由2个亚基p35和p40通过二硫键连接的异源二聚体型细胞因子。IL12可刺激T细胞增殖,促进Th1细胞的生长、分化 。IL12的2个亚基基因定位于不同的染色体上,编码p40的基因IL12B定位于5q31-33。据报道,IL12B基因多态性与糖尿病、哮喘、精神分裂症等[17-19]自身免疫性疾病相关联。动物模型研究发现IL12参与GD和HT发病,GD患者IL12水平显著升高[17]。目前关于IL12B基因多态性与GD易感性的研究很多,绝大多数集中在3′UTR区能够影响IL12B转录的功能SNP 1188A/C[19-21],但该多态性与GD发病是否相关,研究结果尚不一致。Ikeda等[10]和Hiromatsu等[11]在日本人群的2个研究提示IL12B基因3′UTR 1188A/C多态与Graves病的发病没有关联,这与Yang等[12]的研究结果一致,但Anvari等[8-9]的研究却发现1188A/C多态与GD、GO发病相关,1188C等位基因和CC基因型发病率显著增高。
目前关于IL12B 基因多态性与Graves病的相关研究均为小样本研究,统计效力较低,Meta分析通过对多个目的相同相互独立的研究结果进行综合评价分析,以增加样本量提高检验效能,已成为探索疾病与基因关联常用的研究方法。本研究采用Meta分析方法对IL12B基因1188A/C多态性与GD的易感性进行定量合并分析,纳入符合标准的文献5篇,所有研究的对照组基因型分布均符合Hardy-Weinberg平衡。因纳入文献只有5篇,故未做漏斗图分析发表偏倚,Egger’s及Begg’s检验提示尚不能认为存在发表偏倚。
本研究结果显示,IL12B基因1188A/C多态性在3种遗传模型下与GD均无统计学意义相关,与GD总体发病风险关系不大。但对纳入研究以国别为分层因素进行分析,发现在3个日本人群的研究中,3种遗传模型下的差异均无统计学意义。但由于关于IL12B基因多态性与GD的关联研究较少,且均为小样本研究,5个研究总样本量只有不足1 500人;在文献数据收集中,部分文献由于无法提供完整数据而损失;因此IL12B基因3′UTR 1188A/C多态性与GD易感性的关系仍需扩大样本进行进一步研究。
[参考文献]
[1] Jin Y, Teng W, Ben S, et al. Genome-wide scan of Graves' disease: evidence for linkage on chromosome 5q31 in Chinese Han pedigrees[J]. J Clin Endocrinol Metab, 2003, 88(4): 1798-1803.
[2] Akamizu T, Hiratani H, Ikegami S, et al. Association study of autoimmune thyroid disease at 5q23-q33 in Japanese patients[J]. J Hum Genet, 2003, 48(5): 236-242.
[3] Sakai K, Shirasawa S, Ishikawa N, et al. Identification of susceptibility loci for autoimmune thyroid disease to 5q31-q33 and Hashimoto's thyroiditis to 8q23-q24 by multipoint affected sib-pair linkage analysis in Japanese[J]. Hum Mol Genet, 2001, 10(13): 1379-1386.
[4] 胡世芸, 陈妍雯, 潘宗琴, 等. 我国肝衰竭医院感染危险因素的Meta分析[J]. 遵义医学院学报, 2014, 37(5): 520-528.
[5] Liu S, Hou P, Morahan G, et al. No association between IL12B gene polymorphisms and Graves' disease in the Chinese population[J]. Endocr Res, 2012, 37(4): 182-187.
[6] Liu Y H, Chen C C, Liao L L, et al. Association of IL12B polymorphisms with susceptibility to Graves ophthalmopathy in a Taiwan Chinese population[J]. J Biomed Sci, 2012,19(1):97-104.
[7] Walsh J P, Berry J, Liu S, et al. The clinical presentation of autoimmune thyroid disease in men is associated with IL12B genotype[J]. Clin Endocrinol (Oxf), 2011, 74(4): 508-512.
[8] Anvari M, Khalilzadeh O, Esteghamati A, et al. Graves’ disease and gene polymorphism of TNF-α, IL-2, IL-6, IL-12, and IFN-γ[J]. Endocrine, 2010, 37(2): 344-348.
[9] Anvari M, Khalilzadeh O, Esteghamati A, et al. Genetic susceptibility to Graves’ ophthalmopathy: the role of polymorphisms in proinflammatory cytokine genes[J]. Eye (Lond), 2010, 24(6): 1058-1063.
[10] Ikeda Y, Yoshida W, Noguchi T, et al. Lack of association between IL-12B gene polymorphism and autoimmune thyroid disease in Japanese patients[J]. Endocr J, 2004, 51(6): 609-613.
[11] Hiromatsu Y, Fukutani T, Ichimura M, et al. Interleukin-12B gene polymorphism does not confer susceptibility to Graves’ ophthalmopathy in Japanese population[J]. Endocr J, 2006, 53(6): 753-759.
[12] Yang J M, Nagasaka S, Yatagai T, et al. Interleukin-12p40 gene (IL-12B) polymorphism and Type 1 diabetes mellitus in Japanese: possible role in subjects without having high-risk HLA haplotypes[J]. Diabetes Res Clin Pract, 2006, 71(2): 164-169.
[13] 孙玲玲,褚迅,黄薇. 华东地区汉族人群IL 12B基因多态性与Graves病相关性研究[J]. 国际遗传学杂志, 2007, 30(4): 258-260.
[14] Wells G, Shea B, O’Connell D, et al. NewCastle-Ottawa Quality Assessment Scale—Case Control Studies[EB/OL].[2012-06-15]. http://www.ohri.ca/programs/clinical_epidemiology/oxford.asp.
[15] 杨书, 杨晓虹, 刘新. 发表性偏倚产生的原因及可行性论证[J]. 成都医学院学报, 2008, 3(2): 132-135.
[16] Lau J, Ioannidis J P, Terrin N, et al. The case of the misleading funnel plot[J]. BMJ, 2006, 333(7568): 597-600.
[17] Fountoulakis S, Tsatsoulis A. On the pathogenesis of autoimmune thyroid disease: a unifying hypothesis[J]. Clin Endocrinol (Oxf), 2004, 60(4): 397-409.
[18] Morahan G, Huang D, Ymer S I, et al. Linkage disequilibrium of a type 1 diabetes susceptibility locus with a regulatory IL12B allele[J]. Nat Genet, 2001, 27(3): 218-221.
[19] Morahan G, Huang D, Wu M, et al. Association of IL12B promoter polymorphism with severity of atopic and non-atopic asthma in children[J]. Lancet, 2002, 360(9331): 455-459.
[20] Ozbey U, Tug E, Kara M, et al. The value of interleukin-12B (p40) gene promoter polymorphism in patients with schizophrenia in a region of East Turkey[J]. Psychiatry Clin Neurosci, 2008, 62(3): 307-312.
[21] Seegers D, Zwiers A, Strober W, et al. A TaqI polymorphism in the 3'UTR of the IL-12 p40 gene correlates with increased IL-12 secretion[J]. Genes Immun, 2002, 3(7): 419-423.
[收稿2015-12-29;修回2016-03-08]
(编辑:陈娅)
[基金项目]国家自然科学基金青年项目(NO:81402351);安徽省重点实验室项目(NO:1306C083008)。
[中图法分类号]R581
[文献标志码]B
[文章编号]1000-2715(2016)03-0293-04
Meta-analysis of the association between IL 12B gene polymorphism and Graves’ disease
SunLingling,DongBohan,LingLiefeng
(Department of Biochemistry, Wannan Medical College, Wuhu Anhui 241002, China)
[Abstract]Objective To assess the association between 1188 A/C polymorphism of IL12B 3′UTR and Graves’ disease (GD) by meta-analysis.Methods The relevant studies about the correlation between IL12B 3′UTR 1188A/C polymorphism and GD were collected by searching PubMed, EMbase, CNKI, VIP and CBM according to the inclusion criteria. Heterogeneity tests and meta-analysis were conducted.Results Five studies consisting of 747 cases and 698 controls were included. The results of meta-analysis showed that there was no significant difference between the 1188A/C polrmorphism of IL12B 3′UTR and GD (for dominant genetic model: OR=1.18, 95% CI=0.24~2.17, P=0.59; for recessive genetic mode: OR=1.61, 95% CI=0.97~2.67, P=0.06; for allelic genetic model: OR=1.32, 95% CI=0.93~1.87, P=0.12). In the 3 Japanese studies of the correlation between 1188 A/C polymorphism and the susceptibility of GD, no statistically signicant correlation was found (for dominant genetic model: OR=0.78, 95% CI=0.45~1.37, P=0.39; for recessive genetic mode: OR=1.15, 95% CI=0.87~1.52, P=0.31; for allelic genetic model: OR=0.99, 95% CI=0.83~1.18, P=0.92).Conclusion There is no significant correlation between IL 12B 3′UTR 1188A/C polymorphism and GD.
[Key words]Graves disease; IL12B; gene polymorphism; Meta-analysis

