普通烟草茄尼基焦磷酸合酶基因NtSPS的克隆和表达分析
闫 宁,赵韬智,向德虎,龚达平,张洪博,杜咏梅,刘新民,张忠锋,刘艳华*
(1.中国农业科学院烟草研究所,青岛 266101;2.东北农业大学生命科学学院,哈尔滨 150030)
普通烟草茄尼基焦磷酸合酶基因NtSPS的克隆和表达分析
闫宁1,赵韬智2,向德虎1,龚达平1,张洪博1,杜咏梅1,刘新民1,张忠锋1,刘艳华1*
(1.中国农业科学院烟草研究所,青岛 266101;2.东北农业大学生命科学学院,哈尔滨 150030)
为揭示烟草茄尼基焦磷酸合酶(Nicotiana tabacum solanesyl diphosphate synthase,NtSPS)在烟草茄尼醇生物合成中的作用,分离了烟草品种红花大金元茄尼醇生物合成关键基因NtSPS1和NtSPS2,并对其进行了序列比对、进化分析和亚细胞定位分析,研究了其在烟草植株不同器官的表达水平以及烟草植株不同器官的茄尼醇、叶绿素含量与NtSPS表达水平的相关性。结果表明,NtSPS1和NtSPS2开放读码框(ORF)大小分别为1209、1206 bp,分别编码402、401个氨基酸;NtSPS1 和NtSPS2均存在2个保守的DDxxD结构域,这与NtSPS功能发挥相关;NtSPS1、NtSPS2与番茄SPS同源性较高,这与烟草、番茄均为茄科作物有关;NtSPS1、NtSPS2均定位于叶绿体中;烟草植株不同器官NtSPS1和NtSPS2表达水平排序为:叶>茎>根,这与茄尼醇、叶绿素在烟草植株中的分布规律一致。本研究可为NtSPS调控烟草茄尼醇生物合成机制的深入研究奠定基础。
烟草;茄尼醇;茄尼基焦磷酸合酶;基因表达;叶绿素
茄尼醇为四倍半萜烯醇,是一种重要的药物中间体,可用于合成辅酶Q10和维生素K2等泛醌类药物和抗癌增效剂SDB[1-5]。辅酶Q10可用于治疗偏头痛、帕金森综合症、神经退行性疾病[6-7],并可作为2型糖尿病患者的膳食补充剂[8];维生素K2已被用于治疗骨质疏松症等[9];茄尼醇衍生物SDB能够克服肿瘤细胞经由P-糖蛋白介导的多种抗药性,并与一些抗肿瘤药物发挥协同作用[1,10]。由于茄尼醇链长、合成步骤多,其人工合成难度很大[11],目前主要依赖于从植物中提取,而烟叶是提取茄尼醇最理想的材料[4,12]。自Rowland等[13]首次在烟草中发现茄尼醇以来,茄尼醇在马铃薯、番茄、茄子和辣椒等茄科作物中均有报道,烟草中含量最高[14-15];在烟草中,植株不同器官中的茄尼醇含量也不同,以叶中的含量最高,尤其是上部叶[16-17]。茄尼醇在植物中以游离态和酯型结合态2种形式存在,烟草叶片游离态茄尼醇/总茄尼醇范围为0.18~0.85[17]。为鉴定出富含茄尼醇的烟草品种,本课题组测定了93份烟草种质的茄尼醇含量,发现其含量为1.78~3.60%[4]。最近,向德虎等[18]研究发现,烟草茄尼醇含量的遗传由主基因和多基因共同决定,以主基因遗传为主,同时受到环境的影响。
在植物组织中,茄尼醇是在质体中经由2-甲基-D-赤藻糖醇-4-磷酸(MEP)途径合成的[4,15,19-20]。1-脱氧-5-磷酸木酮糖合成酶(DXS)催化丙酮酸和甘油醛-3-磷酸缩合形成 1-脱氧-5-磷酸木酮糖(DXP),DXP在1-脱氧-5-磷酸木酮糖还原异构酶(DXR)的催化作用下,经过分子内重排和还原反应形成MEP;MEP在一系列酶的催化作用下形成异戊烯基焦磷酸(IPP)和二甲基烯丙基焦磷酸(DMAPP)[4,15]。IPP在异戊烯基焦磷酸异构酶(IPI)的催化下形成DMAPP,茄尼基焦磷酸合酶(Solanesyl diphosphate synthase,SPS)催化IPP和DMAPP形成茄尼基焦磷酸(SPP),SPP是茄尼醇生物合成的前体物质[4,15,19]。目前已在拟南芥[21-24]、水稻[25]和番茄[26]中鉴定出SPS的同源基因。而烟草中关于SPS的克隆和表达分析的研究未见报道。
本研究分离获得烟草茄尼醇生物合成关键酶基因NtSPS1和NtSPS2,对其进行了序列比对、进化分析、亚细胞定位分析以及表达特性分析,分析了烟草植株不同器官的茄尼醇、叶绿素含量与NtSPS表达水平的相关性,为NtSPS调控烟草茄尼醇生物合成的机制的深入研究奠定基础。
1 材料与方法
1.1植物材料
供试材料为普通烟草品种红花大金元(Nicotiana tabacum cv.Honghuadajinyuan)。烟草培养条件为:培养温度25℃,光暗周期14 h/10 h,相对湿度(70±10)%;土壤条件为:pH 7.2,全氮1.89 g/kg,碱解氮48.3 mg/kg,全磷0.45 g/kg,有效磷32.4 mg/kg,全钾32.5 g/kg,速效钾219 mg/kg,有机质7.39 g/kg。移栽后30 d,分别采集根、茎和叶样品。采取混合取样的方法:选择9株有代表性的健康植株,每3株混合,取根、茎、叶,3次重复。
1.2基因克隆
使用GeneJET Plant RNA Purification Mini Kit (Thermo)提取烟草植株不同器官(根、茎、叶)总RNA。采用PrimerScriptTM RT-PCR Kit(Takara)反转录第一链cDNA,作为PCR扩增的模板。检索中国烟草基因组数据库(http://218.28.140.17/),得到普通烟草NtSPS1和NtSPS2基因全长CDS,并据其进行相关基因的引物设计(表1),用于扩增普通烟草NtSPS1和NtSPS2基因全长。PCR扩增条件参照文献[27]。将PCR产物检测回收,连接pmd18-T载体后转化大肠杆菌感受态DH5α。筛选阳性克隆,并送华大基因公司测序。

表1 烟草茄尼基焦磷酸合酶(NtSPS)基因克隆和表达分析的引物及其序列Table 1 Primers used in cloning and expression analysis of Nicotiana tabacum solanesyl diphosphate synthase(NtSPS).
1.3多序列比对、系统进化和亚细胞定位分析
采用DNAMAN软件将得到的NtSPS1和NtSPS2序列与拟南芥、水稻和番茄SPS进行多序列比对分析;利用MEGA 5.0[28]构建NJ进化树。采用在线程序Predotar[29]和TargetP[30],分别对NtSPS1 和NtSPS2亚细胞定位预测。
1.4荧光定量表达分析
分别提取烟草植株不同器官(根、茎和叶)的总RNA,去除基因组DNA污染后,稀释到100 μg/μL。按照试剂盒说明,利用PrimeScriptTM RT Reagent Kit with gDNA Eraser(Perfect Real Time,Takara)在荧光定量 PCR仪 ABI7500上进行qRT-PCR分析。所用基因特异引物见表1,以烟草Actin基因作为内参。
1.5茄尼醇含量测定
参照文献[17]方法,进一步优化提取条件后利用超高效液相色谱检测烟草植株不同器官(根、茎和叶)中总茄尼醇和游离态茄尼醇含量,并计算游离态/总茄尼醇。仪器条件为,色谱柱:BEHC181.7μm 2.1*50 mm,流动相:甲醇+乙腈=50+50,流速:0.5 mL/min,柱温:30℃,检测波长:208nm。
1.6叶绿素含量测定
参照文献[31]的方法,测定烟草植株不同器官(根、茎和叶)中叶绿素a、叶绿素b和总叶绿素含量,并计算叶绿素a/b。
1.7统计分析
试验结果用Excel整理,所有数据在P<0.05水平下进行Tukey多重比较。试验中所有的统计分析在SPSS18.0(SPSSInc.,Chicago,IL,USA)软件中完成。
2 结果
2.1NtSPS1、NtSPS2基因及其编码蛋白信息
根据中国烟草基因组数据库中检索得到的普通烟草NtSPS1和NtSPS2基因全长CDS,设计相关引物(表1),在普通烟草红花大金元中获得了两个基因的序列,NtSPS1和NtSPS2基因的PCR产物电泳图见图1。NtSPS1和NtSPS2开放读码框(ORF)长度分别为1209、1206 bp,编码氨基酸数目分别为402、401个,DDxxD结构域数目均为2个;在线程序Predotar和TargetP预测结果表明,NtSPS1 和NtSPS2均具有叶绿体定位序列,成熟蛋白定位于叶绿体,参与茄尼醇在叶绿体中的合成反应(表2)。
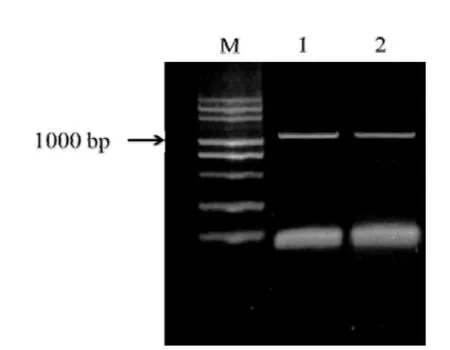
图1 NtSPS1和NtSPS2基因的PCR产物电泳图Fig.1 Agarose gel electrophoresis results of NtSPS1 and NtSPS2.

表2 NtSPS1、NtSPS2及其编码蛋白的序列信息Table 2 Sequence information of NtSPS1,NtSPS2 and their corresponding proteins.
2.2多序列比对和系统进化分析
将得到的烟草SPS与拟南芥、水稻和番茄SPS进行多序列比对(图2)。从图2看出,不同作物中的SPS均存在2个保守的富含天冬氨酸的DDxxD结构域。DDxxD结构域是异戊烯基焦磷酸合酶最典型的保守结构域,它可以结合二价金属离子,参与协调二价金属离子和底物分子二磷酸基团的结合;DDxxD结构域位于催化位点的入口,对反应底物的定位起关键作用[32]。因此,NtSPS1和NtSPS2均具有2个DDxxD结构域,而作为SPS的保守结构域,DDxxD结构域可以确保NtSPS功能发挥。

图2 烟草、拟南芥、水稻和番茄SPS序列比对结果Fig.2 Alignment results of SPS sequence from tobacco, Arabidopsis,rice and tomato.

图3 不同物种SPS、DPS、GPS、HPS和OPS的系统进化分析Fig.3 Phylogenetic relationships among SPS,DPS,GPS, HPS and OPS in different species
利用MEGA5.0对不同物种中的茄尼基焦磷酸合酶(SPS)、聚十异戊烯基焦磷酸合酶(DPS)、牻牛儿基焦磷酸合酶(GPS)、聚六异戊烯基焦磷酸合酶(HPS)和聚八异戊烯基焦磷酸合酶(OPS)进行系统进化分析(图3)。从图3可以看出,NtSPS1、NtSPS2与SlSPS1同源性较高,这与烟草、番茄均为茄科作物有关;相比之下,NtSPS1、NtSPS2 与CsSPS1、AtSPS1、AtSPS2、OsSPS2、CrSPS1、NsSPS1、SsSPS1、PmSPS1等同源性较低,这主要与烟草和黄瓜、拟南芥、水稻、莱茵衣藻、鱼腥藻PCC7120、蓝藻、集胞藻PCC6803等亲缘关系较远有关。NtSPS1、NtSPS2与SlGPS1同源性较低,这与SPS和GPS分别用于催化合成C45茄尼基焦磷酸和C10牻牛儿基焦磷酸有关[33];另外,在拟南芥中AtSPS1、AtSPS2与AtSPS3同源性较低,在水稻中OsSPS1与OsSPS2的同源性较低,这可能与不同SPS基因具有不同的生物催化功能相关,其中OsSPS1、OsSPS2分别催化合成线粒体中的泛醌和叶绿体中的质体醌[25]。
2.3荧光定量表达分析
从图4可以看出,烟草植株不同器官NtSPS1和NtSPS2的相对表达量差异显著(P>0.05),二者均是叶>茎>根。其中,叶中NtSPS1和NtSPS2的相对表达量分别是茎的7.69倍、4.95倍,茎中NtSPS1 和NtSPS2的相对表达量分别是根的10.4倍、12.3倍。由此可见,叶中NtSPS1和NtSPS2相对表达量显著高于茎和根的。
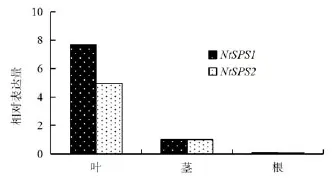
图4 烟草植株不同器官NtSPS1和NtSPS2的相对表达量Fig.4 Relative expression levels of NtSPS1 and NtSPS2 in different organs of tobacco plants.
2.4茄尼醇含量
从表3可以看出,烟草植株不同器官总茄尼醇和游离态茄尼醇含量差异显著(P>0.05),二者均是叶>茎>根;叶和茎的游离态/总茄尼醇无显著差异(P<0.05),且均显著高于根(P>0.05)。叶中总茄尼醇和游离态茄尼醇含量分别是茎的25.6倍、27.0倍;根中总茄尼醇和游离态茄尼醇含量均为0。由此可见,叶中总茄尼醇和游离态茄尼醇含量显著高于茎和根的。
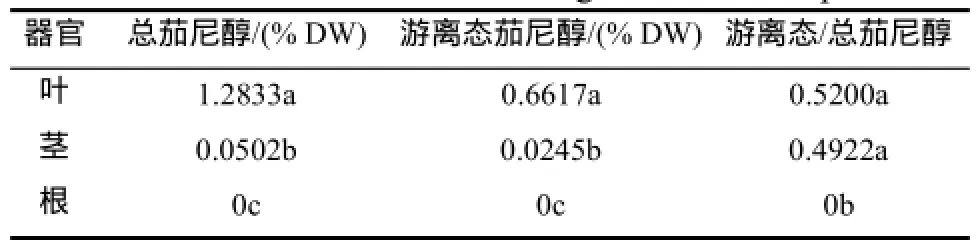
表3 烟草植株不同器官总茄尼醇、游离态茄尼醇含量和游离态/总茄尼醇Table 3 Total solanesol,free state solanesol and the ratio of free:total solanesol in different organs of tobacco plants.
2.5叶绿素含量
从表4可以看出,烟草植株不同器官中的叶绿素a、叶绿素b、叶绿素a/b和总叶绿素差异显著(P>0.05),四者均是叶>茎>根。其中,叶中叶绿素a、叶绿素b、叶绿素a/b和总叶绿素分别是茎的26.8倍、14.1倍、1.88倍、21.9倍,根中叶绿素a、叶绿素b和总叶绿素含量均为0。由此可见,叶中叶绿素a、叶绿素b、叶绿素a/b和总叶绿素含量显著高于茎和根的。
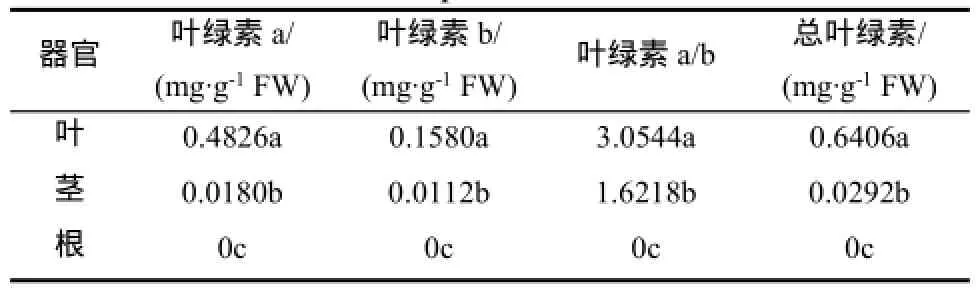
表4 烟草植株不同器官叶绿素a、叶绿素b、叶绿素a/b和总叶绿素Table 4 Chlorophyll a,chlorophyll b,chlorophyll a/b ratio and total chlorophyll content in different organs of tobacco plants.
3 讨论
本研究克隆获得了普通烟草NtSPS1和NtSPS2基因序列,其开放读码框长度分别为1209、1206 bp,编码氨基酸数目分别为402、401个。NtSPS1和NtSPS2的DDxxD结构域数目均为2个,DDxxD结构域是异戊烯基焦磷酸合酶最典型的保守结构域,其参与协调二价金属离子和底物分子二磷酸基团的结合,对反应底物的定位起关键作用,确保SPS功能发挥[32]。在线预测表明,NtSPS1和NtSPS2成熟蛋白均定位于叶绿体中,并参与茄尼醇的生物合成,这与番茄SPS定位于叶绿体中相一致[26]。构建系统进化树可以分析分子之间的亲缘关系,通常位于同一亚家族或小分枝上的分子往往可能具有相似的功能[27]。本研究中,系统进化分析表明,NtSPS1 和NtSPS2与番茄中的SPS亲缘关系最近,这与烟草、番茄均为茄科作物有关;然而NtSPS1和NtSPS2与番茄中的GPS同源性较低,这与SPS、GPS具有不同的生物催化功能有关,其分别用于催化合成C45茄尼基焦磷酸和C10牻牛儿基焦磷酸[33]。表达特性分析表明,叶中NtSPS1和NtSPS2的相对表达量显著高于茎和根的,这与茄尼醇在叶中含量最高相一致[16-17]。叶中叶绿素a、叶绿素b和总叶绿素含量显著高于茎和根的,这与NtSPS1和NtSPS2的相对表达量在叶中最高一致,可能与叶绿体是茄尼醇生物合成的场所有关[19]。
本研究发现,NtSPS1和NtSPS2主要在叶中表达,这与拟南芥中两个SPS基因AtSPS1和AtSPS2主要在叶中表达相一致[21-23]。水稻中,已经鉴定出两个SPS基因OsSPS1和OsSPS2,OsSPS1主要在根中表达,OsSPS2主要在根和叶中表达,并分别合成线粒体中的泛醌和叶绿体中的质体醌[25]。最近研究发现,AtSPS1和AtSPS2基因沉默会降低拟南芥叶片中的质体醌含量并诱导产生PSII光抑制[24],而fibrillin 5(FBN5)结合到AtSPS1和AtSPS2上调控质体醌合成[34];番茄SlSPS组成型过表达可提高烟草幼嫩叶片中的质体醌含量,SlSPS对番茄叶绿体结构和功能发挥是必须的[26]。因此,目前对SPS功能的研究主要集中在质体醌生物合成中的作用,研究对象主要是拟南芥、水稻和番茄等模式植物,而SPS在茄尼醇生物合成中的作用研究很少,尤其在重要经济作物烟草中的研究未见报道。作为茄尼醇含量最丰富的植物资源,烟草茄尼醇合成调控仍不清楚,特别是NtSPS调控烟草茄尼醇生物合成的机制有待深入研究。本研究可为NtSPS调控烟草茄尼醇生物合成机制的深入研究奠定基础。
4 结论
本研究从普通烟草中克隆得到2个SPS基因,命名为NtSPS1和NtSPS2。NtSPS1和NtSPS2均存在两个保守的DDxxD结构域,其与NtSPS功能发挥相关;系统进化分析显示,NtSPS1和NtSPS2与番茄SPS同源性较高,这与烟草、番茄均为茄科作物有关;在线预测表明,NtSPS1、NtSPS2均定位于叶绿体中;烟草植株不同器官NtSPS1和NtSPS2表达水平排序为:叶>茎>根,这与茄尼醇、叶绿素在烟草植株中的分布规律一致。
[1]Wang J H,Wang C J,Gan Y,et al.Design,synthesis andsynergistic effects of novel derivatives of solanesol [J].Chem Res Chin Univ,2007,23(4):417-420.
[2]Tian Y,Yue T,Yuan Y,et al.Tobacco biomass hydrolysate enhances coenzyme Q10 production using photosynthetic Rhodospirillum rubrum[J].Bioresour Technol,2010,101(20):7877-7881.
[3]Mu F S,Luo M,Fu Y J,et al.Synthesis of the key intermediate of coenzyme Q10[J].Molecules,2011, 16(5):4097-4103.
[4]Yan N,Liu Y H,Gong D P,et al.Solanesol:a review of itsresources,derivatives,bioactivities,medicinal applications,and biosynthesis[J].Phytochem Rev,2015, 14(3):413-417.
[5]陈爱国,申国明,梁晓芳,等.茄尼醇的研究进展与展望[J].中国烟草科学,2007,28(6):44-48.
[6]Abdin A A,Homouda H E.Mechanism of the neuroprotective role of coenzyme Q10 with or without L-dopainrotenone-inducedparkinsonism[J]. Neuropharmacology,2008,55(8):1340-1346.
[7]Bentinger M,Tekle M,Dallner G.Coenzyme Q-biosynthesis and functions[J].Biochem Biophys Res Commun,2010,396(1):74-79.
[8]Mezawa M,Takemoto M,Onishi S,et al.The reduced form of coenzyme Q10 improves glycemic control in patients with type 2 diabetes:An open label pilot study [J].BioFactors,2012,38(6):416-421.
[9]Hamidi M S,Gajic-Veljanoski O,Cheung A M.Vitamin K and bone health[J].J Clin Densitom,2013,16(4): 409-413.
[10]Sidorova T A,Nigmatov A G,Kakpakova E S,et al. Effects of isoprenoid analogues of SDB-ethylenediamine onmultidrugresistanttumorcellsaloneandin combination with chemotherapeutic drugs[J].J Med Chem,2002,45(24):5330-5339.
[11]Roe S J,Oldfield M F,Geach N,et al.A convergent stereocontrolled synthesis of[3-14C]solanesol[J].J Lablled Compd Rad,2013,56(9-10):485-491.
[12]Santana-Méridas O,González-Coloma A,Sánchez-Vioque R.Agricultural residues as a source of bioactive natural products[J].Phytochem Rev,2012,11(4):447-466.
[13]Rowland R L,Latimer P H,Giles J A.Flue-cured tobacco. I.Isolation of solanesyl,an unsaturated alcohol[J].J Amer Chem Soc,1956,78(18):4680-4683.
[14]Kotipalli K P,Rao N C V,Raj K.Estimation of solanesol in tobacco and nontobacco plants from Solanaceae family [J].J Med Arom Plant Sci,2008,30:65-68.
[15]Taylor M A,Fraser P D.Solanesol:Added value from Solanaceous waste[J].Phytochemistry,2011,72(11-12): 1323-1327.
[16]Zhao C J,Zu Y G,Li C Y,et al.Distribution of solanesol in Nicotiana tabacum[J].J Forest Res,2007,18(1): 69-72.
[17]杜咏梅,张怀宝,张忠锋,等.我国烤烟茄尼醇含量及其与烟草和烟气主要化学成分的相关性[J].中国烟草科学,2014,35(6):54-58.
[18]向德虎,赵韬智,杜咏梅,等.烟草茄尼醇含量的遗传分析[J].中国烟草科学,2015,36(6):1-7.
[19]Fukusaki E,Takeno S,Bamba T,et al.Biosynthetic pathway for the C45 polyprenol,solanesol,in tobacco[J]. Biosci Biotechnol Biochem,2004,68(9):1988-1990.
[20]Vranova´E,Coman D,Gruissem W.Structure anddynamics of the isoprenoid pathway network[J].Mol Plant,2012,5(2):318-333.
[21]Hirooka K,Bamba T,Fukusaki E,et al.Cloning and kinetic characterization of Arabidopsis thaliana solanesyl diphosphate synthase[J].Biochem J,2003,370(2): 679-686.
[22]Jun L,Saiki R,Tatsumi K,et al.Identification and subcellular localization of two solanesyl diphosphate synthases from Arabidopsis thaliana[J].Plant Cell Physiol,2004,45(12):1882-1888.
[23]Hirooka K,Izumi Y,An CI,et al.Functional analysis of two solanesyl diphosphate synthases from Arabidopsis thaliana[J].Biosci Biotechnol Biochem,2005,69(3): 592-601.
[24]Block A,Fristedt R,Rogers S,et al.Functional modeling identifiesparalogoussolanesyl-diphosphatesynthases that assemble the side chain of plastoquinone-9 in plastids[J].J Biol Chem,2013,288(38):27594-27606.
[25]Ohara K,Sasaki K,Yazaki K.Two solanesyl diphosphate synthases with different subcellular localizations and their respective physiological roles in Oryza sativa[J].J Exp Bot,2010,61(10):2683-2692.
[26]Jones M O,Perez-Fons L,Robertson F P,et al.Functional characterizationoflong-chainprenyldiphosphate synthases from tomato[J].Biochem J,2013,449(3): 729-740.
[27]康乐,张丽,张磊,等.普通烟草钙依赖蛋白激酶NtCDPK15的基因克隆及表达分析[J].中国烟草科学,2013,34(3):48-54.
[28]Tamura K,Peterson D,Peterson N,et al.MEGA5: molecular evolutionary genetics analysis using maximum likelihood,evolutionarydistance,andmaximum parsimony methods[J].Mol Biol Evol,2011,28(10): 2731-2739.
[29]Small I,Peeters N,Legeai F,et al.Predotar:A tool for rapidly screening proteomes for N-terminal targeting sequences[J].Proteomics,2004,4(6):1581-1590.
[30]Emanuelsson O,Nielsen H,Brunak S,et al.Predicting subcellularlocalizationofproteinsbasedontheir N-terminal amino acid sequence[J].J Mol Biol,2000, 300(4):1005-1016.
[31]Yan N,Xu X F,Wang Z D,et al.Interactive effects of temperature and light intensity on photosynthesis and antioxidant enzyme activity in Zizania latifolia Turcz. plants[J].Photosynthetica,2013,51(1):127-138.
[32]王凌健,方欣,杨长青,等.植物萜类次生代谢及其调控[J].中国科学:生命科学,2013,43(12):1030-1046.
[33]Liang P H,Ko T P,Wang A H.Structure,mechanism and function of prenyltransferases[J].Eur J Biochem,2002, 269(14):3339-3354.
[34]Kim E H,Lee Y,Kim H U.Fibrillin 5 is essential for plastoquinone-9 biosynthesis by binding to solanesyl diphosphate synthases in Arabidopsis[J].Plant Cell, 2015,27(10):2956-2971.
Cloning and Expression Analysis of Solanesyl Diphosphate Synthase(NtSPS) Genes in Nicotiana Tabacum
YAN Ning1,ZHAO Taozhi2,XIANG Dehu1,GONG Daping1,ZHANG Hongbo1, DU Yongmei1,LIU Xinmin1,ZHANG Zhongfeng1,LIU Yanhua1*
(1.Tobacco Research Institute of ChineseAcademy ofAgricultural Sciences,Qingdao 266101,China;2.College of Life Science, NortheastAgricultural University,Harbin 150030,China)
We cloned two solanesyl diphosphate synthase genes,NtSPS1 and NtSPS2,from tobacco(Nicotiana tabacum cv. Honghuadajinyuan)plants to investigate their role in tobacco solanesol biosynthesis.In this study,we performed sequence alignment, phylogenetic analysis,and subcellular localization analysis of NtSPS1 and NtSPS2.Further,we studied the expression levels of NtSPSs in different organs of tobacco plants,and analysed the relationship between solanesol,chlorophyll content and the expression levels of NtSPSs in different organs of tobacco plants.The results showed that:NtSPS1 contained an open reading frame(ORF)of 1209 bp encoding 402 amino acids and NtSPS2 contained an ORF of 1206 bp encoding 401 amino acids.Both NtSPS1 and NtSPS2 had two conserved DDxxD domains,which were related to the function of NtSPS.The homology among NtSPS1,NtSPS2,and SlSPS was very high,probably because both tobacco and tomato were solanaceous crops.Both NtSPS1 and NtSPS2 were located in the chloroplast.The expression levels of NtSPS1 and NtSPS2 in different organs of tobacco plants decreased according to this order: leaf>stem>root,which was consistent with the distribution of solanesol and chlorophyll in tobacco plants.This study could lay a foundation for further research on the role of NtSPSs in the regulation of tobacco solanesol biosynthesis.
Nicotiana tabacum;solanesol;solanesyl diphosphate synthase;gene expression;chlorophyll
S572.03
1007-5119(2016)03-0045-07
10.13496/j.issn.1007-5119.2016.03.008
中国农业科学院科技创新工程(ASTIP-TRIC05);中国烟草总公司科技重大专项项目“烟草低苯并芘突变体筛选和基因定位研究”[110201401008(JY-08)];公益性行业(农业)科研专项项目“烟草增香减害关键技术研究与示范”(201203091)
闫宁,男,博士,助理研究员,从事烟草功能成分与综合利用研究。E-mail:yanning5110@163.com。*通信作者,E-mail:liuyanhua@caas.cn
2015-11-02
2016-04-06

