豫南烟区烟草青枯病菌的致病力及遗传多样性分析
李小杰,李淑君,陈玉国,王海涛,李成军,赵凤霞,李彦平
(河南省农业科学院烟草研究所,河南 许昌 461000)
豫南烟区烟草青枯病菌的致病力及遗传多样性分析
李小杰,李淑君*,陈玉国,王海涛,李成军,赵凤霞,李彦平
(河南省农业科学院烟草研究所,河南 许昌 461000)
为有效防控豫南烟区烟草青枯病,对来自信阳市罗山县、驻马店市确山县和遂平县的烟草青枯病菌的致病力和遗传多样性进行了测定分析。人工接种试验表明,豫南烟区烟草青枯病菌的致病力分为强、中和弱3种,不同寄主来源的烟草青枯病菌具有显著的致病力差异。从100个随机引物中筛选出8个扩增条带清晰且具有丰富多态性的引物用于不同地区烟草青枯病菌菌株DNA的RAPD分析,共扩增出720条带,其中多态性带占88.9%。聚类结果和遗传相似系数分析显示,供试菌株可分为A、B两大类,遗传相似系数范围为0.49~1.00,且供试菌株间的遗传相似性与其地理来源有一定的相关性。综上所述,豫南烟区烟草青枯病菌的致病力存在明显差异且其DNA具有丰富的遗传多样性。
豫南烟区;烟草青枯病菌;致病力;遗传多样性
烟草青枯病是由青枯雷尔氏菌(Ralstonia solanacearum)引起的,在世界范围内广泛分布、危害严重的细菌性烟草根茎病害,目前在我国长江流域及其以南烟区普遍发生,造成了巨大的损失[1-2]。同时由于气候等方面的原因,该病害发生有向北扩展蔓延趋势。目前,河南、安徽、山东、陕西等地均有烟草青枯病的发生并造成不同程度的损失[3-6]。青枯雷尔氏菌具有显著的生理分化现象[7-8],不同地理来源和来自不同寄主植物的病原菌在致病力等方面存在着较大差异。目前有关青枯菌致病力的研究已有许多报道,何自福等[9]利用鉴别寄主的方法将31个茄科青枯菌菌株分为强致病力、中等致病力和弱致病力3个组群,表明其致病力存在明显差异;黎妍妍等[10]、王国平等[11]、陈晓敏等[12]根据烟草青枯病菌在不同烟草品种上的致病力强弱,将其分为不同的致病型或致病力类群。正因为青枯雷尔氏菌的致病力分化如此显著,从而导致青枯病的防治更加困难,因此对青枯菌进行致病性分析对病害防治具有重要的指导意义。
植物青枯菌菌株间的致病性差异的本质有可能在于其遗传物质DNA的变异,近年来,已有研究者开始利用分子生物学技术研究青枯菌菌株间的遗传差异[13-16],这些研究结果都表明了青枯菌的DNA存在着丰富的遗传多样性。本研究在前人研究的基础上,利用RAPD分子标记技术对河南省烟草青枯病菌进行了遗传差异分析。
本研究对豫南烟区烟草青枯病菌的致病力以及遗传多样性进行研究,旨在探讨不同来源青枯菌的致病力差异以及进化和亲缘关系,为指导烟草品种的合理布局和病害预测与防治提供科学依据。
1 材料与方法
1.1材料
1.1.1供试菌株从河南省信阳市罗山县、驻马店市确山县和遂平县采集分离到的19个烟草青枯菌菌株作为供试菌株。
1.1.2供试烟草品种河南省主栽品种中烟100作为供试烟草品种。
1.1.3培养基菌株分离培养基(TTC):多聚蛋白胨5 g,酵母提取物1 g,牛肉浸膏3 g,蔗糖10 g,琼脂18 g,蒸馏水1000 mL。分离时在基本培养基中加入氯化三苯基四氮唑(TTC),终浓度为0.05%。
1.2方法
1.2.1烟草青枯病菌的致病力测定将供试菌株分别在选择性TTC琼脂平板上划线,28℃下培养48 h后,用无菌水配制成浓度为3×l08cfu/mL的细菌悬浮液供接种用。在温室条件下按常规方法育苗,幼苗长至4~6叶时供接种使用。采用叶片注射接种法测定各菌株的致病力:从烟株顶芽往下数第3片叶背的叶脉,用灭菌的4号针头将菌液注射到叶肉细胞间隙,并对叶片正面进行喷水保湿处理。每处理接种5株烟苗,烟苗置于28℃、湿度70%的条件下培养,每天观察并记录各处理烟苗发病情况,直至病情稳定。
病情分级标准:0级,无明显症状;1级,叶片皱缩,注射区没有褪绿变黄;2级,注射区形成黄色坏死斑;3级,注射区形成褐色坏死斑;4级,注射区坏死斑明显扩展,叶片萎蔫;5级,整片叶片萎蔫;6级,植株枯萎死亡。
致病力评价标准:根据青枯病菌菌株对寄主致病力的强弱平均病级,分为3个类群:A群(强致病力),平均病级>4;B群(中等致病力),3≤平均病级≤4;C群(弱致病力),平均病级<3。
1.2.2不同致病力的青枯菌在烟苗组织内的含菌量检测制备菌悬液,浓度为3×l08cfu/mL,每株10 mL灌根接种,烟苗为4~6叶期。每处理15株,3个重复,同时设置清水对照。28℃ 12 h光照培养,于接种后10 d取样,取样部位为烟株茎基部。每1 g样本加入3 mL无菌水进行充分研磨,按10倍梯度稀释,分别取不同稀释液0.1 mL涂布于TTC培养基上,28℃培养72 h后进行平板菌落计数,然后换算成每克鲜重青枯菌量。公式如下:

利用DPS软件对结果进行方差分析。
1.2.3烟草青枯病菌的RAPD分析基因组DNA提取:将青枯菌菌株接种在NA固体培养基上,25℃条件下培养48 h,用灭菌水悬浮菌体,根据细菌基因组提取试剂盒(生工生物)说明书提取基因组DNA。用0.8%琼脂糖凝胶电泳检测DNA纯度和完整性,贮存于-20℃冰箱中备用。
RAPD分析:从100个随机引物中筛选得到8个条带清晰、多态性好的引物(表1)用于青枯菌DNA 的RAPD分析,引物由生工(上海)生物技术有限公司合成。RAPD反应总体系为25 μL,各反应组分终浓度为:1.25 U Taq DNA聚合酶,10 μmol/L引物1 μL,2.5 mmol/LdNTPs 2μL,10×PCR缓冲液2.5 μL,DNA模板40 ng。PCR扩增反应程序为:94℃预变性5 min,94℃变性1 min,37℃退火90 s,72℃延伸2 min,41个循环;72℃ 延伸10 min;4℃保存。PCR产物经电泳分离后,记录每条引物每个菌株的扩增结果。对电泳结果采用有带记为“1”、无带记为“0”的方法记录谱带。利用NTSYS2.1分析软件,对结果以非加权算术平均数配对(unweighted pair group method with arithmetic averages,UPGMA)进行聚类分析,自动生成相似性系统数和树状图进行聚类分析并构建种间及种内的系统聚类图。

表1 筛选出的随机引物以及扩增的条带数Table 1 Number of fragments amplified with 8 primers selected from 100 random primers
2 结果
2.1豫南烟区烟草青枯病菌的致病性
菌株接种后72 h开始出现典型症状,一般在15 d左右病情稳定。根据烟草青枯菌菌株对寄主致病力的强弱,将19个供试菌株分为3个类群:A群(强致病力群),占供试菌株的42.1%;B群(中等致病力群),占供试菌株的42.1%;C群(弱致病力群),占供试菌株的15.8%(表2)。其中强致病力菌株主要分布在驻马店确山县瓦岗镇,寄主烟草品种以云烟87为主;中等致病力菌株主要分布在驻马店遂平县玉山镇,寄主烟草品种以中烟100为主。由此表明,不同寄主来源的烟草青枯病菌之间具有明显的致病力差异。
2.2不同致病力的烟草青枯病菌在烟株体内的繁殖情况
接种后10 d,不同菌株导致烟株发病情况有很大差异。对不同发病症状的具有代表性的烟株进行体内青枯病菌含量测定(图1),结果表明,接种强致病力菌株TXLLJ14-3的烟株体内青枯病菌的含量较高,且极显著差异于接种中等致病力菌株TSP14-2和SP14-3的烟株体内的含菌量,而接种弱致病力菌株TXLT14-2的烟株体内含菌量为最少。由此表明,供试烟草青枯病菌的致病力与其在寄主体内的繁殖量成正比。
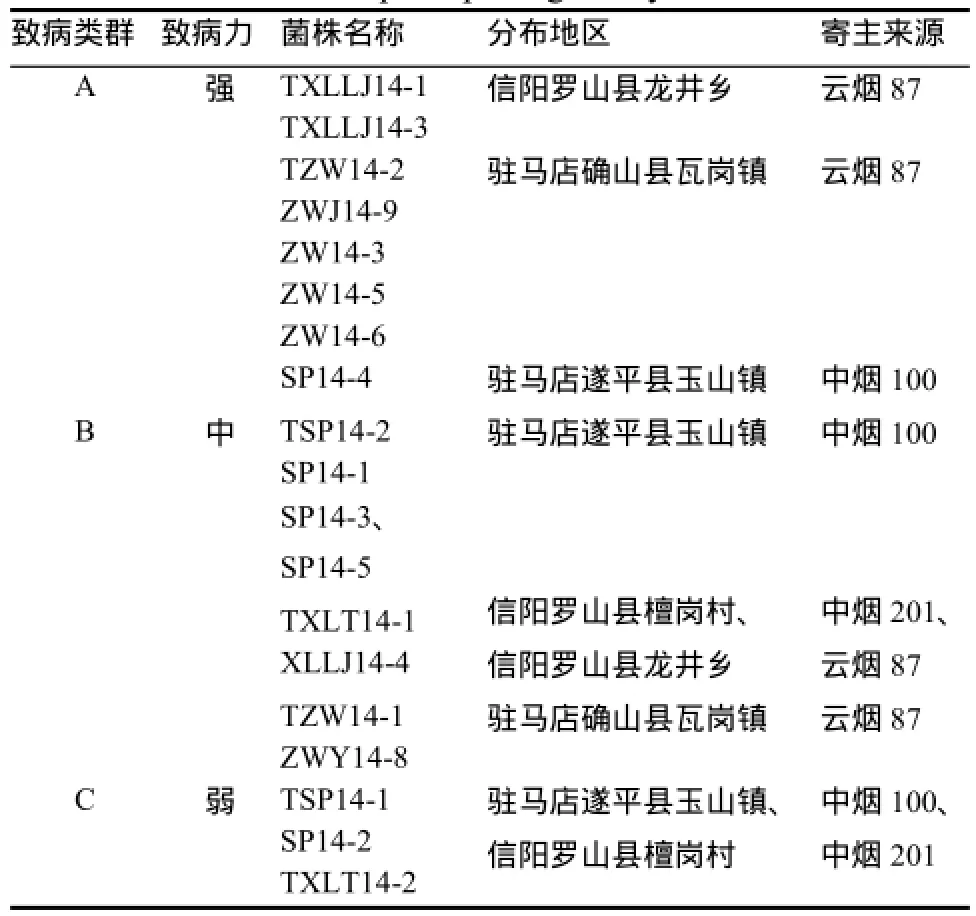
表2 分离菌株的致病性强弱类群Table 2 Groups of pathogenicity of isolates
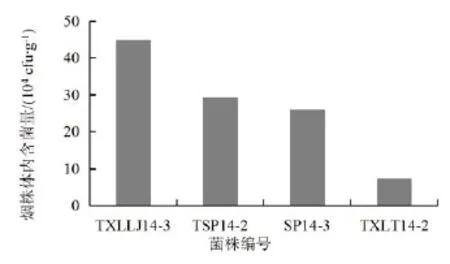
图1 接种不同烟草青枯病菌的烟株体内含菌量Fig.1 Determination of the amount of bacteria in tobacco plant after inoculation of tobacco bacterial wilt
2.3烟草青枯病菌的RAPD分析
利用筛选出的8条引物对上述不同地区具有代表性的10个烟草青枯病菌菌株进行RAPD分析。PCR扩增结果表明,扩增条带表现出明显的多态性,且条带大小主要分布在0.35~5.0 kb。供试的8条引物所标记出的总的DNA指纹谱带数为720条,其中多态性条带640条,多态检测率为88.9%,表明8条随机引物对供试烟草青枯病菌菌株有丰富的遗传多态性。图2为随机引物S27和S29的扩增结果。
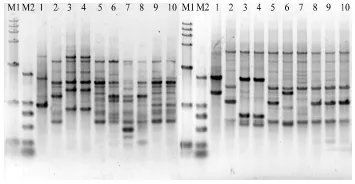
图2 随机引物S29和S27的RAPD扩增结果Fig.2 RAPDproductsamplifiedwithrandomprimeS29andS27
聚类分析结果表明(图3),供试的10个菌株大体可以聚为A、B两大类,当取相似值0.67时,A类又可分为2个群,A1群包括1个来自信阳罗山县龙井乡云烟87品种的青枯病菌菌株,A2群包括2个来自信阳罗山县檀岗村中烟201品种的青枯病菌菌株;当取相似值0.74时,B类也可分为2个群,其中B1群包括2个来自信阳罗山县龙井乡云烟87品种的青枯病菌菌株和3个来自驻马店遂平县玉山镇中烟100品种的青枯病菌菌株,B2群包括2个来自驻马店确山县瓦岗镇云烟87品种的青枯病菌菌株。以上聚类分析结果表明,10个供试烟草青枯病菌菌株中不同地理来源的菌株之间存在着明显的遗传差异,相同地理来源的菌株之间存在着遗传相似性。
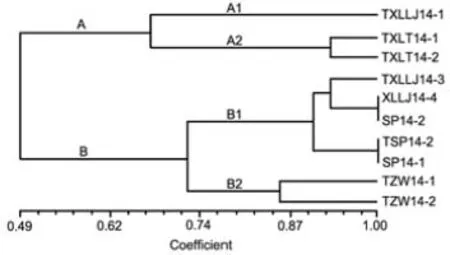
图3 烟草青枯病菌的RAPD聚类分析树状图Fig.3 Dendrogram based on RAPD analysis of R. solanacearum from tobacco
3 讨论
关于青枯菌致病力分化的研究,大多数研究者都采用了鉴别寄主植物的方法来研究其致病力差异[9-12],但他们均没有对不同致病力的青枯菌在寄主植物体内的繁殖情况进行定量分析。本研究通过人工接种试验,将豫南烟区烟草青枯病菌的致病力分为强、中、弱3种类型,其中强致病力菌株的寄主烟草品种以云烟87为主,中等致病力菌株的寄主烟草品种以中烟100为主,这可能是导致青枯菌菌株之间致病力差异的主要原因。同时,本研究还首次表明,青枯菌的致病力差异与其在寄主体内的繁殖量呈明显的正相关性。
目前应用分子生物学技术如RAPD(随机扩增多态性DNA)[9,13-14]、RFLP[15]、MLST(多位点序列分型)等[16]分子标记从基因水平上来研究不同青枯菌菌株间的DNA多态性的报道还比较少。本研究首次对豫南烟区烟草青枯病菌进行了RAPD分析,结果表明,供试烟草青枯菌菌株的DNA有着丰富的遗传多态性,且不同地理来源的青枯菌菌株之间存在着明显的遗传差异,但这种遗传差异与菌株的致病性之间无明显相关性,这与前人研究结果基本一致[9,12-13]。因此,关于豫南烟区烟草青枯病菌的致病性与遗传多样性的关系还有待进一步研究。
值得注意的是,豫南烟区为河南省烟草青枯病首次发现的新病区,且青枯菌的寄主品种中烟100为河南省的主栽品种,这就增加了青枯病在河南省范围内的传播机会,因此,为防止烟草青枯病在河南省其他各主产烟区的扩大危害,要尽量避免地区间的烟苗运输和跨地区田间操作。
4 结论
对豫南烟区烟草青枯病菌进行了致病力和遗传多样性分析,明确了烟草青枯病菌的致病力差异。RAPD分析结果表明,不同地理来源的青枯菌菌株之间存在着明显的遗传差异,但这种遗传差异与菌株的致病性之间无明显相关性。研究结果为河南省烟草青枯病的预测预报及防治提供了依据。
[1]陈瑞泰,朱贤朝,王智发,等.全国16个主产烟省(区)烟草侵染性病害调查报告[J].中国烟草科学,1997,18(4):1-7.
[2]刘旭,夏先全,姚革,等.四川省烟草青枯病的病原茵及发病规律研究[J].西南农业学报,2008,21(6):1587-1590.
[3]李小杰,王海涛,李淑君,等.豫南烟区烟草青枯病危害调查及病原鉴定[J].中国烟草科学,2015,36(3):86-89.
[4]顾江涛,许大凤,李英,等.安徽皖南烟区青枯病病原菌生化型研究[J].中国烟草科学,2008,29(3):60-61.
[5]郑继法,丁爱云.山东省烟草青枯病的发生和病原菌鉴定研究[J].山东农业大学学报,1996,27(1):17-22.
[6]成巨龙.陕西烟草青枯病的病原鉴定[J].中国烟草学报,2014,20(5):87-92.
[7]方树民,纪成灿,顾钢,等.烟草青枯病菌生理分化的研究[J].中国烟草学报,1998(1):38-43.
[8]刘海龙,黎妍妍,严亚琴,等.湖北恩施地区烟草青枯菌的生理分化研究[J].中国烟草科学,2014,35(5):79-83.
[9]何自福,虞皓,罗方芳.广东茄科青枯菌致病力分化及其 DNA多态性分析[J].植物病理学报,2003,33(5):415-420.
[10]黎妍妍,刘海龙,王林,等.湖北恩施烟区烟草青枯菌致病力分析[J].中国烟草科学,2015,36(5):59-63.
[11]王国平,罗宽,廖晓兰,等.湖南烟草青枯病菌的致病性及生物型研究[J].湖南农业大学学报,1996,22 (4):371-374.
[12]陈晓敏,胡方平,吴燕榕.福建省花生青枯病菌致病型及生物型的测定[J].福建农业大学学报,2000,29 (4):470-473.
[13]郑向华,邓海滨,刘琼光,等.广东省烟草青枯茵的菌系和遗传多样性[J].华中农业大学学报,2007,26 (4):463-468.
[14]谢世勇,阮宏椿,杜宜新,等.福建省花生青枯病菌遗传多态性分析[J].福建农业学报,2009,24(4):351-354.
[15]Poussier S,Vandewalle P,Luisetti J.Genetic diversity of African and worldwide strains of Ralstonia solanacearum asdeterminedbyPCR-restrictionfragmentlength polymorphismanalysisofthehrpgeneregion[J]. Applied and Environmental Microbiology,1999,65(5): 2184-2194.
[16]周训军,杨玉文,王静,等.烟草青枯菌遗传多样性分析[J].中国烟草学报,2014,20(4):69-74.
Analysis of Pathogenicity and Genetic Diversity of Ralstonia Solanacearum on Tobacco in Southern Henan Province
LI Xiaojie,LI Shujun*,CHEN Yuguo,WANG Haitao,LI Chengjun,ZHAO Fengxia,LI Yanping
(Tobacco Research Institute of HenanAcademy ofAgricultural Sciences,Xuchang,Henan 461000,China)
In order to take effective measures to control tobacco bacterial wilt in Henan Province,the pathogenicity and genetic diversity of Ralstonia solanacearum from tobacco in Luoshan,Queshan and Suiping counties of Henan Province were investigated. The results showed that all the isolates could be divided into three pathogenic types including strong,medium and week pathogenicity by artificial inoculation.Also,the R.solanacearum strains from different hosts showed significant difference in pathogenicity.Eight primers which were screened from 100 primers were used in RAPD analysis of R.solanacearum Isolates.A total of 720 bands were obtained and 88.9%of them were polymorphic.Based on clustering and similarity analysis,the tested isolates fell into two groups and the genetic similarity among different strains was from 0.49 to 1.00.Moreover,the genetic similarity might be related to different geographical origin.In summary,the R.solanacearum isolates infecting tobacco in southern Henan Province showed obvious differentiation of pathogenicity with abundant genetic diversity.
tobacco area in southen Henan province;tobacco bacterial wilt;differentiation of pathogenicity;genetic diversity
S435.72
1007-5119(2016)03-0062-05
10.13496/j.issn.1007-5119.2016.03.011
河南省烟草公司科技项目“河南省烟草青枯病的病原鉴定及防控技术研究”(HYKJ201407);河南省基础与前沿技术研究计划项目“豫南烟区烟草青枯病菌的种群分析及与寄主互作机理研究”(152300410142)
李小杰(1983-),女,博士,助理研究员,主要研究方向为烟草植保。E-mail:lixiaojie000631@sina.com
,E-mail:13603749396@126.com
2015-11-12
2016-01-20

