复方甲苯咪唑乳膏微生物限度检查方法的研究
郭秀秀
安徽省宿州市食品药品检验所,安徽 宿州 234000
复方甲苯咪唑乳膏微生物限度检查方法的研究
郭秀秀
安徽省宿州市食品药品检验所,安徽宿州234000
【摘要】目的:建立复方甲苯咪唑乳膏的微生物限度检查方法。方法:按《中国药典》2015年版第三部通则非无菌微生物限度检查法规定的常规法进行验证。结果:铜绿假单胞菌、枯草芽孢杆菌、黑曲霉、白色念珠菌、金黄色葡萄球菌以常规法验证回收率均大于70%,铜绿假单胞菌、金黄色葡萄球菌菌液对照组和试验组生长良好。结论:需氧菌总数、霉菌和酵母菌总数的计数采用常规的平皿倾注法,控制菌的检查采用常规法。
【关键词】复方甲苯咪唑乳膏;微生物限度检验法;药品检验
1仪器与材料
1.1试验环境根据2015年版《中国药典》第三部“9203药品微生物质量管理原则”[3]规定,试验在环境洁净度B级、局部洁净度A级的单向流空气的无菌室进行,阳性菌操作在符合国家Ⅱ级生物安全标准的生物安全柜内进行。
1.2仪器BHC-1300ⅡA2型生物安全柜(苏州苏净仪器自控设备有限公司);GHP-9162型电热恒温培养箱(上海金慧科电子有限公司);MJX-160B-Z型微电脑霉菌培养箱(上海博讯实业有限公司医疗设备厂);DYX-DHS型隔水式电热恒温培养箱(上海跃进医疗器械厂);YXQ-LS-75SⅡ型立式压力蒸汽灭菌器(上海市博讯实业有限公司医疗设备厂);TZQ-Ⅱ型匀质器型号(天津市津德实验仪器技术开发中心)。
1.3材料复方甲苯咪唑乳膏(批号:160101、160102、160103,宿州亿帆药业有限公司),0.1%无菌吐温溶液、pH7.0无菌氯化钠-蛋白胨缓冲液(自配),胰酪大豆胨液体培养基(TSB,批号:20151210-00)、胰酪大豆胨琼脂培养基(TSA,批号:20160111-00)、沙氏葡萄糖琼脂培养基(SDA,批号:20151110-00)、甘露醇氯化钠琼脂培养基(批号:20150716-00)、溴化十六烷基三甲铵琼脂培养基(批号:20151026-00)、沙氏葡萄糖液体培养基(SDB,批号:20151112-00)等均由杭州微生物试剂有限公司提供。
1.4试验菌种铜绿假单胞菌(Pseudomonas aeruginosa)[CMCC(B) 10 104]、枯草芽孢杆菌(Bacillus subtilis)[CMCC(B) 63 501]、金黄色葡萄球菌(Staphylococcus aureus)[CMCC(B) 26 003]、白色念珠菌(Candida albicans)[CMCC(F) 98 001]、黑曲霉(Aspergillus niger)[CMCC(F) 98 003]等由中国医学菌种保藏中心和中国药品生物制品检定所提供,试验用菌株的传代次数为3代。
2方法与结果
2.1菌悬液的制备及菌悬液菌落数的检查
2.1.1菌悬液的制备取经35℃培养18~24h的铜绿假单胞菌的TSB培养物1ml,用pH7.0无菌氯化钠-蛋白胨缓冲液10倍递增稀释至10-6备用,枯草芽孢杆菌和金黄色葡萄球菌用同样方法分别稀释至10-5和10-8备用,取经25℃培养2~3天的白色念珠菌的SDB培养物1ml,用上述方法稀释至10-5,备用;取经25℃培养1周的黑曲霉斜面培养物,加4mlpH7.0无菌氯化钠-蛋白胨缓冲液洗下黑曲霉孢子,吸取出孢子悬液1ml,用pH7.0无菌氯化钠-蛋白胨缓冲液10倍递增稀释至10-6,备用。
2.1.2菌悬液中菌落数的检查取“2.1.1”铜绿假单胞菌10-6级菌悬液、枯草芽孢杆菌10-5级菌悬液、金黄色葡萄球菌10-8级菌悬液各0.1ml,分别用已灭菌的45℃胰酪大豆胨琼脂培养基20ml注皿,各平行测定两皿;取2.1.3白色念珠菌10-5级菌悬液、黑曲霉10-6孢子菌悬液各0.1ml,分别用已灭菌的45℃胰酪大豆胨琼脂培养基和已灭菌的45℃沙氏葡萄糖琼脂培养基20ml注皿,各平行测定两皿,按《中国药典》2015年版规定温度培养一定时间,计数,均应不大于100cfu/ml;实测结果见表1,符合要求。
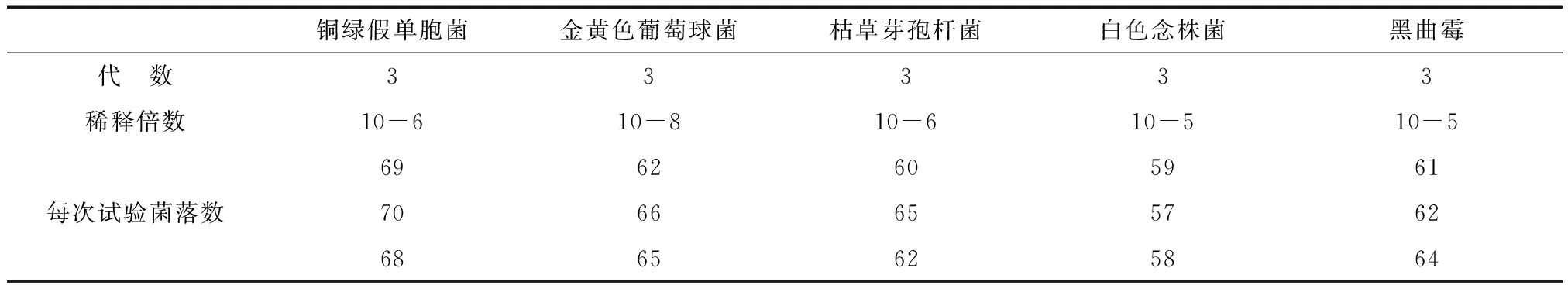
表1 试验用菌液检查(菌落计数结果平均值、单位:cfu/ml)
2.2供试液制备取本品最小包装两支(10g/支),按微生物限度检查法规定称取10g,加40℃无菌0.1%吐温溶液至100ml,匀浆仪2000转/min,3min混匀,即为1∶10的供试品溶液。
㉙有关该调查会来宁访问的情况,可参考王楠《寻找证据——1984年日本调查团的南京之行及其意义》,《江海学刊》2017年第5期。
2.3需氧菌总数、霉菌和酵母菌总数计数方法的适用性试验
2.3.1采用常规法(即平皿倾注法) 进行3次独立的平行试验。
2.3.1.1试验组取5支装有1∶10供试液的试管,分别加“2.1.1”试验菌液0.1ml,使每1ml供试液中含菌量不大于100cfu,分别取上述试验液1ml,置直径90mm的无菌平皿中,立即注入20ml温度不超过45℃熔化的无菌胰酪大豆胨琼脂培养基或无菌沙氏葡萄糖琼脂培养基,平行制备2个平皿,待凝固后置规定温度培养3~5d,逐日观察结果并记录。
2.3.1.2菌液对照组取pH7.0无菌氯化钠-蛋白胨缓冲液代替供试液,按试验组操作。
2.3.1.3供试品对照组取“2.2”制备好的供试液,以无菌0.1%吐温溶液代替菌液同试验组操作。
2.3.1.4阴性对照取无菌0.1%吐温溶液1ml置90mm的无菌平皿中,立即注入20ml温度不超过45℃熔化的胰酪大豆胨琼脂培养基或沙氏葡萄糖琼脂培养基,平行制备2个平皿,待凝固后置规定温度培养3~5d,逐日观察结果并记录。
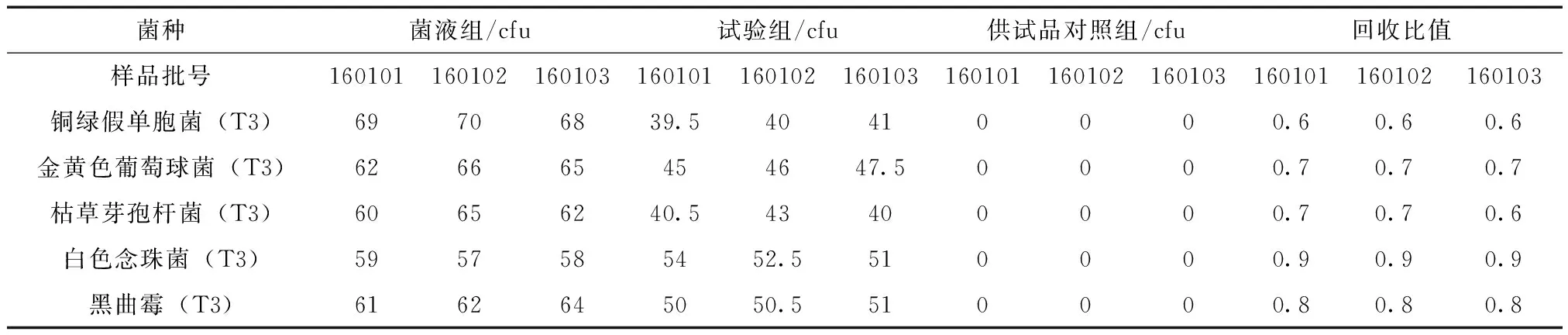
表2 需氧菌总数常规法计数方法的实验结果(常规法)

表3 霉菌和酵母菌总数常规法计数方法的实验结果(常规法)
注:表中T3表示菌种代数,下同。
从表2、表3可知,3次平行试验,试验组的平均菌落数减去供试品对照组的平均菌落数的值与菌液对照组平均菌落数的比值均在0.5~2范围内。2.4控制菌检查方法的适用性试验铜绿假单胞菌、金黄色葡萄球菌检查方法的适用性试验:按常规法进行三次平行试验。
2.4.1试验组分别取“2.2”中1∶10供试液10ml及上述不大于100cfu/ml的铜绿假单胞菌或金黄色葡萄球菌1ml,分别接种置90ml胰酪大豆胨液体培养基中,混匀,置35℃培养18~24h,按相应的控制菌的检查法检查。
2.4.2菌液对照组取pH7.0无菌氯化钠-蛋白胨缓冲液代替供试液,同试验组操作。
2.4.3供试品对照组取1∶10供试液10ml,以0.1%无菌吐温溶液代替菌液同试验组操作。
2.4.4阴性对照组取无菌0.1%吐温溶液11ml,接种置90ml胰酪大豆胨液体培养基中,混匀,置35℃培养18~24h,按相应的控制菌的检查法检查。

表4 控制菌检查方法的结果
由表4方法验证结果可以看出铜绿假单胞菌、金黄色葡萄球菌菌液对照组、试验组生长良好,说明复方甲苯咪唑乳膏对铜绿假单胞菌、金黄色葡萄球菌无抑菌作用或抑菌作用较弱。
3讨论
3.1由上述验证结果可知,三批复方甲苯咪唑乳膏在需氧菌总数、霉菌和酵母菌总数计数检查的方法适用性试验中,平皿法对铜绿假单胞菌、金黄色葡萄球菌、白色念珠菌、枯草芽孢杆菌、黑曲霉菌的回收试验均符合要求;从表4可知,控制菌铜绿假单胞菌、金黄色葡萄球菌检查可采用常规法检查。3.2培养基影响本次验证所用培养基均由杭州微生物试剂有限公司提供,在验证前每批培养基均应进行无菌及性能检查,符合2015版《中国药典》要求方可用于微生物方法验证。
3.3菌种及菌液影响因素《中国药典》2015年版要求选用标准菌株,实验所用黑曲霉菌株由中国药品生物制品检定所提供,其他菌株由中国医学菌种保藏中心提供,均选用第3代为试验菌,符合《中国药典》2015版实验菌株不得超过5代的标准。菌悬液制备完成后立即使用,未超过《中国药典》2015年版规定的“菌液制备后室温下放置,应在2h内使用”的要求。
3.4培养条件影响因素《中国药典》2015年版规定需氧菌用胰酪大豆胨琼脂培养基,培养温度30℃~35℃,培养时间不得超过3d,实验取33℃,培养3d,符合要求。霉菌和酵母菌采用沙氏葡萄糖琼脂培养基,20℃~25℃培养时间不超过5d,本实验采用25℃培养5d,符合要求。
3.5稀释剂的影响因乳膏供试品不易混和均匀,故实验过程中采用0.1%无菌吐温溶液溶解供试品,再用匀浆仪进行搅拌混合。然后用pH7.0无菌氯化钠未检出蛋白胨缓冲液(自配)稀释到合适稀释级,符合《中国药典》2015年版油脂类供试品处理要求。
3.6菌落计数是方法验证实验过程中极为重要的一步,实验采用含菌量不大于100cfu/ml菌悬液,计数时应仔观察,必要时可借助放大镜、两人复核等方法,减少操作误差。
参考文献
[1]国家药典委员会编.中华人民共和国药典(三部)[S].北京:中国医药科技出版社,2015:80-90.
[2]中国药品生物制品检定所,中国药品检验总所.中国药品检验标准操作规范[S].北京:中国医药科技出版社,2010:351-369.
[3]国家药典委员会编.中华人民共和国药典(三部)[S].北京:中国医药科技出版社,2015:220-221.
【中图分类号】R286.0
【文献标志码】A
【文章编号】1007-8517(2016)11-0012-02
(收稿日期:2016.04.11)

