四川动物源大肠杆菌耐药性、产β-内酰胺酶及血清型的检测
代鹏飞,舒 刚,林居纯,钟钦卿,邓 林
四川动物源大肠杆菌耐药性、产β-内酰胺酶及血清型的检测
代鹏飞1,舒刚2,林居纯1,钟钦卿1,邓林1
1.四川农业大学动物医学院新药安全评价实验室,温江611130;2.四川农业大学动物医学院药物制剂实验室,温江611130
摘要:目的为了解四川地区动物源大肠杆菌临床分离菌株耐药性,产β-内酰胺酶以及产酶菌株血清型流行规律。方法采用微量肉汤稀释法对467株临床菌株进行了27种抗菌药物的耐药性检测;采用CLSI推荐产ESBLs、AmpC和碳青霉烯酶检测方法检测了所有菌株产β-内酰胺酶情况;采用O抗原鉴定法对产酶菌株血清型进行了鉴定。结果467株菌对27种抗生素产生了不同程度耐药性;菌株产ESBLs、AmpC和碳青霉烯酶检出率分别为36.83%、13.70%和0.00%,产酶菌比非产酶菌具有更严重的耐药性;176株产酶菌共检测出31种血清型,以O131、O107、O78、O9、O127、O20和O157为优势血清型。结论本次检测大肠杆菌ESBLs和AmpC检出率较高,耐药形势严重,血清型复杂,应加强动物源大肠杆菌产β-内酰胺酶及血清型的监测。
关键词:大肠杆菌;耐药性;β-内酰胺酶;血清型
Supported by the National Science and technology support program of China (No. 2012BAC01B06)
大肠杆菌是动物肠道内正常栖居菌,具有致病性,条件性和非条件性致病菌等特点。大肠杆菌抗原性复杂,血清型多样。目前国内报道能致病血清型已有60多种,呈地区性和多样性分布[1]。
β-内酰胺类药物作为控制感染性疾病的一线用药,其耐药性呈逐年增长趋势。在过去的30多年里,食品动物源大肠杆菌对青霉素类耐药率从19.0%增长到81.3%[2],已有研究显示,产β-内酰胺酶是大肠杆菌重要的耐药机制之一。当前最具有临床意义的β-内酰胺酶是超广谱β-内酰胺酶(extended-spectrum β-lactamases, ESBLs)、碳青霉烯酶和头孢菌素水解酶(AmpC)[3-4]。新型β-内酰胺酶的出现导致菌株对抗生素高水平和多重耐药,其编码基因通过质粒或整合子等可移动基因元件,使得耐药基因在不同菌种间水平传播的速度加快,存在暴发性流行危险,具有重要的流行病学意义[5]。
本次研究对兽医临床分离大肠杆菌菌株进行了耐药性、产新型β-内酰胺酶及血清型的检测,旨在了解产β-内酰胺酶大肠杆菌血清型流行病学规律,为大肠杆菌病的防控提供科学依据。
1材料与方法
1.1菌株来源于2006—2011年间于四川地区分离自临床样本大肠杆菌467株,其中鸡源206株、鸭源55株、猪源198株和牛源8株。
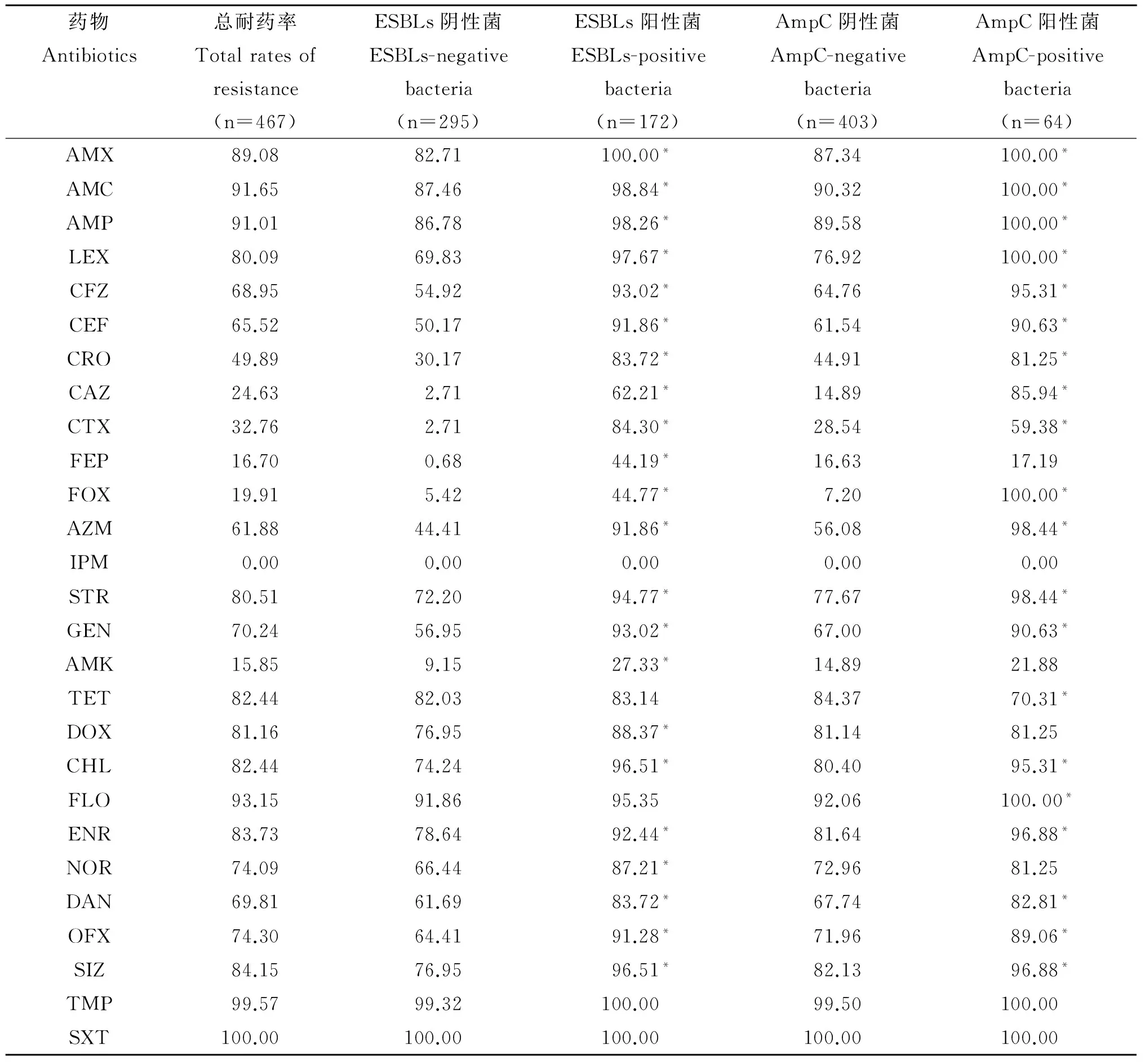
表1 不同菌株对抗菌药物的耐药率
注:与β-内酰胺酶阴性菌耐药率比较,*表示差异有统计学意义(P<0.05)
Note: Compared with β-lactamase negative strains, the * indicates a significant difference (P<0.05)
1.2药品及药敏纸片阿莫西林/克拉维酸(AMC)、氨苄西林(AMP)、头孢氨苄(LEX)、头孢唑啉(CFZ)、头孢噻呋(CEF)、头孢曲松(CRO)、头孢他啶(CAZ)、头孢噻肟(CTX)、头孢吡肟(FEP)、头孢西丁(FOX)、氨曲南(AZM)、亚胺培南(IPM)、链霉素(STR)、庆大霉素(GEN)、阿米卡星(AMK)、四环素(TET)、多西环素(DOX)、达氟沙星(DAN)、氧氟沙星(OFX)、磺胺异噁唑(SIZ)等药品由中国农业大学兽医药理学教研室惠赠;阿莫西林(AMX)、氯霉素(CHL)、氟苯尼考(FLO)、诺氟沙星(NOR)、恩诺沙星(ENR)、甲氧苄啶(TMP)、复方新诺明(SXT)等药品购自中国兽药监察所;头孢他啶(CAZ)、头孢他啶/克拉维酸(CAZ/CA)、头孢噻肟(CTX)、头孢噻肟/克拉维酸(CTX/CA)、头孢西丁(FOX)、美罗培南(MEM)和Ⅰ型新德里金属β-内酰胺酶(NDM-1)检测盒等药敏纸片均购自杭州天和微生物试剂有限公司。
1.3其他试剂36种大肠杆菌O抗原血清,购自中国兽药监察所;质控菌株大肠杆菌ATCC25922购自杭州天和微生物试剂有限公司。
1.4药敏试验及β-内酰胺酶检测采用CLSI标准微量肉汤稀释法测定大肠杆菌对抗菌药物的MIC值[6];采用CLSI推荐双纸片确认法进行产ESBLs检测[6];采用CLSI推荐头孢西丁纸片扩散试验和三维试验进行产AmpC检测[7];根据改良Hoged试验检测碳青霉烯酶[6],采用Ⅰ型新德里金属β-内酰胺酶检测盒进行金属酶检测。
1.5大肠杆菌O抗原血清型鉴定对产β-内酰胺酶菌株,参照中国兽医药品监察所提供的O抗原型血清鉴定说明书进行血清型鉴定。
2结果
2.1耐药性检测结果本次药敏检测结果显示,除对亚胺培南100%敏感外,467株动物源大肠杆菌对其余26种抗菌药物均表现出不同程度的耐药性。菌株对青霉素类(阿莫西林、阿莫西林/克拉维酸和氨苄西林)、四环素类(四环素和多西环素)、氯霉素类(氯霉素和氟苯尼考)、磺胺类(磺胺异噁唑、甲氧苄啶和复方新诺明)、氟喹诺酮类的耐药率较高(耐药率接近或超过70%);对氨基糖苷类除阿米卡星耐药率(15.85%)较低外,对链霉素和庆大霉素耐药率较高;对头孢菌素类第一代、第三代的头孢噻呋和头孢曲松耐药率较高,而对第三代的头孢噻肟、头孢他啶和第四代的头孢吡肟耐药率较低(见表1)。本次检测菌株呈5耐~26耐的多重耐药性,无优势耐药谱型。
2.2菌株产β-内酰胺酶检测及产酶阴性、阳性菌株耐药性比较产酶检测结果显示,467株大肠杆菌除未检出产碳青霉烯酶、金属β-内酰胺酶外,检出产ESBLs菌172株(检出率36.83%);产AmpC菌64株(检出率13.70%),其中4株为单产AmpC酶,60株同时产ESBLs和AmpC酶。产ESBLs、AmpC酶菌株分别对所检测的20种、22种药物耐药率显著高于阴性菌株(P<0.05)(表1),且产酶菌呈更严重的多重耐药性,其中ESBLs阳性菌多重耐药以23耐(18.02%)和24耐(25.58%)为主,而阴性菌以19耐(11.86%)和20耐(10.51%)为主;AmpC阳性菌多重耐药性以24耐(28.13%)为主,阴性菌主要为19耐(9.68%)和20耐(10.92%)。

表2 产β-内酰胺酶菌株O抗原血清型鉴定结果
2.3产β-内酰胺类酶菌株血清型鉴定对176株产β-内酰胺酶菌株(单产ESBLs 112株,单产AmpC 4株,同时产ESBLs和AmpC菌株共60株)进行了36种大肠杆菌标准抗“O”单因子血清型鉴定。鉴定结果显示除1株自凝、23株未定型外,共鉴定出152株,涵盖31种血清型,以O131(检出率16.45%)、O107(9.87%)、O78(7.90%)、O9(6.58%)、O127(6.58%)、O20(5.92%)和O157(5.92%)为优势血清,共占被检出菌株59.21%。6株产ESBLs菌株血清型检测显示为2种:O9/O107、O38/O101、O88/O93、O131/O157、O38/O107、O76/O141,说明存在一定的“O”抗原交叉反应现象。在所有产酶菌株中,单产ESBLs和产双酶菌株的血清型分布非常相似,在相同产酶菌株中有不同血清型,在不同产酶菌中有相同血清型(表2),表明菌株血清型与产酶类型无相关性。
3讨论
青霉素类药物如阿莫西林、氨苄西林等为我国临床常用药物,随药物的广泛使用,耐药菌株逐年增多,且呈交叉耐药和多重耐药之势。本次467株临床大肠杆菌对阿莫西林、氨苄西林的耐药率超过90%,与其他报道一致[8-9],且对阿莫西林/克拉维酸耐药率达91.65%,远远高于2006年与2009年的报道(耐药率6.6% ~10.0%)[8-9],高于2011年报道的51.4 %[10],说明随用药时间延长,菌株已突破β-内酰胺抑制剂的作用;本次菌株对头孢菌素类药物耐药率分布范围广(16.70%~80.09%),除对头孢西丁、头孢吡肟耐药率较低外,对头孢氨苄等耐药率较高(超过30%)。以上耐药表型分析可见,菌株对头孢类的耐药性与药物使用时间相关,药物使用时间越短,耐药率越低。值得重视的是,除头孢噻呋外,本实验所检测的其他头孢类禁止在兽医临床使用,但耐药性已较严重,可能与细菌对药物的交叉耐药性有关,也可能是与兽医临床违规使用药物有关[8];本次菌株对单环酰胺类氨曲南耐药率已达61.88%,明显高于其他报道[9];对碳青霉烯类亚胺培南全部敏感,与相关文献一致[8]。本实验菌株对其他非β-内酰胺类药物,除阿米卡星耐药率较低(15.85%)外,对其余药物耐药现象十分严重,尤其对四环素类、酰胺醇类和磺胺类的耐药率超过80%,所有受试菌株呈5耐~26耐的多重耐药性。以上结论说明本次检测菌株耐药严重,耐药谱型较广,揭示了抗菌药物在兽医临床上过量、高频率的长期使用,故在兽医临床上应谨慎使用抗菌药物,尤其应严格控制新一代头孢菌素的使用。
本次产β-内酰胺酶检测结果显示,467株大肠杆菌除未检出产碳青霉烯酶、Ⅰ型新德里金属β-内酰胺酶外,172株菌产ESBLs,检出率为36.83%,虽低于医学临床检出率(59.0%~71.2%)和兽医临床检出率(76.7%~80%)[9-11],但高于欧美国家的检出率(4.4%~14%),说明产ESBLs大肠杆菌菌株在兽医临床广泛存在。本次还检出64株产AmpC菌株(检出率13.70%),高于兽医临床检出率[14-15],且其中60株菌为同时产ESBLs和AmpC酶,使得酶作用底物更加广泛,水解抗菌药物率更高,从而导致细菌产生更高水平和更广泛的多重耐药性,给临床治疗带来相当大的困难。尽管本次检出AmpC不能确定是染色体或质粒介导产生,但有关研究显示,呈高水平、多重耐药菌株耐药表型检出的AmpC菌株为质粒介导产生的[16];结合本次产AmpC菌株对头孢西丁100%耐药,且呈18耐 ~ 25耐的多重耐药性,说明本次产AmpC菌株极可能为质粒介导产生的,其耐药基因具有广泛的传播性,需加以重视。
比较产酶菌与非产酶菌耐药性可见,产酶菌除亚胺培南外,对其余β-内酰胺类耐药率显著高于非产酶菌(P<0.05),说明ESBLs和AmpC酶是大肠杆菌耐β-内酰胺类的主要机制。此外,产酶菌株对氨基糖苷类、四环素类、酰胺醇类、氟喹诺酮类的多数药物也呈更高水平耐药,且产酶菌株多重耐药谱型更广,这一结果在其他报道可见[17]。这是因为介导新型β-内酰胺酶的耐药基因常由可结合性大质粒编码,后者可同时携带耐氨基糖苷类、喹诺酮类等多种抗菌药物的耐药基因,形成具有多种耐药表型的多重耐药菌。
血清型鉴定结果可见,176株产酶菌涵盖31种血清型,其中25种血清型(占检出血清型80.65%)是属于我国流行的致病性大肠杆菌血清型[18-19],31种血清型以O131、O107、O78、O9、O127、O20和O157为优势血清型,且血清型的分布与菌株产酶类型没有相关性。以上结论说明,无论产ESBLs还是AmpC菌株都具有广泛的致病性血清型,这带来了潜在的发病危机,给疾病治疗带来更大威胁。
参考文献:
[1]Song L, Ning YB, Zhang XY, et al. Comparative research on serotype distribution and antimicrobial resistance ofEscherichiacoliisolates from poultry in different areas of China[J]. Scientia Agricultura Sinica, 2005, 38(7): 1466-1473. (in Chinese)
宋立,宁宜宝,张秀英,等.中国不同地区家禽大肠杆菌血清型分布和耐药性比较研究[J].中国农业科学,2005,38(7): 1466-1473.
[2]Song L, Ning YB, Shen JZ, et al. Comparative research on antimicrobial resistance ofEscherichiacoliisolates from foodproducing animals in different decades of China[J]. Scientia Sinica Vitae, 2009, 39(7): 692-698. (in Chinese)
宋立,宁宜宝,沈建忠,等. 中国不同年代食品动物大肠杆菌耐药性调查研究[J]. 中国科学 C 辑:生命科学,2009,39(7): 692-698.
[3]Yusuf I, Arzai AH, Haruna M, et al. Detection of multi drug resistant bacteria in major hospitals in Kano, North-West, Nigeria[J]. Braz J Microbiol, 2014, 45(3): 791-798.
[4]Rubin JE, Pitout JD. Extended-spectrum β-lactamase, carbapenemase and AmpC producingEnterobacteriaceaein companion animals[J]. Vet Microbiol, 2014, 170(1/2): 10-18. DOI:10.1016/j.vetmic.2014.01.017
[5]Batchelor M, Threlfall EJ, Liebana E. Cephalosporin resistance among animal-associatedEnterobacteria: a current perspective[J]. Expert Rev Anti Infect Ther, 2005, 3(3): 403-417. DOI: 10.1586/14787210.3.3.403
[6]Clinical and laboratory Standards Institute. M100-S22 Performance standards for antimicrobial susceptibility testing, Twenty-second information supplement[R]. Wayne, PA: Clinical and Laboratory Standards Institute, 2012.
[7]Li JZ, Liu LP, Duan XB, et al. EDTA-cefoxitin-agar medium for laboratory detection of AmpC β-lactamases inEnterobacteriaceaeand its preliminary clinical application[J]. Lab Med, 2008, 23(2): 122-124. (in Chinese)
李金钟,刘利平,段雄波,等.EDTA-头孢西丁平板试验检测肠杆菌科细菌AmpC酶及其临床应用[J].检验医学,2008,23(2):122-124.
[8]Wei P. Study on mechanism of β-lactam antibiotic resistance in enteropathogenicE.colifrom chicken[D]. Jinan: Shandong Agricultural University, 2008. (in Chinese)
位朋.鸡源性大肠杆菌对β-内酰胺类药物的耐药机制研究[D].济南:山东农业大学,2008.
[9]Yuan L, Liu JH, Hu GZ, et al. Detection of extended-spectrum β-lactamases genotype and antibiotic resistance analysis among 30E.coliisolates from chicken[J]. Chin J Prev Vet Med, 2009, 6(31): 438-442. (in Chinese)
苑丽,刘建华,胡功政,等.30株鸡大肠杆菌ESBLs基因型检测及耐药性分析[J]. 中国预防兽医学报,2009,6(31):438-442.
[10]Lai J, Liu Y, Wang Y, et al. Surveillance of antimicrobial resistance amongEscherichiacoliisolates from different animals in Sichuan Province in 2007[J]. Chin J Vet Med, 2011, 47(4): 12-14. (in Chinese)
赖婧,刘洋,汪宇,等. 800株不同动物源大肠杆菌的耐药性监测[J]. 中国兽医杂志,2011,47(4): 12-14.
[11]Zhang XL. 201 cases of infection caused by extended-spectrum β-lactamases-producing bacteria[J]. Chin J Infect Ctrl Vol, 2015, 14(4): 270-271. DOI: 10.3969/j.issn.1671-9638.2015.04.014 (in Chinese)
张秀玲. 201例产超广谱β-内酰胺酶细菌感染病例分析[J].中国感染控制杂志,2015,14(4):270-271.
[12]Xue Y, Chen JF, Zhang XY. Detection of extended-spectrum β-lactamases genotype and antibiotic resistance analysis amongE.coliisolates from chicken[J]. Chin J Vet Med, 2011, 4(47): 30-32. (in Chinese)
薛原,陈建飞,张秀英. 鸡源大肠杆菌ESBLs基因型检测及耐药性分析[J].中国兽医杂志,2011,4 (47):30-32.
[13]Harris PN, Tambyah PA, Paterson DL. β-lactam andβ-lactamase inhibitor combination in the treatment of extended-spectrumβ-lactamse producingEnterobacteriaceae: time for a reappraisal in the era of few antibiotic options?[J]. Lancet Infect Dis, 2015, 15(4): 475-485. DOI: 10.1016/S1473-3099(14)70950-8
[14]Tang D, Zhang HJ, Ji XW, et al. Prevalence of plasmid mediated ESBLs and AmpC-type β-lactamases amongE.coliisolated from sick food-producing animals in Guangdong[J]. Chin J Vet Sci, 2012, 32(2): 242-247. (in Chinese)
汤电,张浩吉,纪雪薇,等. 广东地区患病食品动物源大肠杆菌ESBLs和AmpC酶流行分布调查[J]. 中国兽医学报,2012,32(2): 242-247.
[15]Zhang ZZ, Wu JW, Wei SY, et al. Analysis of genotype ofEscherichiacoli-producing ESBLs and AmpC β-lactamases isolated from farm animals[J]. Acta Veterinaria et Zootechnica Sinica, 2009, 40(6): 898-903. (in Chinese)
张珍珍,吴俊伟,魏述永,等.动物源大肠杆菌超广谱β-内酰胺酶与头孢菌素酶基因型分析[J].畜牧兽医学报,2009,40(6):898-903.
[16]Ghodousi A, Bonura C, Di Noto AM, et al. Extended-spectrum-lactamase, AmpC-producing, and fluoroquinolone-resistantEscherichiacoliin retail broiler chicken meat, Italy[J]. Foodborne Pathog Dis, 2015, 12(7): 619-625.
[17]Brolund A, Edquist PJ, Makitalo B, et al. Epidemiology of extended-spectrum β-lactamase -producingEscherichiacoliin Sweden 2007-2011[J]. Clin Microbiol Infect, 2014, 20 (6): 344-352. DOI: 10.1111/1469-0691.12413
[18]Wang XM, Jiang HX, Liao XP, et al. Prevalence of serotypes and virulence genes and antimicrobial susceptibility of pathogenicEscherichiacoliisolates from swine[J]. Scientia Agricultura Sinica, 2010, 43(19): 4109-4115. DOI: 10.3864/j.issn.0578-1752.2010.19.025 (in Chinese)
王秀梅,蒋红霞,廖小萍,等.猪源致病性大肠杆菌的血清型、毒力基因及抗菌药耐药性的调查[J]. 中国农业科学,2010,43(19): 4109-4115.
[19]Lu CP. Veterinary microbiology[M]. 3rd ed. Beijing: China Agriculture Press, 2001,215-218 (in Chinese)
陆承平. 兽医微生物学[M].3版.北京:中国农业出版社,2001,215-218.
DOI:10.3969/j.issn.1002-2694.2016.04.018
通讯作者:林居纯,Email: juchunlin@126.com
中图分类号:R378.2
文献标识码:C 文章编码:1002-2694(2016)04-0412-05
Corresponding author:Lin Ju-chun, Email: juchunlin@126.com
收稿日期:2015-07-20修回日期:2015-12-04
Surveillance of resistance, β-lactamase-producing and serotypes of E. coli isolates from animals in Sichuan Province, China
DAI Peng-fei1,SHU Gang2,LIN Ju-chun1,ZHONG Qin-qing1,DENG Lin1
(1.CollegeofVeterinaryMedicine,NewVeterinaryMedicineSafetyEvaluationLaboratoryofSichuanAgriculturalUniversity,Wenjiang611130,China2.CollegeofVeterinaryMedicineDepartementofPharmacy,SichuanAgriculturalUniversity(SICAI),Wenjiang611130,China)
Abstract:We investigated epidemiological characteristics of resistance, β-lactamase-producing and serotype of E. coli isolates in animals. Broth microdilution method was used to detect antimicrobial resistance; ESBLs, AmpC and carbapenemase production tests were performed on all isolates; O-antigen identification method was used to detect the serotypes of β-lactamase positive strains. The 467 isolates indicated different resistance to both β-lactam and non β-lactam; ESBLs, AmpC and carbapenemase were detected with the rates of 36.83%, 13.70% and 0.00%, respectively. β-lactamase positive isolates showed more serious resistance than negative isolates; 176 β-lactamase positive isolates belonged to 31 serotype and the major epidemic serotype were O131, O107, O78, O9, O127, O20and O157. The detection rate of ESBLs and AmpC was high in the isolates tested, the antibiotic resistance situation was serious, and the serotype of β-lactamase positive isolates was diversified, the surveillance of β-lactamase-producing and serotype of E. coli must be reinforced.
Keywords:E. coli; resistance; β-lactamase; serotype
国家科技支撑计划(No.2012BAC01B06)

