大鼠巨噬细胞感染弓形虫的基因表达谱分析
赵志军,董 辉,汪 涛,郭雅琪,钟 利,王 姝,殷国民,林 茹
大鼠巨噬细胞感染弓形虫的基因表达谱分析
赵志军1,2,董辉1,2,汪涛3,郭雅琪1,钟利1,王姝1,2,殷国民1,林茹4
1. 宁夏医科大学总医院医学实验中心,银川750004;2. 宁夏临床病原微生物重点实验室,银川750004;3. 九江学院基础医学院病原生物学教研室,九江332000;4. 宁夏医科大学检验学院,银川750004
摘要:目的分析大鼠腹腔和肺泡巨噬细胞感染弓形虫RH株的基因表达谱差异。方法以弓形虫RH株速殖子感染SD大鼠腹腔和肺泡巨噬细胞0 h、6 h后提取细胞总RNA,采用NimbleGen 12x135K微阵列基因表达分析芯片检测差异表达基因,并对部分表达变化的基因进行Real time PCR验证。结果表达分析芯片涵盖大鼠26 419个基因,对差异表达基因(Fold Change≥4.0)进行聚类分析显示,经弓形虫RH株作用6 h和0 h 的RNA表达谱相比,大鼠肺泡巨噬细胞上调的基因有49个(主要包括Zfp90,Map4k4,Mrpl42等),下调的基因有130个(主要包括Pitx1,Chpt1,Chd6等)。大鼠腹腔巨噬细胞上调的基因有136个(主要包括Map2k3,Il17b,Phka2等),下调的272个(主要包括Tlr2,Tgfb2,Wnt2等)。GO、Pathway分析差异表达的基因,大鼠腹腔巨噬细胞能够引发更多和弓形虫有关的信号通路变化,其肺泡巨噬细胞则不能引起这一效应。Real time PCR和基因芯片检测结果一致。结论大鼠腹腔和肺泡巨噬细胞感染弓形虫不同的表现型,可能和其基因表达差异引起的信号通路变化有关。
关键词:大鼠巨噬细胞;弓形虫;基因表达谱
Supported by the Ningxia Natural Science Foundation (No. NZ1245), the Ningxia Department of Education Project (2013) and the National Natural Science Foundation of China (No. 81301945)
弓形虫(Toxoplasmagondii)是一种严格的细胞内寄生原虫,能感染包括人在内的几乎所有温血动物,全世界大约有1/3的人口感染弓形虫[1]。弓形虫特殊的生物学特性被认为是研究宿主(或细胞)和寄生虫相互作用的理想模式生物[2]。大鼠和人类相似,具有抗弓形虫感染的固有免疫特征,这种特性可能主要是由巨噬细胞介导的。然而,同一宿主不同类型巨噬细胞对弓形虫感染的固有免疫应答并不一致,这种异质性可能导致肺组织和中枢神经系统对弓形虫易感[3]。本文将在前期工作的基础上,通过微阵列基因表达分析芯片研究具有代表性的大鼠腹腔和肺泡巨噬细胞免疫应答反应引起的mRNA表达谱差异变化,以期为揭示弓形虫病的致病机制和防治提供理论基础。
1材料与方法
1.1主要实验材料与试剂弓形虫RH株由九江学院汪涛副教授惠赠,ICR小鼠、SD大鼠购自宁夏医科大学动物中心(实验所用动物都经过宁夏医科大学伦理委员会批准);胎牛血清、RPMI 1640、DPBS购自GBICO公司,Trizol试剂购自Invitrogen公司;荧光定量PCR试剂采用LightCycler○R480 SYBR Green I Master, 5×1 mL包装。
1.2弓形虫传代与纯化弓形虫RH株的传代采用ICR小鼠腹腔接种。液氮中保存的菌株37 ℃水浴,待复苏后腹腔注射0.3 mL,6~7 d可见小鼠出现耸毛、反应迟钝。对有症状的小鼠,用手术刀剪开腹部毛皮,露出腹膜,腹腔注射5 mL DPBS,轻轻揉腹部约1 min,抽取腹腔液,注射到正常小鼠,3 d左右即可发病,此时获取第2代。如此再次接种,直到获取第3代时,(第3代毒力恢复,虫株状态稳定,)将全部腹腔液收回到15 mL离心管。4 ℃,1 300 g离心10 min,收集沉淀,DPBS冲悬,再次离心,RPMI 1640冲悬,细胞计数分析仪进行计数后备用。
1.3腹腔与肺泡巨噬细胞的收集
1.3.1腹腔巨噬细胞的收集用手术刀剪开大鼠腹部毛皮,露出腹膜,腹腔注射15 mL DPBS,轻轻揉腹部约1 min,抽取腹腔液至15 mL离心管。4 ℃,3 500 r/min离心10 min,收集沉淀,DPBS冲悬,再次离心,最后用RPMI 1640冲悬,细胞计数分析仪计数后调整浓度,用于后续试验。
1.3.2肺泡巨噬细胞的收集将处死的大鼠用手术剪刀剪开颈部皮肤,钝性分离出包囊器官的肌肉层,然后顺着纹理剪开肌肉层,暴露出气管,在气管上剪开一个“V”型口,将输液管的输液端倾斜剪去输液部分,小心插入气管上的“V”型口,小心拔去留置针金属部分。大鼠用10 mL注射器吸满8~10 mL DPBS液,缓慢注入肺腔,有阻力时轻轻调整输液管插入深度,大鼠反复抽吸约5~6次,吸满50 mL肺泡盥洗液至50 mL离心管中,4 ℃,1 300 g离心10 min,收集沉淀,弃上清,DPBS冲悬,再次离心,最后用RPMI 1640冲悬,细胞计数分析仪进行计数后调整浓度,用于后续试验。
1.4巨噬细胞细胞培养与纯化采用6孔板,每孔加入2 mL细胞溶液,总浓度为5×106个细胞/孔。细胞铺板后,将培养板放在细胞培养箱中37 ℃,5% CO2培养4 h,然后将上清吸出,并用37 ℃预热的DPBS轻洗细胞2遍,除去未贴壁的细胞,然后重新加入新鲜的10% 血清的RPMI 1640培养液。
1.5弓形虫感染实验弓形虫与细胞的感染比例为:T.gondii/Cells=1∶1。待巨噬细胞纯化培养后,调整纯化后的弓形虫,感染巨噬细胞,使得弓形虫浓度为4×106个细胞/孔。37 ℃,5% CO2共培养1 h后,吸弃上清,预热的DPBS轻洗细胞2遍,加入新的10 % 血清的RPMI 1640培养液2 mL,此时定义为感染0 h,在细胞培养箱中37 ℃,5% CO2共培养6 h。分别在0 h,6 h吸弃上清,DPBS轻洗细胞两遍后收取细胞,加入TRIzol试剂反复吹打后-80 ℃保存。
1.6表达谱芯片以及数据分析RNA提取采用TRIzol试剂,RNA定量采用NanoDrop ND-1000,并进行甲醛变性凝胶电泳检测完整性。反转录采用Invitrogen Superscript ds-cDNA synthesis kit,ds-cDNA标记采用NimbleGen One-Color DNA labeling kit,表达谱芯片采用NimbleGen 12 x 135K Gene Expression Array。Axon GenePix 4000B扫描仪采集芯片图像,Agilent GeneSpring GX software (version 11.5.1) 软件进行数据分析。所有样品通过均一化处理后,选择RNAs信号强度≥50,重复3次取其平均值,本实验在上海康成生物有限公司完成。
1.7生物信息学分析对表达谱差异基因基于KEGG (Kyoto Encyclopedia of Genes and Genomes)数据库进行Pathway 分析,Gene Ontology (www.geneontology.org)进行GO分析。
1.8荧光定量PCR试验验证随机选取表达上调和下调因子(NFΚBia、TLR4、TLR2、IL-6、MAP3K8、IL-17b、AKT1、AKT2),进行引物设计,送上海生工合成。在Roche 480 II荧光定量PCR仪上进行扩增检测反应。
2结果
2.1RNA的纯化及检测提取的RNA通过甲醛变性琼脂凝胶电泳检测结果显示18S和28S条带清晰,亮度比约为2∶1。Nanodrop核酸测定仪检测结果显示A260/280分别为1.83,1.85,2.00,1.99。提示总RNA纯度达到实验要求无明显降解。
2.2差异基因表达分析结果采用NimbleGen 12x135K 微阵列基因表达分析芯片,涵盖大鼠26 419个基因。杂交后的芯片经过扫描、软件分析及标准化处理后,针对RAMs0h_vs_RAMs6h,RPMs0h_vs_RPMs6h差异表达的RNA(Fold Change≥4.0),进行聚类分析。数据分析显示,经过弓形虫RH株作用6 h后的肺泡巨噬细胞与0 h RNA表达谱相比,上调的RNA有49个,主要包括Zfp90,Map4k4,Mrpl42等。下调的基因有130个,主要包括Pitx1,Chpt1,Chd6等。弓形虫RH株作用6 h后的腹腔巨噬细胞与0 h RNA表达谱相比,上调的RNA有136个,主要包括Map2k3,Il17b,Phka2等。下调的272个,主要包括Tlr2,Tgfb2,Wnt2等。
2.3差异表达基因聚类GO分析以P≤0.05作为筛选条件,RAMs6h_vs_RAMs0h_down基因主要的生物学功能是binding(GO:0005488)、protein binding(GO:0005515)、nucleic acid binding(GO:0003676)等,RAMs6h_vs_RAMs0h_up基因主要的生物学功能是binding(GO:0005488)、catalytic activity(GO:0003824)、hydrolase activity(GO:0016787)等,RPMs6h_vs_RPMs0h_down基因主要的生物学功能是NF-kappaB binding(GO:0051059),polysaccharide binding(GO:0030247),GTPase activity(GO:0003924)等,RPMs6h_vs_RPMs0h_up基因主要的生物学功能是enzyme regulator activity(GO:0030234),kinase activity(GO:0016301),phosphatase activity(GO:0016791)等。
2.4Pathway 结果分析针对RPMs6h_vs_RPMs0h变化显著的基因,统一指向了弓形虫引起的共同信号通路(见表1),RAMs6h_vs_RAMs0h表达差异显著的基因,经过Pathway分析基因变化引起的信号通路与表1中提示的无关,提示这些信号通路可能在腹腔巨噬细胞抵抗弓形虫、肺泡巨噬细胞易感弓形虫中发挥着重要的作用。
表1差异性显著表达基因KEGG通路分析结果
Tab.1KEGG pathway analysis with differentially expressed genes

KEGG通路分析KEGGpathwayP包含基因数量Genenumber主要基因KeygeneNOD-likereceptorsignalingpathway0.00007216816IL6,BIRC3,CASP1,CCL2,IL18//IL1BToll-likereceptorsignalingpathway0.00054780621TLR2//TLR4//TLR7NF-kappaBsignalingpathway0.00418823718BCL10//BCL2A1D//NFKBIAHIF-1signalingpathway0.01141496015AKT1//AKT2//BCL2MAPKsignalingpathway0.01537111027MAP3//MAP2K3//MAP3KmTORsignalingpathway0.0462888208AKT1//AKT1S1//AKT2TGF-betasignalingpathway0.00279550418ACVR1//ACVR2B//BMP7PI3K-Aktsignalingpathway0.04712266019CCND1//COL27A1//COL2A1Jak-STATsignalingpathway0.04926903010CCND1//CNTFR//CREBBP
2.5荧光定量PCR试验验证针对RAMs0h_vs_RAMs6h,RPMs0h_vs_RPMs6h差异表达的RNA(Fold Change≥4.0)随机选取各自上调因子和下调因子进行Real time PCR验证,结果基本相符。相对于大鼠RPM0h,RPM6h在NFκB、TLR4、TLR2、IL-6、MAP3K8等呈显著下调趋势,而炎性应答因子如IL-17b、AKT1、AKT2等则呈显著上调趋势,IL-17表达升高近4.5倍;相对于大鼠RAM0h,RAM6h除了NFκB、MAP3K8呈显著上调趋势外,TLR4、TLR2、IL-6、IL-17b、AKT1、AKT2等则呈无明显变化。
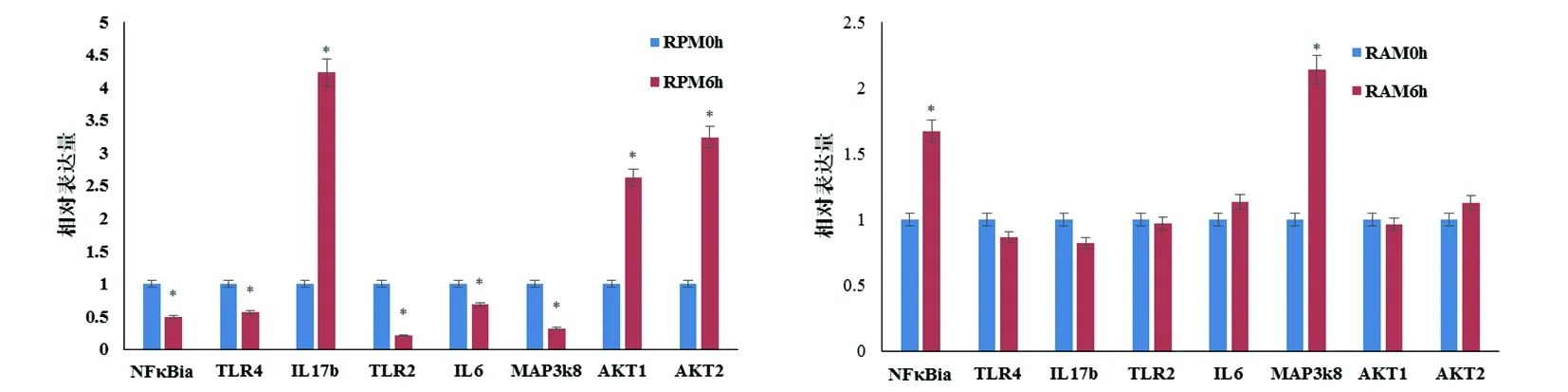
A 大鼠腹腔巨噬细胞感染弓形虫6 h基因表达谱变化;B大鼠肺泡巨噬细胞感染弓形虫6 h基因表达谱变化。差异有统计学意义是分别与RPM0h、RAM0h情况比较±s,n=3)A: RPM 6 h VS RPM 0 h; B: RAM 6 h VS RAM 0 h.图1 Real time PCR对表达谱芯片结果的验证Fig.1 Verification of the results of the expression profile chip by real time PCR
3讨论
大鼠和人感染弓形虫的特征相似,因此被认为是研究人弓形虫病的理想模式动物。巨噬细胞对宿主生理功能、免疫调节等具有重要的意义[4],同时也被认为是机体对抗病原体如弓形虫等感染最重要防御细胞。由于体外培养的大鼠巨噬细胞能够抑制弓形虫增殖,而其他易感宿主细胞却能支持弓形虫增殖,因此,巨噬细胞又被认为能够介导宿主对弓形虫的抗性[5-7]。
前期工作显示,弓形虫能够在大鼠肺泡巨噬细胞内增殖,而在其腹腔巨噬细胞内则被抑制[8],这和Catterall等[5]认为同一宿主体内不可能出现对弓形虫具有不同抗性巨噬细胞的观点相反,但与Chinchilla等[6]报道弓形虫能够在体外培养的大鼠肺泡巨噬细胞内增殖的结论一致。由于肺泡巨噬细胞是宿主抵抗微生物感染的重要防御阵线,人和动物的肺弓形虫病也常有发生,因此,我们对大鼠巨噬细胞感染弓形虫不同结局的差异分子机理产生了浓厚的兴趣,而腹腔和肺泡巨噬细胞又是宿主体内重要的免疫调节细胞,因此研究大鼠腹腔和肺泡巨噬细胞感染弓形虫后的基因表达谱差异,对于揭示同一宿主体内不同巨噬细胞弓形虫感染抗性差异机制具有重要的意义。
实际上,基因表达谱分析及PCR验证试验也确实在一定程度上反映了差异机制的存在。弓形虫RH株感染6 h后的肺泡巨噬细胞相比其0 h表达谱,有49个RNA上调,而腹腔巨噬细胞上调的RNA则有136个,说明腹腔巨噬细胞对弓形虫存在积极活跃的应答,继续分析上调基因的特性,肺泡巨噬细胞都主要集中在固有组成型基因(如Zfp90,Mrpl42等)的表达,而腹腔巨噬细胞则表现为包括Map2k3,Il17b,Phka2等激酶及Th1细胞因子的上调表达,在促炎性免疫应答反应过程中抑制了弓形虫在细胞内的增殖,从而造成腹腔巨噬细胞对弓形虫特有的抗性。在下调基因表达中,肺泡巨噬细胞仍然没有腹腔巨噬细胞活跃,只有130个基因表达下调,而腹腔巨噬细胞则有272个,进一步分析下调基因特性仍然显示肺泡巨噬细胞表达下调的基因和弓形虫免疫应答相关性不强,而腹腔巨噬细胞则集中在相关信号通路及Tp相关因子主要包括Tlr2,Tgfb2,Wnt2等基因的表达下调。通过以上表达上调和下调的基因分析,我们推测腹腔巨噬细胞可能通过巨噬细胞极化[9]作用发挥了抗弓形虫的作用,而肺泡巨噬细胞似乎在感染过程中被弓形虫挟持,造成了“木马效应”[10]。
在差异表达基因聚类GO分析和Pathway 结果分析中,我们可以明确看到RPMs6h对RPMs0h变化显著的基因,和弓形虫引起的共同信号通路(见表1)有关,如RPMs6h对RPMs0h_up中enzyme regulator activity(GO:0030234),kinase activity(GO:0016301),phosphatase activity(GO:0016791)等基因的表达上调,能够很好的解释腹腔巨噬细胞抗弓形虫感染的特性。而RAMs6h对 RAMs0h变化显著的基因并无此相关通路,这和我们认为腹腔和肺泡巨噬细胞通过Th1/Tp免疫平衡进而影响巨噬细胞极化造成对弓形虫的抗性预测不同,肺泡巨噬细胞对弓形虫的感染免疫应答似乎存在其他的机制。另外Pathway结果将RPMs6h对RPMs0h变化显著的基因,统一指向了弓形虫诱导的共同信号通路(见表1),而RAMs6h对RAMs0h变化显著的基因并无此相关通路,肺泡巨噬细胞易感弓形虫的分子机制,除了可能和上述“木马效应”有关外,也可能和其静息状态有关[11-12]。
综上,通过基因表达谱分析及其验证试验,我们发现大鼠腹腔巨噬细胞抑制弓形虫在其细胞内增殖的分子机制,主要是通过上调和Th1有关的因子和降低Tp有关因子,相关信号通路都指向了弓形虫诱导的共同的信号通路,而肺泡巨噬细胞对弓形虫的抗性虽已明确,但通过表达谱分析我们并未发现有规律的基因表达变化,提示我们尚需扩大样本量研究或改变研究策略以获得其可能的感染机制。
参考文献:
[1] Liu JF, LYU FL. Research review of pulmonary toxoplasmosis[J]. J Trop Med, 2014, 14(4): 541-544. (in Chinese)
刘晋锋,吕芳丽. 肺弓形虫病研究进展[J]. 热带医学杂志,2014,14(4):541-544.
[2] Kafsack BF, Pena JD, Coppens I, et al. Rapid membrane disruption by a perforin-like protein facilitates parasite exit from host cells[J]. Science, 2009, 323(5913): 530-533.
[3] Catterall JR, Sharma SD, Remington JS. Oxygen-independent killing by alveolar macrophages[J]. J Exper Med, 1986, 163(5): 1113-1131.
[4] Geissmann F, Manz MG, Jung S, et al. Development of monocytes, macrophages, and dendritic cells[J]. Science, 2010, 327(5966): 656-661. DOI: 10.1126/science.1178331
[5] Catterall JR, Black CM, Leventhal JP, et al. Nonoxidative microbicidal activity in normal human alveolar and peritoneal macrophages[J]. Infect Immun, 1987, 55(7): 1635-1640.
[6] Chinchilla M, Guerrero OM, Solano E. Lack of multiplication ofToxoplasmain macrophages of ratsinvitro[J]. J Parasitol, 1982, 68(5): 952-955.
[7] Li Z, Zhao ZJ, Zhu XQ, et al. Differences in iNOS and arginase expression and activity in the macrophages of rats are responsible for the resistance againstT.gondiiinfection[J]. PLoS One, 2012, 18(6): e35834. DOI: 10.1371/journal.pone.0035834
[8] Zhao ZJ, Zhang J, Wei J, et al. Lower expression of inducible nitric oxide synthase and higher expression of arginase in rat alveolar macrophages are linked to their susceptibility toToxoplasmagondiiinfection[J]. PLoS One, 2013, 18(5): e63650. DOI: 10.1371/journal.pone.0063650
[9] Zhang AM, Shen Q, Li M, et al. Comparative studies of macrophage-biased responses in mice to infection withToxoplasmagondiiToxoDB#9 strains of different virulence isolated from China[J]. Parasit Vectors, 2013, 6(1): 308.
[10] Luder CG, Lang C, Giraldo-Velasquez M, et al.Toxoplasmagondiiinhibits MHC class II expression in neural antigen-presenting cells by down-regulating the class II transactivator CIITA[J]. J Neuroimmunol, 2003, 134(1/2): 12-24.
[11] Holt PG, Oliver J, Bilyk N, et al. Down regulation of the antigen presenting cell function (s) of pulmonary dendritic cellsinvivoby resident alveolar macrophages[J]. J Exper Med, 1993, 177(2): 397-407.
[12] Lambrecht BN. Alveolar macrophage in the driver's seat[J]. Immunity, 2006, 24(4): 366-368.
DOI:10.3969/j.issn.1002-2694.2016.04.011
通讯作者:董辉,Email:173401951@qq.com
中图分类号:R382.5
文献标识码:A
文章编号:1002-2694(2016)04-0371-05
Corresponding author:Dong Hui,Email:173401951@qq.com
收稿日期:2015-09-17修回日期:2015-12-17
Gene expression profile analysis of the rat macrophages infected withToxoplasmagondii
ZHAO Zhi-jun1,2, DONG Hui1,2, WANG Tao3, GUO Ya-qi1,ZHONG Li1,2, WANG Shu1,2, YIN Guo-min1, LIN Ru4
(1.GeneralHospitalofNingxiaMedicalUniversity,Yinchuan750004,China;2.NingxiaKeyLaboratoryofClinicalandPathogenicMicrobiology,Yinchuan750004,China;3.DepartmentofPathogenicBiology,MedicalCollege,JiujiangUniversity,Jiujiang33200,China;4.DepartmentofInspectionCollege,NingxiaMedicalUniversity,Yinchuan750004,China)
Abstract:Since rat macrophages are very important for the resistance of Toxoplasma gondii infection, we investigated the differential expression profiling between rat peritoneal and alveolar macrophages by using NimbleGen 12x135K microarray in this study. Through clustering analysis (Fold Change≥4.0), the results showed that there were 49 high expression genes (mainly including Zfp90, Map4k4, Mrpl42 and so on) and 130 low expression genes (mainly including Pitx1, Chpt1, Chd6 and so on) in rat alveolar macrophages at the time course of T.Gondii RH strain infection 0 h and 6 h. As for rat peritoneal macrophages at this condition, there were 136 high expression genes (mainly including Map2k3, Il17b, Phka2 and so on) and 272 low expression genes(mainly including Tlr2, Tgfb2, Wnt2 and so on). Further analysis by Go and Pathway methods revealed that rat peritoneal macrophages could trigger more reaction on the related pathway about toxoplamosis, otherwise the alveolar macrophages could not. The results were verified by real-time PCR and the result of verification were entirely coincident. Therefore, the results indicated that the different phenotype between rat alveolar and peritoneal macrophages infected with T. Gondii RH strain may be related to their different expression gene which was connected to toxoplasmosis reaction.
Keywords:rat macrophaes; alveolar; peritoneal; gene expression profile
宁夏自然科学基金(No.NZ1245),宁夏教育厅项目(2013)以及国家自然科学基金青年科学基金(No.81301945)联合资助

