山楂叶不同采收期多种有效成分含量的比较
王兆华,张大军
(吉林省中医药科学院,长春 130012)
山楂叶不同采收期多种有效成分含量的比较
王兆华,张大军
(吉林省中医药科学院,长春130012)
摘要:目的探索山楂叶最佳采收期。方法HPLC条件:金丝桃苷检测采用Shim-pack C18(150 mm×4.6 mm,5 μm);乙腈-甲醇-四氢呋喃-5 mL·L-1醋酸溶液(1∶1∶19.4∶78.6)为流动相,检测波长为363 nm。牡荆素鼠李糖苷检测采用Diamonsil C18柱(250 mm×4.6 mm,5 μm);四氢呋喃-甲醇-乙腈-乙酸-水(38∶3∶3∶4∶152)为流动相;检测波长为330 nm。总黄酮检测利用可见分光光度法,以芦丁对照品为对照,NaNO2-Al(NO3)3-NaOH体系作显色剂,在500 nm波长处测定总黄酮含量。结果金丝桃苷进样量在0.080 5~0.402 4 μg范围内,质量浓度与峰面积线性关系良好(r=0.999 3);牡荆素鼠李糖苷进样量在0.418~2.090 μg范围内,质量浓度与峰面积线性关系良好(r=0.999 1)。结论5月采收的山楂叶中牡荆素鼠李糖苷含量最高;8~11月采收的山楂叶中金丝桃苷及总黄酮的含量较高。
关键词:金丝桃苷;牡荆素鼠李糖苷;总黄酮;山楂叶;采收期;HPLC;分光光度法;含量测定
山楂叶[1]为rataeguspinnatifidaBge.var.majorN.E.Br.CrataeguspinnatifidaBge.或Crataegus pinnatifida Bge.的干燥叶,是卫生部公布的既是食品又是药品的中药[2],是健脾开胃、消食化滞、活血化瘀的良药。山楂叶是常用中药,具有活血化瘀、理气通脉、化浊降脂的功效[3]。现代药理研究表明,山楂叶黄酮对心脏、肝脏均具有保护作用;对脑缺血亦具有保护作用,此外,还具有降脂、抗炎、活血化瘀等多种药理活性[4],临床上对心绞痛等疾病具有良好疗效[5]。山楂叶的主要活性成分为黄酮类成分,其代表成分有金丝桃苷、牡荆素葡萄糖苷、牡荆素鼠李糖苷、牡荆素等多种成分[6]。在实验研究中发现,山楂叶总黄酮提取物中各种有效成分变化较大,考虑到可能是不同采收季节所致,故对不同采收季节山楂叶的多种成分进行了测定,以探求山楂叶的最佳采收期。
1仪器与试药
1.1仪器UV-2800紫外-可见分光光度计(上海精密科学仪器有限公司);LC-10 AT高效液相色谱仪,SPD-10A紫外检测器(日本岛津公司);KQ-250型超声波处理器(天津奥特赛恩斯仪器公司);AE163电子天平(瑞士梅特勒公司)。
1.2试药金丝桃苷对照品(批号111521-200303,供含量测定用),牡荆素鼠李糖苷对照品(批号111668-200602,供含量测定用),芦丁对照品(批号100080-200707,供含量测定用),均购自中国食品药品检定研究院;山楂叶样品5,6,7,8,9,10和11月采自同一生长区,晒干,粉碎成细粉。甲醇、乙腈为色谱纯;四氢呋喃、乙酸、硝酸钠、硝酸铝和氢氧化钠等均为分析纯。
2方法与结果
2.1总黄酮含量测定
2.1.1对照品溶液的制备精密称取芦丁对照品19.90 mg,置于100 mL量瓶中,加乙醇溶液溶解并定容至刻度,摇匀,即得,质量浓度为0.199 mg·mL-1。2.1.2标准曲线绘制精密吸取芦丁对照品溶液1,2,3,4和5 mL,分别置于25 mL量瓶中,依次加水至6 mL,再分别加入质量浓度为50 g·L-1的亚硝酸钠溶液1 mL,混匀,放置6 min,各加质量浓度为100 g·L-1的硝酸铝溶液1 mL,混匀,放置6 min,分别加氢氧化钠试液10 mL,最后加水定容至刻度,摇匀,放置15 min,以相应的试剂为空白,在500 nm波长处测定吸光度[1,7]。以吸光度为纵坐标、质量浓度为横坐标绘制标准曲线,得回归方程:Y=0.477 4X-0.018 4,r=0.999 3。
2.1.3供试品溶液的制备与测定取山楂叶细粉约1 g,精密称定,置于索氏提取器中,加三氯甲烷适量,放置30 min后,加热回流(约3 h)提取至回流液近无色,弃去三氯甲烷液,药渣挥去溶剂,再置于索氏提取器中,加甲醇适量,继续提取(约4 h)至近无色,将提取液蒸干,残渣加稀乙醇溶解,转移至50 mL量瓶中,稀释至刻度,摇匀,作为供试品储备液。取供试品储备液,滤过,精密量取续滤液5 mL,置于25 mL量瓶中,加水稀释至刻度,摇匀。精密量取此液2 mL,置于25 mL量瓶中,按照标准曲线制备项下的方法,自加水至6 mL起依法操作,测定吸光度,计算样品中总黄酮含量,不同采收时间山楂叶中总黄酮含量测定结果见表1。由表1可知,总黄酮在5月时含量较低,随着生长时间的增加,含量逐渐升高,在8~11月趋于平稳,11月又有下降的趋势。
2.2金丝桃苷含量测定
2.2.1色谱条件色谱柱:Shim-pack C18(150 mm×4.6 mm,5 μm;流动相:乙腈-甲醇-四氢呋喃-5 mL·L-1醋酸溶液(1∶1∶19.4∶78.6);流速:1 mL·min-1;检测波长:363 nm;柱温:室温;进样量:10 μL[3]。
2.2.2对照品溶液的制备精密称定金丝桃苷对照品11.25 mg,置于50 mL量瓶中,加稀乙醇溶解并稀释至刻度,摇匀。精密量取此液5.0 mL,置于50 mL量瓶中,加稀乙醇稀释至刻度,摇匀,即得,质量浓度为22.5 μg·mL-1。
2.2.3供试品溶液的制备与测定分别精密吸取2.1.3项下山楂叶供试品溶液及上述金丝桃苷对照品溶液各10 μL,按照2.2.1项下的色谱条件进行测定,计算含量,不同采收时间山楂叶中金丝桃苷含量测定结果见表1。金丝桃苷在5月时含量较低,随着生长时间的增加,含量逐渐升高,在8~11月趋于平稳,11月又有下降的趋势。
2.2.4线性关系考察精密吸取2.2.2项下对照品溶液(质量浓度为22.5 μg·mL-1)4,8,12,16和20 μL,分别注入高效液相色谱仪,测定峰面积积分值,以质量浓度(C)为纵坐标,以峰面积积分值(A)为横坐标,绘制标准曲线,得回归方程:Y=1 105 397X-6 593,r=0.999 3,结果表明,金丝桃苷进样量在0.080 5~0.402 4 μg范围内,质量浓度与峰面积呈良好的线性关系。2.2.5精密度实验准确吸取质量浓度为22.5 μg·mL-1的金丝桃苷对照品溶液10 μL,按照2.2.1项下色谱条件连续进样6次,结果金丝桃苷峰面积的RSD为0.85%,表明仪器精密度良好。
2.2.6稳定性实验精密吸取供试品溶液10 μL,每隔3 h进样1次,连续考察24 h,结果金丝桃苷峰面积的RSD为0.96%,表明金丝桃苷在24 h内稳定。
2.3牡荆素鼠李糖苷含量测定
2.3.1色谱条件色谱柱:Diamonsil C18柱(250 mm×4.6 mm,5 μm);流动相:四氢呋喃-甲醇-乙腈-乙酸-水(38∶3∶3∶4∶152);流速:1 mL·min-1;检测波长:330 nm;柱温:室温;进样量:10 μL[8]。
2.3.2对照品溶液的制备精密称取牡荆素鼠李糖苷对照品7.78 mg,置于50 mL量瓶中,加体积分数为60%的乙醇溶解并稀释至刻度,摇匀,即得,质量浓度为155.6 μg·mL-1。
2.3.3供试品溶液的制备与测定分别精密吸取2.1.3项下山楂叶供试品溶液及上述牡荆素鼠李糖苷对照品溶液各10 μL,按照2.3.1项下的色谱条件进行测定,计算牡荆素鼠李糖苷含量。不同采收时间山楂叶中牡荆素鼠李糖苷含量测定结果见表1。牡荆素鼠李糖苷在5月时含量最高,随着生长时间的增加,含量逐渐下降,在8~11月趋于平稳,11月有下降的趋势。液相色谱图见图1。
表1不同采收时间山楂叶中各成分含量测定结果
Tab.1 Results of the active ingredient concentrations of Hawthorn leaves for samples of different harvests (n=3)
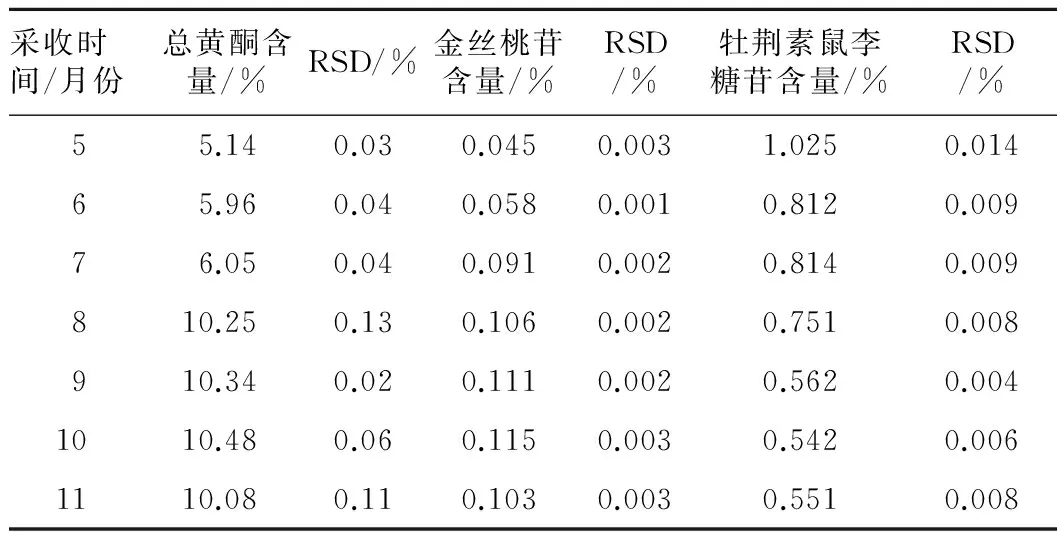
采收时间/月份总黄酮含量/%RSD/%金丝桃苷含量/%RSD/%牡荆素鼠李糖苷含量/%RSD/%55.140.030.0450.0031.0250.01465.960.040.0580.0010.8120.00976.050.040.0910.0020.8140.009810.250.130.1060.0020.7510.008910.340.020.1110.0020.5620.0041010.480.060.1150.0030.5420.0061110.080.110.1030.0030.5510.008
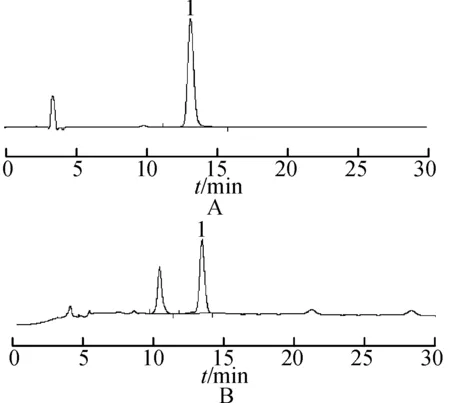
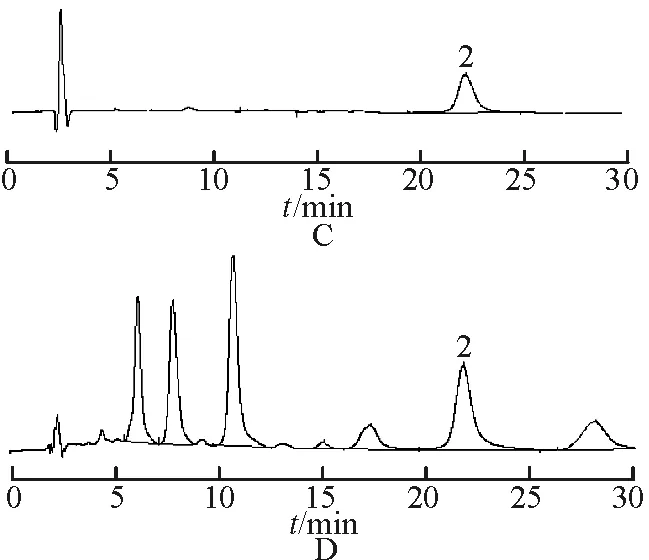
图1HPLC图
A.金丝桃苷对照品;B.山楂叶1;C.牡荆素鼠李糖苷对照品;D.山楂叶2;1.金丝桃苷;2.牡荆素鼠李糖苷
Fig.1 HPLC chromatogram
A.hyperin;B.hawthorn leaves 1;C.vitexin-2-O-rhamnoside;D.hawthorn leaves 2;1.hyperin;2.Cvitexin rat lee glycoside
2.3.4线性关系考察精密吸取2.3.2项下对照品溶液(155.6 μg·mL-1)4,8,12,16和20 μL,分别注入高效液相色谱仪,测定峰面积,以质量浓度(C)为纵坐标,以峰面积积分值(A)为横坐标,绘制标准曲线,得回归方程:Y=1 253 583X+30 884,r=0.999 1,表明牡荆素鼠李糖苷进样量在0.418~2.090 μg范围内,质量浓度与峰面积积分值线性关系良好。
2.3.5精密度实验精确吸取牡荆素鼠李糖苷对照品溶液(155.6 μg·mL-1)10 μL,按照2.3.1项下色谱条件重复进样6次,结果牡荆素鼠李糖苷的峰面积积分值的RSD为0.79%,表明精密度良好。2.3.6稳定性实验精确吸取供试品溶液10 μL,每隔3 h 进样1次,连续考察24 h,结果牡荆素鼠李糖苷面积的RSD为0.91%,表明牡荆素鼠李糖苷在24 h内稳定。
3讨论
山楂叶的主要活性成分为黄酮类化合物,代表成分有金丝桃苷、牡荆素鼠李糖苷。山楂叶及山楂叶提取物均收载于2010年版《中国药典》一部,山楂叶含量测定项下测定总黄酮及金丝桃苷含量;山楂叶提取物含量测量项下测定总黄酮及牡荆素鼠李糖苷含量,笔者参考《中国药典》,分别对不同采收时间的山楂叶中3种成分进行了测定。
《中国药典》规定山楂叶的采收季节为夏、秋两季,对不同时间采收的山楂叶中总黄酮、金丝桃苷及牡荆素鼠李糖苷含量的测定,实验结果发现:5月采收的山楂叶中牡荆素鼠李糖苷的含量最高;8~11月采集的山楂叶中金丝桃苷及总黄酮的含量较高。山楂叶牡荆素鼠李糖苷的含量较高时宜在5月采收;山楂叶金丝桃苷的含量及总黄酮较高时宜在8~11月采收,实验结果与文献报道稍有差别[9-10],本实验提示,依据成分及临床需要适时采收山楂叶较适宜。
参考文献:
[1]国家药典委员会.中国药典2010版[S].一部. 北京:中国医药科技出版社,2010:29.
[2]卫生部.关于进一步规范保健食品原料管理的通知[Z].卫法监发[2002]51号.
[3]国家药典委员会.中国药典2010版[S]. 一部. 北京:中国医药科技出版社,2010:30.
[4]于栋华,包顺茹,于纯淼,等.山楂叶总黄酮药理作用研究进展[J].辽宁中医药大学学报,2013,15(3):174-177.
[5]李慧,鲁卫星.山楂叶提取物在心血管疾病中的研究进展[J].世界中西医结合杂志,2014,9(8):881-884.
[6]王领弟,李艳荣,潘海峰,等.山楂叶的研究近况[J].承德医学院学报,2011,28(3):313-315.
[7]汪远江,汪洪武,都俊辉,等.分光光度法测定玉兰总黄酮含量[J].西北药学杂志,2008,26(6):356-358.
[8]国家药典委员会. 中国药典2010版[S]. 一部. 北京:中国医药科技出版社,2010:372.
[9]王肖,杜义龙,赵胜男,等.承德产山楂叶中总黄酮和5种黄酮类成分含量的动态分析 [J]. 中国实验方剂学杂志,2013,19(17):171-175.
[10]高光跃,冯毓秀.山楂果实和叶中成分积累动态的研究[J].西北药学杂志,1993,8(4):157-159.
基金项目:国家重大新药创制项目(编号:2012X09103201-25);国家科技重大专项项目(编号:2013ZX09103002-022);吉林省科技发展计划专项项目(编号:20140311014YY)
doi:10.3969/j.issn.1004-2407.2016.04.007
中图分类号:R927.2
文献标志码:A
文章编号:1004-2407(2016)04-0350-04
(收稿日期:2015-09-23)
Comparison of the active ingredient contents in hawthorn leaves samples of different harvests
WANG Zhaohua,ZHANG Dajun
(Academy of Chinese Medical Sciences of Jilin Province,Changchun 130012,China)
Abstract:ObjectiveTo explore the suitable time to harvest hawthorn leaves.MethodsHPLC was used and the conditions were as follows:Shim-pack C18(150 mm×4.6 mm,5 μm) column with the mobile phase consisted of acetonitrile-methanol-tetrahydrofuran -5 mL·L-1acetic acid(1∶1∶19.4∶78.6) in the separation of hyperin,and the detection wavelength was set at 363 nm. The separation of vitexin-2-O-rhamnoside was performed on the Diamonsil C18(250 mm×4.6 mm,5 μm) column with the mobile phase consisted of tetrahydrofuran,acetonitrile, methanol, acetic acid and water(in a ratio of 38∶3∶3∶4∶152). The detection wavelength was set at 330 nm . The content of total flavone in hawthorn leaves was determined by spectrophotometry.To compare with the rutin reference substance,NaNO2-Al(NO3)3-NaOH was used as the color development reagent. The detection wavelength was set at 500 nm. ResultsThe linear relationship between area and amount was noted for hyperin with the amount of 0.080 5-0.402 4 μg(r=0.999 3); The linear relationship between area and amount was noted for vitexin-2-O-rhamnoside with the amount of 0.418-2.090 μg(r=0.999 1).ConclusionThe content of vitexin-2-O-rhamnoside in hawthorn leaves which were harvested in May was the highest;The contents of hyperin and total flavone in hawthorn leaves which were harvested from August to November were relatively high. Key words: hyperin;vitexin-2-O-rhamnoside; total flavone;hawthorn leaves;harvest; HPLC; spectrophotometry;content determination

