太白蓼中酚酸类成分的UPLC/Q-TOF-MS研究
唐瑜蓉,罗定强,刘 越,刘海静*
(1.陕西中医药大学,咸阳 712046;2.陕西省食品药品检验所,西安 710065)
太白蓼中酚酸类成分的UPLC/Q-TOF-MS研究
唐瑜蓉1,罗定强2,刘越2,刘海静2*
(1.陕西中医药大学,咸阳712046;2.陕西省食品药品检验所,西安710065)
摘要:目的建立太白蓼(Polygonum taipaishanense Kung)酚酸类化学成分的超高效液相色谱串联四级杆飞行时间质谱(UPLC-Q-TOF-MS)的分析方法。方法采用UPLC-Q-TOF-MS法分析,Agilent Eclipse Plus C18色谱柱(150 mm×2.1 mm,3.5 μm);流动相为1 mL·L-1冰醋酸(A)-乙腈(B)梯度洗脱;进样量为2 μL;流速为0.3 mL·min-1;柱温为30 ℃。飞行时间质谱采用负离子模式,扫描范围为100~1 100;Fragmentor 130 V ;Drying Gas 10 L· min-1;Nebuilzer 45 psi;Gas Temp 350 ℃;Skimmer 45 V。结果鉴定了太白蓼中13个成分,其中4个成分通过对照品比对确认。结论建立了UPLC/Q-TOF-MS方法对太白蓼中化学成分进行了鉴定,为太白蓼的质量控制及标准建立奠定了基础。
关键词:酚酸类成分;太白蓼;超高效液相色谱-飞行时间质谱
太白蓼为蓼科植物太白蓼PolygonumtaipaishanenseKung的干燥根茎,又名大红粉[1],《中华本草》将太白蓼作为蝎子七的多基源品种之一收录其中。太白蓼产于陕西眉县和太白县及青海、四川、云南等地[2-3]。梁波等[4]在对太白蓼中13种挥发油成分进行鉴定的同时,测定了其抗菌活性,并在太白蓼中分离得到8个单体化合物,分别为β-谷甾醇、5-粘霉烯-3-酮、大黄素、3′4′,5,7-四甲氧基黄酮、表儿茶素、儿茶素、没食子表儿茶素和绿原酸。对太白蓼的化学成分研究报道较少,作者采用UPLC-Q-TOF-MS快速鉴定分析了太白蓼中的酚酸类化合物,为进一步研究太白蓼的化学成分提供依据。
1仪器与试药
1.1仪器超高效液相色谱仪(Agilent Technologies 1290 Lnfinity);超高效分辨率的精确质量四级杆-飞行时间质谱仪(Agilent 6540 Q-TOF);Mass Hunter及Qualitative Analysis工作站。Mass Hunter PCDL Manager数据库软件。
1.2试药太白蓼药材采自陕西秦岭山,经陕西省食品药品检验所罗定强副主任药师鉴定为蓼科植物太白蓼(PolygonumtaipaishanenseKung)的根茎。对照品:绿原酸(中国药品生物制品检定所,批号110753-201314,质量分数为96.6%);柠檬酸(中国药品生物制品检定所,批号111679-200401);没食子酸(中国药品生物制品检定所,批号110831-201204);表儿茶素(中国药品生物制品检定所,批号878-200102);甲醇、乙腈为色谱纯;水为超纯水。
2方法与结果
2.1供试品溶液的制备取太白蓼粗粉0.5 g,精密称定,置于具塞锥形瓶中,精密加入50 mL甲醇,称定质量,超声处理30 min,冷却,称定质量,用甲醇补足损失的质量,滤过,弃去初滤液,用0.22 μm微孔滤膜滤过,取续滤液,即得。
2.2对照品溶液的制备取绿原酸、没食子酸、表儿茶素和柠檬酸对照品适量,精密称定,加甲醇制成质量浓度为10 μg·mL-1的溶液,作为对照品溶液。
2.3色谱条件Agilent Eclipse Plus C18色谱柱(150 mm×2.1 mm,3.5 μm)。流动相:1 mL·L-1冰醋酸(A)-乙腈(B),梯度洗脱,0~2 min,5% B;2~10 min,30% B;10~20 min,95% B;20~22 min,95% B;22~22.1 min,5% B;22.1~30 min,5% B。流速为0.3 mL·min-1;柱温为30 ℃;进样量为2 μL。
2.4质谱条件采用负离子模式;电子喷雾离子源(ESI)负离子模式,Fragmentor 130 V;Drying gas 10 L·min-1;Nebuilzer 45 psi;Gas temp erature 350 ℃;Skimmer 45 V;OCT IRE VPP 750 V;scan range 100~1 100;Acquisition rate/time 2 s-1。
2.5成分的鉴定太白蓼样品在2.3及2.4色谱条件及质谱条件下分析得太白蓼的UPLC/Q-TOF-MS总离子流图,见图1。化合物的鉴定方法:首先,根据飞行时间质谱测得的总离子流色谱峰上所得到的精确相对分子质量,应用Qualitative Analysis分析软件计算可能的分子组成(误差<5 ppm),并结合Mass Hunter PCDL Manager数据库比对,对各化合物进行初步鉴定。其次,选择合适的分子离子峰通过二级质谱的裂解,获得各个成分峰的二级质谱碎片信息,根据离子的裂解情况并结合对照品比对和太白蓼的化学成分的文献报道进一步确认推测,共鉴定了太白蓼中的13个成分,见表1。
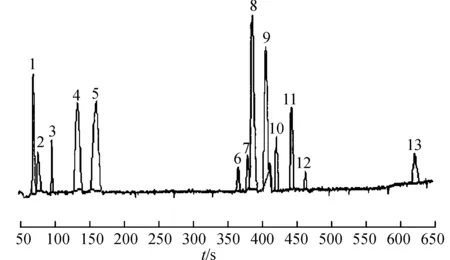
图1太白蓼的总离子流图
Fig.1 UPLC/Q-TOF-MS chromatogram ofPolygonumtaipaishanenseKung
峰2和峰3 TOF-MS均给出分子离子峰191.020 2,Qualitative Analysis工作站计算其分子式为C15H14O7,与Mass Hunter PCDL Manager中药数据库进行比对,初步推测为柠檬酸。再根据TOF-MS二级碎片离子信息m/z111.008 6,经与对照品比对,确定为柠檬酸。
峰9分子离子峰m/z值为 289.072 1,由质谱软件计算精确分子式为C15H14O6,与中药数据库进行比对,与表儿茶素相对分子质量一致,故初步鉴定为表儿茶素[5-6]。经过TOF-MS二级碎片离子信息m/z125.045 1,245.082 4和203.071 2,与对照品比对一致,确定为表儿茶素。
峰11的鉴定方法为:根据总离子流图色谱峰中所得的精确化合物的相对分子质量353.087 6,通过Qualitative Analysis工作站计算其精确分子式为C16H18O9,并根据数据库与文献比对,初步鉴定了该化合物[7-11]。进而选择该母离子峰进行碰撞诱导解离,通过二级质谱裂解,获得化合物相应的离子碎片191.056 2、161.024 5,并且其色谱保留时间、分子离子峰和二级质谱碎片与绿原酸对照品完全一致,根据离子的裂解情况并结合文献推测,故鉴定该化合物为绿原酸[11-14]。
表1太白蓼UPLC-Q-TOF-MS化学成分的鉴定分析结果
Tab.1 Results of qualitative analysis of chemical constituents inPolygonumtaipaishanenseKung

峰号tR/min实测值m/z理论值m/z分子式离子碎片鉴定化合物名称11.192195.0510195.0510C6H12O7113.0238gluconicacid(葡萄糖酸)a21.308191.0202191.0197C6H8O7111.0086citricacid(柠檬酸/枸橼酸)ab31.640191.0202191.0197C6H8O7111.0086citricacid(柠檬酸/枸橼酸)ab42.579169.0147169.0142C7H6O5125.0242gallicacid(没食子酸)ab52.720331.0671391.0671C13H16O10271.0463,211.0249,169.0143galloyl-glucose(1-单宁酸苷)a66.142577.1341577.1351C30H26O12125.0242,289.0715,407.0765apigenin-7-O-(6"-(E)-p-coumaroyl)-beta-D-galactopyranosidea76.375483.0770438.0780C20H20O14169.0139,211.0240,271.0448,313.0583,241.03581,6-Di-O-galloyl-glucosea86.491191.0566191.0561C6H10O4686.7723methylglutarate(戊二酸氢甲酯)a96.815289.0721289.0718C15H14O6125.0451、245.0824、203.0712(-)-epicatechin(表儿茶素)ab106.906465.1028465.1038C21H22O12191.0557,353.0857,112.9859,429.0028plantagoside(车前子苷)a117.438353.0876353.0878C16H18O9191.0559,161.0245chlorogenicacid(绿原酸)ab127.762729.1452729.1461C37H30O16125.0239,169.0157,289.0714,407.0754,577.1330procyanidinB5,3'-O-gallate(原花青素)a1310.644435.1291435.1297C21H24O10licoagrosideF(次果甘草苷F)a
注:a. Identificated from mass data;b. Confirmed by comparison with reference standards.
3讨论
太白蓼根茎呈扁圆柱形,稍弯曲,长3~5 cm,直径0.5~3.0 cm,外表粗糙,呈灰褐色至黑褐色,环节较明显,有横皱纹,常残留褐色细小须根;质地坚硬,脆而易折断;味涩、微苦,性平。秦巴山区民间用太白蓼治疗痢疾、腹泻、肠风下血、崩漏、白带、吐血、外伤出血等病症[12-14]。
采用超高效液相色谱串联四级杆飞行时间质谱(UPLC-Q-TOF-MS)法进行定性分析,通过分析质谱碎片、相对分子质量、参考文献数据及与对照品比对,推测并鉴定了太白蓼中的13种化学成分,其中4个二级质谱与对照品比对,结果显示,其二级质谱碎片信息完全一致。秦岭七药资源丰富,约122种,其基源植物分属46科92属,以蓼科、毛茛科、菊科、百合科等来源的植物较多[15-16]。随着研究的不断深入,秦岭七药的一药多源等现象较为普遍,本研究为太白蓼成分定性提供了快速高效的方法,为快捷准确地鉴别及评价太白蓼的药材质量提供参考。
实验考察了超声提取和加热回流提取方法对化合物提取效率的影响,结果表明,超声提取法操作简便,提取效率高,对遇热易分解的化合物影响较小。考察了不同提取溶剂(水、甲醇、乙醇和体积分数为50%的甲醇)对提取效率的影响,最终确定样品的制备方法。
通过色谱条件的优化,考察了1 mL·L-1的冰醋酸-乙腈、1 mL·L-1的甲酸-乙腈、1 mL·L-1的冰醋酸-甲醇和1 mL·L-1的甲酸4种不同种类的流动相系统对太白蓼的分离情况,结果发现1 mL·L-1冰醋酸-乙腈峰分离度及质谱响应较好,最终选择1 mL·L-1冰醋酸-乙腈为流动相系统。
本实验比较了正离子模式和负离子模式下的峰响应,发现负离子模式下峰响应优于正离子模式,同时文献报道负离子模式下酚酸类化合物的质谱解析,方便二级质谱的文献比对。实验考察了Fragmentor、Nebuilzer、Gas temp、Skimmer、OCT IRE VPP等参数,进行了优化。最终建立了太白蓼HPLC-Q-TOF-MS方法,为太白蓼药材及制剂的质量控制和进一步研究提供了依据。
参考文献:
[1]中国科学院西北植物研究所.秦岭植物志[M].北京:科学出版社,1981:163.
[2]吴振海,傅青,陈书文.陕西特有的中草药[J].中国药学杂志,1991,26(11):654.
[3]吴振海,傅青,陈书文.陕西民间“七”药种类整理[J]. 中药材,1990,13(5):14-16.
[4]梁波.山西太白山两种野生药用植物化学成分的研究[D].西安:陕西师范大学,2007.
[5]李映丽,吕居娴,苏艳芳.太白蓼的生药学研究[J].西安医科大学学报,1995,16(3):298-301.
[6]宋小妹,刘海静.太白七药研究与应用[M].北京:人民卫生出版社,2011,3:314-321.
[7]许文,傅志勤,林婧,等.HPLC-Q-TOF-MS和UPLC-QqQ-MS的三叶青主要成分定性与定量研究[J].中国中药杂志,2014,39(22):4365-4372.
[8]Ibrahim M Abu-Reidah,David Arráez-Román,Rosa Quirantes-Piné,et al.HPLC-ESI-Q-TOF-MS for a comprehensive characterization of bioactive phenolic compounds in cucumber whole fruit extract[J].Food Res Int,2011,46(4):108-117.
[9]Anna L C, Chiara C,Carlo C,et al.Comparison of extraction methods for the identification and quantification of polyphenols in virgin olive oil by ultra-HPLC-QToF mass spectrometry[J].Food Chem,2014,158(2):392-400.
[10]Ferreres F,Grosso C,Gil-lzquierdo A,et al.HPLC-DAD-ESI/MS(n) analysis of phenolic compounds for quality control of Grindelia robusta Nutt and bioactivities[J]. J Pharm Biomed Anal,2014,94(3):163-172.
[11]Qi L W,Chen C Y,Li P.Structural characterization and identification of iridoid glycosides,saponins,phenlic acids and flavonids in Flos Lonicerae Japonicae by a fast liquid chromatography method with diode-array detection and time-of-flight mass spectrometry[J].Rapid Commun Mass Spectrom,2009,23(19):3227-3242.
[12]罗定强,黄艳,樊宝娟,等.白蝎子七的质量标准[J].安徽医药, 2013, 17(11):1856-1858.
[13]邸云龙.太白蓼质量标准研究[D].咸阳:陕西中医学院,2010.
[14]秦建平,吴健雄,李艳静,等.DART/Q-TOF-MS快速鉴定龙血竭中5个酚酸类成分[J].药物分析杂志,2014,34(5):819-823.
[15]张琳,张磊,尹梅,等.秦岭七药植物资源的调查研究[J].西北药学杂志,2014,29(4):335-342.
[16]席可,郭增军,张卉,等.陕西七药中的一药多源考证及分析[J].西北药学杂志,2013,28(6):565-569.
基金项目:陕西省科技统筹创新工程计划项目(编号:2013KTCQ03-14)
作者简介:唐瑜蓉,女,在读硕士研究生
*通信作者:刘海静,女,主任药师,硕士研究生导师
doi:10.3969/j.issn.1004-2407.2016.04.006
中图分类号:R284
文献标志码:A
文章编号:1004-2407(2016)04-0347-04
(收稿日期:2015-09-07)
Study on phenolic compounds in Polygonum taipaishanense Kung by UPLC-Q-TOF-MS
TANG Yurong1,LUO Dingqiang2,LIU Yue2,LIU Haijing2*
(1.Shaanxi University of Traditional Chinese Medicine,Xianyang 712046,China;2.Shaanxi Institute for Food and Drug Control,Xi′an 710061,China)
Abstract:ObjectiveTo establish a method for the analysis of phenolic compounds in Polygonum taipaishanense Kung by UPLC-Q-TOF-MS. MethodsThe method was performed on an Agilent Eclipse Plus C18column (150 mm×2.1 mm,3.5 μm),and the mobile phase consisted of 1 mL·L-1acetic acid aqueous solution and acetonitrile with gradient elution program.The injection volume was 2 μL at a flow rate of 0.3 mL·min-1.The column tempetature was 30 ℃.Compound identification was performed by UPLC-Q-TOF-MS in a negative ionization mode.The identitication conditions were as follows:sheath gas flow was 10 L·min-1;Gas temp erature was 350 ℃; Fragmentor was 130 V; Nebuilzer was 45 psi; Skimmer was 45 V;Scan range was 100-1 100;Acquisition rate time was 2 s-1. Results The main peaks were separated clearly and respectively in 30 min,and 13 compounds were identified.ConclusionThe established method for the determination of the chemical constituents in Polygonum taipaishanense Kung is simple,rapid,and reliable,and paves a way for the quality control and further study.
Key words:phenolic compounds;Polygonum taipaishanense Kung;UPLC-Q-TOF-MS

