微生物发酵法产脱落酸的研究进展
施天穹,彭辉,季荣钰,石焜,曾斯雨,黄和,纪晓俊(南京工业大学生物与制药工程学院,材料化学工程国家重点实验室,江苏 南京 211816)
进展与述评
微生物发酵法产脱落酸的研究进展
施天穹,彭辉,季荣钰,石焜,曾斯雨,黄和,纪晓俊
(南京工业大学生物与制药工程学院,材料化学工程国家重点实验室,江苏 南京 211816)
摘要:脱落酸是一种以异戊二烯为基本单位的酸性倍半萜类物质,是一种重要的植物激素,在调节植物生长代谢、抵抗农业自然灾害、增加农作物产量等诸多方面发挥着重要的作用,具有非常广阔的应用前景。本文介绍了天然脱落酸的生物合成途径,并从发酵菌株、发酵底物、发酵工艺、分离提取等方面阐述了微生物发酵产脱落酸的研究进展。同时讨论了天然脱落酸发酵过程中存在的问题,如初始菌株产量低、发酵周期长、发酵工艺不稳定、产物提取效率低等,因此本文在此基础上指出,筛选优良性状的生产菌株、进一步研究脱落酸生物合成途径中关键酶的酶学性质以及进一步开发脱落酸的先进发酵与分离提取工艺是今后研究的重点方向。
关键词:脱落酸;倍半萜;发酵;灰葡萄孢霉
脱落酸(abscisic acid,ABA)是一种以异戊二烯为基本单位的酸性倍半萜类物质,与生长素、赤霉素、细胞分裂素、乙烯同为植物的五大类内源激素,是一种重要的植物激素,除了能够诱导植物抗逆基因表达,激活植物体内的抗逆免疫系统,提高植物自身对干旱、寒冷、病虫害、盐碱的抗性以外,还具有促进种子和果实贮存蛋白与糖分的积累,提高农作物与水果的品质以及控制花芽分化,调节花期等特性,因此具有较高的开发与应用前景[1-5]。由于天然脱落酸 [(+)ABA] 在植物中的含量非常低,每200kg的棉桃仅能提取9mg(+)ABA晶体,因此提取法很难实现(+)ABA的规模化生产。而化学法合成ABA,不仅步骤繁琐,成本高,而且由于分子结构中存在手性碳原子,合成的产物是天然型(+)ABA与非天然型(–)ABA的混合物(如图 1所示),其活性较低[6],也很难广泛地应用于大规模的农业生产。所以,长期以来,虽然(+)ABA具有很强的功效,但却是五大类植物激素中唯一未能在生产上得到广泛应用的植物激素。用微生物发酵法产ABA可以摒弃提取法和化学合成法的缺陷,得到的脱落酸是(+)ABA,具有活性、纯度高等优点,有利于实现(+)ABA的工业化生产,解决(+)ABA价格昂贵、合成困难以及存在异构体的难题,能进一步促进其在各个领域的研究运用。
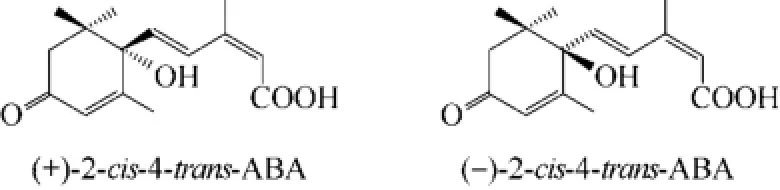
图1 天然脱落酸及其对映异构体化学结构
1 脱落酸的生物合成途径
与植物主要通过甲基赤藻糖磷酸(MEP)途径生成脱落酸前体不同,微生物在代谢途径中大多利用甲羟戊酸(MVA)途径来生成脱落酸的前体异戊烯基焦磷酸(isopentenyl pyrophosphate,IPP)与二甲基烯丙基焦磷酸(dimethylallyldiphosphate,DMAPP)[7-9],之后的合成途径虽然在不同的微生物中略有差异,但主要的合成步骤已经基本确定,见图2。脱落酸生物合成过程中,首先糖类、脂质、蛋白质在各自的代谢作用下生成乙酰CoA,一部分乙酰CoA进入三羧酸循环供能。与此同时,另一部分乙酰CoA流入MVA途径形成IPP与DMAPP,两者在异戊烯基转移酶(isopentenyl transferases,IPT)和法尼基焦磷酸合酶(Farnesyl diphosphate synthase,FPS)的作用下生成法尼基焦磷酸(Farnesyl pyrophosphate,FPP)。在大多数情况下,FPP可以直接合成ABA的初始骨架。但是,有一些研究表明[10],在发酵培养底物中增加类胡萝卜素的浓度,可以显著提高微生物产ABA的能力,因此,并不能完全排除存在另一条与高等植物类似的类胡萝卜素降解途径生成 ABA骨架的可能性,其中的关键酶编码基因还有待进一步的研究挖掘。最后,ABA 骨架再经一系列氧化反应后生成终产物ABA。
2 发酵菌株
自然界中可以积累 ABA的菌株主要有尾孢霉属(Cercospora)、葡萄孢霉属(Botrytis)、长喙壳属(Ceratocystis)、曲霉属(Aspergillus)等,见表1。在这些微生物中,尾孢霉属、葡萄孢霉属和曲霉属产量相对较高。1977年,ASSANTE等[11]首次发现蔷薇色尾孢霉(Cercospora rosicola)可以用来生产ABA,但存在着发酵时间长(30~40天),产量低(0.06g/L)的情况,很难用于大规模工业化生产。1982年,MARUMO等[12]开始使用灰葡萄孢霉(Botrytis cinerea)来生产(+)ABA。与前者相比,该菌的发酵时间显著缩短,产量有所提升,具有较好的工业化生产前景,因此是生产(+)ABA的热门菌株之一,受到广泛的关注。在此之后,很多(+)ABA的工业化研究工作都围绕着灰葡萄孢霉菌种的诱变筛选进行,并取得了一定的成果。如余永柱利用紫外激光复合诱变技术筛选出产量达到2.1mg/g的发酵菌种。郑衍、吴江[14]从植物致病菌株中分离出的灰葡萄孢霉,经紫外和硫酸二乙酯多次诱变后,ABA产量提升了14倍,达374mg/L。
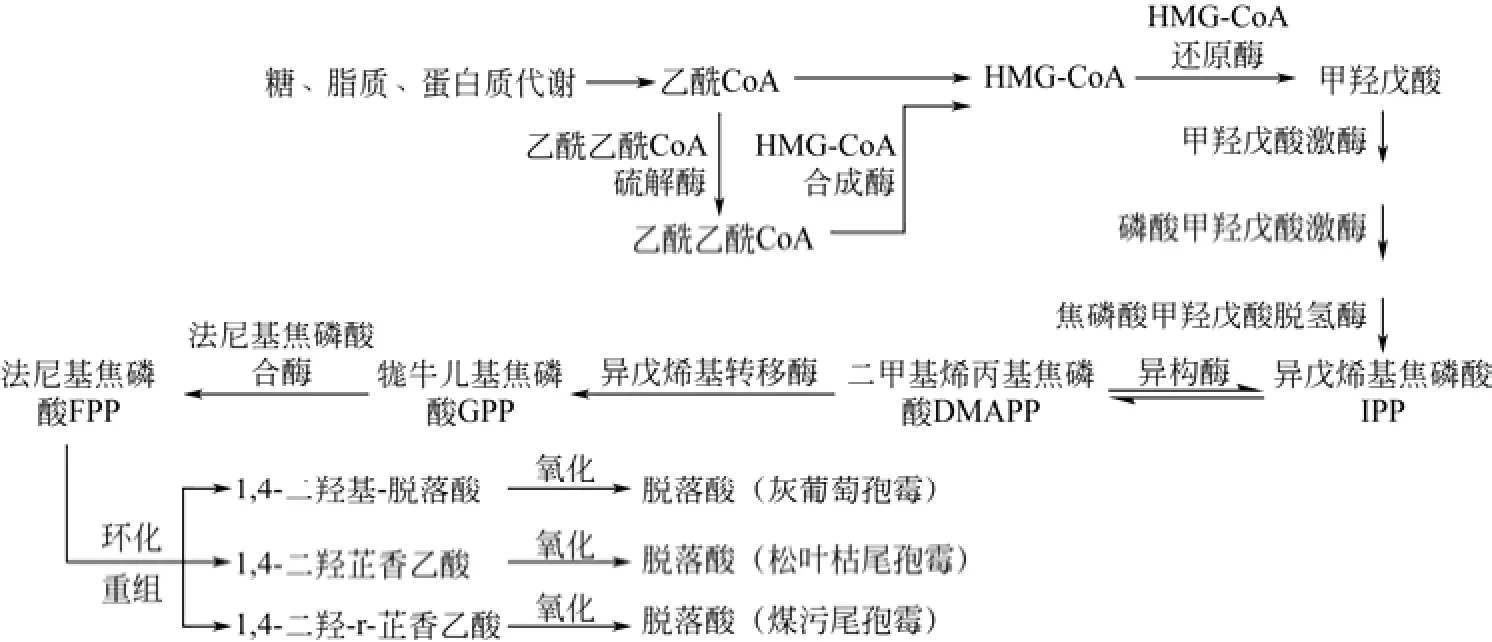
图2 脱落酸生物合成途径
谭红等[15]利用紫外诱变、原生质体诱变等技术对菌株进行了遗传学改良,使(+)ABA产量高达1.4g/L。随后再采用DNA碱基定向诱变、关键酶基因改良等分子遗传学技术手段,逐步改良筛选(+)ABA高产菌株,使ABA产量最终高达7.0g/L,随后,建立了世界上第一条生产(+)ABA的工业化生产线,首次实现了(+)ABA的规模化生产及农业应用,带动了(+)ABA生产与技术的发展。
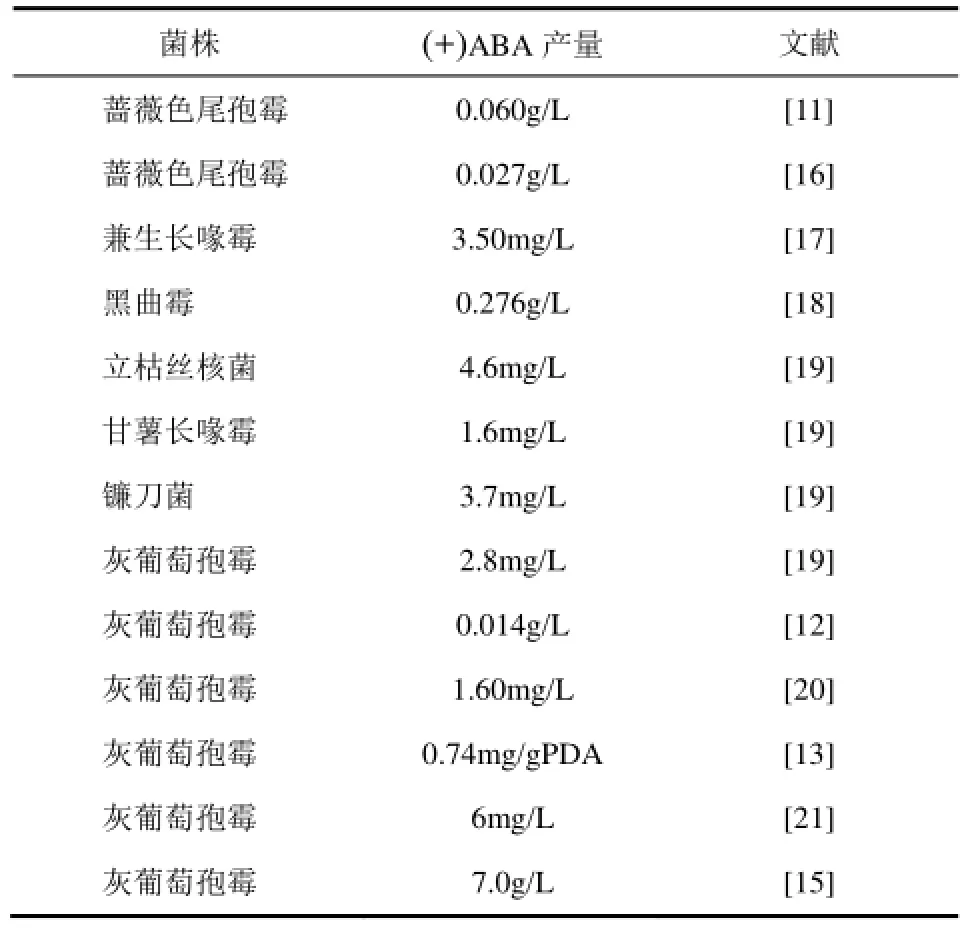
表1 产(+)ABA的发酵菌株研究情况
3 发酵底物
微生物发酵产(+)ABA的过程中,很多糖类可以被微生物使用作为碳源,其中葡萄糖是最常使用的一种碳源。除此之外,淀粉、蔗糖、麦芽糖、乳糖等也可以作为碳源被B.cinerea、C.rosicola等菌株使用并转化为(+)ABA[15,22]。郑珩等[10]以 B.cinerea为发酵菌株进行研究,深入考察了不同碳源对(+)ABA发酵产量的影响。结果表明,采用混合碳源比采用单一葡萄糖为碳源效果更好,当控制蔗糖与葡萄糖的比例为3∶2时,可使(+)ABA产量提高68.8%。添加其他碳源可以降低葡萄糖效应,加快菌体生长。当葡萄糖消耗完毕后,菌体再利用其它糖类作为碳源促进代谢产物的累积,可明显提高(+)ABA的产量。
4 发酵工艺
4.1 固体发酵
微生物发酵生产(+)ABA的方法有固体发酵法与液体深层发酵法。早期(+)ABA主要通过固体发酵法制备。ASSANTE等[11]使用 C.rosicola产(+)ABA,产量达 0.06g/L培养基。DORFFLING等[19]从植物病原菌中分离出丝核菌、长喙霉、镰刀菌、灰葡萄孢霉等并进行了30天的长时间培养,最大产量达4.6mg/L培养基。MARUMO[13]也利用固体发酵技术产(+)ABA,产量达到较高水平,约为0.74mg/g培养基。相比之下,我国对微生物发酵产(+)ABA的研究起步较晚,1993年,吴少伯[24]才开始使用固体发酵产(+)ABA,实验以草莓灰葡萄孢为菌株,用固体发酵方式进行培养,得到的(+)ABA平均产量为3.94mg/L。随后,吴江等[25]学者也进行了固体发酵法产(+)ABA的研究工作,并取得了一定的成果。在(+)ABA的发酵生产过程中,虽然固体发酵法工艺简单,成本低廉,所需投资较少,但固态发酵始终存在着周期长、占地面积大、产量低、提纯难等缺点,因此研究方向渐渐转向能提高最终菌体生物量,缩小生物反应器体积,缩短发酵周期的液态发酵。
4.2 液体深层发酵
4.2.1 摇瓶液体发酵工艺优化
摇瓶培养是菌种筛选培育阶段,目的是为了确定菌种培养的最佳操作条件,以便最终转移到大发酵罐进行生产。因此对于微生物产(+)ABA发酵条件的优化,一直在持续地进行中。MASAO[23]发现在培养基中添加玉米提取物可以使(+)ABA的产量大幅提升。NORMAN等[26]研究不同光照条件以及单一和混合氨基酸对(+)ABA生物合成的影响,以提高其产量。TAKAYAMA等[27]研究在不同发酵阶段的培养基中添加不同浓度的水仙植物提取物,最终使得(+)ABA产量提高了30多倍。国内学者吴少伯[24]考察了维生素A、柠檬酸钠、玉米粉和葡萄糖这4种因素对(+)ABA发酵产量的影响,选择四因素三水平的正交设计,优化各添加成分的浓度,使(+)ABA 液体发酵产量提高 122.3%,达 到622.3mg/L。张卉等[18]同样使用了正交试验法对野生黑曲霉的液体发酵条件进行优化,确定了最佳产酸条件。王惠等[28]使用了半天然 PD培养基生产(+)ABA,不仅提高了(+)ABA的活性,而且还降低了成本,更符合工业化的要求。郑衍等[25,29]考察了不同营养添加物以及前体对(+)ABA产量的影响,并通过 Plackett-Burman设计与球面对称设计对(+)ABA产生菌液体发酵培养基进行了优化。研究发现,当添加一定量的玉米粉、柠檬酸三钠并控制蔗糖∶葡萄糖=3∶2时,可以使(+)ABA的含量提高4倍,达到212mg/L。因此,在(+)ABA发酵过程中确定最佳发酵条件是很有必要的,摇瓶发酵培养中得到的各项参数同样也推动了液体深层发酵工艺的进一步优化。
4.2.2 分批发酵工艺
从摇瓶液体发酵中确定了最佳发酵条件后,为了扩大(+)ABA的生产规模,需要进一步放大发酵工艺,传统的工艺采用分批发酵的方法。分批发酵是指在一个密闭系统内投入有限数量的营养物质后,接入少量的微生物菌种进行培养繁殖,在特定的条件下只完成一个生长周期的微生物培养方法。与摇瓶培养相比,该工艺比较容易解决杂菌污染和菌种退化等问题,对营养物的利用效率较高,产物浓度也比较高,通过在罐内输入氧气满足了菌种对氧气的需求,并通过调控pH,搅拌等各项参数,使整个发酵过程处在更有利的条件下进行。但缺点是人力、物力、动力消耗较大,生产效率低。由于在分批发酵工艺中,营养物质是一次性加入的,与外界并没有其他物质交换,因此只能完成一个微生物生长周期,特别是当产物浓度达到一定时,出现的产物抑制效应极大地阻碍了(+)ABA产量的提高,造成了资源的浪费[23]。
4.2.3 固定化菌体半连续发酵工艺
为了充分提升微生物菌种产酸能力,提高(+)ABA的产量,谭红等[30]在液体分批发酵工艺的基础上研发了固定化菌体半连续发酵工艺。该工艺在发酵过程中,采用了固定化细胞技术将菌丝体固定,调节溶氧、pH、温度等参数降低菌体生长速率,并通过连续流加优化的液体培养基及前体,调控菌体的代谢途径,提高了(+)ABA的产量。该工艺能使微生物产(+)ABA的产酸高峰期保持较长的时间,消除产物的阻遏作用,提高了单位时间产酸量,从而降低资源消耗,节约成本。利用固定化菌体半连续发酵工艺使得(+)ABA的产量最高达到了1.2g/L,远超分批发酵工艺。但该技术工艺同样存在着缺点,如工艺复杂,难以精确调控,且易染杂菌等。
4.2.4 (+)ABA批次流加补料发酵工艺
批次流加补料发酵工艺是在分批发酵工艺的基础上流加培养基或营养物质来培养微生物的发酵方法。与上述发酵方法相比,该工艺不仅可以解除底物抑制,产物抑制,还可以控制杂菌,实现自动化控制,因此被广泛使用于(+)ABA的发酵生产研究中。虽然用该工艺生产(+)ABA产量有所提高,但葡萄糖阻遏效应依然存在,当底物浓度较高时,会产生细胞代谢抑制作用,使菌体对其它糖的利用率下降,影响(+)ABA产量。因此,谭红等[15]提出流加肌醇、人为控制碳氮比例的策略,解除了葡萄糖阻遏,提高了(+)ABA产量。与此同时,在分批流加发酵工艺的基础上,添加了乙酰CoA作为前体,并使用生物表面活性剂吐温-20改善了发酵罐内的溶氧情况。通过这些手段,菌株对氧气的利用率显著提高,菌株的底物转化率与合成速率明显加快,使(+)ABA的产量达到 6.0 g/L,进一步推动了(+)ABA的工业化生产进程。
5 分离提取工艺
经微生物发酵后的发酵液中除了含有(+)ABA外,还存在着很多其他的代谢产物,如何从这些混合物中分离出高纯度、高收率的(+)ABA,成为了又一个难题。郑衍等[31]对发酵生产(+)ABA的分离纯化工艺进行了初步探索。发酵液经过滤、浓缩、去杂、乙酸乙酯萃取、NaHCO3反萃取、硅胶柱层析、结晶等步骤进行分离纯化得到ABA,产品经光谱鉴定、旋光测定证实为(+)ABA,纯度在98 %以上。该提取工艺路线步骤较短,操作简单,重现性好,但是(+)ABA的收率较低,仅为39.7%。王天山等[32]用离子交换树脂将发酵液中的有机物富集后,用乙醇解吸得到膏状物,再经硅胶吸附后用石油醚洗脱得到脂溶性的油状化合物,并进行了GC/MS分析,初步确定了这些脂溶性成分的主要来源,为改善整个发酵工艺及(+)ABA的分离提取工艺提供重要的数据依据。周金燕等[33]对(+)ABA的提取工艺做了进一步的优化,通过发酵液酸化后过滤,大孔吸附树脂洗脱,洗脱液经过浓缩后萃取,萃取液浓缩后得到初提物。初提物溶解后用硅胶吸附杂质,加入乙烷等结晶助剂,减压浓缩,冷却结晶,洗涤,真空干燥,可得99%以上的(+)ABA,产品收率也达到了90%以上。
6 展 望
ABA作为一种重要的植物激素,在调节植物生长代谢,提高农作物产量,抵抗不良生长环境等方面发挥着重要的作用,具有广泛的应用前景。植物提取法和化学法合成的ABA由于成本昂贵且活性低,难以实现大规模的工业化生产。所以用微生物发酵法产(+)ABA日益备受关注。从目前的报道来看,ABA大规模产量约为2~4g/L,虽然与野生菌每升几十毫克的产量相比进步明显,但与其它一些微生物发酵产物相比,脱落酸的产量还较低。因此,今后的研究工作可以从以下几个方面展开。
(1)菌株是工业生产的灵魂,是决定发酵生产效率以及产业化或者商业化的关键因素。只有筛选获得优良性状的菌株,才有可能得到理想的发酵产品。因此应重视菌株的选育,利用物理、化学等联合诱变方法及高通量筛选方法对(+)ABA生产菌株进行选育,以得到高产量菌株。
(2)进一步研究(+)ABA生物合成分子机制,解析脱落酸生物合成中的关键途径并鉴定其关键酶,研究其酶学性质,为遗传改造(+)ABA生产菌株奠定基础。
(3)进一步开发高效低耗的(+)ABA提取工艺,为实现(+)ABA的规模化生产奠定基础。
参考文献
[1] MORRISON E N,KNOWLES S,HAYWARD A,et al.Detection of phytohormones in temperate forest fungi predicts consistent abscisic acid production and a common pathway for cytokinin biosynthesis[J].Mycologia,2015,107(2):245-257.
[2] QUAGHEBEUR K.Use of S-abscisic acid for improving fruit set and producing parthenocarpic fruits and as a growth inhibitor:US,8999892[P].2015-04-07.
[3] PENGCHENG W,YANYAN D,YUEH-JU H,et al.Nitric oxide negatively regulates abscisic acid signaling in guard cells by S-nitrosylation of OST1[J].Proceedings of the National Academy of Sciences of the United States of America,2015,112(2):613-618.
[4] GUO Chiming,LUO Chengke,GUO Lijia,et al.OsSIDP366,a DUF1644 gene,positively regulates responses to drought and salt stresses in rice[J].Journal of Integrative Plant Biology,2016,58(5):492-502.
[5] KANG J,YIM S,CHOI H,et al.Abscisic acid transporters cooperate to control seed germination[J].Nature Communications,2015,6:8113.
[6] 沈嘉祥,丹羽利夫,丸茂晋吾.天然型与非天然型脱落酸的生物活性比较[J].植物生理学报,1995,21(2):166-174.
[7] NAMBARA E,MARION-POLL A.Abscisic acid biosynthesis and catabolism[J].Annual Review of Plant Biology,2005,56:165-185.
[8] ORITANI T,KIYOTA H.Biosynthesis and metabolism of abscisic acid and related compounds[J].Natural Product Reports,2003,20(48):414-425.
[9] DONG T,PARK Y,HWANG I.Abscisic acid: biosynthesis,inactivation,homoeostasis and signalling[J].Essays in Biochemistry,2015,58:29-48.
[10] 梁研,郑珩,吴亮,等.类胡萝卜素等物质对灰葡萄孢霉菌脱落酸的影响[J].药物生物技术,2004,11(2):96-98.
[11] ASSANTE G,MERLINI L,NASINI G.(+)-Abscisic acid,a metabolite of the fungus Cercospora rosicola[J].Experientia,1977,33(12):1556-1557.
[12] MARUMO S,KATAYAMA M,KOMORI E,et al.Microbial production of abscisic acid by Botrytis cinerea.[J].Agricultural & Biological Chemistry,1982,46(7):1967-1968.
[13] NAOHISA T,MAMORU I.Purification of abscisic acid: JP06[P].1994.
[14] 郑珩,吴江.脱落酸产生菌的遗传育种[J].菌物系统,1999(2):164-167.
[15] 谭红,周金燕,钟娟,等.一种高效制备天然脱落酸的方法:201110369946.1[P].2013-06-05.
[16] GRIFFIN D H,WALTON D C.Regulation of abscisic acid formation in Mycosphaerella(cercospora)rosicola by phosphate[J].Mycologia,1982,74(4):614-618.
[17] KETTNER J,RFOING K D.Abscisic acid metabolism in Ceratocystis coerulescens[J].Physiologia Plantarum,1987,69(2):278-282.
[18] 张卉,尚双华,刘俊,等.产脱落酸真菌的筛选及其发酵条件研究[J].沈阳化工大学学报,2007,21(3):170-173.
[19] DORFFLING K,PETERSEN W,SPRECHER E,et al.Abscisic acid in phytopathogenic fungi of the Genera Botrytis,Ceratocystis,Fusarium,and Rhizoctonia[J].Zeitschrift Für Naturforschung C,2014,39(6):683-684.
[20] TUOMI T,ILVESOKSA J,LAAKSO S,et al.Interaction of abscisic acid and indole-3-acetic acid-producing fungi with Salix leaves[J].Journal of Plant Growth Regulation,1993,12(3):149-156.
[21] DING Z T,ZHANG Z,LUO D,et al.Gene overexpression and RNA silencing tools for the genetic manipulation of the S-(+)-abscisic acid producing ascomycete Botrytis cinerea[J].International Journal of Molecular Sciences,2015,16(5):10301-10323.
[22] 雷宝良,谭红,李志东,等.制备14C或3H标记的天然活性脱落酸的方法:200510021825.2[P],2008-10-22.
[23] MASAO I.Production of natural type abscisic acid: JP2109988[P].1990.
[24] 吴少伯.灰葡萄孢霉菌固体培养产生的(+)ABA及其生物学效应[J].植物生理学报,1993(3):193-195.
[25] 吴江,郑珩,王鲁燕,等.植物病原真菌灰葡萄孢A23产生脱落酸的研究[J].中国药科大学学报,1997,28(4):313-316.
[26] NORMAN S M,MAIER V P,ECHOLS L C.Influence of nitrogen source,thiamine,and light on biosynthesis of abscisic acid by Cercospora rosicola Passerini[J].Applied & Environmental Microbiology,1981,41(4):981-985.
[27] TAKAYAMA T,YOSHIDA H,ARAKI K,et al.Microbial production of abscisic acid with Cercospora rosicola.1.Stimulation of abscisic acid accumulation by plant extracts[J].Biotechnology Letters,1983,5(1):55-58.
[28] 王惠,钮绪燕,张建,等.灰葡萄孢BC4菌株产生天然脱落酸的研究[J].西北农林科技大学学报(自然科学版),2004,32(11):34-36.
[29] 郑珩,盛海林.脱落酸产生菌液体发酵培养基的优化[J].中国药科大学学报,1999,30(6):460-462.
[30] 谭红,李志东,丁立生,等.真菌发酵生产天然脱落酸的新方法:96117784.5[P].2001-06-27.
[31] 郑珩,吴梧桐,廖建民,等.灰绿葡萄孢发酵液中天然型脱落酸的分离纯化[J].中国抗生素杂志,2002,10(10):589-591.
[32] 王天山,王闵霞,代富英,等.工业生产ABA发酵液中脂溶性成分的GC/MS分析[J].天然产物研究与开发,2006,3(03):461-463.
[33] 周金燕,谭红,杨杰,等.一种天然脱落酸的研究方法:200410040681.0[P].2004-9-14
第一作者:施天穹(1993—),男,硕士研究生。联系人:纪晓俊,副教授,研究方向为微生物代谢工程。E-mail xiaojunji@njtech.edu.cn。
中图分类号:Q 939.97
文献标志码:A
文章编号:1000-6613(2016)07-2140-05
DOI:10.16085/j.issn.1000-6613.2016.07.029
收稿日期:2015-11-30;修改稿日期:2016-01-07。
基金项目:国家自然科学基金(21376002,21476111)、江苏省自然科学基金(BK20131405)及江苏高校优势学科建设工程项目。
Production of abscisic acid by fermentation:a review
SHI Tianqiong,PENG Hui,JI Rongyu,SHI Kun,ZENG Siyu,HUANG He,JI Xiaojun
(State Key Laboratory of Materials-Oriented Chemical Engineering,College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211816,Jiangsu,China)
Abstract:Abscisic acid (ABA) is an important plant hormone,which plays a significant role in regulating plant growth,resisting agricultural natural disaster and increasing crop yields activity,etc.Therefore,it has broad application prospects.This paper makes a brief introduction about its biosynthetic pathway as well as the research progress in the production of abscisic acid by fermentation including the strains,substrates and the fermentation processes.The problems occurred during the fermentation of abscisic acid are also discussed,such as the low yield of original strains,long fermented time,deficient fermentation technology and low efficiency in product extraction.It is pointed out that more attentions should be paid to the breeding the ABA high-producing strains,the main enzyme activity in the biosynthetic pathway and the extraction and purified technology.
Key words:abscisic acid;sesquiterpenes;fermentation;Botrytis cinerea
——青蒿素

