下颌骨髁突仿生复合支架的制备与表征
习伟宏王真朱洪水李晓峰熊远飞
1.南昌大学附属口腔医院口腔颌面外科;2.南昌大学第一附属医院骨科,南昌 330006
·颞下颌关节专栏·
下颌骨髁突仿生复合支架的制备与表征
习伟宏1王真1朱洪水1李晓峰2熊远飞2
1.南昌大学附属口腔医院口腔颌面外科;2.南昌大学第一附属医院骨科,南昌 330006
[摘要]目的 构建下颌骨髁突一体化壳聚糖(CS)-聚己酸内酯(PCL)-羟磷灰石(HA)(HA/PCL-CS)仿生复合支架,并探讨其在髁突组织工程中应用的可行性。方法 应用快速成形技术形成下颌骨髁突模具,利用溶液浇铸-冰沥方法制备下颌骨髁突一体化仿生复合支架模型,PCL︰CS按4︰1的比例混合,分别加入质量比为40%、50%、60%、70%的HA,分为a、b、c、d组,观察支架的微观形貌、孔隙率、红外光谱、X线衍射、力学性能等特性。结果 支架与下颌骨髁突形状相吻合,外观黄白色,坚硬,分上层及下层两部分。扫描电子显微镜显示该复合支架具有三维网络空间结构,孔隙率70%~85%,孔径大小10~200 μm。红外光谱显示随着HA的含量减少,其波峰强度降低。X线衍射结果显示随着HA含量的增加,其衍射峰强度相对降低。HA含量为50%时支架具有适宜的抗拉伸强度及抗压、抗弯强度。结论 溶液浇铸-冰沥方法制得的支架具有良好的综合材料性能,有望成为一种髁突自体组织工程用支架材料。
[关键词]下颌骨髁突; 骨组织工程; 仿生支架; 壳聚糖; 聚己酸内酯; 羟磷灰石
颞下颌关节是颌面部唯一的联动关节,在颌面部肌肉作用下参与咀嚼、吞咽、语言及表情等重要活动。流行病学调查显示6%~12%的人患有颞下颌关节疾患[1],严重的可引起骨关节病变,造成髁突破坏。此外,髁突肿瘤、外伤也常常造成髁突的缺损和破坏。对于这类骨性病变的患者,手术治疗是其必要的选择,但临床目前缺少有效的髁突植入或置换材料,多采用自体骨移植或者人工材料替换,但自体骨缺乏较好的外形且增加供骨区损伤,现有人工材料因力学韧性要求、降解周期及术后感染等问题而难以取得理想的效果[2-3]。随着组织工程的发展,双相复合材料的出现为人们寻找新的髁突组织材料提供了新的思路[4-5]。本研究采用溶液浇铸-冰沥方法制备了一种上下层不同孔径、孔隙率的一体化壳聚糖(chitosan,CS)-聚己酸内酯(polycaprolactone, PCL)-羟磷灰石(hydroxyapatite,HA)(HA/PCL-CS)仿生复合支架,并对其性能进行一系列检测,探讨其在髁突骨软骨一体化组织工程中应用的可行性。
1 材料和方法
1.1 主要试剂与仪器
壳聚糖(国药集团化学试剂有限公司)、四氢呋喃(成都西亚试剂有限公司)、聚己酸内酯(上海阿拉丁试剂有限公司)、羟磷灰石(上海基免实业有限公司)、恒温磁力搅拌器(常州国华电器有限公司);髁突阴模(上海交通大学)、XL-30扫描电子显微镜(scanning electron microscope,SEM)(Philips公司,日本)、万能测试机(Toshiba公司,日本)、EQUINOX55型傅立叶变换红外光谱仪(fourier transform infrared spectrometer,FT-IR)(Bruker公司,德国)、MASL2XD2型全自动X-射线衍射(X-ray diffraction,XRD)仪(北京大学仪器厂)。
1.2 致孔剂的制备
采用冰粒子作为致孔剂。将蒸馏水通过毛细管快速喷入装有液氮的容器中,使其迅速凝固成冰粒子。由于表面张力的作用,制备出来的冰粒子呈圆球型。在零度以下的环境下筛选出直径50~100 μm和直径100~200 μm的2种冰颗粒,真空下-80 ℃保存以备用。
1.3 多孔支架的制备
应用快速成形技术形成下颌骨髁突模具,利用溶液浇铸-冰沥方法制备下颌骨髁突一体化仿生复合支架模型。在室温下将PCL︰CS按4︰1的比例溶于20 mL四氢呋喃溶液中,并分别加入质量比为40%、50%、60%、70%的HA,分为a、b、c、d组。将混合溶液在磁力搅拌仪上搅拌30 min,放入冰箱(-20 ℃)中预冻一段时间。将准备好的冰颗粒分别加入混合液,并混合均匀。调整冰粒子的大小及含量以制得不同冰含量的混合物。-20 ℃冷冻干燥得到较稠混合物,依次将混合物根据加入的致孔剂大小及含量从小到大分别呈梯度加入髁突模具。-20 ℃再次冷冻干燥,去除溶剂四氢呋喃,最后室温下干燥去除致孔剂得到HA/PCL-CS复合支架。
1.4 孔隙率的测定
采用排乙醇法测定孔隙率。在室温下,取两个相同的空容器,将支架放入容器甲中,倒入一定无水乙醇,记录此时体积为V1,使完全浸泡,密封,将容器中空气尽量排出,这时标记体积位置,将容器乙倒入相同标记位置的乙醇,记录体积为V2,按以下公式计算支架的孔隙率(P),P = V2/V1×100%。1.5 FT-IR分析
使用FT-IR,先将产物用KBr压片法制样,然后对支架进行红外光谱分析。
1.6 XRD分析
使用全自动X-射线衍射仪测定支架共聚物的XRD曲线,研究其结晶性能。
1.7 SEM检查
使用SEM先对样品进行喷金处理,然后观察支架内部的形态。
1.8 力学性能测试
使用万能测试机测试材料的三点抗弯及抗压强度。抗弯强度测试条件为:加载速度10 mm·min-1,跨度 30 mm,压头直径4 mm。抗弯强度的计算公式为:R=(3F×L)/(2b×h×h),式中F为破坏载荷,L为跨距,b为宽度,h为厚度。抗压强度测试条件为:加载速度5 mm·min-1。如果支架材料在形变小于25%之前断裂,其断裂强度即为抗压强度;如果材料在形变25%时未断裂,则其抗压强度取其形变25%时的强度。
2 结果
2.1 支架形态
支架的形态见图1、2。从图1可见,支架的外观与髁突形状相吻合,外观黄白色,质地坚硬,表面呈蜂窝状。SEM(图2)可见,材料呈多网孔状结构,支架上层相当于软骨部分的孔径大小为100~200 μm,孔隙率约为85%,支架下层相当于软骨下骨部分的孔径大小为50~100 μm,孔隙率约为70%。HA均匀分布在PCL-CS基质中,分散性良好,PCL以半结晶方式堆砌排列,其内有少部分更小的孔隙(孔径10~40 μm)。从总体上看,形成的支架从下层往上呈孔径(70%~85%)、孔隙率(10~200 μm)逐渐变大的三维网络空间结构。

图 1 支架的大体观Fig 1 The generally appearance of scaffold

图 2 支架内部形态 SEM × 100Fig 2 Internal form of scaffold SEM × 100
2.2 FT-IR分析
不同含量HA支架的FT-IR分析结果见图3。HA 在1 038 cm-1左右出现P-O键特征吸收峰,在1 375 cm-1出现PCL的甲基,在1 820 cm-1出现C=O双键特征吸收峰,而在此区间,CS、PCL的C-O键、酰胺键、N-H键的重叠,使此区间呈现一个不规则波峰,在3 450 cm-1呈现CS的羟基键特征吸收峰。随着HA的含量减少,其波峰强度也降低。
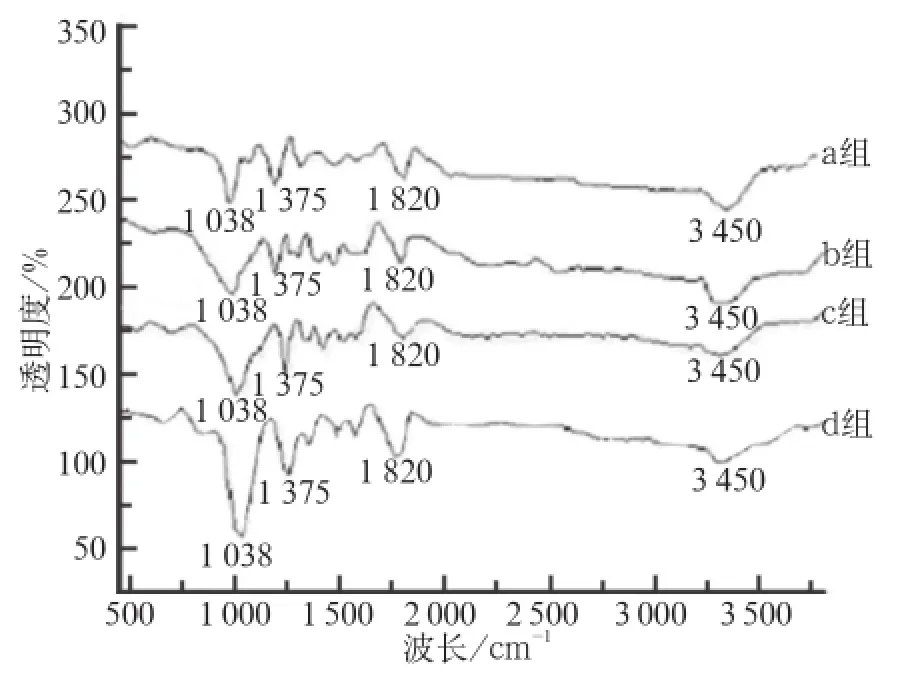
图 3 不同含量HA支架的FT-IR结果Fig 3 FT-IR results of different content of HA scaffold
2.3 XRD分析
不同含量HA支架的XRD分析见图4。由于PCL为半结晶聚合物,其在22.4°及24.9°时均出现了较强的衍射峰,谱图上的峰形尖锐,表明该颗粒的结晶度较好;随着HA含量的增加,22.4°及24.9°出现的衍射峰强度相对降低,说明其随着HA含量的增加,支架材料的结晶度相对降低。

图 4 不同含量HA支架的X-射线衍射结果Fig 4 X-ray diffraction results of different content of HA scaffold
2.4 力学性能测试
不同含量HA支架的力学性能测试结果见图5。从图5可见,支架的抗压强度和抗弯强度随着HA含量的增加而增大;而抗拉伸强度随着HA含量的增加而减少。HA含量为50%时支架具有适宜的抗拉伸强度及抗压、抗弯强度。
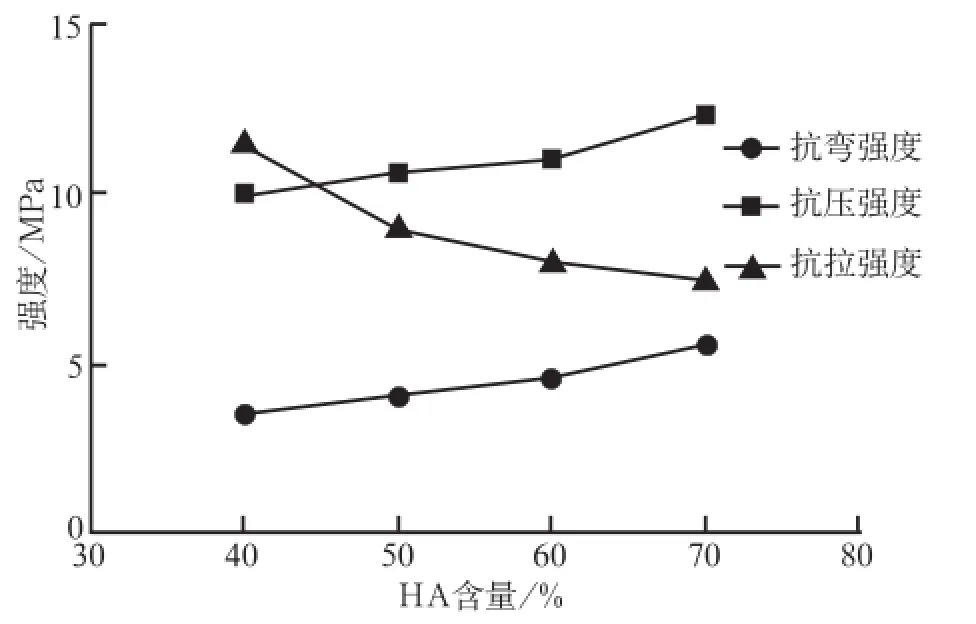
图 5 不同含量HA支架的力学性能测试结果Fig 5 Mechanical test results of different content of HA scaffold
3 讨论
颞下颌关节是人体最复杂的关节,髁突病变缺损的修复十分困难[6]。快速成形技术的发展,给其复杂的外形提供了新的技术支持。关于骨支架材料的研究很多[7],但目前尚未找出相对理想的材料。临床上关节损伤通常包括软骨及软骨下骨区域损伤,两者所含细胞类型及细胞外基质构成不同,生物力学要求也不相同,因此在构造复合支架时可采用多相复合构型。骨相材料力学强度大,软骨相材料多孔高弹性,同时促进骨、软骨再生。研究[8]发现大多数的软骨组织工程支架修复骨软骨缺损时,支架或植入物常出现脱落、塌陷以及移位,导致修复失败。学者[5]利用磷酸钙骨水泥-聚乳酸-羟基乙酸共聚物获得个性化下颌骨髁突双相支架,但骨水泥脆性大、力学强度低,结果显示软骨相与骨相链接不甚牢靠。
Sherwood等[9]使用三维打印机制备一种双层支架,分软骨下骨及软骨两层,分别具有不同孔径、孔隙率的三维支架构造。该特殊的设计使两层过度区域的内部结构呈梯度变化,避免了不同材料在软骨再生过程中出现的分层和分离。本研究采用HA/ CS-PCL作为支架材料,构建一体化髁突结构,制备了上下层不同孔径、孔隙率的一体化HA/CS-PCL仿生支架。这种特殊的设计使髁突支架上下层间移行区域的材料和孔隙率呈梯度变化,实现了两者间的紧密结合。其中壳聚糖和聚己酸内酯是生物相容性良好的可降解材料,其降解产物为二氧化碳和水,能被人体吸收及排出体外[10]。聚己酸内酯以堆砌和折叠的方式排列,并形成细长的结晶区,在非晶区中分子链互相交错,为半结晶性的线性聚合物,因而聚己酸内酯具有良好的抗压性能以及力学松弛和蠕变性能,具有良好的柔韧性,其降解半衰期达1年以上[11],是髁突缺损植入的理想材料。聚己酸内酯缺少良好的亲水性,而壳聚糖的羟基导致其亲水性强,但机械性能相对较差。羟磷灰石具有与自然骨无机矿物质相似的化学成分组成,而且有良好的生物活性和较高的机械强度,但抗疲劳性差,且易发生迁移。
天然材料和人工合成材料各有优缺点,单一成分构建支架仅具备部分优点,难以满足组织器官对支架材料的要求。刘建斌[12]在壳聚糖—明胶复合支架中加入磷酸三钙,提高了复合支架的压缩强度,随着植入时间的延长复合支架逐渐降解、吸收,并最后由增生的软骨细胞所代替。Frenkel等[13]在兔关节软骨缺损修复实验中,一组支架采用透明质酸—壳聚糖聚电解质复合物,另一组支架采用Ⅰ型胶原蛋白,软骨缺损区域均植入含透明质酸的聚乳酸,结果显示两组均可形成软骨,但透明质酸—壳聚糖聚电解质复合物组更有利于软骨及软骨下骨组织再生。本研究将HA、CS、PCL三者合一,对天然材料和人工合成材料取长补短,制成比较理想的髁突支架。
本研究采用溶液浇铸-冰沥法取得的一体化仿生髁突支架模型,无致孔剂残留。经过电镜检查显示其孔隙率为70%~85%,大小从基底层50 μm往上逐渐递增,最上层部分孔隙大小为150~200 μm。根据细胞归巢理论,支架具有潜在的诱导间充质干细胞分化成骨祖细胞[14],在所构建的结构中,分化出相应的细胞来重新进行组织结构的重建。Lee等[15]报道在无培养种子细胞而直接将含有细胞因子的支架结构植入体内获得成功的案例,孔隙的孔径及连通性是设计支架结构的关键[16]。研究表明,15~50 μm的孔隙可以诱导纤维组织的长入,50~100 μm的孔隙则可刺激骨样组织的生成,而100~400 μm的孔隙可以直接诱发矿化骨的生成。因此通过调控孔隙孔径、复合可缓释的诱导因子一体化仿生髁突支架结构有望形成双相支架,这有待在今后的动物实验中进一步研究。
林宗琼等[17]研究表明,PCL︰CS为4︰1时,其复合构造材料不改变PCL的韧性结晶结构,且具有一定亲水性。本研究根据该实验数据,调整HA在HA/PCL-CS中的比例,从力学检测结果来看,HA 在50%含量时具有相对适宜的抗拉伸强度和抗压、抗弯强度,此时复合支架抗拉伸强度为8.12 MPa,有学者[18]报告髁突软骨需要承受的抗拉伸强度为(2.50±0.72)MPa,因此笔者认为该支架符合髁突所需力学要求,由于其含有CS及PCL成分,具有一定的生物相容性,并利于支架的诱导成骨,总体而言该方法制作的复合支架有望成为综合性能良好的髁突组织工程支架。
体内植入后随着PCL-CS的降解与软骨重建,支架力学性能是否会发生改变?其耐磨性如何?组织相容性是否发生改变?能否适应髁突运动的力学性能及咀嚼功能要求?在大块支架内是否能实现理想的细胞团营养和废物交换?这些问题都需要通过进一步的动物实验进行探讨。
[参考文献]
[1]Bagis B, Ayaz EA, Turgut S, et al. Gender difference in prevalence of signs and symptoms of temporomandibular joint disorders: a retrospective study on 243 consecutive patients[J]. Int J Med Sci, 2012, 9(7):539-544.
[2]Coelho NM, González-García C, Planell JA, et al. Different assembly of type Ⅳ collagen on hydrophilic and hydrophobic substrata alters endothelial cells interaction[J]. Eur Cell Mater, 2010, 19:262-272.
[3]Zhou LB, Shang HT, He LS, et al. Accurate reconstruction of discontinuous mandible using a reverse engineering/ computer-aided design/rapid prototyping technique: a preliminary clinical study[J]. J Oral Maxillofac Surg, 2010,68(9):2115-2121.
[4]Da H, Jia SJ, Meng GL, et al. The impact of compact layer in biphasic scaffold on osteochondral tissue engineering[J]. PLoS ONE, 2013, 8(1):e54838.
[5]李轶, 冉炜, 王改玲, 等. 新型骨组织工程支架材料生物相容性的体内研究[J]. 华西口腔医学杂志, 2009, 27(4): 447-450. Li Y, Ran W, Wang GL, et al. Biocompatibility of new bone tissue engineering scaffolds in vivo[J]. West China J Stomatol, 2009, 27(4):447-450.
[6]Reshad M, Cascione D, Aalam AA. Fabrication of the mandibular implant-supported fixed restoration using CAD/CAM technology: a clinical report[J]. J Prosthet Dent, 2009, 102 (5):271-278.
[7]Hui JH, Ren X, Afizah MH, et al. Oligo[poly(ethylene glycol)fumarate] hydrogel enhances osteochondral repair in porcine femoral condyle defects[J]. Clin Orthop Relat Res,2013, 471(4):1174-1185.
[8]Solchaga LA, Yoo JU, Lundberg M, et al. Hyaluronan-based polymers in the treatment of osteochondral defects[J]. J Orthop Res, 2000, 18(5):773-780.
[9]Sherwood JK, Riley SL, Palazzolo R, et al. A three-dimensional osteochondral composite scaffold for articular cartilage repair[J]. Biomaterials, 2002, 23(24):4739-4751.
[10]季娟娟, 丁仲鹃, 杨雪莲. 壳聚糖缓释膜的制备及性能研究[J]. 华西口腔医学杂志, 2009, 27(3):248-251. Ji JJ, Ding ZJ, Yang XL. Preparation and properties of chitosan film as a drug sustained-release system[J]. West China J Stomatol, 2009, 27(3):248-251.
[11]Jin L, Wan Y, Shimer AL, et al. Intervertebral disk-like biphasic scaffold-demineralized bone matrix cylinder and poly(polycaprolactone triol malate)-for interbody spine fusion[J]. J Tissue Eng, 2012, 3(1):2041731412454420.
[12]刘建斌. 壳聚糖-明胶/β-磷酸三钙复合体作为组织工程软骨支架材料的实验研究[J]. 组织工程与重建外科杂志,2010, 6(6):319-322. Liu JB. Experimental study on chitosan-gelatin/β-tricalcium complex as novel scaffolds for cartilage tissue engineering [J]. J Tissue Eng Reconstr Surg, 2010, 6(6):319-322.
[13]Frenkel SR, Bradica G, Brekke JH, et al. Regeneration of articular cartilage—evaluation of osteochondral defect repair in the rabbit using multiphasic implants[J]. Osteoarthr Cartil,2005, 13(9):798-807.
[14]Amorosa LF, Lee CH, Aydemir AB, et al. Physiologic loadbearing characteristics of autografts, allografts, and polymerbased scaffolds in a critical sized segmental defect of long bone: an experimental study[J]. Int J Nanomedicine, 2013,8:1637-1643.
[15]Lee CH, Cook JL, Mendelson A, et al. Regeneration of the articular surface of the rabbit synovial joint by cell homing: a proof of concept study[J]. Lancet, 2010, 376(9739):440-448.
[16]Maquet V, Boccaccini AR, Pravata L, et al. Porous poly (alpha-hydroxyacid)/Bioglass composite scaffolds for bone tissue engineering. Ⅰ: Preparation and in vitro characterisation[J]. Biomaterials, 2004, 25(18):4185-4194.
[17]林宗琼, 肖秀峰, 佘厚德, 等. 纳米羟基磷灰石/聚己内酯-壳聚糖复合多孔支架材料的制备与表征[J]. 高分子材料科学与工程, 2008, 24(10):155-158. Lin ZQ, Xiao XF, She HD, et al. Preparation and characterization of hydroxyapatite/polycaprolactone-chitosan composite porous scaffold[J]. Polym Mater Sci Eng, 2008, 24 (10):155-158.
[18]Koolstra JH, Tanaka E. Tensile stress patterns predicted in the articular disc of the human temporomandibular joint[J]. J Anat, 2009, 215(4):411-416.
(本文编辑 李彩)
[中图分类号]Q 81
[文献标志码]A [doi] 10.7518/hxkq.2016.01.014
[收稿日期]2015-05-29; [修回日期] 2015-09-20
[基金项目]江西省科技支撑计划项目(20132BBG70095)
[作者简介]习伟宏,副主任医师,博士,E-mail:xwh1975@163.com
[通信作者]朱洪水,主任医师,硕士,E-mail:zhuhongshui@126.com
Synthesis and characteristics of integrated bionic mandibular condylar scaffold
Xi Weihong1, Wang Zhen1, Zhu Hongshui1, Li Xiaofeng2, Xiong Yuanfei2.
(1. Dept. of Oral and Maxillofacial Surgery, Affiliated Stomatological Hospital of Nanchang University, Nanchang 330006, China; 2. Dept. of Orthopaedics, The First Affiliated Hospital of Nanchang University,Nanchang 330006, China)
Supported by: Science and Technology Support Program of Jiangxi Province (20132BBG70095). Correspondence: Zhu Hongshui, E-mail: zhuhongshui@126.com.
[Abstract]Objective This study aims to construct a chitosan (CS)-polycaprolactone (PCL)-hydroxyapatite (HA) composite biomimetic scaffold to replace condyle and to explore the tissue engineering applications of condylar. Methods A resin mold of the mandibular condyle was prepared by using rapid prototyping techniques. A mandibular condylar integrated biomimetic scaffold model was prepared by solution casting-ice Lek. PCL and CS were mixed at a ratio of 4︰1. HA at quality ratios of 40%, 50%, 60%, and 70% was added to groups a, b, c, and d, respectively. The microscopic morphology, porosity,infrared spectra, X-ray diffraction pattern, and mechanical properties of the scaffold were observed. Results The scaffold that includes both upper and lower parts displayed the same features (i.e., shape, yellow-white appearance, and hard texture)as the mandibular condyle. Scanning electron microscopy showed that the composite scaffold had a 3D network spatial structure, 70%-85% porosity, and 10-200 μm pore size. Infrared spectra showed that the peak intensity reduced with decreasing HA content. X-ray diffraction showed that the diffraction peak decreased with increasing HA content. Suitable tensile and compressive and flexural strength were discovered in the presence of 50% HA. Conclusion The scaffold prepared by solution casting-ice Lek shows favorable comprehensive features and is expected to replace human condylar.
[Key words]mandibular condyle; bone tissue engineering; biomimetic scaffolds; chitosan; polycaprolactone; hydroxyapatite
------Bayadi”鲜食葡萄贮藏后果实品质及抗氧化能力的影响

