热休克蛋白27在烟草烟雾提取物介导的牙龈成纤维细胞损伤中的表达变化
周芹 孙睿男 朱震坤
山东大学口腔医学院·山东省口腔组织再生重点实验室,济南 250012
热休克蛋白27在烟草烟雾提取物介导的牙龈成纤维细胞损伤中的表达变化
周芹 孙睿男 朱震坤
山东大学口腔医学院·山东省口腔组织再生重点实验室,济南 250012
[摘要]目的 观察在不同质量分数烟草烟雾提取物(CSE)干预下,热休克蛋白(HSP)27在人牙龈成纤维细胞(HGFs)损伤过程中的表达。方法 取原代培养并经过鉴定的3~8代HGFs,采用细胞划痕试验检测不同刺激质量分数(0、2.5%、5.0%、12.5%、25.0%、50.0%)的CSE对HGFs体外迁移的影响,并采用Western blot方法检测HSP27 在HGFs中的表达。结果 CSE质量分数越高,细胞的迁移能力越弱;HSP27在正常HGFs中呈弱阳性表达,在CSE刺激后的HGFs中呈强阳性表达,且随CSE质量分数的增高,HSP27的相对表达量有逐渐增高的趋势,与细胞迁移能力相反。结论 HSP27在CSE介导的HGFs损伤中表达升高,在CSE介导的上皮损伤中有重要作用。
[关键词]烟草烟雾提取物; 热休克蛋白27; 人牙龈成纤维细胞; 上皮损伤
大量临床和流行病学资料表明,吸烟是牙周病发生发展及愈合过程中的高危因素。烟草烟雾提取物(cigarette smoke extract,CSE)是燃烧烟草中的主要成分。有研究[1]表明,CSE可抑制人牙龈成纤维细胞(human gingival fibroblasts,HGFs)的生长及黏附,而HGFs可通过分泌大量的细胞因子,调节细胞的移动、增殖、分化以及产生基质成分,在维持内环境的稳定中发挥着重要作用。热休克蛋白(heat shock protein,HSP)是一组结构上高度保守的蛋白家族,具有重要的分子伴侣功能:帮助蛋白质折叠及移位,防止蛋白质聚集,帮助变性蛋白质解聚及复性,促进严重受损蛋白质的降解,在应激作用下可以改变细胞内各种蛋白质的表达,保护细胞免受各种应激因素的损害。HSP27是该家族的重要成员之一,与肿瘤及细胞炎症等的发生发展有着密切关系[2],并与上皮创伤愈合、纤维细胞迁移及黏附存在相关性。
本实验通过测定不同质量分数CSE作用下HGFs 中HSP27的表达变化,研究HSP27在牙龈组织损伤和愈合中的作用。
1 材料和方法
1.1 材料
α-MEM培养液、0.25%胰蛋白酶、双抗(青霉素100 μg·mL-1,链霉素100 μg·mL-1)均购自美国Gibco公司,Ⅰ型胶原酶、Dispase酶均购自美国Sigma公司,胎牛血清(fetal bovine serum,FBS)购自美国Hyclone公司,HSP27多克隆抗体购自美国CST公司。免疫组织化学染色试剂盒、DAB显色试剂盒、鼠抗人波形蛋白抗体、鼠抗人角蛋白抗体(北京中杉金桥生物技术有限公司),BCA蛋白定量试剂盒、β-actin兔多克隆抗体、高灵敏度化学发光检测试剂盒(北京康为世纪生物科技有限公司),二甲基亚砜(dimethyl sulfoxide,DMSO,天津市标准科技有限公司)。
微量分光光度计(Biochrom公司,英国),水平电泳槽、电泳仪(Bio-Rad公司,美国);酶标仪(上海雷勃分析仪器公司);倒置相差显微镜(奥林巴斯公司,日本)。
1.2 方法
1.2.1 烟草烟雾提取物的制备 具体提取方法参照文献[3]并进行适当改进。香烟为某品牌烤烟型香烟,焦油量14 mg,烟气中烟碱含量1.0 mg。试验时取1支香烟和1个三通管,去除滤嘴,将烟嘴插入1 mL枪头中再与三通管的一通连接,一通与10 mL的注射器连接,另一通与4 mL培养基连接,通过三通的抽气作用,使烟草燃烧,产生香烟烟雾。模拟人吸烟情况,控制烟雾流量为0.3 L·min-1左右,使香烟燃烧速度接近人的吸烟速度。通过内含4 mL无血清α-MEM的吸收瓶来吸收烟雾,制成一定含量的CSE(每毫升0.25支,即1 mL CSE相当于含有0.25支香烟的烟雾成分),静置2 h,将pH值调整至7.4。采用0.22 μm孔径的微孔滤膜过滤得到100%CSE原液,将其分别稀释至0、2.5%、5.0%、12.5%、25.0%、50.0%,所得溶液在30 min内用于实验或于-70 ℃条件下保存备用。
1.2.2 HGFs原代培养 牙龈组织取材于2013年1—6月于山东大学口腔医院口腔颌面外科门诊就诊患者的因临床导萌术切下的牙龈或因种植微创手术环切的牙龈(采用2%利多卡因进行阻滞麻醉后),切取牙龈后立即浸入含2倍双抗的α-MEM液中。切除上皮组织,α-MEM液冲洗5~7次,剪成1 mm×1 mm× 1 mm左右的小块,转移组织块至15 mL离心管中,加入1 mLⅠ型胶原酶和Dispase酶的混合消化液(Ⅰ型胶原酶3 g·L-1,Dispase酶4 g·L-1,体积比1∶1),37 ℃下消化15 min,每5 min摇晃离心管以使组织块分散。随后加入2 mL体积分数为20%的FBS,中和消化液,1 000 r·min离心5 min后,倾去上清液,加入500 μL细胞培养液,吹散组织块,转入细胞培养瓶中,用牙科探针将组织块在瓶壁上摆放均匀,置于CO2培养箱中37 ℃条件下培养。待组织块贴壁1~2 h后,补加3 mL原代细胞培养液(体积分数20% FBS+α-MEM)。1~2周左右可见细胞贴满瓶底,取第3~8代细胞用于实验。
1.2.3 细胞来源的鉴定 将第4代HGFs细胞消化,接种于预置盖玻片的6孔板中,待细胞生长至对数生长期,4%甲醛固定30 min。按照免疫组织化学染色试剂盒说明步骤行细胞角蛋白和波形丝蛋白抗原抗体反应(稀释度均为1∶100),按DAB显色试剂盒说明显色,苏木精复染,梯度乙醇逐级脱水,吹干后树脂封片。
1.2.4 噻唑蓝[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]法测定CSE对HGFs增殖的作用 取6块96孔板,分别接种第4代HGFs,细胞密度为每孔1×104个,每种细胞接种3块板,每孔加入α-MEM细胞培养液200 μL。接种12 h,待细胞贴壁后,吸出原培养液,分别加入含CSE为0、2.5%、5.0%、12.5%、25.0%、50.0%的培养液,每种质量分数设5个复孔。分别于培养12、24、48 h后取出1个培养板,相继加入MTT和DMSO,用酶标仪测定各孔的A490值,用以确定最佳CSE刺激时间及质量分数梯度。
1.2.5 细胞划痕试验检测CSE对HGFs迁移的影响 使用α-MEM完全细胞培养基,于6孔板中接种HGFs,细胞密度为每孔1×106个,每种质量分数每种细胞各设3个复孔。待细胞生长至70%~90%融合时即细胞划痕前12~18 h,更换1%双抗无血清培养基,使细胞饥饿12~18 h后,用200 μL枪头于每个孔的中央部位划一道直线,人造细胞划痕,宽约1 mm。用PBS清洗3次,洗掉划痕过程中的脱落细胞,同时更换含有不同质量分数CSE(0、2.5%、5.0%、12.5%、25.0%、50.0%)的全营养培养基。使用倒置相差显微镜在放大40倍状态下拍照,每孔细胞沿划痕自上至下取10个视野测量点,测量划痕宽度。将细胞置于37 ℃,5% CO2培养箱中培养,分别于划痕后0、12、24 h再次拍照测量划痕宽度,以0 h时的细胞划痕宽度作为参考值,计算并比较各组细胞间划痕愈合的差异。
1.2.6 Western blot试验检测HSP27表达 选取第3代HGFs,按每孔1×106个细胞的密度接种于6孔板,待细胞长到70%~80%时,饥饿12~18 h,选用不同质量分数(0、2.5%、5.0%、12.5%、25.0%、50.0%)的CSE刺激细胞24 h,检测HSP27的表达变化。
CSE刺激后,首先提取细胞总蛋白,按BCA蛋白定量试剂盒说明测定蛋白质浓度,分装后将其置于-70 ℃待用。每个样品取30 μg蛋白质加入等体积4×SDS上样缓冲液中,100 ℃金属浴煮沸5 min,经聚丙烯酰胺凝胶电泳后,100 V电压转移聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜55 min,5%脱脂奶粉室温封闭2~4 h或4 ℃过夜,加入1∶1 000稀释HSP27一抗,37 ℃孵育2 h,TBST洗膜,加1∶2 000稀释生物素标记二抗(北京康为世纪生物有限公司),37 ℃孵育1 h后TBST洗膜,滴加超敏曝光液曝光,在暗室中显影。
1.3 统计学处理
采用SPSS 19.0软件进行数据分析,采用重复测量方差分析比较不同时间点和不同组间各划痕宽度减少量的差异,检验水准为双侧α=0.05。
2 结果
2.1 原代细胞形态学观察
原代培养HGFs的形态学观察见图1。HGFs均呈长梭形或星形,细胞突细长,细胞体丰满,细胞质均匀,中央有圆形或椭圆形的细胞核,核仁清晰,一般有1~3个细胞呈放射状漩涡状排列。
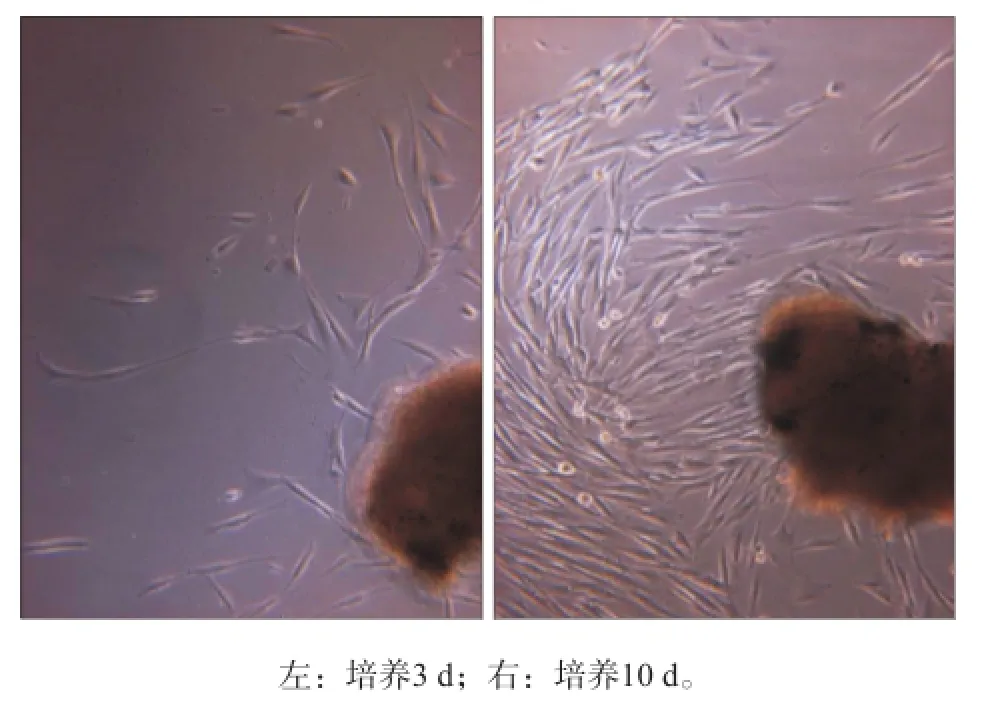
图 1 HGFs的形态学观察 倒置相差显微镜 × 200Fig 1 Morphology of HGFs inverted phase contrast microscope × 200
2.2 免疫组织化学鉴定结果
免疫组织化学实验均显示细胞波形丝蛋白染色阳性,角蛋白染色阴性(图2),证实细胞为中胚层组织来源而非上皮来源。

图 2 HGFs中波形丝蛋白(左)与角蛋白(右)染色结果 光学显微镜 × 400Fig 2 Staining results of Vimentin (left) and keratin (right) of HGFs light microscope × 400
2.3 CSE对HGFs增殖的影响
通过剂量和时间梯度试验筛选出刺激HGFs适宜的CSE质量分数梯度为0、2.5%、5.0%、12.5%、25.0%、50.0%,适宜的刺激时间为24 h(图3)。

图 3 不同质量分数CSE对HGFs增殖的影响Fig 3 The comparison of expression amount of CSE at different concentrations
2.4 CSE刺激对HGFs迁移的影响
与空白对照组比较,CSE能明显抑制HGFs的迁移,且随着CSE质量分数的增高,HGFs细胞的划痕愈合速度减慢。细胞划痕试验结果见图4(图4中红线为细胞划痕边缘)。培养12 h后,0、2.5%、5.0%、12.5%、25.0%、50.0%CSE组HGFs的划痕宽度减少百分比分别是46.67%±3.72%、33.32%±1.86%、25.95%± 3.09%、21.87%±0.77%、14.92%±2.02%、6.61%± 1.17%;24 h后,6组细胞划痕宽度减少百分比分别是99.74%±0.00%、64.82%±0.79%、54.01%±0.68%、51.22%±1.51%、41.90%±2.11%、22.80%±1.54%。经统计学分析,培养12 h及24 h后6组细胞划痕宽度减少百分比的差异具有统计学意义(P<0.01)。

图 4 细胞划痕实验结果 倒置相差显微镜 × 40Fig 4 Wound-healing assay result inverted phase contrast microscope × 40
2.5 CSE刺激HGFs后HSP27的表达
不同质量分数的CSE刺激HGFs损伤24 h后,细胞中HSP27的Western blot检测结果见图5。由图5可以看出,HSP27的相对表达量随着CSE质量分数的增加而增加。

图 5 不同质量分数CSE对HSP27表达的影响Fig 5 Effect of CSE with different concentrations on the expression of HSP27
3 讨论
吸烟是牙周病发生发展的重要危险因素。国内外学者就吸烟对牙周病的影响已作了大量研究[4-8],结果发现:吸烟志愿者形成牙周袋的概率是不吸烟者的4.7倍,牙周附着丧失的危险为不吸烟者的7倍,牙周细胞的凋亡增加。Tanur等[9]认为,烟草有害成分可妨碍细胞对无病变牙根的贴附,烟草中的有害物质可对HGFs的附着、分泌、增殖等正常生物学行为造成影响。Rota等[10]认为,HGFs内大量分布的微管和微丝可能是烟草中毒性物质作用的理想靶成分。Cattaneo等[11]研究显示,吸烟所产生的丙烯醛、乙醛可以明显抑制体外培养HGFs的贴附和增殖。吴溪溪等[12]的研究显示,吸烟可直接或间接损伤HGFs,抑制其增殖、合成和分泌功能,在导致种植体周围炎进而造成种植失败的病变过程中产生重要的影响。Dinos等[13]发现,尼古丁和机械应激可影响牙龈成纤维细胞并推迟伤口愈合。每支香烟经过燃烧可产生4 000余种化合物,以往研究大多介绍了尼古丁等单一成分对细胞生长的影响,本实验采用烟草烟雾提取物,较为全面地保留了烟草的多种成分。细胞划痕试验显示,CSE对HGFs的迁移具有抑制作用,且CSE质量分数越高,抑制作用越明显。这与曹艳等[14]关于尼古丁抑制牙周膜成纤维细胞生长和增殖的研究结果相一致。
HSP27在人肿瘤细胞及正常细胞中都存在,作为分子伴侣而发挥作用,可以调节多种信号转导通路[15-16]。已有研究[17]证实,HSP27与晶状体中的αA-晶体蛋白及αB-晶体蛋白在氨基酸和基因水平上高度同源,在多种组织与创伤愈合中存在相关性,其表达规律与创伤时间及不同类型细胞的分布状况有关[18]。Jain等[19]研究表明,HSP27与角膜上皮的创伤愈合有关。Hirano等[20]发现,HSP27的表达能够调节浮动的成纤维细胞胶原网格的收缩,成纤维细胞的黏附,胶原的伸长与移动,并且有一定的剂量相关性。兰卫东等[21]发现,牙髓炎早期,HSP27在牙髓成纤维细胞中呈强阳性表达。本实验结果显示,HSP27在CSE作用下的HGFs中的表达高于正常对照组,并随CSE质量分数的升高而增高,表现出一定的剂量依赖性,与武文妍等[22]关于HSP27在牙周膜成纤维细胞中表达的研究结果一致,也与本课题组研究的HSP27在脂多糖介导的牙龈成纤维细胞损伤中的表达结果一致[23]。
本研究选取社会环境中常见的香烟烟雾所致牙周炎的最终途径——氧化性损伤作用为处理因素,研究HGFs中HSP27的表达情况。正常HGFs中存在HSP27的表达,在外源性应激条件下,CSE作用质量分数越高,HGFs迁移能力越弱;在CSE干预后的HGFs中呈强阳性表达,且随干预质量分数的增高表达量有逐渐增高的趋势,并与细胞迁移能力相反。该结果提示HSP27在CSE介导的上皮氧化损伤过程中具有重要作用。
由本实验结果可以推断,吸烟可以通过烟雾含有的氧自由基降低细胞中过氧化物歧化酶的活性,导致脂质过氧化物蓄积从而直接损伤HGFs,抑制其增殖、分化、合成和分泌等功能,在牙龈炎和牙周炎发生过程中有重要的影响。推测其相关机制可能是:由于CSE直接使HGFs氧化中毒,HGFs发生应激损伤,细胞骨架破坏,蛋白质合成下降,影响与其接触的细胞表面结构进而影响细胞附着;CSE破坏HGFs对胶原纤维束的调节作用,增加外界物质入侵机会;改变底物表面的电荷,干扰HGFs的黏附;CSE抑制细胞吞噬功能,造成变性胶原纤维不能及时被清除,牙周组织修复能力下降,加速牙龈炎和牙周炎的进展。在这个过程中,细胞中HSP27产生增多,以帮助蛋白质折叠及移位,防止蛋白质聚集,帮助变性蛋白质解聚及复性,促进严重受损蛋白质的降解。
综上所述,在香烟提取物的刺激下,HGFs中的HSP27的表达水平呈剂量依赖性升高,提示HSP27参与了HGFs应激条件下的保护作用,为牙周炎的防治提供了新思路。
[参考文献]
[1]徐燕, 袁萍, 李颂, 等. 尼古丁和烟草浸提液对人牙龈成纤维细胞生长和贴附能力的影响[J]. 口腔医学研究, 2004,20(1):16-18. Xu Y, Yuan P, Li S, et al. The effects of nicotine and smokeless tobacco extract on the growth and attachment of human gingival fibroblasts[J]. J Oral Sci Res, 2004, 20(1):16-18.
[2]Kaul G, Thippeswamy H. Role of heat shock proteins in diseases and their therapeutic potential[J]. Indian J Microbiol, 2011, 51(2):124-131.
[3]Carnevali S, Petruzzelli S, Longoni B, et al. Cigarette smoke extract induces oxidative stress and apoptosis in human lung fibroblasts[J]. Am J Physiol Lung Cell Mol Physiol, 2003,284(6):L955-L963.
[4]Li Q, Hsia J, Yang G. Prevalence of smoking in China in 2010[J]. N Engl J Med, 2011, 364(25):2469-2470.
[5]Sørensen LT. Wound healing and infection in surgery. The clinical impact of smoking and smoking cessation: a systematic review and meta-analysis[J]. Arch Surg, 2012, 147(4): 373-383.
[6]Li H, Fu X. Mechanisms of action of mesenchymal stem cells in cutaneous wound repair and regeneration[J]. Cell Tissue Res, 2012, 348(3):371-377.
[7]Sumanth S, Bhat KM, Bhat GS. Periodontal health status in pan chewers with or without the use of tobacco[J]. Oral Health Prev Dent, 2008, 6(3):223-229.
[8]Wang Y, Ge X, Xu XF, et al. Acetylcholinesterase inhibitor is a potentially useful therapeutic agent for nicotine-induced periodontal disease[J]. Med Hypotheses, 2009, 73(4):604-605.
[9]Tanur E, McQuade MJ, McPherson JC, et al. Effects of nicotine on the strength of attachment of gingival fibroblasts to glass and non-diseased human root surfaces[J]. J Periodontol, 2000, 71(5):717-722.
[10]Rota MT, Poggi P, Boratto R. Human gingival fibroblast cytoskeleton is a target for volatile smoke components[J]. J Periodontol, 2001, 72(6):709-713.
[11]Cattaneo V, Cetta G, Rota C, et al. Volatile components of cigarette smoke: effect of acrolein and acetaldehyde on human gingival fibroblasts in vitro[J]. J Periodontol, 2000, 71 (3):425-432.
[12]吴溪溪, 余占海, 卢立志, 等. 烟草烟雾提取物对人牙龈成纤维细胞在3Y-TZP表面生长状态的影响[J]. 口腔医学研究, 2011, 27(12):1094-1097. Wu XX, Yu ZH, Lu LZ, et al. The effects of cigarette smoke extract on the growth state of HGFs on the surfacs of 3YTZP[J]. J Oral Sci Res, 2011, 27(12):1094-1097.
[13] Dinos ME, Borke JL, Swiec GD, et al. In vitro study of the adverse effect of nicotine and physical strain on human gingival fibroblasts as a model of the healing of wounds commonly found in the military[J]. Mil Med, 2015, 180(3 Suppl):86-91.
[14] 曹艳, 王军, 王建国, 等. 尼古丁对牙周膜成纤维细胞的细胞毒性研究[J]. 中华口腔医学研究杂志: 电子版, 2009,3(6):609-615. Cao Y, Wang J, Wang JG, et al. The impact of cigarette smoke extract on periodontal fibroblast[J]. Chin J Stomatol Res: Electron Ed, 2009, 3(6):609-615.
[15]Ciocca DR, Oesterreich S, Chamness GC, et al. Biological and clinical implications of heat shock protein 27,000 (Hsp 27): a review[J]. J Natl Cancer Inst, 1993, 85(19):1558-1570.
[16]Salari S, Seibert T, Chen YX, et al. Extracellular HSP27 acts as a signaling molecule to activate NF-κB in macrophages [J]. Cell Stress Chaperones, 2013, 18(1):53-63.
[17]Hoehenwarter W, Tang Y, Ackermann R, et al. Identification of proteins that modify cataract of mouse eye lens[J]. Proteomics, 2008, 8(23/24):5011-5024.
[18]Laplante AF, Moulin V, Auger FA, et al. Expression of heat shock proteins in mouse skin during wound healing[J]. J Histochem Cytochem, 1998, 46(11):1291-1301.
[19]Jain S, De la Cruz J, Kang E, et al. Expression of phosphorylated heat shock protein 27 during corneal epithelial wound healing[J]. Cornea, 2012, 31(7):820-827.
[20]Hirano S, Shelden EA, Gilmont RR. HSP27 regulates fibroblast adhesion, motility, and matrix contraction[J]. Cell Stress Chaperones, 2004, 9(1):29-37.
[21]兰卫东, 解保生. 热休克蛋白27在大鼠牙髓炎中的免疫组化研究[J]. 昆明医学院学报, 2005, 26(3):28-32. Lan WD, Xie BS. An experimental study on the dynamic expression of hsp27 in rats pulpitis[J]. Acad J Kunming Med Coll, 2005, 26(3):28-32.
[22]武文妍, 王翔宇, 孙克勤. 脂多糖介导人牙周膜成纤维细胞损伤过程中热休克蛋白27表达的研究[J]. 中国药物与临床, 2011, 11(12):1381-1382. Wu WY, Wang XY, Sun KQ. Expression of hsp27 in lipopolysaccharide-induced injury of human periodontal ligament fibroblasts[J]. Chin Remed Clin, 2011, 11(12):1381-1382.
[23]朱震坤, 周芹, 孙睿男, 等. 热休克蛋白27在脂多糖介导的牙龈成纤维细胞损伤中的表达[J]. 山东大学学报: 医学版, 2015, 53(3):36-40. Zhu ZK, Zhou Q, Sun RN, et al. Expression of hsp27 in lipopolysaccharide-induced injury of human gingival fibroblasts [J]. J Shandong Uni: Health Sci, 2015, 53(3):36-40.
(本文编辑 吴爱华)
[中图分类号]Q 51
[文献标志码]A [doi] 10.7518/hxkq.2016.01.004
[收稿日期]2015-08-05; [修回日期] 2015-11-02
[基金项目]中国博士后科学基金(2012M511524);山东省博士后创新项目专项资金(2012030407);中国博士后科学基金特别资助项目(2013T60679);山东省医药卫生科技发展计划基金(2013WSB19019)
[作者简介]周芹,助教,硕士,E-mail:zq201213966@126.com
[通信作者]朱震坤,讲师,博士,E-mail:zhenkunzhu@sdu.edu.cn
Expression of heat shock protein 27 in cigarette smoke extract-induced injury of human gingival fibroblasts
Zhou Qin,Sun Ruinan, Zhu Zhenkun.
(School of Stomatology of Shandong University, Shandong Provincial Key Laboratory of Oral Tissue Regeneration, Jinan 250012, China)
Supported by: China Postdoctoral Science Foundation (2012M511524); Postdoctoral Innovation Special Foundation in Shandong Province (2012030407); China Postdoctoral Science Foundation Special Funding (2013T60679); Medical Science and Technology Development Plans Foundation in Shandong Province (2013WSB19019). Correspondence: Zhu Zhenkun, E-mail: zhenkunzhu@sdu.edu.cn.
[Abstract]Objective This research aimed to observe the expression of heat shock protein 27 (HSP27) in human gingival fibroblasts (HGFs) cell injury induced by different concentrations of cigarette smoke extract (CSE). Methods The third to eighth generations of cultured HGFs were treated with serially diluted CSE of different concentrations (0, 2.5%, 5.0%, 12.5%,25.0%, 50.0%). Wound-healing assay was performed to determine the migration of HGFs, and Western blot was used to determine the expression of HSP27. Results The migration capability of HGFs weakened with the increase of CSE concentration. HSP27 expression was negative in normal HGFs but positive in CSE-intervened HGFs in a concentration-dependent manner. Conclusion HSP27 concentration increased in the CSE-induced injury of HGFs. This finding suggests that HSP27 plays an important role in CSE-induced epithelial injury.
[Key words]cigarette smoke extract; heat shock protein 27; human gingival fibroblasts; epithelial injury

