模拟体液仿生矿化法制备的羟磷灰石-壳聚糖支架的性能研究
许可 赵艳红 李洪发
天津医科大学口腔医院正畸科,天津 300070
·基础研究·
模拟体液仿生矿化法制备的羟磷灰石-壳聚糖支架的性能研究
许可 赵艳红 李洪发
天津医科大学口腔医院正畸科,天津 300070
[摘要]目的 应用模拟体液(SBF)仿生矿化法制备羟磷灰石(HA)-壳聚糖支架,探讨矿化时间对HA-壳聚糖支架结构及细胞相容性的影响。方法 应用冷冻干燥法制备壳聚糖支架,将该支架应用交替浸泡法进行预钙化,然后浸入SBF中进行矿化,控制矿化时间分别为7、14、21 d,即为3组实验组,以单纯壳聚糖支架为对照组,检测4组支架的理化性质。再将经过成骨诱导后的脂肪基质干细胞(ADSCs)接种到HA-壳聚糖支架上,检测不同矿化时间支架的细胞相容性。结果 矿化14 d,HA-壳聚糖支架的矿化物分布均匀,晶体组成符合HA特征,压缩弹性模量随着矿化时间的延长而增强,在矿化21 d时其压缩弹性模量与对照组的差异具有统计学意义(P<0.05)。矿化14 d,ADSCs的增殖量最多,与其他实验组的差异均有统计学意义(P<0.05);其钙离子和Ⅰ型胶原的分泌量也最多。结论 SBF仿生矿化法可用于制备HA-壳聚糖骨组织工程支架,该支架在SBF中矿化14 d左右时其生物相容性及理化性质可达到最佳状态。
[关键词]仿生矿化; 羟磷灰石; 壳聚糖
传统口腔颌面部的骨缺损修复方法有自体骨移植及同种异体骨移植,然而,供体组织的有限性以及可能出现的排异反应限制了该方法在临床上的应用[1]。
口腔骨组织工程为口腔颌面部骨缺损修复带来了契机。羟磷灰石(hydroxyapatite,HA)是最常用于口腔颌面部骨缺损修复的合成材料。在制备组织工程支架的过程中,可以采用仿生矿化法复合HA与天然高分子,在经过修饰的支架材料上模拟体内的矿化过程[2-4]生成HA。本实验采用模拟体液浸泡生成HA的方法,在壳聚糖有机基质上进行体外溶液浸泡,并进行细胞培养,观察矿化时间对矿化物生成的影响,探讨采用该方法生成的支架的理化性质以及生物相容性。
1 材料和方法
1.1 实验材料
1 000 mL模拟体液(simulated body fluid,SBF),配制方法参见Tadashi等[5]的报道;壳聚糖(90%脱乙酰度),Ⅰ型胶原蛋白抗体;二抗试剂盒;DAB显色剂,茜素红粉末。
1.2 方法
1.2.1 HA-壳聚糖支架的制备 将2%壳聚糖-乙酸溶液冷冻干燥,0.1%NaOH-乙醇-水溶液除酸,2.5%多聚磷酸钠溶液交联,采用超纯水洗去支架上的无机盐离子,得到初始支架。将初始壳聚糖支架分别浸入100 mL 0.1 mol·L-1CaCl2溶液和Na2HPO4溶液中,中间用蒸馏水冲洗20 min,重复5个周期,进行交替浸泡[6]。
1.2.2 分组 将预钙化后的壳聚糖支架浸入SBF中进行矿化,按照矿化时间不同,将实验分为3组,矿化至第7天时为Ⅰ组,矿化至第14天时为Ⅱ组,矿化至第21天时为Ⅲ组;并以单纯壳聚糖支架组作为对照组。
将成骨诱导后的脂肪基质干细胞(adipose-derived stem cells,ADSCs)接种到各组中,观察支架的细胞相容性。
1.2.3 HA-壳聚糖支架性能检测 将Ⅰ、Ⅱ、Ⅲ组及对照组支架分别进行扫描电子显微镜(scanning electron microscopy,SEM)、X射线衍射(X-ray diffraction,XRD)、傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)及机械性能测试。
在ADSCs培养至第7天时进行Live/Dead染色和SEM观察,测定细胞的活性和黏附性;在3个实验组分别培养至第7、14、21天时分别进行细胞计数(cell counting kit-8,CCK-8)检测、茜素红染色、Ⅰ型胶原免疫组织化学染色,观察细胞的成骨情况及基质分泌情况。
1.3 统计学方法
采用SPSS 22.0统计软件进行分析,机械性能测试采用单因素方差分析,CCK-8细胞增殖量采用析因分析,样本数均为5,检验水准为双侧α=0.05。

图 1 实验组及对照组的支架特征 SEM × 600Fig 1 The characteristics of the experimental and control groups SEM × 600
2 结果
2.1 支架特征
实验组及对照组支架见图1:支架均为多孔状,随着矿化时间的延长,由模拟体液法生成的HA增多,其中Ⅲ组的HA呈团聚状,且有杂质碎片,支架孔隙变小。
实验组及对照组支架的XRD和FTIR图见图2。由XRD图像可见,Ⅰ组在2θ角度为25°~26°时出现很窄的峰,其结晶体不如Ⅱ、Ⅲ组HA晶体典型,Ⅱ、Ⅲ组在31.79°、32.21°、32.90°处出现3个特征衍射峰,说明在矿化至14 d时形成了HA晶体。在FTIR中,Ⅰ组在1 033 cm-1和962 cm-1处出现了P-O伸缩振动峰,在874 cm-1处和1 094 cm-1处出现C-O伸缩振动峰;Ⅱ、Ⅲ组在1 033 cm-1、564 cm-1和472 cm-1处出现P-O振动峰,说明Ⅰ组产生了碳酸化HA。

图 2 实验组及对照组的XRD(左)和FTIR(右)图Fig 2 XRD (left) and FTIR (right) spectra of experimental and control groups
实验Ⅰ、Ⅱ、Ⅲ组及对照组经机械性能测试,其压缩弹性模量分别为(78.388±0.398)、(78.516± 0.473)、(79.198±1.032)、(77.732±0.548) kPa,4组之间的差异有统计学意义(F=4.128,P=0.024),经两两比较,只有Ⅲ组与对照组的差异具有统计学意义(P=0.003),说明实验组在矿化3周左右的压缩弹性模量与对照组有较大差异。
2.2 接种后ADSCs的成活性及黏附性
实验组接种ADSCs培养7 d后的黏附性及成活性见图3。

图 3 实验组支架接种ADSCs培养7 d后的黏附性及成活性Fig 3 Viability and adhesion of ADSCs seeded in the experimental groups after 7 days culture time
由图3可见,在Ⅲ组的细胞和支架复合物中出现死亡细胞及过多碎片,过多碎片的存在以及过量的HA生成量影响到了ADSCs的成活性。在Ⅰ、Ⅱ组中均可以观察到细胞外基质的分泌,其黏附性及分布状态良好。
2.3 细胞增殖量的观察
实验组及对照组ADSCs在不同培养时间的CCK-8计数测量的吸光度A值及统计学分析结果见表1和表2。经两因素析因分析(表2),组别效应组的差异具有统计学意义,细胞培养时间效应组的差异也有统计学意义(P<0.05);但是组别和细胞培养时间两因素之间没有交互效应。进一步经两两比较,Ⅱ组与其他各组的差异均有统计学意义(P<0.05),且Ⅱ组的均数值最大,提示Ⅱ组细胞的增殖能力最强(P<0.05)。
2.4 茜素红染色及免疫组织化学染色
接种的成骨诱导后的ADSCs均能在实验组支架上生长,细胞成骨分化良好;随着培养时间的延长,ADSCs钙离子及Ⅰ型胶原分泌量增加,其中,Ⅱ组细胞的分泌量增加最多,Ⅲ组细胞的分泌量增加最少(图4、5)。
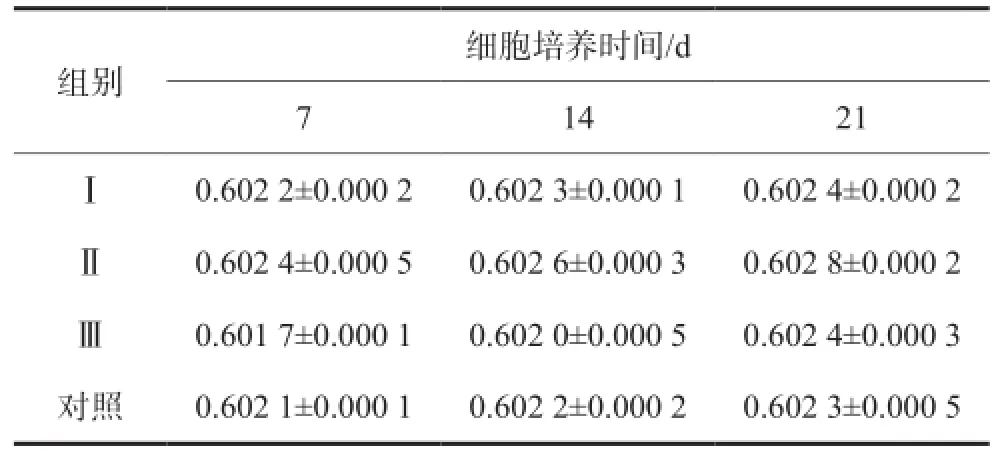
表 1 实验组及对照组ADSCs在不同培养时间的吸光度A值Tab 1 The A values of experimental and control groups after different cell culture time

表 2 两因素析因分析结果Tab 2 The results of two factor analysis

图 4 实验组接种ADSCs在不同培养时间的成骨情况 茜素红染色 × 100Fig 4 The bone formation of experimental groups seeded with ADSCs in different culture time alizarin red staining × 100
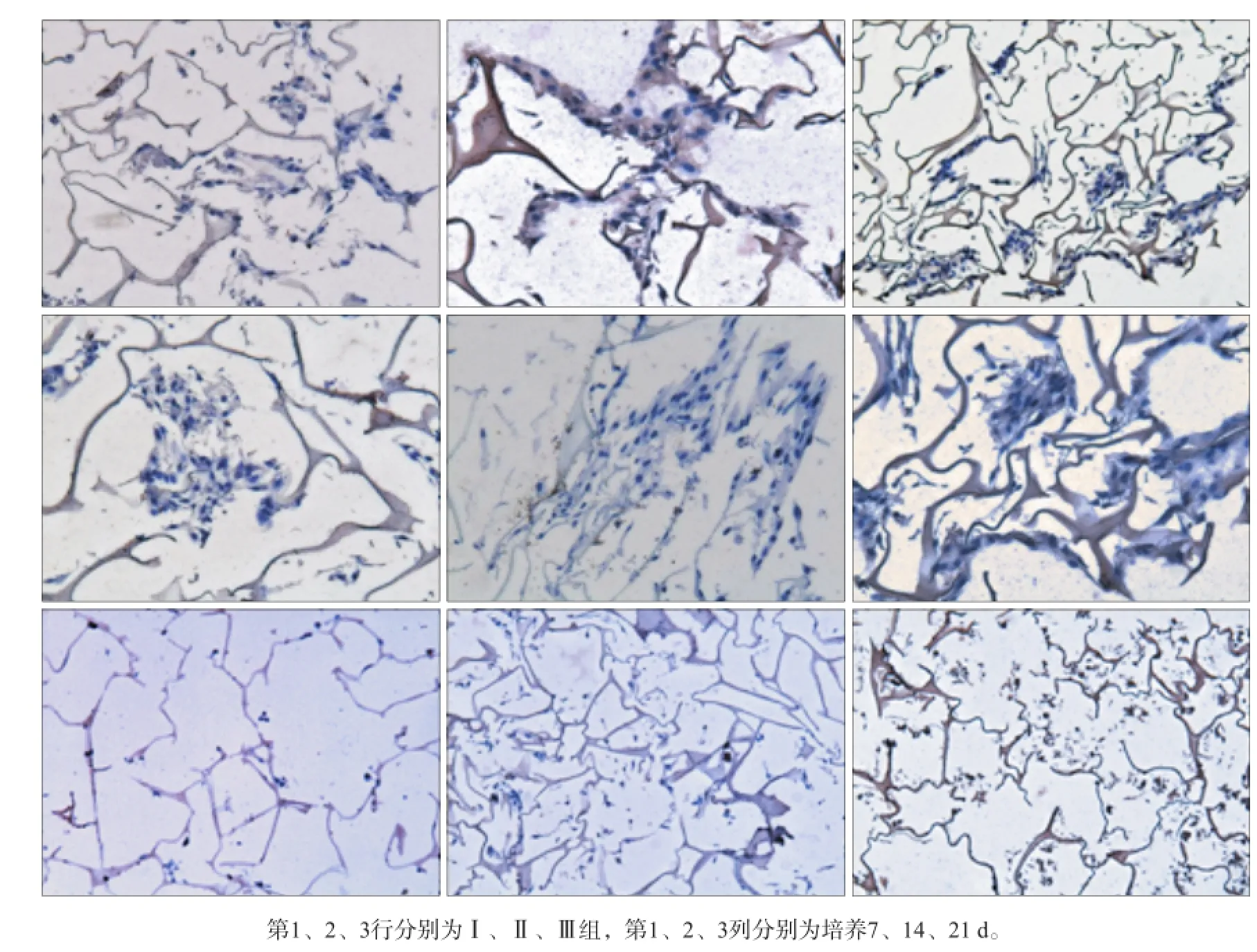
图 5 实验组接种ADSCs在不同培养时间的基质分泌情况 Ⅰ型胶原染色 × 100Fig 5 The matrix secretion of experimental groups seeded with ADSCs in different culture time typeⅠcollagen staining × 100
3 讨论
组织工程材料表面在体内形成HA是在蛋白质参与下复杂的蛋白调控过程;而组织工程支架中有机高分子化合物与无机物的体外结合方法主要有共混法、沉淀法和原位沉积法等[7]。这些结合方法需要有机质为溶解状态,其后的提取过程复杂,增加了工作量和不必要的负担,而且提取过程易使支架形态遭到破坏。现在的研究趋势逐渐转向采用仿生法研究HA在支架上的生成情况。有学者将基质材料浸泡于过饱和钙磷混合溶液中[8-11],但是忽略了人体血浆中其他电解质的存在,而模拟体液中各种离子的浓度与人体血浆非常接近,pH值也相近,可以最大程度地模拟人体血浆的浓度及微环境,是真正的仿生方法。本实验采用模拟体液法作为生成生物活性HA的主要方法,该方法对pH值、温度有着严格要求,观察应用该方法在天然高分子支架材料上生成生物活性HA的能力具有真正的仿生意义和实用价值,与传统的机械结合方法有明显不同。
体外仿生矿化生成HA是一个复杂的过程。在进行仿生矿化之前往往需要对支架材料或者仿生矿化液进行预处理,这样可以降低壳聚糖支架表面的自由能,引入HA成核的附着点,加速HA的成核及晶体形成。预处理的方法有多种。Yin等[9]为减少生成时间及增加类骨磷灰石矿化量,将壳聚糖甲基磷酸化,引入磷酸根后的壳聚糖支架孔的表面性质改变,能促使类骨磷灰石在孔壁上成核及生长;但是该方法过程复杂,会引入杂质且不易去除。Sahil等[12]将仿生矿化液中的HCO3-的浓度由原来的4.2 mmol·L-1提高到27 mmol·L-1,显著缩短了类骨磷灰石生成的时间,但是易使溶液产生沉淀,反应过程不容易控制。基于上述方法的各种不足,本实验采用交替浸泡法[6]。该方法预钙化过程易于控制,简便易行,所引入的CaCl2和Na2HPO4是少量的HA前体,不会有杂质引入。赵勇[13]应用仿生矿化方法在3周后才在支架表面出现散在的晶体沉积,本实验生成HA的矿化时间与其相比明显缩短,可能原因在于赵勇的预钙化方法为在饱和Ca(OH)2中浸泡3 d,而本实验采用交替浸泡过饱和矿化液的方法,过饱和矿化液可以将能加速HA成核的带阴性基团的磷酸根引入到支架中,明显缩短矿化时间。
Zhao等[7]通过实验研究发现,矿化15 d左右的晶体构成符合HA特征,其产生的量均匀,HA的形态呈网状分布,本实验的结果与其基本一致。根据本实验XRD结果,在矿化时间不足时(如矿化时间为7 d)会出现少量低结晶度的HA晶体,当矿化时间到达14 d时,其结晶体结构较为典型,之后虽然时间延长(矿化21 d时),矿化物的构成与矿化14 d时没有明显差别。从实验组及对照组的XRD图可以看出,14、21 d时壳聚糖支架上沉积的HA结晶形态较好,根据机械性能测试结果,矿化21 d时随着矿化物的增多其机械性增强;但是从SEM结果来看,矿化14 d矿化物与壳聚糖支架结合良好,分布均匀,而矿化21 d时HA产生的量明显增多,造成矿化物的团聚,且有杂质碎片进入支架,矿化物在支架中形成树突状、团块状等结构,使支架孔隙变小甚至封闭,这样会降低支架的生物相容性,细胞在这样的支架中增殖能力降低,出现死亡细胞,造成细胞计数吸光度A值、茜素红和Ⅰ型胶原染色结果所呈现的矿化14 d时优于21 d的结果。由此可见,超过14 d后延长矿化时间对于细胞培养来说是不利的,说明矿化过程中控制矿化时间非常必要。
根据FTIR测试结果,在矿化时间不足时(Ⅰ组矿化7 d),会产生碳酸化HA,矿化时间延长后,磷酸根基团会取代碳酸根基团,生成更符合生物活性的HA。
本实验为了检验支架材料对细胞分化的影响,先将鼠ADSCs体外诱导分化为骨样细胞再接种到支架上,在培养过程中对培养基加入成骨诱导因子,观察发现,细胞分泌的钙离子和Ⅰ型胶原的量随着培养时间的增加而增多,并且细胞数量也随着培养时间的延长而增加,而无论是钙离子、Ⅰ型胶原的分泌量还是细胞增殖量,矿化14 d组均优于其他两个实验组,说明矿化14 d支架的理化性质和细胞相容性均达到最佳状态。该结果提示,采用模拟体液仿生矿化法制备的支架材料在成骨诱导因子存在的条件下支持ADSCs向成骨细胞方向分化,生物相容性良好。
综上所述,采用模拟体液法与壳聚糖制备的HA-壳聚糖支架具有良好的生物相容性,且在矿化14 d左右其理化性质及生物特性达到最佳状态,是修复骨软骨缺损的良好选择。
[参考文献]
[1]Lv Q, Nair L, Laurencin CT. Fabrication, characterization,and in vitro evaluation of poly(lactic acid glycolic acid)/ nano-hydroxyapatite composite microsphere-based scaffolds for bone tissue engineering in rotating bioreactors[J]. J Biomed Mater Res A, 2009, 91(3):679-691.
[2]Abe Y, Kokubo T, Yamamuro T. Apatite coating on ceramics, metals and polymers utilizing a biological process[J]. J Mater Sci: Mater Med, 1990, 1(4):233-238.
[3]Evangelos D, Jannis KK, Petros GK. Crystallization of hydroxyapatite on polymers[J]. Langmuir, 1991, 7(8):1822-1826.
[4]Tretinnikov ON, Kato K, Ikada Y. In vitro hydroxyapatite deposition onto a film surface-grated with organophosphate polymer[J]. J Biomed Mater Res, 1994, 28(11):1365-1373.
[5]Tadashi K, Hiroaki T. How useful is SBF in predicting in vivo bone bioactivity[J]. Biomaterials, 2006, 27(15):2907-2915.
[6]Tachaboonyakiat W, Serizawa T, Akashi M. Hydroxyapatite formation on/in biodegradable chitosan hydrogels by an alternate soaking process[J]. Polym J, 2001, 33(2):177-181.
[7]Zhao H, Wang G, Hu S, et al. In vitro biomimetic construction of hydroxyapatite-porcine acellular dermal matrix composite scaffold for MC3T3-E1 preosteoblast culture[J]. Tissue Eng Part A, 2011, 17(5/6):765-776.
[8]Du C, Cui FZ, Zhang W, et al. Formation of calcium phosphate/collagen composites through mineralization of collagen matrix[J]. J Biomed Mater Res, 2000, 50(4):518-527.
[9]Yin YJ, Luo XY, Cui JF, et al. A study on biomineralization behavior of N-methylene phosphochitosan scaffolds[J]. Macromol Biosci, 2004, 4(10):971-977.
[10]Sampaio S, Taddei P, Monti P, et al. Enzymatic grafting of chitosan onto Bombyx mori silk fibroin: kinetic and IR vibrational studies[J]. J Biotechnol, 2005, 116(1):21-33.
[11]Göpferich A, Peter SJ, Lucke A, et al. Modulation of marrow stromal cell function using poly(D,L-lactic acid)-block-poly (ethylene glycol)-monomethyl ether surfaces[J]. J Biomed Mater Res, 1999, 46(3):390-398.
[12]Sahil J, Sarit BB, Cuneyt TA. Using a synthetic body fluid (SBF) solution of 27 mM HCO3-to make bone substitutes more osteointegrative[J]. Mater Sci Eng: C, 2008, 28(1):129-140.
[13]赵勇. 仿生合成丝素蛋白/羟基磷灰石复合支架材料的骨组织工程研究[D]. 成都: 四川大学, 2006:25. Zhao Y. Studies on biomimetic methods to fabricate silk fibroin/hydroxyapatite scaffold for bone tissue engineering [D]. Chengdu: Sichuan University, 2006:25.
(本文采编 石冰)
[中图分类号]Q 81
[文献标志码]A [doi] 10.7518/hxkq.2016.01.002
[收稿日期]2015-09-15; [修回日期] 2015-11-02
[基金项目]国家自然科学基金(31300798)
[作者简介]许可,硕士,E-mail:15510931689@163.com
[通信作者]李洪发,教授,学士,E-mail:leehongfa@aliyun.com
Fabrication and evaluation of hydroxyapatite-chitosan scaffold via simulated body fluid biomimetic mineralization
Xu Ke, Zhao Yanhong, Li Hongfa.
(Dept. of Orthodontics, Stomatological Hospital, Tianjin Medical University, Tianjin 300070, China)
Supported by: Natural Science Foundation of China (31300798). Correspondence: Li Hongfa, E-mail: leehongfa@aliyun.com.
[Abstract]Objective This research aimed to fabricate a hydroxyapatite (HA)-chitosan scaffold via simulated body fluid (SBF) biomimetic mineralization and determine how mineralization time affects scaffold construction and cell compatibility. Methods The HA-chitosan scaffolds were fabricated by freeze-drying technique and then subjected to precalcification, also known as alternative soaking method. Afterward, precalcificated scaffolds were placed into the SBF to conduct the mineralization process. Mineralization time was set at 7, 14, and 21 days, corresponding to three experimental groups. Pure chitosan scaffolds acted as the control group, and the physical and chemical properties of the four groups were tested. Osteogenicinduced adipose-derived stem cells (ADSCs) were seeded into the scaffolds to investigate the scaffolds’ cell compatibility. Results The mineral substance of the 14-day group exhibited a uniform distribution. The crystal composition of the mineral substance suited the HA’s features. The compressive elastic modulus increased along with the extension of mineralization time. The 21-day group showed a statistically significant increase in compressive elastic modulus compared with the control group (P<0.05). The cell proliferation level of the 14-day group was significantly the highest among the three experimental groups (P<0.05). The calcium ion and the typeⅠcollagen had the highest secretion amount when the cells were seeded into the 14-day group. Conclusion The SBF biomimetic mineralization method can be used to fabricate HA-chitosan bone-tissueengineering scaffolds. The biological compatibility, as well as the chemical and physical properties, reached the optimum levels at day 14.
[Key words]biomimetic mineralization; hydroxyapatite; chitosan
------Bayadi”鲜食葡萄贮藏后果实品质及抗氧化能力的影响

