分水岭性脑梗死患者的早期复发及危险因素分析
常焕显,王以翠,季晓宇,孔令胜
(江苏省连云港市东方医院,江苏 连云港 222042)
分水岭性脑梗死患者的早期复发及危险因素分析
常焕显,王以翠,季晓宇,孔令胜
(江苏省连云港市东方医院,江苏 连云港 222042)
[摘要]目的分析分水岭性脑梗死(CWI)患者早期复发的危险因素。方法选取94例CWI患者作为研究对象,观察1个月,根据患者有无复发分为复发组29例和对照组65例。比较2组NIHSS、基线资料和临床特点;分析CWI早期复发的危险因素。结果入院时,对照组NIHSS为(5.14±1.75)分,复发组NIHSS为(7.81±1.16)分,差异有统计学意义(P<0.05)。复发组再次梗死时NIHSS评分明显高于初次梗死时(P<0.05)。2组基线收缩压、低灌注、梗死分型、狭窄程度、斑块性质和治疗方式比较差异有统计学意义(P均<0.05);患者性别、年龄、基线舒张压、既往病史、就诊时间和住院时间比较差异无统计学意义(P均>0.05)。基线收缩压≥140 mmHg、发病前低灌注、狭窄>70%和不稳定斑块与CWI的早期复发呈正相关(P均<0.05),支架植入与CWI早期复发呈负相关(P<0.05),MCWI和扩容与复发的相关性不显著(P>0.05)。结论CWI的复发率较高,高血压、低灌注、严重的血管狭窄和不稳定斑块是CWI早期复发的危险因素。
[关键词]分水岭性脑梗死;早期复发;危险因素
分水岭性脑梗死(cerebral watershed infarction, CWI)即发生在大脑主要动脉分布区交界处的脑梗死,因主要发生在皮质动脉、基底核区小动脉的供血区之间的边缘带,又称边缘带脑梗死[1-2]。CWI患者的临床症状较轻,预后较好,但患者复发率高,其中1个月内复发的患者为早期复发[3]。CWI的发生和复发机制较为复杂,一般多认为由于血流动力学障碍所致,少数由心源性或动脉源性栓塞引起。常见于颈内动脉严重狭窄或闭塞,且狭窄越严重,越易出现交界区脑梗死。许多研究表明,其发生颅、内外大血管狭窄密切相关。本研究旨在对CWI患者的早期复发危险因素进行分析。
1临床资料
1.1一般资料选取2011年5月—2014年11月我院收治的94例CWI患者作为研究对象,纳入标准:①患者均在发病48 h内入院,就医较为及时,患者经过MR弥散成像(MR-DWI)检查确诊为CWI。②所有患者治疗前至少进行下列头颈部检查中的1项:磁共振血管造影(MRA)、CT血管造影(CTA)和数字减影血管造影(DSA)。检查发现患者梗死区存在明确的责任血管,血管为中重度狭窄(狭窄率≥50%),患者不伴有对侧血管狭窄或其他的颅外血管狭窄。③患者不存在心、肺源性栓子的风险。④患者凝血功能异常,无高凝现象和出血倾向。⑤本次研究中的所有治疗和检查措施均征得患者及家属同意,所有患者均自愿配合完成本次研究,符合医学伦理学原则。其中男65例,女29例。所有患者自治疗后进行1个月的观察,根据有无复发将患者分为2组:复发组29例,男21例,女8例;年龄56~73(65.7±7.2)岁;对照组65例,男44例,女21例;年龄55~73(64.9±7.5)岁。2组性别、年龄比较差异无统计学意义(P均>0.05),具有可比性。
1.2影像学检查39例患者入院后采用MAGNETOM Avanto磁共振成像系统(德国西门子公司)行头颈MRA检查,31例患者采用BrillianceCT6Slice设备(美国飞利浦公司)行头颈CTA检查,24例患者行DSA检查,扫描范围由颈动脉弓平面到颅顶。血管狭窄程度的判定标准:狭窄率=(狭窄血管远端管径-最狭窄处管径)/狭窄血管远端管径×100%。狭窄率<50%为轻度狭窄;狭窄率51%~70%为中度狭窄;狭窄率71%~99%为重度狭窄;狭窄率100%为闭塞[4]。根据患者的病变部位进行分型[5]:大脑前动脉(ACA)和大脑中动脉(MCA)皮质支供血区病变者为前皮质型;大脑中动脉和大脑后动脉(PCA)皮质支供血区病变者为后皮质型;ACA/MCA/PCA皮质支之间狭窄者为皮质上型;ACA皮质支、Heubner折返动脉、MCA的皮质支、豆纹动脉或脉络膜前动脉供血区病变者为皮质下前型;脉络膜前动脉与MCA之间病变者为皮质下上型;豆纹动脉与岛叶动脉之间病变者为皮质下外侧型。同时存在2种以上的上述病变者为混合型分水岭梗死(MCWI)。所有患者均行彩色超声多普勒检查,扫描范围从颈动脉根至颅顶,观察有无斑块形成斑块性质。
1.3基线资料与临床特点采集①所有患者均完成(可由家属代为完成)本科室自行制定的调查问卷,包括性别、年龄、基线收缩压(SBP)和舒张压(DBP)、糖尿病、血脂异常、冠心病、发病前低灌注和烟酒史。②患者的责任医师完成下列问卷,包括复发率、分型、狭窄程度(轻度/中度/重度)、斑块性质(稳定/不稳定)、就诊时间、治疗方式(支架植入、扩容、单纯药物治疗)和住院时间。脑梗死患者早期复发的诊断标准:患者经过治疗后症状趋于好转,而后出现症状加重,患者MR-DWI检查存在新的梗死区。③所有患者均在脑梗死后由专人进行美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)评估[6],复发组患者在再次梗死后重新进行评估。比较2组入院时的NIHSS,比较复发组患者初次梗死和再次梗死的NIHSS。
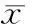
2结果
2.12组NIHSS评分比较入院时,对照组NIHSS评分明显低于复发组(P<0.05)。复发组初次梗死和再次梗死时NIHSS评分比较差异有统计学意义(P<0.05)。见表1。
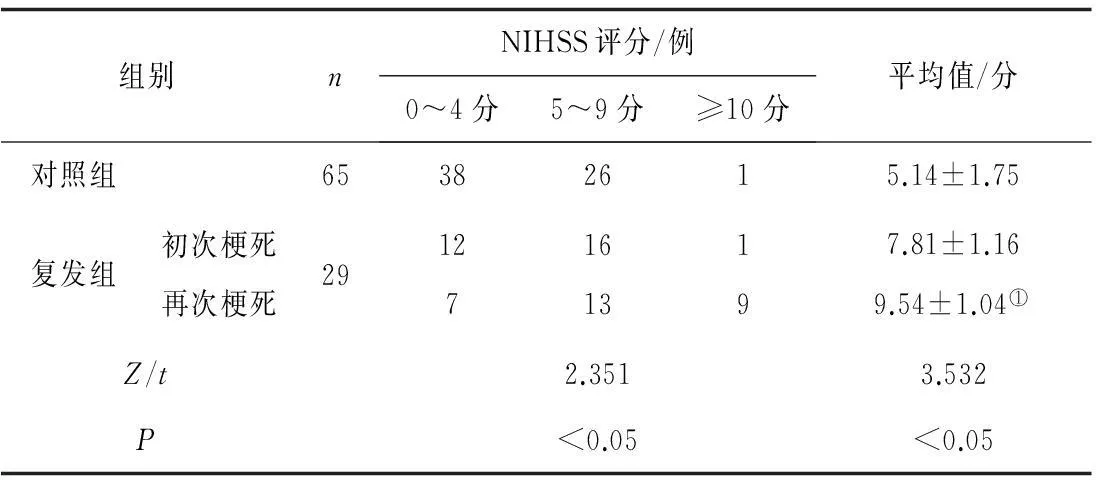
表1 2组NIHSS评分比较
注:①与初次梗死比较,t=2.982,P<0.05。
2.22组基线资料和临床特点比较2组基线收缩压、发病前低灌注、分型、狭窄程度、斑块性质和治疗方式比较差异有统计学意义(P均<0.05);患者性别、年龄、基线舒张压、既往病史(除低灌注)、就诊时间和住院时间比较差异无统计学意义(P均>0.05)。见表2。
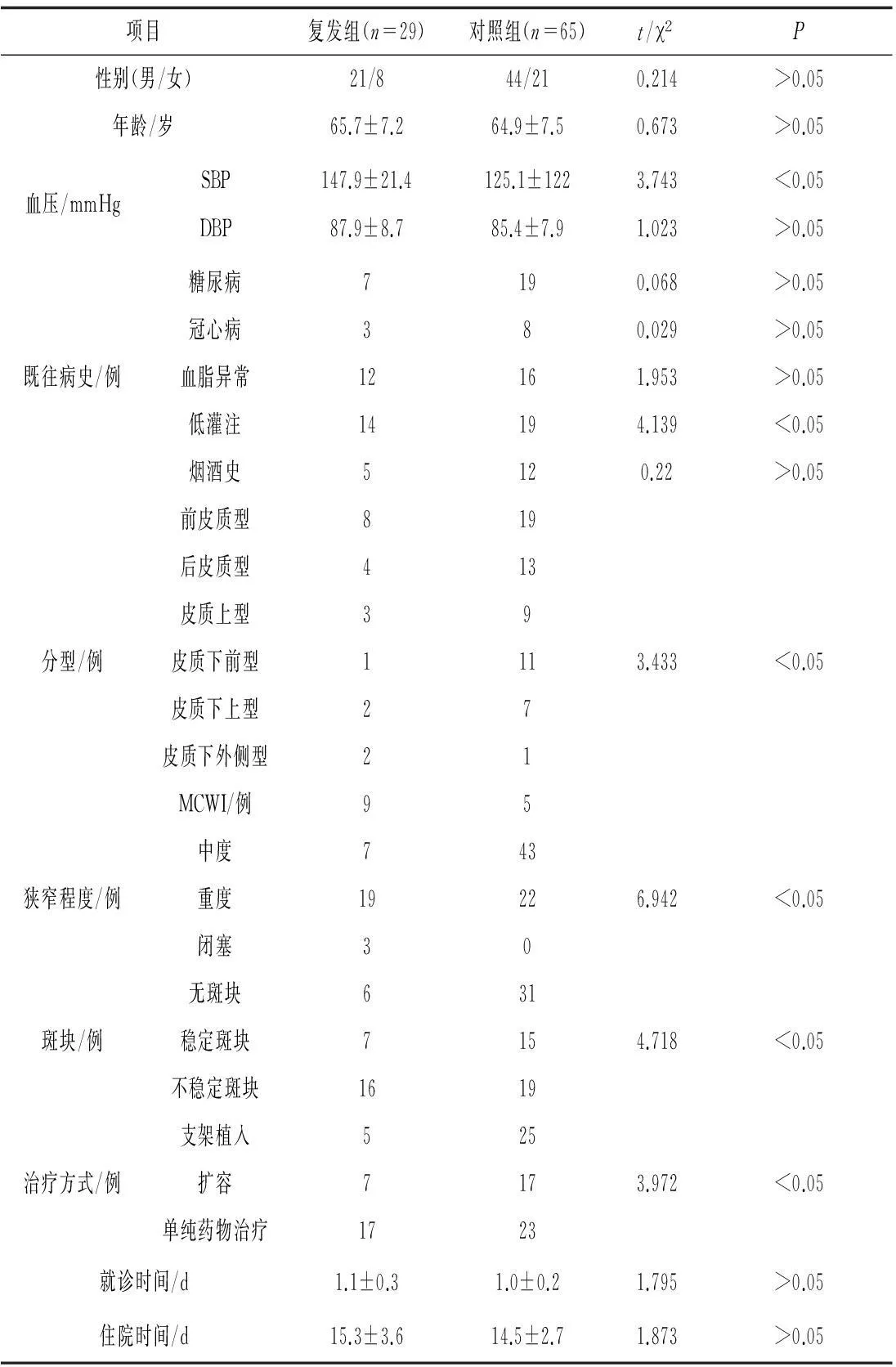
表2 2组基线资料和临床特点比较 例
注:1 mmHg=0.133 kPa。
2.3早期复发的危险因素分析Logistic分析显示基线收缩压≥140 mmHg、发病前的低灌注、狭窄>70%和不稳定斑块与CWI的早期复发呈显著正相关(P均<0.05),MCWI的相关性不显著(P>0.05);支架植入与CWI早期复发呈显著负相关(P<0.05),扩容治疗与复发的相关性不显著(P>0.05)。见表3。
3讨论
分水岭性脑梗死是发生在颅内2条及以上相邻血管供血区之间的脑梗死,又称边缘性脑梗死[7]。该疾病较为常见,占全部缺血性脑血管疾病的12%~13%[8]。CWI可以累积大脑的多个区域,多为大脑前动脉、大脑中动脉、大脑后动脉和基底核区小动脉的供血区之间的边缘带,根据发病部位的不同,患者的临床表现较为复杂:如意识障碍、运动和感觉障碍、语言障碍、各种失语、精神障碍、智力异常、性格改变和锥体束阳性体征等[9]。
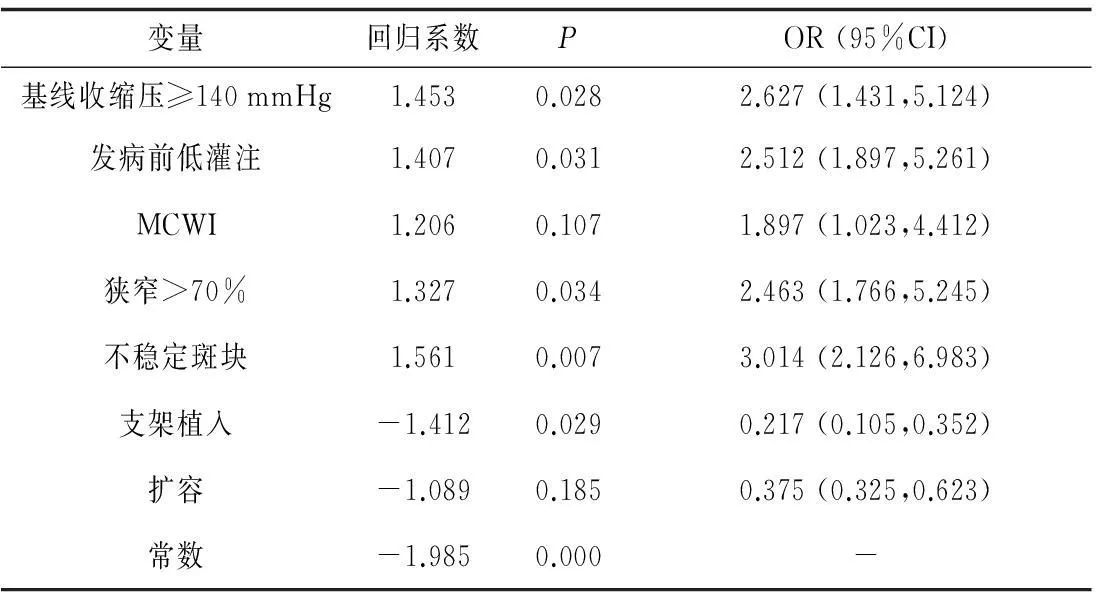
表3 早期复发的危险因素分析
既往认为,CWI患者的临床症状和体征较轻,患者预后较好;近年来研究发现,分水岭性脑梗死的复发率尤其是近期复发率较高,临床上应给予足够的重视[10]。本研究选取94例分水岭性脑梗死患者作为观察对象,研究患者的复发率和早期复发的危险因素。94例患者中29例患者出现早期复发,复发率为30.85%,明显高于其他类型的脑梗死患者。
根据CWI有无复发将患者分为2组,入院时对照组NIHSS评分与复发组比较差异有统计学意义。NIHSS评分是目前应用较为广泛的、内容全面、可信度高的综合性脑卒中量表,可以较为准确地反应患者的症状严重程度。与对照组患者相比,复发组入院时的症状较重;对复发组初次梗死和再次梗死时的NIHSS评分进行比较,再次梗死时患者的NIHSS评分明显升高,患者症状加重。通过比较复发组和对照组基线资料和临床特点,初步筛选CWI早期复发的危险因素:2组基线收缩压、发病前低灌注、分型、狭窄程度、斑块性质和治疗方式差异有统计学意义,患者的性别、年龄、基线舒张压、既往病史、就诊时间和住院时间比较差异无统计学意义;对危险因素进行Logistic分析,基线收缩压≥140 mmHg、发病前的低灌注、狭窄>70%、不稳定斑块和MCWI与CWI的早期复发呈正相关,提示高血压、低灌注和责任血管重度及以上狭窄、不稳定斑块和MCWI是CWI复发的危险因素;而支架植入和扩容治疗则与CWI的早期复发呈负相关,说明支架植入和扩容可以预防CWI早期复发的发生。
目前,分水岭性脑梗死的发病和复发机制尚未明确,脑皮质的低灌注是CWI发生的重要危险因素[11-12]:当患者存在大血管狭窄时,血压的波动可以加重患者的低灌注,引起脑梗死[13];栓子脱落导致的栓塞在脑梗死的发生中发挥着重大的作用。发生脑梗死时患者多出现血压升高,但多数患者于发病后5 d内血压可自行下降,慢性高血压患者的基础血压较高,血压的下降可加重患者的脑灌注不足[14-15];不稳定斑块易发生脱落,导致CWI复发[16];MCWI患者存在多血管病变,病情更为复杂和严重,易发生复发,上述因素均可以增加CWI的早期复发风险。支架植入可以很大程度上改善病变血管的狭窄问题,对患者的康复意义重大;积极的扩容治疗可以减小患者血压的波动,一定程度上预防CWI的复发[17]。
综上所述,CWI的复发率较高,高血压、低灌注、严重的血管狭窄和不稳定斑块是CWI早期复发的危险因素。
[参考文献]
[1]张捷,陈海亮,张俊,等. 分水岭脑梗死的临床特点及相关因素分析[J]. 中国实用神经疾病杂志,2011,14(23):1-4
[2]陈玉珺,衣学伟,秦素霞,等. 分水岭脑梗死50例临床分析[J]. 中西医结合心脑血管病杂志,2012,10(10):1269-1270
[3]Denier C,Masnou P,Mapoure Y,et al. Watershed infarctions are more prone than other cortical infarcts to cause early-onset seizures[J]. Arch Neurol,2010,67(10):1219-1223
[4]沈燕,黎红华,廖光昊,等. 颈内动脉系统短暂性脑缺血发作患者颅内血管狭窄程度和ABCD2评分与近期预后的关系[J]. 临床神经病学杂志,2012,25(1):51-53
[5]王嗣欣,周丽红,贺雄军,等. 分水岭脑梗死分型与颅内外血管狭窄以及侧支循环代偿的关系[J]. 中国老年学杂志,2014,34(11):3138-3140
[6]张超,谢炳玓. 脑梗死TOAST分型与同型半胱氨酸和NIHSS评分的关系[J]. 广东医学,2011,32(18):2443-2445
[7]王万华,马召玺,张炎,等. 分水岭脑梗死早期复发及相关因素分析[J]. 临床神经病学杂志,2014,27(1):26-29
[8]邱石,赵静,罗彬,等. 皮层分水岭脑梗死与内分水岭脑梗死患者的临床特征及病因分析[J]. 山东医药,2014,54(36):8-10
[9]唐铁钰,刘一辉,蔡玉建,等. 分水岭脑梗死的临床和影像学特点[J/CD]. 中华临床医师杂志:电子版,2013,7(2):829-831
[10] Goldenberg NA,Bernard TJ,Fullerton HJ,et al. Antithrombotic treatments, outcomes, and prognostic factors in acute childhood-onset arterial ischaemic stroke:a multicentre, observational, cohort study[J]. Lancet Neurol,2009,8(12):1120-1127
[11] McMillan HJ,Johnston DL,Doja A. Watershed infarction due to acute hypereosinophilia[J]. Neurology,2008,70(1):80-82
[12] Davenport A,Buscombe JR. Watershed cerebral infarction in a hemodialysis patient[J]. Kidney Int,2010,77(12):1140
[13] Morel A,Naggara O,Touzé E,et al. Mechanism of ischemic infarct in spontaneous cervical artery dissection[J]. Stroke,2012,43(5):1354-1361
[14] Mackay MT,Wiznitzer M,Benedict SL,et al. Arterial ischemic stroke risk factors: the International Pediatric Stroke Study[J]. Ann Neurol,2011,69(1):130-140
[15] Pezzini A,Grassi M,Del Zotto E,et al. Influence of acute blood pressure on short-and mid-term outcome of ischemic and hemorrhagic stroke[J]. J Neurol,2011,258(4):634-640
[16] Isabel C,Lecler A,Turc G,et al. Relationship between watershed infarcts and recent intra plaque haemorrhage in carotid atherosclerotic plaque[J]. PloS One,2014,9(10):e108712
[17] Chimowitz MI,Lynn MJ,Derdeyn CP,et al. Stenting versus aggressive medical therapy for intracranial arterial stenosis[J]. New England J Med,2011,365(11):993-1003
doi:10.3969/j.issn.1008-8849.2016.20.012
[中图分类号]R743.3
[文献标识码]B
[文章编号]1008-8849(2016)20-2201-03
[收稿日期]2016-01-25

