3D生物打印技术打印组织和器官的研究进展
姚 斌 刘南波 黄 沙 谢江帆 付小兵
(1.解放军总医院第一附属医院全军创伤修复与组织再生重点实验室, 北京 100048;2.南开大学医学院,天津 300071; 3.南方医科大学南方医院心胸外科,广东 广州 501515)
综述
3D生物打印技术打印组织和器官的研究进展
姚 斌1,2刘南波3黄 沙1谢江帆1付小兵1
(1.解放军总医院第一附属医院全军创伤修复与组织再生重点实验室, 北京 100048;2.南开大学医学院,天津 300071; 3.南方医科大学南方医院心胸外科,广东 广州 501515)
3D打印技术由Charles W. Hull在1986年第1次提出,称为“立体光固化技术”,即将紫外光照射后的薄层材料打印形成固体3D结构,这种方法后来用于将生物材料塑造成具有三维结构的树脂模型[1]。3D生物打印作为一种组织工程技术,其发展需要3D打印技术、细胞生物学和材料学的发展推动。无溶剂系统的发现促使生物材料可以直接打印形成可用于移植的3D支架[2]。目前,在临床医学应用中,3D生物打印已被用来制作导管和夹板[3]。
3D生物打印技术能够精确控制每一层中生物材料、生化药剂和活细胞等功能性成分的定位,一层一层打印形成3D结构。常见的3D生物打印方法有生物模拟、自主的自我组装和迷你组织模块的构建。目前,研发新的3D生物打印方法,打印出能够用于临床、有生物活性的3D组织结构受到很多研究者关注,其中一大挑战是将传统的打印塑料和金属的技术转变成新型的打印敏感、有活性的生物材料的技术,而最主要的挑战是极高精度地重现细胞外基质和多种细胞的微结构并评估其生物功能。现将3D生物打印技术打印组织结构的主要方法、不同类型的生物打印机与其对组织结构打印的影响等3D生物打印技术在器官组织工程方面的应用情况综述如下。
1 3D生物打印方法
1.1生物模拟3D生物打印技术方面的问题以生物工程方法来解决,生物工程方法可用来精确构建组织和器官的细胞内和细胞外组分[4]。生物工程手段可再现组织特异的细胞内功能组分,可在结构上模拟血管分支,也可制造类似于机体相应组织生理结构并具有功能的生物材料类型并维持其生理浓度。因此,发展3D生物打印技术需要深入了解机体微环境,包括功能细胞和支撑细胞的分布、可溶和不可溶性因子的浓度、细胞外基质的成分和生物力的本质。此外,生物模拟的可行度依赖于工程学、影像学、生物材料科学、细胞生物学、生物物理学和医学等领域基础研究的发展和基础知识的完善。
1.2自主的自我组装这种方法是建立在详尽了解胚胎发生和组织发生的发育机制的基础上,在生物打印的组织中利用环境促进胚胎发育。以胚胎器官发育为参照是组织再生的一种方法。在组织发育过程中,细胞生成细胞外基质、适宜的细胞信号和自主结构,形成最终的微结构并具备相应的功能[5]。在这种方法中细胞是组织形成的驱动者,主导了细胞组成、定位、功能和结构性质[6]。
1.3迷你组织模块迷你组织模块的概念与上述两种3D生物打印方法密切相关。组织和器官由许多小的功能组成模块或迷你组织模块构成,它们可以被看作是组织中最小的结构和功能单元(如肾单位),而迷你组织模块通过合理的设计或者自我组装可以构成完整的组织。这种方法有两种主要构成策略:第一,自我组装的细胞球体(类似于迷你组织模块)通过生物启发设计和组成装配形成完整的组织[7];第二,高精度的组织单元克隆自我组装,形成功能性的完整组织,例如血管组成模块自我组装成分支血管网络[8]。3D生物打印高精度的迷你组织模块可在微流体网络下用于筛选药物和疫苗,或作为体外疾病模型[9]。
综合以上3种策略才有可能打印出功能、结构、性质与机体组织器官相符合的3D生物结构。3D生物打印的主要步骤包括成像和模型设计,材料和细胞选择,组织结构打印(图1,见封三)。损伤组织成像可用来引导生物打印组织的设计。生物模拟、组织的自我组装[10]和迷你组织模块[11]3种设计方法可单独或组合应用。材料的选择和细胞来源对于组织构建和组织功能具有重要的意义并且具有特异性。普通材料包括合成或天然聚合物、去细胞的细胞外基质[12]。细胞可来源于自体或异体[13]。这些组分必须与打印系统(如喷墨式打印机、微挤压式打印机或激光辅助打印机)[14]相结合。某些组织在移植前可能需要在生物反应器中经过一段时间的成熟化。3D生物打印的结构或者用于移植,或者经过一段时间的体外成熟化再移植,或者保存用于体外分析、进行体外研究。
2 成像和模型设计
全面了解组织器官的结构是克隆异质的功能性组织器官的基础。医学成像技术是组织工程提供细胞、组织、器官乃至有机体的3D结构信息的一项必不可少的工具。这些技术包括最普通的无不良反应的成像模式——X射线断层扫描技术 (CT)和磁共振技术(MRI)。计算机辅助设计和计算机辅助制造工具(CAD-CAM)与数学模型被用来进行组织的层析成像信息和结构信息的采集和数字化。
将完整的组织或器官模型与数字化操控的生物打印系统相结合,进行原型设计和实体打印,这一过程又叫做3D生物打印。这个过程经过了2D到3D重建的转换,如将3D模型分割成很多薄的2D水平切片(具有固定的大小和方向),经打印系统输出完成。2D水平切片包含的解剖学和结构学的信息指导生物打印装置一层一层堆积,最终打印成组织。3D生物打印技术的变化会影响组织器官设计,有的生物打印系统通过打印连续的材料微球累积来组成3D结构。有的打印系统通过短的不规则的或明确间断的材料累积来组成3D结构。组织器官模型的设计必须考虑生物3D打印机的性质和功能。
3 组织打印手段
用于生物材料累积和成型的主要技术有喷墨式打印[15]、微挤压式打印[16]和激光辅助打印[17](图2)。下面从3D生物打印技术最重要的因素——界面分辨率、细胞活性和用于打印的生物材料——论述它们的区别(表1)。温控的喷墨式打印机加热喷头可使管口产生脉冲气压打出液滴;声学打印机通过压电式或者超声产生脉冲压;微挤压式打印机使用气动或者机械(活塞或螺旋)驱动系统挤出连续的含有材料和细胞的小球;激光辅助打印机利用激光聚焦于一种吸收性底物,为生物材料打印提供驱动力[18],吸收性底物通过吸收激光将材料挤压出去。
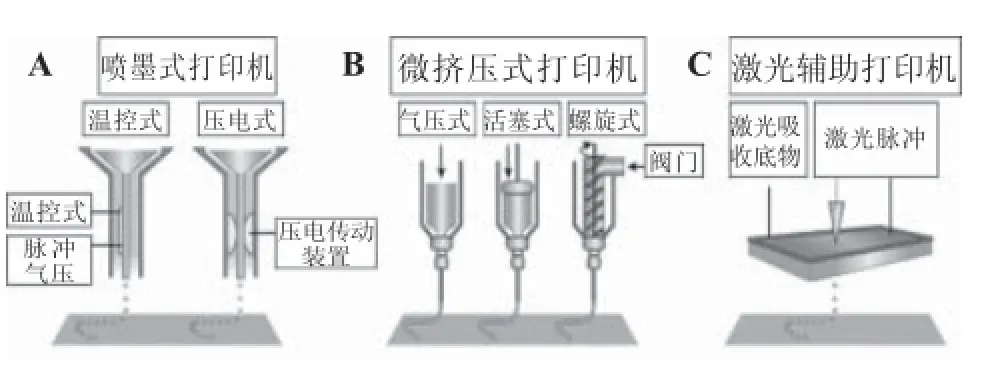
图2 喷墨式打印机(A)、微挤压式打印机(B)和激光辅助打印机(C)的组成和结构
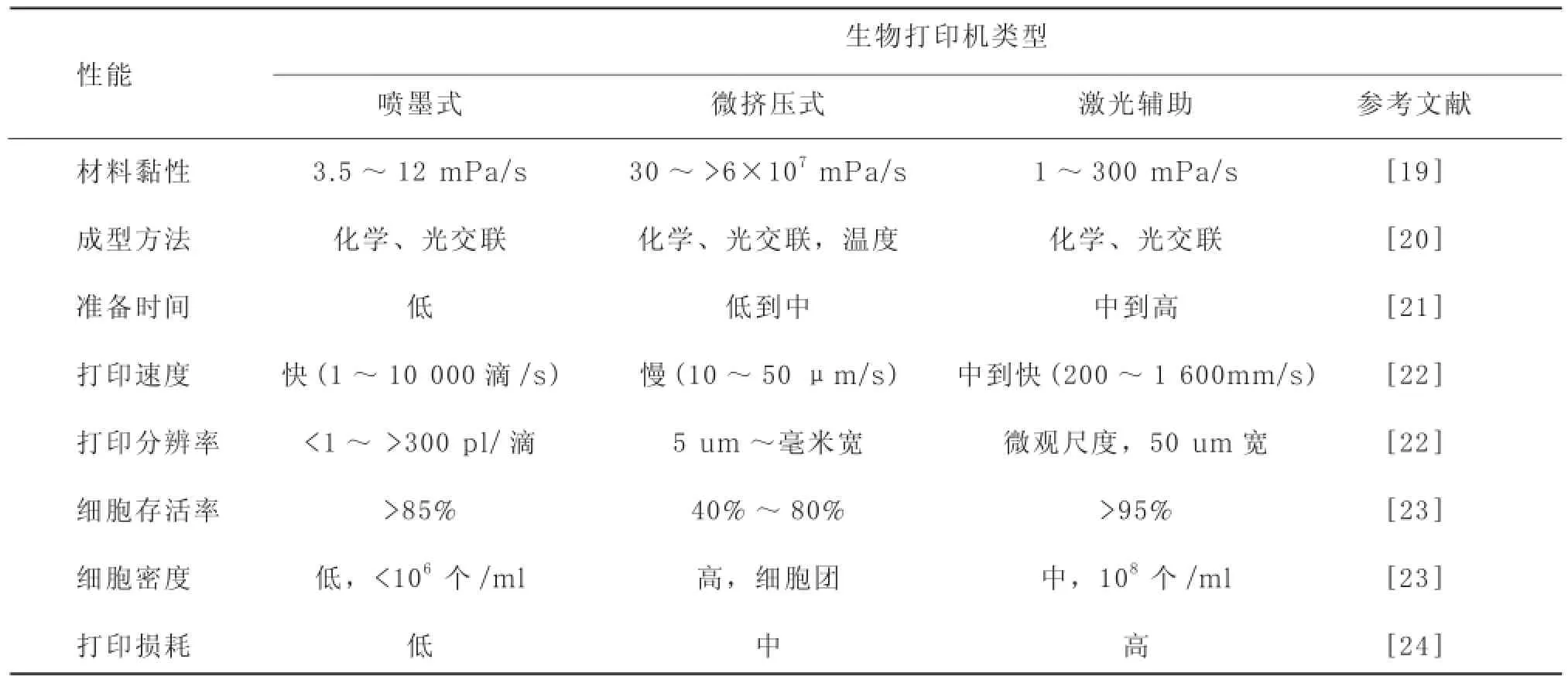
表1 不同种类生物打印机性能的比较
4 材料和支架
3D打印技术最初用于非生物领域,如金属沉积、制陶术、热塑性塑料聚合物生产等,且涉及到有机溶剂、高温和交联试剂等与生物材料和活细胞不兼容的技术。因此,寻找既能与生物材料兼容又能提供组织支架所需的适宜的机械特性和功能特性的材料是3D生物打印的一大挑战。目前使用的几种3D生物打印机的性能比较见表1。
5 细胞来源
组织器官的细胞选择对3D生物打印产物拥有应有的功能至关重要。组织和器官包括多种具有特异功能和基本功能的细胞类型,打印的组织必须包含这些细胞。除了基本的功能细胞,大多数组织还包含起支撑作用和结构功能的细胞,如参与血管化、为干细胞保持干性和细胞分化提供微环境的细胞。目前细胞打印包括功能性细胞打印或者干细胞打印,并且干细胞可以增殖分化形成需要的细胞种类。用于打印的细胞的结构和功能应该与体内生理状态的细胞尽可能相近,且可通过优化打印条件来维持它们在体内的功能[25]。
6 展望与挑战
3D打印组织不仅可用于器官移植,还可用于药物传送,化学试剂、生物学制剂和毒性物质的分析、基础研究等。3D打印组织技术非常复杂,从2D组织如皮肤开始,通过形成中空的管道(如血管)和中空的非管状物的器官(如膀胱),最终形成实体器官如肾,这些是目前的3D技术远远不能做到的。诸多挑战横亘在我们面前,包括细胞和材料的选择,组织的成熟化和功能化,适宜的血管化和神经化。要实现3D生物打印应用于再生医学,还需要汇集多学科的知识来解决这些问题。
参考文献
[1]Hull CW. Apparatus for production of three-dimensional objects by stereolithography[P]. 1986,US 4575330 A (Google Patents). http://www.freepatentsonline.com/4575330.html,1986-11-03.
[2]Nakamura M, Iwanaga S, Henmi C, Arai K, Nishiyama Y. Biomatrices and biomaterials for future developments of bioprinting and biofabrication[J]. Biofabrication, 2010, 2:014110. http://www.ncbi.nlm.nih.gov/pubmed/?term=Biomatrices+and+bi omaterials+for+future+developments+of+bioprinting+and+biofab rication,Epub 2010 -06- 10.
[3]Zopf DA, Hollister SJ, Nelson ME, Ohye RG, Green GE. Bioresorbable airway splint created with a three-dimensional printer[J]. New Engl J Med, 2013, 368:2043–2045.
[4]Ingber DE, Mow VC, Butler D, Niklason L, Huard J, Mao J, Yannas I, Kaplan D, Vunjak-Novakovic G. Tissue engineering and developmental biology: going biomimetic[J]. Tissue Eng, 2006, 12:3265–3283.
[5]Marga F, Neagu A, Kosztin I, Forgacs G. Developmental biology and tissue engineering[J]. Birth Defects Res C Embryo Today, 2007, 81:320–328.
[6]Derby B. Printing and prototyping of tissues and scaffolds[J]. Science, 2012, 338: 921–926.
[7]Mironov V, Visconti RP, Kasyanov V, Forgacs G, Drake CJ, Markwald RR. Organ printing: tissue spheroids as building blocks[J]. Biomaterials, 2009, 30: 2164–2174.
[8]Kamei M, Saunders WB, Bayless KJ, Dye L, Davis GE, Weinstein BM. Endothelial tubes assemble from intracellular vacuoles in vivo[J]. Nature, 2006, 442: 453–456.
[9]Huh D, Matthews BD, Mammoto A, Montoya-Zavala M, Hsin HY, Ingber DE. Reconstituting organ-level lung functions on a chip[J]. Science, 2010, 328: 1662–1668.
[10]Mironov V, Visconti RP, Kasyanov V, Forgacs G, Drake CJ, Markwald RR. Organ printing: tissue spheroids as building blocks[J]. Biomaterials, 2009, 30:2164-2174.
[11]Norotte C, Marga FS, Niklason LE, Forgacs G. Scaffold-free vascular tissue engineering using bioprinting[J]. Biomaterials, 2009; 30:5910-5917.
[12]Baptista PM, Orlando G, Mirmalek-Sani SH, Siddiqui M, Atala A, Soker S. Whole organ decellularization-a tool for bioscaffold fabrication and organ bioengineering[J]. Conf Proc IEEE Eng Med Biol Soc, 2009; 2009:6526-6529.
[13]Kajstura J, Rota M, Hall SR, Hosoda T, D'Amario D, Sanada F, Zheng H, Ogórek B, Rondon-Clavo C, Ferreira-Martins J, Matsuda A, Arranto C, Goichberg P, Giordano G, Haley KJ, Bardelli S, Rayatzadeh H, Liu X, Quaini F, Liao R, Leri A, Perrella MA, Loscalzo J, Anversa P. Evidence for human lung stem cells[J]. N Engl J Med, 2011, 364:1795-1806.
[14]Guillemot F, Souquet A, Catros S, Guillotin B, Lopez J, Faucon M, Pippenger B, Bareille R, Rémy M, Bellance S, Chabassier P, Fricain JC, Amédée J. High-throughput laser printing of cells and biomaterials for tissue engineering[J]. Acta Biomater, 2010; 6:2494-2500.
[15]Klebe RJ. Cytoscribing: a method for micropositioning cells and the construction of two- and three-dimensional synthetic tissues[J]. Exp Cell Res, 1988, 179:362–373.
[16]Cohen DL, Malone E, Lipson H, Bonassar LJ. Direct freeform fabrication of seeded hydrogels in arbitrary geometries[J]. Tissue Eng, 2006, 12:1325–1335.
[17]Barron JA, Wu P, Ladouceur HD, Ringeisen BR. Biological laser printing: a novel technique for creating heterogeneous 3-dimensional cell patterns[J]. Biomed Microdevices, 2004, 6:139–147.
[18]Malda J, Visser J, Melchels FP, Jüngst T, Hennink WE, Dhert WJ, Groll J, Hutmacher DW. 25th anniversary article: engineering hydrogels for biofabrication[J]. Adv Mater, 2013, 25:5011–5028.
[19]Guillemot F, Souquet A, Catros S, Guillotin B, Lopez J, Faucon M, Pippenger B, Bareille R, Rémy M, Bellance S, Chabassier P, Fricain JC, Amédée J. High-throughput laser printing of cells and biomaterials for tissue engineering[J]. Acta Biomater, 2010, 6:2494–2500.
[20]Murphy SV, Skardal A, Atala A. Evaluation of hydrogels for bio-printing applications[J]. J Biomed Mater Res A, 2013, 101:272–284.
[21]Peltola SM, Melchels FP, Grijpma DW, Kellomaki M. A review of rapid prototyping techniques for tissue engineering purposes[J]. Ann Med, 2008, 40: 268–280.
[22]Guillotin B, Souquet A, Catros S, Duocastella M, Pippenger B, Bellance S, Bareille R, Rémy M, Bordenave L, Amédée J, Guillemot F. Laser assisted bioprinting of engineered tissue with high cell density and microscale organization[J]. Biomaterials, 2010, 31:7250–7256.
[23]Xu T, Jin J, Gregory C, Hickman JJ, Boland T. Inkjet printing of viable mammalian cells[J]. Biomaterials, 2005, 26:93–99.
[24]Jones N. Science in three dimensions: the print revolution[J]. Nature,2012, 487: 22–23.
[25]Ambesi-Impiombato FS, Parks LA, Coon HG. Culture of hormone-dependent functional epithelial cells from rat thyroids[J]. Proc Natl Acad Sci USA, 1980, 77:3455–3459.
(修改日期:2016-1-31)
DOI:10. 3969/j. issn. 1672-8521. 2016. 01. 018
基金项目:国家重点基础研究计划(973计划)项目(2012CB518105);国家自然科学基金委员会创新研究群体科学基金(81121004)
通讯作者:付小兵,研究员,中国工程院院士(E-mail: fuxiaobing@ vip.sina.com)

