黑色素细胞中过量表达Pax610Neu基因对MITF和TYR的影响
聂瑞强,杨玉静,谢建山,2,范瑞文,高文俊,董常生
(1山西农业大学动物科技学院,山西太谷 030801;2山西医科大学基础医学院,太原030001)
黑色素细胞中过量表达Pax610Neu基因对MITF和TYR的影响
聂瑞强1,杨玉静1,谢建山1,2,范瑞文1,高文俊1,董常生1
(1山西农业大学动物科技学院,山西太谷 030801;2山西医科大学基础医学院,太原030001)
摘要:【目的】 MITF和β-catenin是黑色素生成通路中重要的调节基因,而Pax6通过调控MITF和β-catenin来调控黑色素细胞的黑色素生成,通过对只含有正常Pax6 paird domain 的前102个氨基酸的Pax610Neu的研究,来探究Pax610Neu是否还有生物学功能,以及Pax6对其下游基因的作用机理。【方法】根据NCBI查找到的Pax610Neu基因序列设计PCR引物,克隆Pax610Neu,收集所得基因片段送华大基因测序确认。后通过对Pax610Neu和慢病毒表达载体的序列分析来筛选合适的酶切位点,通过分析选取Sal I和Xba I作为酶切位点,设计含有Sal I和Xba I酶切位点的PCR引物,大量克隆Pax610Neu基因,从而通过胶回收得到含有Sal I和Xba I酶切位点的Pax610Neu基因。将含有酶切位点的目的片段与T载体相连,并送华大基因测序。将与T载体连接成功的质粒导入感受态细胞使其大量扩增,提取质粒,双酶切后,胶回收,得到大量含有Sal I和Xba I酶切位点的Pax610Neu基因片段,将其与含有小鼠tyrp2特异性启动子和绿色荧光蛋白(GFP)的慢病毒表达载体相连接,送华大基因测序确认。将连接好的慢病毒表达载体导入感受态细胞使其大量扩增,通过质粒中提试剂盒获得大量去内毒素的Pax610Neu慢病毒真核表达载体。将慢病毒真核表达载体通过细胞转染导入到培养的绵羊黑色素细胞中,使其过量表达。收集细胞,分别通过观察绿色荧光蛋白和使用RT-PCR来检测转染效率,使用RT-PCR和Western blot来检测MITF和TYR在mRNA和蛋白水平的变化,同时检测黑色素细胞中黑色素生成量的变化。【结果】与正常组相比,在mRNA水平,MITF显著升高3.2倍(P<0.05),TYR升高1.31倍,由此得出,Pax610Neu可以有效促进MITF mRNA 的产生,对TYR mRNA产生的影响不是太显著;在蛋白质水平,MITF显著升高8.24倍(P<0.001),TYR显著升高2.09倍(P<0.001),由此得出,Pax610Neu可以显著提高MITF 、TYR 蛋白的产生;同时黑色素细胞产生黑色素的量显著升高1.22倍(P<0.05),由此得出Pax610Neu可以有效促进黑色素细胞黑色素的生成。【结论】只含有正常Pax6 paird domain前102个氨基酸的Pax610Neu,仍然可以在黑色素细胞中与MITF相互作用,同时间接调控TYR的表达,从而使黑色素细胞黑色素的生成量发生改变。
关键词:Pax610Neu;Pax6;MITF;TYR;黑色素
联系方式:聂瑞强,E-mail:ibernie@126.com。通信作者董常生,E-mail:cs_dong@sxau.edu.cn
0 引言
【研究意义】动物的毛色是动物经济价值的重要指标之一。目前,毛纺织品的多彩主要是靠化学染料染色,对人体和环境都有危害,如果可以通过基因工程从动物自身来改变毛色,丰富动物的天然毛色,对提高毛用动物的经济价值,以及保护人体健康和环境都有很大的好处。动物的毛色主要是由位于皮肤内的黑色素的种类和数量决定的。在黑色素生成通路中,MITF是其中的一个关键调控基因[1]。MITF点突变可以导致动物被毛白化[2-3],miR-137调控MITF的表达量可以使小鼠毛色改变[4]。而Pax6可以通过调控MITF的表达来调控黑色素的生成[5-6]。【前人研究进展】BAUMER等2003年在突变小鼠中发现Pax6与Pax2的复合物对于视网膜色素上皮细胞的分化和发育是必须的[7]。朱芷葳等 2012年发现Pax3参与了黑色素细胞的增殖、分化和迁移,Pax3与色素的形成相关[8]。RAVIV 等2014年发现,Pax6在调控MITF的表达时,同时会通过另一快捷途径向MITF发出前馈信号,使Pax6调控MITF的过程更加准确[5]。FUJIMURA等2015年通过对小鼠基因的选择性敲除发现,在视网膜色素上皮细胞发育过程中,Pax6会与β-catenin相互作用[9],而β-catenin是已知色素生成通路中的关键基因[10-11]。Pax(paired box)家族属于转录因子中高度保守的家族,在脊椎动物中共包含9个成员(Pax1— Pax9),其3个保守结构域包括配对域(paireddomain,PD)、八肽域(octapeptide,OP)和同源域(homeodomain,HD)[12-13]。Pax家族广泛参与细胞内信号的传导过程[14],在胚胎和神经嵴的发育过程中起重要的调控作用[15]。Pax基因在体内表达紊乱时,会使多个器官组织发育畸形[16]。Pax6是由PD和HD组成,Pax 基因中,编码PD的序列非常保守,是其作为转录因子与其调控基因相互作用的主要功能域,而PD是由氨基端(PAI)和羧基端(RED)两个亚结构域连接组成的(PAI+ RED=PAIRED),PAI直接和其调控基因相互作用,RED则辅助Pax因子与目标基因的相互连接;在其家族进化过程中,编码PAI的序列比编码RED的序列的保守性高,种间差异小[16-17]。FAVOR等在2001年对小鼠Pax6进行以表型为基础的试验,发现了9 个Pax6的突变体(Pax62Neu—Pax610Neu),其中7个在转录时提前终止且小鼠表型上没有变化。Pax610Neu就是其中之一。Pax610Neu在碱基对发生替换时,在paired box的羧基端产生了一个终止密码子,这个突变体产物包含正常 Pax6前 102个氨基酸,丢失了paired domain的最后43个氨基酸,以及连接区域、同源域和P/S/T region[18]。【本研究切入点】由于编码PD的序列十分保守,是Pax 蛋白与DNA 结合的主要功能域[16]。而Pax610Neu中只包含PD高度保守的区段,那么 Pax610Neu在分子水平上是否还具有一定的作用,其是否仍然可以在黑色素细胞中与其调控的下游基因相互作用?且从未有研究以Pax610Neu为切入点来研究Pax6作为转录因子调控下游基因的具体功能位点。这对研究Pax6的功能位点,以及对动物毛色形成机理的研究都有重要的意义。【拟解决的关键问题】本试验在细胞水平上通过细胞转染技术过量表达 Pax610Neu,以探究 Pax610Neu是否仍与MITF和TYR相互作用。
1 材料与方法
试验于2015年1—10月在山西农业大学羊驼生物工程实验室完成。
1.1 材料
试剂:DMEM培养基(Life,美国)、黑色素细胞培养基(Sciencell,美国)、Trizol(Invitrogen,美国)、RT-PCR kit(康为,北京)、MITF多克隆抗体、TYR多克隆抗体、RIPA蛋白裂解液(碧云天,北京)。
1.2 试验方法
1.2.1 小鼠 Pax610Neu基因序列的获取 通过 NCBI (http://www.ncbi.nlm.nih.gov/)来查找获得。
1.2.2 小鼠Pax610Neu基因片段的克隆 使用Trizol法提取小鼠皮肤总RNA,使用反转录试剂盒合成相应的cDNA。设计Pax610Neu基因引物(表1),送华大基因公司合成。使用普通PCR扩增目的基因,胶回收后送华大基因公司双向测序确认。
1.2.3 Pax610Neu基因真核表达载体的构建 首先使用连有SalⅠ、XbaⅠ酶切位点的Pax610Neu基因与T载体相连,测序成功后,将Pax610Neu基因用SalⅠ、XbaⅠ酶切下,胶回收后,再连接启动子为黑色素细胞特异性启动子小鼠 tyrp2的慢病毒载体(载体为实验室保存)。
1.2.4 细胞培养 试验所用细胞为实验室保存的第6代绵羊黑色素细胞。将细胞从液氮中取出,置于37℃水浴锅中,使其快速溶解。复苏后的细胞接种于加有黑色素细胞培养基的6孔板上,在37℃、5% CO2培养箱中培养。
1.2.5 细胞转染 设置正常组、空载组和试验组,在6孔板的每孔加入大约1.8 mL含血清的正常培养基,接种1×106个细胞,培养细胞至铺满底部75%;正常组为正常培养的黑色素细胞,空载组和试验组中的细胞,在传代1 d后,加入转染试剂与表达载体形成的脂质体,混匀,37℃培养24 h,吸去含有转染试剂的培养基,每孔加入1.8 mL 含血清的正常培养基。在37℃条件下培养细胞48 h,进行转染结果检测。

表1 试验所用引物Table 1 Primers used in this study
1.2.6 黑色素含量测定 用胰酶将黑色素细胞从细胞培养板上消化下来,用PBS清洗3 次后细胞计数。用0.2 mol·L-1NaOH(1×106cells/mL)溶解细胞,使用酶标仪在475 nm 波长进行测值[19]。用黑色素标准品做标准曲线,每组重复3次。
1.2.7 Real-time PCR检测 使用Trizol法提取细胞RNA,并使用反转录试剂盒获得cDNA。由于Pax610Neu基因序列长度只有309 bp,故直接使用普通PCR引物作为荧光定量PCR引物(表1),且通过试验其效果良好。根据荧光定量PCR结果的CT 值计算试验结果,目的基因的相对表达水平=2-△△CT,所有数据用GraphPad Prism5.0进行统计分析,实时荧光定量PCR结果均用均值±标准误(Means ± SEM)表示,其中各基因的表达量均经β-actin校正,两组之间的数据比较全部采用GraphPad Prism5.0 统计软件进行t检验,3组之间的比较全部采用单因素方差分析。
1.2.8 蛋白免疫印迹试验 用RIPA蛋白裂解液提取黑色素细胞蛋白,进行SDS-PAGE 电泳,后转至NC膜。MITF和TYR抗体所用浓度为1000倍稀释。孵育二抗后,用ECL显色后暗室曝光,获得有条带的胶片,分析。用Image-ProPlus 6.0 软件对绵羊MITF、TYR和β-actin 结果进行条带面积和灰度值半定量分析,数据均用Means ± SEM 表示,两组之间的数据比较全部采用GraphPad Prism5.0 统计软件进行t检验,3组之间的比较全部采用单因素方差分析。
2 结果
2.1 小鼠Pax610Neu基因序列的获得
小鼠Pax610Neu基因mRNA在GeneBank中的编号为AJ307468.1。
2.2 小鼠 Pax610Neu氨基酸序列与绵羊 Pax6氨基酸序列比对
经过小鼠与绵羊Pax6蛋白质(XP_011951552.1)前102个氨基酸序列的比对,发现小鼠Pax610Neu氨基酸序列与绵羊Pax6前102个氨基酸序列的相似性为99.02%(图 1)。故通过绵羊黑色素细胞来验证小鼠Pax610Neu是否还有其生物学功能是可行的。
2.3 Pax家族氨基酸序列比对
Pax家族的 9个成员的氨基酸序列同源性为32.56%。Pax6的保守区域主要集中于前130个氨基酸处,而Pax610Neu的氨基酸序列为其保守区的前102个氨基酸(图2),故Pax610Neu很可能还保留有Pax6的生物学功能。

图1 Pax610Neu氨基酸序列比对Fig.1 Alignment of amino acid sequence of Pax610Neu

图2 小鼠PAX家族氨基酸序列比对Fig. 2 Alignment of amino acid sequence of PAX family of mouse
2.4 Pax610Neu真核表达载体构建
PCR纯化的Pax610Neu基因被连接到含有可在黑色素细胞内特异表达的小鼠 tyrp2启动子的慢病毒质粒载体中,同时该载体连接有绿色荧光蛋白(green fluorescent protein,GFP)(图3)。
连接后的表达载体送华大基因公司进行了测序,结果完全符合预期大小,并且通过比对在NCBI中找到了与Pax610Neu序列完全一致的区域。
2.5 黑色素细胞的培养
细胞接种12 h后,即可见细胞贴壁伸展,24 h后细胞呈典型的树突状(图4-A, B)。
2.6 质粒真核表达载体在黑色素细胞中的转染
2.6.1 黑色素细胞转染效率检测 在黑色素细胞对数生长期进行转染,并且通过绿色荧光的观察(图4-C,D,E,F)和RT-PCR来检测转染效率,结果可以表明试验构建的真核表达载体可以在黑色素细胞中正常表达且通过荧光定量 PCR发现,试验组中 Pax610Neu被极显著的提高(P<0.001)(图5)。
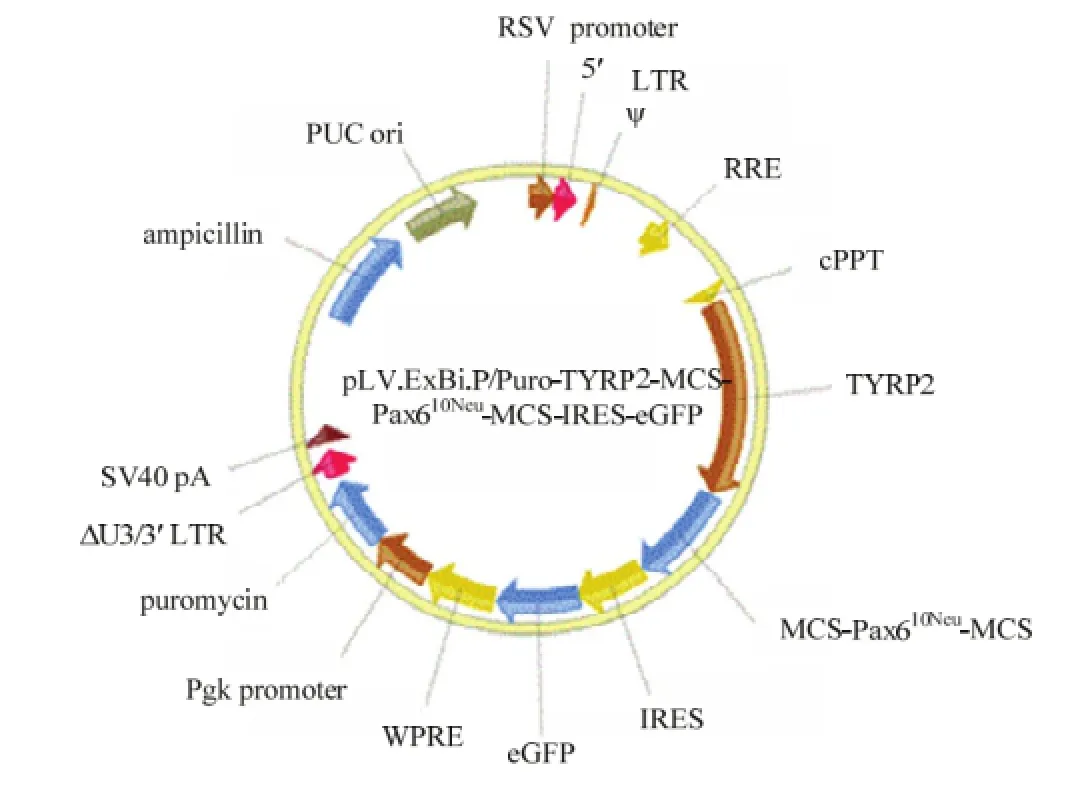
图3 Pax610Neu真核表达载体Fig. 3 Structure of over-expressing Pax610Neu

图4 黑色素细胞培养和转染荧光图Fig. 4 The pictures of cell culture and green fluorescence
2.6.2 Western blot 检测MITF、TYR蛋白在转染后黑色素细胞中的表达 提取转染后黑色素细胞的蛋白质,使用Western blot检测后,通过统计分析获得结果显示(图6),与正常组相比,试验组MITF蛋白显著升高8.24倍,TYR蛋白显著升高2.09倍。由此得出,Pax610Neu可以显著提高MITF、TYR蛋白的产生(P<0.001)。
2.6.3 转染后黑色素细胞MITF和TYR mRNA表达量检测 提取转染后黑色素细胞的 RNA后,通过荧光定量PCR检测,结果显示(图7):与正常组相比,试验组MITF mRNA显著升高3.2倍(P<0.05),TYR mRNA升高1.31倍。由此得出,Pax610Neu可以显著促进MITF mRNA的产生,对TYR mRNA的影响不显著。
2.6.4 转染后黑色素含量测定 收集黑色素细胞,用酶标仪对黑色素含量进行测定,结果显示,转染后的黑色素细胞中,试验组黑色素含量是空白组的1.22倍(P<0.05)(图8)。

图5 Pax610Neu转染黑色素细胞的效率Fig. 5 Pax610NeumRNA levels in melanocytes transfected with the Pax610Neustructure
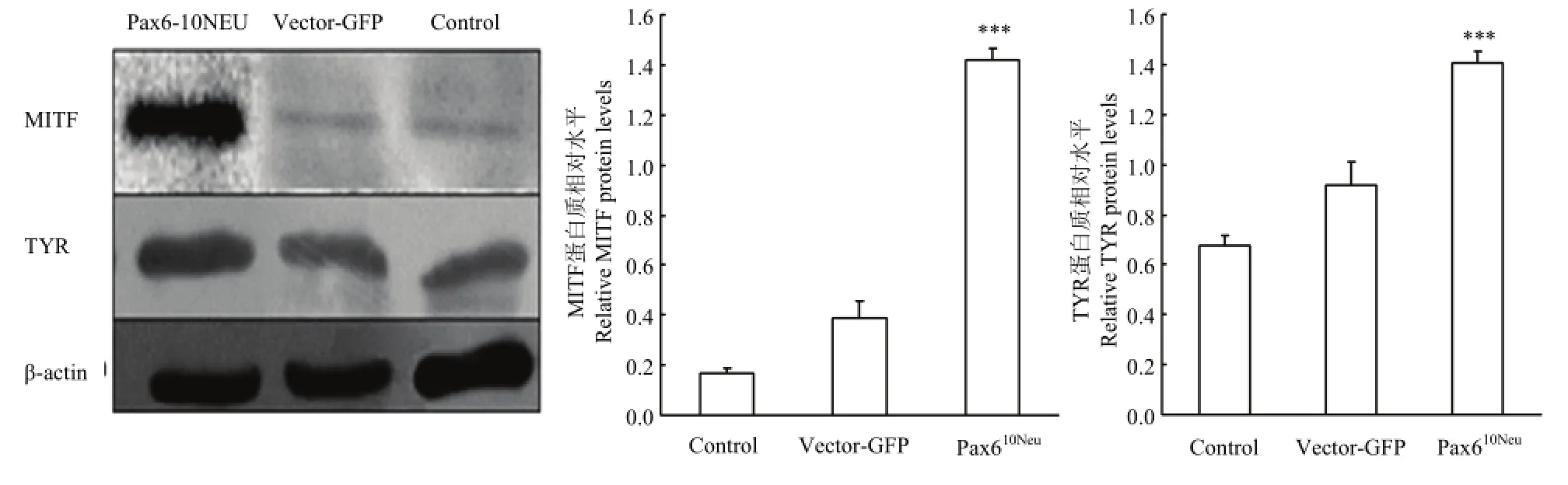
图6 Pax610Neu转染后黑色素细胞MITF、TYR蛋白的表达量Fig. 6 Western blot analysis of MITF, TYR expression in melanocytes transfected with the Pax610Neustructure and vector control
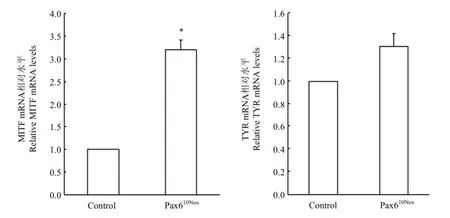
图7 转染Pax610Neu后黑色素细胞的MITF和TYR mRNA检测Fig. 7 Real-time PCR analysis of MITF,TYR expression in melanocytes transfected with the Pax610Neustructure

图8 过表达Pax610Neu对黑色素细胞黑色素生成的影响Fig. 8 Melanin production in melanocytes over-expressing Pax610Neustructure
3 讨论
本试验在分子水平上,通过细胞转染技术,构建Pax610Neu真核表达载体,研究Pax6调控黑色素生成的调节机制。试验通过Western bolt以及RT-PCR对黑色素细胞中的MITF和TYR进行检测,同时对黑色素细胞中黑色素含量进行测定,结果显示Pax610Neu的高表达可以促进MITF的表达,并通过MITF调控促进了 TYR的表达,进而影响黑色素细胞生成黑色素的量。这个结果为进一步研究 Pax6的功能域以及与MITF作用的功能区域提供了基础。
FAVOR等发现Pax6的突变体Pax610Neu,并通过小鼠的表现型验证其为无效等位基因,从而得出Pax6功能的发挥需要全部的功能域都完整[18],但是,通过本次试验结果得出,只含有正常Pax6 paird domain 的前102个氨基酸的Pax610Neu也可以与MITF相互作用,从而促进MITF和TYR的表达。序列比对结果显示,Pax610Neu含有多个paired domain的保守序列,所以可以推断 Pax6与 MITF的作用位点很可能是在 paired domain高度保守的区域。
MAZUR在2013年发现Pax6通过与MITF相互作用来调节色素细胞的分化[20]。MITF具有碱性的螺旋-环-螺旋亮氨酸拉链结构[21],调控皮肤和视网膜色素细胞特异性基因的表达[22-23]。同时,在视网膜色素上皮细胞的发育中,Pax6也调控黑色素生成通路中Wnt/β-catenin通路的β-catenin[24-25]。
在生命进化过程中,生物大分子之间的相互作用和调控有多种多样的方式,包括实验证实的和未证实的,Pax6在黑色素细胞中的作用机理,及其结构的不完整性对其作用的影响还有待于进一步的研究。
4 结论
只含有正常Pax6 paird domain前102个氨基酸的Pax610Neu仍然可以在黑色素细胞中与MITF相互作用,从而间接调控TYR的表达量,进而调节黑色素细胞黑色素的生成。
References
[1] PAN L, MA X, WEN B, SU Z, ZHENG X, LIU Y, LI H, CHEN Y,WANG J, LU F, QU J, HOU L. Microphthalmia-associated transcription factor/T-box factor-2 axis acts through Cyclin D1 to regulate melanocyte proliferation. Cell Proliferation, 2015, 48:631-642.
[2] KURITA K, NISHITO M, SHIMOGAKI H, TAKADA K,YAMAZAKI H, KUNISADA T. Suppression of progressive loss of coat color in microphthalmia-vitiligo mutant mice. The Journal of Investigative Dermatology, 2005, 125(3):538-544.
[3] YUSNIZAR Y, WILBE M, HERLINO A O, SUMANTRI C, NOOR R R, BOEDIONO A, ANDERSSON L, ANDERSSON G. Microphthalmiaassociated transcription factor mutations are associated with whitespotted coat color in swamp buffalo. Animal Genetics, 2015, 46:676-682.
[4] DONG C, WANG H, XUE L, DONG Y, YANG L, FAN R, YU X,TIAN X, MA S, SMITH G W. Coat color determination by miR-137 mediated down-regulation of microphthalmia-associated transcription factor in a mouse model. RNA, 2012, 18(9):1679-1686.
[5] RAVIV S, BHARTI K, RENCUS-LAZAR S, COHEN-TAYAR Y,SCHYR R, EVANTAL N, MESHORER E, ZILBERBERG A,IDELSON M, REUBINOFF B. PAX6 regulates melanogenesis in the retinal pigmented epithelium through feed-forward regulatory interactions with MITF. PLoS Genetics, 2014, 10(5):e1004360.
[6] BHARTI K, GASPER M, OU J, BRUCATO M, CLOREGRONENBORN K, PICKEL J, ARNHEITER H. A regulatory loop involving PAX6, MITF, and WNT signaling controls retinal pigment epithelium development. PLoS Genetics, 2012, 8(7):e1002757.
[7] BAUMER N, MARQUARDT T, STOYKOVA A, SPIELER D,TREICHEL D, ASHERY-PADAN R, GRUSS P. Retinal pigmented epithelium determination requires the redundant activities of Pax2 and Pax6. Development (Cambridge, England), 2003, 130(13): 2903-2915.
[8] 朱芷葳, 贺俊平, 于秀菊, 李鹏飞, 程志学, 董常生. PAX3转录因子在羊驼皮肤组织中的表达和定位分析. 畜牧兽医学报, 2012(5):729-734.ZHU Z W, HE J P, YU X J, LEI P F, CHENG Z X, DONG C S. Expression and location analysis of pax3 transcription factor in Alpaca skin. Acta Veterinaria et Zootechnica Sinica, 2012, 43(5): 729-734. (in Chinese)
[9] FUJIMURA N, KLIMOVA L, ANTOSOVA B, SMOLIKOVA J,MACHON O, KOZMIK Z. Genetic interaction between Pax6 and β-catenin in the developing retinal pigment epithelium. Development Genes and Evolution, 2015, 225(2):121-128.
[10] ZHU P Y, YIN W H, WANG M R, DANG Y Y, YE X Y. Andrographolide suppresses melanin synthesis through Akt/GSK3β/βcatenin signal pathway. Journal of Dermatological Science, 2015,79(1):74-83.
[11] PARK H J. CARI ONE induces anagen phase of telogenic hair follicles through regulation of β-catenin, stimulation of dermal papilla cell proliferation, and melanogenesis. Journal of Dietary Supplements,2014, 11(4):320-333.
[12] LANG D, POWELL S K, PLUMMER R S, YOUNG K P, RUGGERI B A. PAX genes: roles in development, pathophysiology, and cancer. Biochemical Pharmacology, 2007, 73(1):1-14.
[13] PAIXAO-CORTES V R, SALZANO F M, BORTOLINI M C. Origins and evolvability of the PAX family. Seminars in Cell & Developmental Biology, 2015, 44: 64-74.
[14] BLAKE J A, ZIMAN M R. Pax genes: regulators of lineage specification and progenitor cell maintenance. Development (Cambridge, England), 2014, 141(4): 737-751.
[15] MONSORO-BURQ A H. PAX transcription factors in neural crest development. Seminars in Cell & Developmental Biology, 2015,44:87-96.
[16] 王秀, 王蔚, 王义权. Pax基因功能及其选择性剪接的研究进展.生命科学, 2008, 20(1):125-130. WANG X, WANG W, WANG Y Q. Progress in the study of Pax gene family and its alternative splicing. Chinese Bulletin of Life Sciences,2008, 20(1):125-130. (in Chinese)
[17] EBERHARD D, JIMENEZ G, HEAVEY B, BUSSLINGER M. Transcriptional repression by Pax5 (BSAP) through interaction with corepressors of the Groucho family. The EMBO Journal, 2000,19(10):2292-2303.
[18] FAVOR J, PETERS H, HERMANN T, SCHMAHL W, CHATTERJEE B, NEUHAUSER-KLAUS A, SANDULACHE R. Molecular characterization of Pax6(2Neu) through Pax6(10Neu): an extension of the Pax6 allelic series and the identification of two possible hypomorph alleles in the mouse Mus musculus. Genetics, 2001, 159(4): 1689-1700.
[19] DONG Y, WANG H, CAO J, REN J, FAN R, HE X, SMITH GW,DONG C. Nitric oxide enhances melanogenesis of alpaca skin melanocytes in vitro by activating the MITF phosphorylation. Molecular and Cellular Biochemistry, 2011, 352(1/2):255-260.
[20] MAZUR M A, WINKLER M, GANIC E, COLBERG J K,JOHANSSON J K, BENNET H, FEX M, NUBER U A, ARTNER I. Microphthalmia transcription factor regulates pancreatic β-cell function. Diabetes, 2013, 62(8):2834-2842.
[21] HODGKINSON C A, MOORE K J, NAKAYAMA A, STEINGRIMSSON E, COPELAND N G, JENKINS N A, ARNHEITER H. Mutations at the mouse microphthalmia locus are associated with defects in a gene encoding a novel basic-helix-loop-helix-zipper protein. Cell, 1993,74(2):395-404.
[22] SHIBAHARA S, YASUMOTO K, AMAE S, UDONO T,WATANABE K, SAITO H, TAKEDA K. Regulation of pigment cell-specific gene expression by MITF//Pigment Cell Research Sponsored by the European Society for Pigment Cell Research and the International Pigment Cell Society, 2000, 13(8):98-102.
[23] SPENCE J R, MADHAVAN M, AYCINENA J C, DEL RIO-TSONIS K. Retina regeneration in the chick embryo is not induced by spontaneous Mitf downregulation but requires FGF/FGFR/MEK/Erk dependent upregulation of Pax6. Molecular Vision, 2007, 13:57-65.
[24] ZHAO Y, WANG P, MENG J, JI Y, XU D, CHEN T, FAN R, YU X,YAO J, DONG C. MicroRNA-27a-3p Inhibits Melanogenesis in Mouse Skin Melanocytes by Targeting Wnt3a. International Journal of Molecular Sciences, 2015, 16(5):10921-10933.
[25] YUN C Y, YOU S T, KIM J H, CHUNG J H, HAN S B, SHIN E Y,KIM E G. p21-activated kinase 4 critically regulates melanogenesis via activation of the CREB/MITF and β-catenin/MITF pathways. The Journal of Investigative Dermatology, 2015, 135(5):1385-1394.
(责任编辑 林鉴非)
The Influences of Over-Expressing Pax610Neuon MITF and TYR in Melanocytes
NIE Rui-qiang1, YANG Yu-jing1, XIE Jian-shan1,2, FAN Rui-wen1, GAO Wen-jun1, DONG Chang-sheng1
(1College of Animal Science and Veterinary Medicine, Shanxi Agricultural University, Taigu 030801, Shanxi;2School of Basic Medical Sciences, Shanxi Medical University, Taiyuan 030001)
Abstract:【Objective】 MITF and β-catenin are important regulatory genes of the melanin system. Pax6 regulates the production of melanin indirectly, through regulates MITF and TYR. In order to explore the function of Pax610Neuand the mechanism of Pax6 with its target genes, we explored the function of Pax610Neu, which only included 102 N-terminalanimo acids of the paird domain. 【Method】 According to the sequence of Pax610Neuin NCBI, the primers of Pax610Neuwere designed and synthesized byBGI. The coding sequences of Pax610Neuwere PCR amplified and then confirmed by sequencing. Sal I and Xba I restriction sites were selected by analyzing the sequences of Pax610Neuand the mammalian expression vector. The Pax610Neuwas cloned into the T-Vector, meanwhile, confirmed by sequencing. The fragment was then subcloned into a mammalian expression vector, resulting in a construction that contained a specific mouse tyrp2 promoter driving the expression of the green fluorescent protein (GFP) and the target fragment with Sal I and Xba I restriction sites. The plasmid vector was confirmed by sequencing. The expression vector was amplified by competent cells and obtained without endotoxin by the plasmid midiprep system. Then, the sheep melanocytes were transfected with the vector using Liposome 2000. There were three methods used in the results test which were quantitatively real-time PCR, western blot, and melanin content measurement. 【Result】 The results showed that the MITF mRNA, MITF and TYR protein, melanin content were significantly increased. MITF mRNA was significantly increased to 3.2 times (P<0.05) and TYR mRNA was increased to 1.31 times, compared with control group, MITF protein was significantly increased to 8.24 times (P<0.001) and TYR protein was significantly increased to 2.09 times (P<0.001). Meanwhile, the melanin content was significantly increased to 1.22 times (P<0.05). 【Conclusion】 We demonstrated that the Pax610Neustill interacts with MITF, and then regulated TYR indirectly, meanwhile changing the production of melanin of melanocytes.
Key words:Pax610Neu; Pax6; MITF; TYR; melanin
收稿日期:2015-10-28;接受日期:2015-12-25
基金项目:国家高科技研究发展计划(863计划)(2013AA102506)、国家公益性行业(农业)科研专项(201303119)、山西农业大学创新团队

