Smads与Hippo通道中YAP1基因在湖羊肌肉组织中时空表达研究及关联分析
鲍建军,苏 锐,王庆增,吕晓阳,高 雯,于嘉瑞,王利宏,陈 玲,吴文忠,盛水兴,周 洪,孙 伟,戴国俊
(1扬州大学动物科学与技术学院,江苏扬州225009;2苏州市畜牧兽医站,江苏苏州215200;3徐州市睢宁县林牧渔业局,江苏睢宁221200)
Smads与Hippo通道中YAP1基因在湖羊肌肉组织中时空表达研究及关联分析
鲍建军1,苏锐1,王庆增1,吕晓阳1,高雯1,于嘉瑞1,王利宏1,陈玲2,吴文忠2,盛水兴2,周洪3,孙伟1,戴国俊1
(1扬州大学动物科学与技术学院,江苏扬州225009;2苏州市畜牧兽医站,江苏苏州215200;3徐州市睢宁县林牧渔业局,江苏睢宁221200)
摘要:【目的】通过在mRNA表达水平检测TGF-β/smad信号通路基因在湖羊肌肉组织中时空表达,来探究各基因的表达规律及内在联系。【方法】利用荧光定量PCR技术对湖羊Smads基因在出生后不同生长阶段(2日龄,2月龄和6月龄)不同性别的两种不同骨骼肌(腓肠肌、趾长伸肌)的相对表达进行分析,以及对湖羊 Smad家族(Smad2、Smad3、Smad4、Smad7)基因、YAP1基因的表达相关性分析。【结果】湖羊肌肉TGF-β/smad信号通路中Smads基因时空表达规律研究发现:Smads在不同肌肉组织的表达分析中,Smads在腓肠肌中的表达高于趾长伸肌,可能与这两种骨骼肌分属不同部位有关;Smads在不同月龄的表达分析中,Smad2、Smad3、Smad4在2日龄的表达量均高于其它月龄,而Smad7在2日龄的表达量低于6月龄,2月龄时表达量最低;在不同性别的表达分析中,Smads在 2日龄公羊中的表达量高于母羊,Smad2、Smad4、Smad7 在2月龄和6月龄则低于母羊;Smad3在不同生长阶段中公羊表达量高于母羊。湖羊肌肉TGF-β/smad信号通路中Smads、YAP1基因表达相关性研究发现:在2日龄腓肠肌中,Smad2、Smad3、Smad4、Smad7的表达与YAP1相关不显著(P>0.05);在2月龄腓肠肌中,Smad2的表达与YAP1存在显著正相关(P<0.05),Smad3、Smad4、Smad7的表达与YAP1相关不显著(P>0.05);在6月龄腓肠肌中,Smad2、Smad3、Smad4、Smad7的表达与YAP1相关不显著(P>0.05);在腓肠肌的不同生长阶段中,Smad3的表达YAP1存在极显著负相关(P <0.01),Smad2、Smad4、Smad7的表达与YAP1相关不显著(P>0.05)。在2日龄趾长伸肌中,Smad3的表达与YAP1存在极显著正相关(P<0.01),Smad2、Smad4、Smad7的表达与YAP1存在显著正相关(P<0.05);在2月龄趾长伸肌中,Smad2、Smad3、Smad4、Smad7的表达与YAP1相关不显著(P>0.05);在6月龄趾长伸肌中, Smad7与YAP1存在极显著正相关(P<0.01);Smad2、Smad3、Smad4的表达与YAP1相关不显著(P >0.05);在趾长伸肌的不同生长阶段中,Smad2、Smad3、Smad4、Smad7的表达与YAP1存在极显著正相关(P <0.01)。【结论】由此推断不同组织、生长阶段以及性别等因素均可影响Smads在肌肉中的表达;在湖羊这两种不同肌肉组织中,Hippo通道中YAP1基因可通过参与调控TGF-β/smad信号通路而参与肌肉的增殖和分化过程。
关键词:湖羊;Smads;YAP1;Hippo通路;TGF-β通路
联系方式:鲍建军,E-mail:imaple14@163.com。苏锐,E-mail:99114074@qq.com。鲍建军和苏锐为同等贡献作者。通信作者孙伟,E-mail:dkxmsunwei@163.com
0 引言
【研究意义】湖羊是世界著名的绵羊品种之一,不仅具有高繁殖率等特点,而且肉质细嫩、多汁。通过检测影响湖羊骨骼肌生长发育相关基因的表达情况是分析湖羊肌肉生长分子机制的基础,从而可以发现与肌肉质量性状相关的候选基因。【前人研究进展】YAP1(Yes-associated protein 1)也被称为YAP65、YAP等,已被定位于人类染色体11q22[1],广泛表达于哺乳动物机体各组织中,参与细胞内多条信号通路的传导。研究发现,YAP1作为Hippo信号通路的中枢调控剂之一,在细胞增殖和凋亡动态平衡的维持、细胞接触性抑制的调控、器官大小的控制,以及肿瘤的形成等过程中具有重要作用[2-7]。Smad基因家族分为3类:第一类是受体活化型Smad (R-Smad),包括Smad1-3, Smad5, Smad8;第二类是共同调节型Smad(Co-Smad),主要为Smad4;第三类是抑制型Smad(I-Smad),由Smad6、Smad7组成[8]。转化生长因子β(transforming growth factor-β,TGF-β)是一个由33种结构相似多肽组成的超级家族,包括 TGF-β、活化素、抑制素和骨形成蛋白(BMPs)等[9-10],其家族细胞因子可广泛调节细胞活动,如细胞增殖分化、凋亡、运动、细胞外基质重排以及血管生成等[11-13],可通过胞内信号分子Smads 蛋白转导信号,具有抑制生长、促进细胞分化等多种功能[14]。FERRIGNO[15]在研究TGF-β通道与 YAP1过程中,运用酵母双杂交技术对人类胎盘cDNA表达文库进行筛选,发现用鼠全长 Smad7作探针时,YAP1基因可以被其识别。在COS-7细胞中YAP1与 Smad7的相互结合被证明使用了共同表达的标记蛋白,而移除PY基序[16]后,这种关联依然存在,由此可以看出,YAP1与Smad7相互作用的结构域不仅仅只有PY基序。【本研究切入点】课题组前期利用芯片研究绵羊双肌臀性状的遗传机理,筛选出美臀绵羊和正常表型羊肌肉组织差异表达基因YAP1[17],目前关于Hippo通道中YAP1影响肌肉生长发育的研究较少,TGF-β通道在肌肉生长发育中发挥着重要作用,而Smads家族基因是TGF-β通道中重要的成员,因此推断YAP1可能通过与Smad蛋白家族结合,促进或抑制 TGF-β等通道的活性,进而对肌肉的生长发育发挥着重要的作用。【拟解决的关键问题】本试验通过分析湖羊YAP1基因以及与肌肉形成发育相关的Smad家族基因(Smad2、Smad3、Smad4、Smad7)在湖羊不同性别、不同月龄、不同肌肉组织的时空表达趋势,以及 YAP1基因与此 4个基因表达的关联性,探讨YAP1是否通过Smad蛋白家族来影响湖羊的肌肉生长发育。
1 材料与方法
2015年2—11月在扬州大学动物科学与技术学院江苏省重点实验室——动物遗传繁育与分子设计实验室进行如下试验。
1.1 试验动物
试验用羊于2015年2月购自苏州市种羊场。湖羊选择2日龄(初生)、2月龄(断奶)、6月龄三个阶段,每阶段3公3母总共18只。选择生长发育良好、日龄体重相近的羊进行屠宰,采集腓肠肌、趾长伸肌后于液氮罐保存。
1.2 主要试剂
PrimerScript RT reagent Kit、SYBR® Premix Ex TaqTM II(Tli RNaseH Plus)、Trizol、rTaq酶等试剂购自TaKaRa公司。
1.3 总RNA的提取
用Trizol法提取总RNA。
1.4 实时荧光定量PCR引物的设计与合成
绵羊Smads和18S rRNA基因实时荧光定量PCR引物信息见表1。
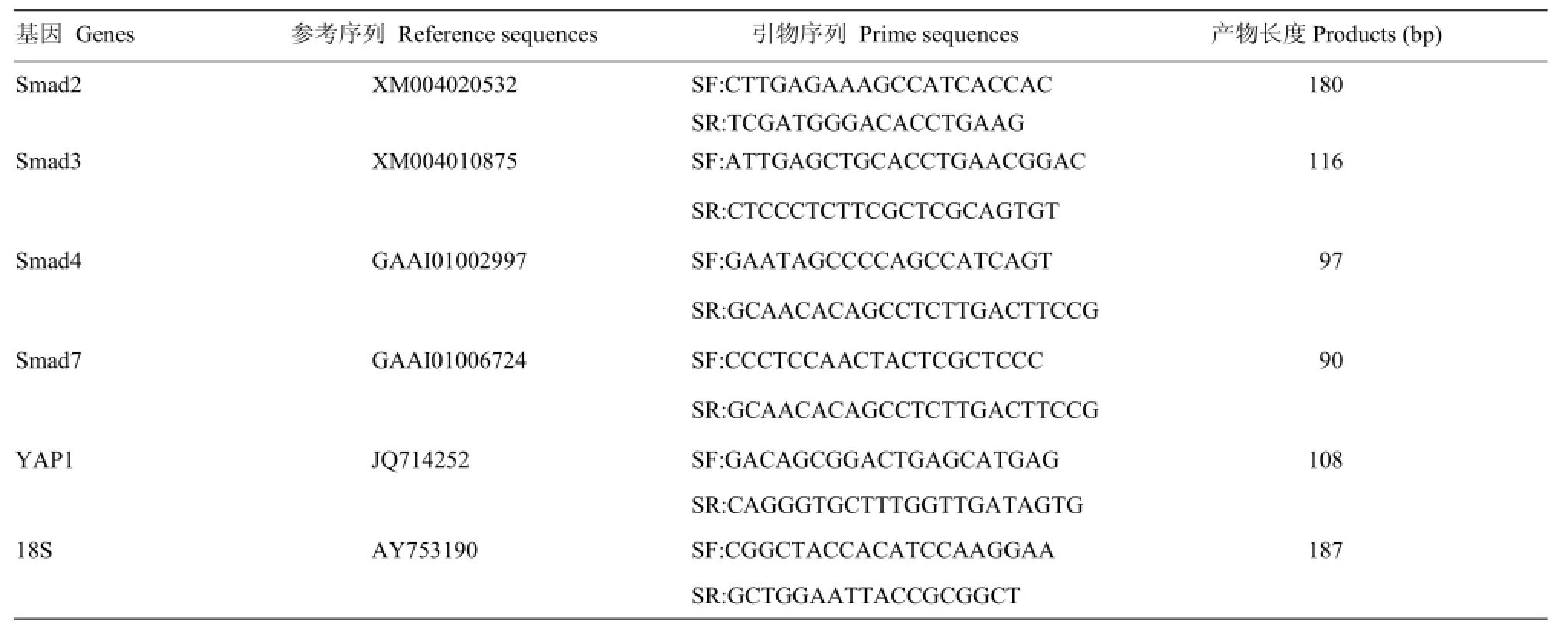
表1 绵羊Smads和18S rRNA基因q-PCR引物序列Table 1 Primer sequence of Smads and 18S rRNA genes of sheep for RT-PCR
1.5 cDNA第一链的合成
参照PrimeSYBR® RT Reagent Kit Perfect Real Time试剂盒说明书对总RNA进行反转录,反应体系为 10 μL,包括:总 RNA 0.5 μL(100 ng·μL-1),PrimerScript Buffer 2 μL,Oligo dT 0.5 μL,Random 6 mers 0.5 μL,PrimerScript RT Enzyme Mix I 0.5 μL,RNase free H2O 补至10 μL。37℃反应15 min后,85℃变性5 s。
1.6 Q-PCR检测
将合成的cDNA产物做10倍浓度梯度稀释,使用ABI7500型荧光定量PCR仪进行定量分析。用18S(真核)作为内参基因。按照 SYBR GreenI 试剂盒(TaKaRa公司)推荐的体系,在其他条件相同的情况下,对退火温度(53—63℃)和引物浓度进行优化,然后以优化的退火温度、引物浓度进行试验。20 μL反应体系包括:上、下游引物各0.8 μL(10 mmol·L-1),ROX Reference DyeⅡ 0.4 μL,H2O 7 μL,SYBR Green Realtime PCR Master Mix 10 μL,模板1 μL,混匀。反应条件:95℃ 30 s,95℃ 5 s,60℃ 34 s,40个循环。每个样品做3管平行试验。根据电脑自动分析荧光信号将其转换为Smad2、 Smad3、Smad4、Smad7、YAP1基因的起始拷贝数Ct值,根据各样品的Ct值,计算其起始模板拷贝数。
1.7 数据处理与统计分析
湖羊同月龄同组织不同性别、同性别同月龄不同组织以及同组织同性别不同月龄间的比较,均采用单因素方差分析(ANOVA)进行显著性分析。数据采用 2-ΔΔCt方法处理计算相对表达量,分析基因相对表达差异量。ΔCt=Ct(目的基因)-Ct(内参基因);湖羊同月龄同组织不同性别比较中ΔΔCt=ΔCt(公)-ΔCt(母);湖羊同性别同组织不同月龄比较中ΔΔCt=ΔCt(其他月龄)-ΔCt(2日龄);同月龄同性别不同组织比较中 ΔΔCt=ΔCt(趾长伸肌)-ΔCt(腓肠肌);2-ΔΔCt表示实验组目的基因的表达量相对于对照组的倍数。
2 结果
2.1 总RNA质量分析
提取总RNA通过1%琼脂糖凝胶电泳检测,显示清晰的28S和18S条带,核酸蛋白分析仪检测,A260/ A280≥1.8,提示RNA完整性和质量较好(图1)。

图1 总RNA琼脂糖凝胶电泳图Fig.1 The agarose gel electrophoresis figure of total RNA
2.2 Smads基因在绵羊肌肉中的时空表达分析
2.2.1 Smads基因在湖羊同月龄、同性别、不同肌肉组织中的时空表达分析 由图2可以看出,Smads在湖羊趾长伸肌中的表达量低于腓肠肌。由图2-Ⅰ可以看出,各月龄公、母羊中Smad2在肌肉组织中的表达量之间差异不显著(P>0.05);由图2-Ⅱ可以看出,2日龄、2月龄公母羊中Smad3的表达量无显著差异(P>0.05)。6月龄的母羊中,Smad3在腓肠肌和趾长伸肌中表达量存在显著差异(P<0.05);由图 2-Ⅲ可以看出,各月龄公、母羊中Smad4在肌肉组织中的表达量之间无显著性差异(P>0.05);由图2-Ⅳ可以看出,2月龄公母羊中Smad7的表达量无显著性差异(P>0.05)。2日龄的母羊和6月龄的公羊中,Smad7在腓肠肌和趾长伸肌中表达量存在极显著差异(P<0.01)。
2.2.2 Smads基因在湖羊同组织、同性别、不同生长阶段的时空表达分析 由图3可以看出,随着月龄的增加,Smad2的表达总体上呈现先降低后增加的趋势。由图 3-Ⅰ可以看出,Smad2表达量除在公羊腓肠肌中不同生长阶段间的差异极显著外(P<0.01),在公、母羊其他肌肉组织中均无显著差异(P>0.05);由图3-Ⅱ可以看出,公、母羊肌肉组织Smad3的表达量在 2日龄与 2月龄间均存在显著或极显著差异(P<0.05);由图3-Ⅲ可以看出,公、母羊肌肉组织中Smad4的表达量在2月龄与6月龄间差异均不显著(P>0.05);由图3-Ⅳ可以看出,Smad7在 6月龄的表达量高于其他生长阶段。公、母羊肌肉组织中Smad7的表达量在2日龄和2月龄的差异均不显著(P>0.05)。
2.2.3 Smads基因在湖羊同组织、同月龄、不同性别的时空表达分析 由图4-Ⅰ可以看出,各生长阶段肌肉组织中 Smad2表达量在公、母羊间的差异不显著(P>0.05);由图4-Ⅱ可以看出,Smad3表达量除在2月龄趾长伸肌中存在显著差异外(P<0.05),在其他生长阶段肌肉组织中的差异不显著(P>0.05);由图4-Ⅲ可以看出,6月龄腓肠肌中Smad4在公、母羊间存在极显著差异(P<0.01);其他生长阶段肌肉组织中,Smad4表达量在公、母羊间无显著差异(P>0.05);由图 4-Ⅳ可以看出,各生长阶段肌肉组织中 Smad7的表达量在公、母羊间无显著性差异(P>0.05)。
2.3 Smads与YAP1基因表达的关联分析
由表2可以看出,在2日龄腓肠肌中,Smad2的表达与Smad3、Smad4、Smad7存在极显著正相关(P <0.01);Smad3的表达与Smad4、Smad7存在极显著正相关(P<0.01);Smad4的表达与Smad7存在极显著正相关(P<0.01);Smad2、Smad3、Smad4 、Smad7的表达与YAP1相关不显著(P>0.05)。
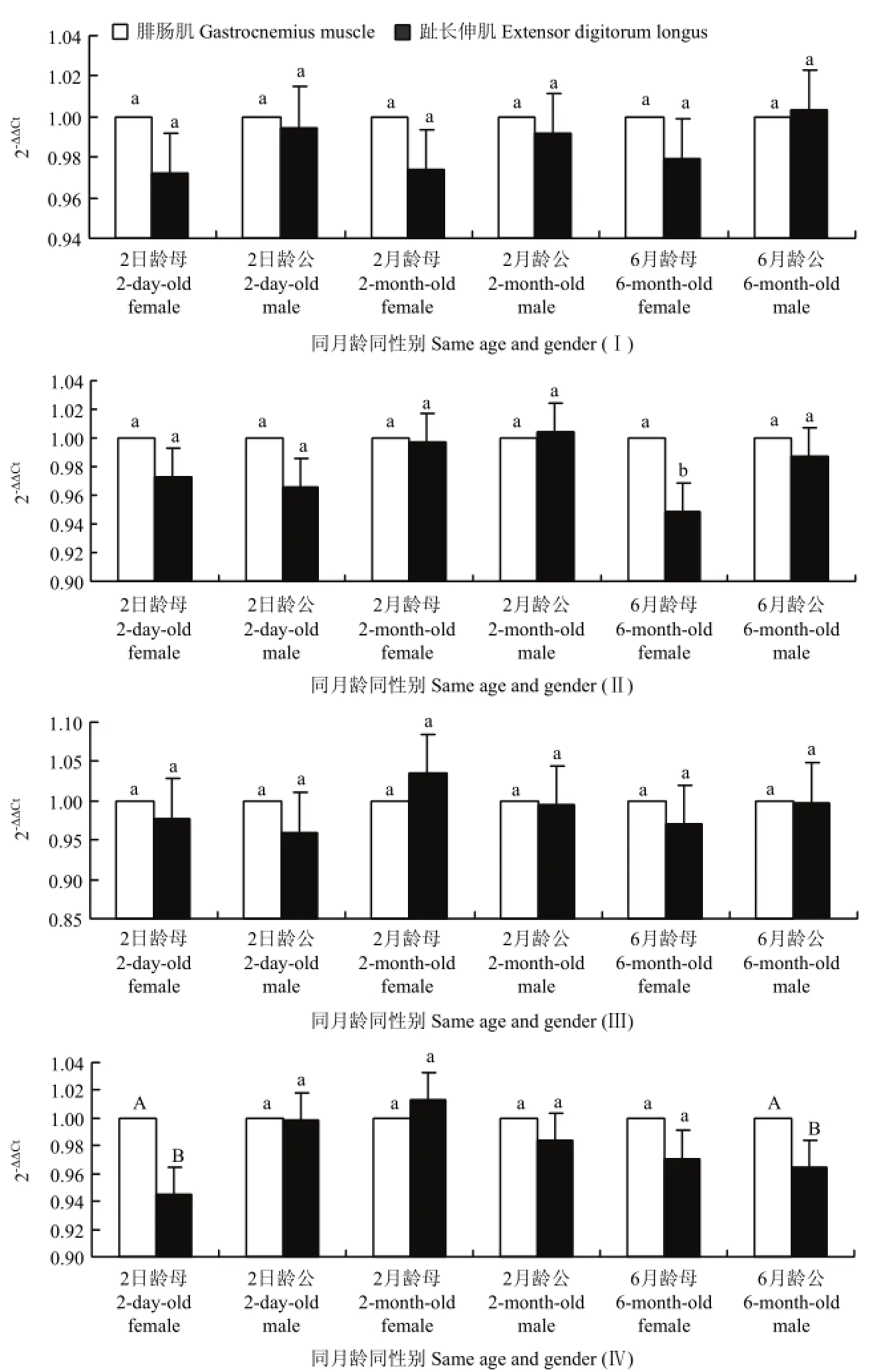
Ⅰ-Smad2;Ⅱ- Smad3;Ⅲ-Smad4;Ⅳ-Smad7。A、B、C、a、b、c系列的字母表示多重比较结果;相同字母表示差异不显著,不同小写字母表示差异显著,不同大写字母表示差异极显著。下同Ⅰ-Smad2; Ⅱ- Smad3; Ⅲ-Smad4; Ⅳ-Smad7. A, B, C, a, b, c show the results of multiple comparison. The same letters are no significant different (P>0.05),the values with different letters are significant different (0.01<P<0.05), the values with different capitals are extremely significant different (P<0.01). The same as below图2 湖羊Smads基因在不同肌肉组织中表达的差异比较Fig. 2 The comparison of sheep Smads different expressions in different muscles
由表3可以看出,在2月龄腓肠肌中,Smad2的表达与Smad3、Smad7、YAP1存在显著正相关(P<0.05);Smad3的表达与Smad7存在极显著正相关(P <0.01);Smad3、Smad4、Smad7的表达与YAP1相关不显著(P>0.05)。
由表4可以看出,在6月龄腓肠肌中,Smad2的表达与Smad3存在极显著正相关(P<0.01);Smad3的表达与Smad4存在极显著正相关(P<0.01);Smad2、Smad3、Smad4、Smad7的表达与YAP1相关不显著(P>0.05)。
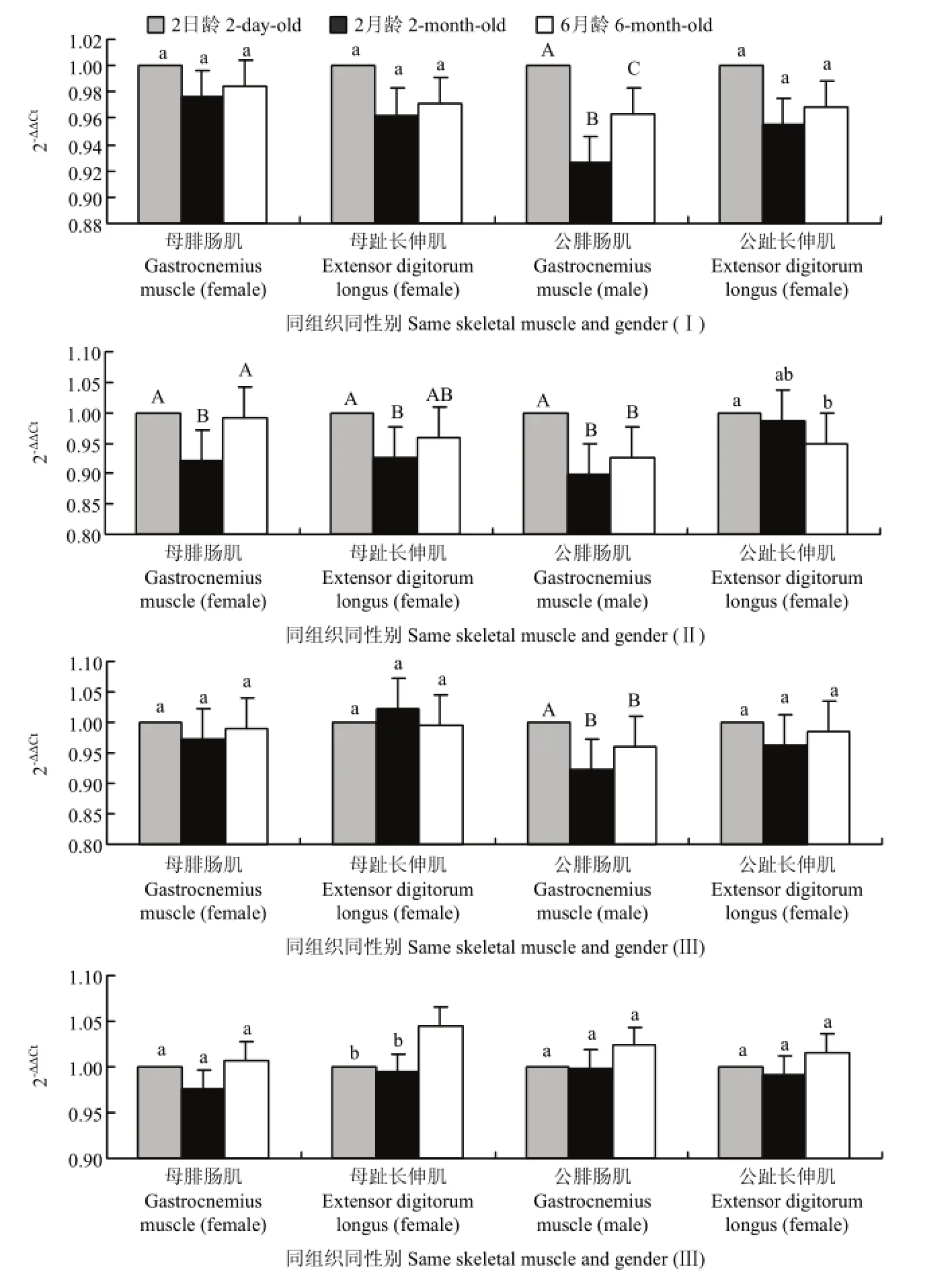
图3 湖羊Smads基因在不同生长阶段表达的差异比较Fig. 3 The comparison of sheep Smads different expressions at different growth stages
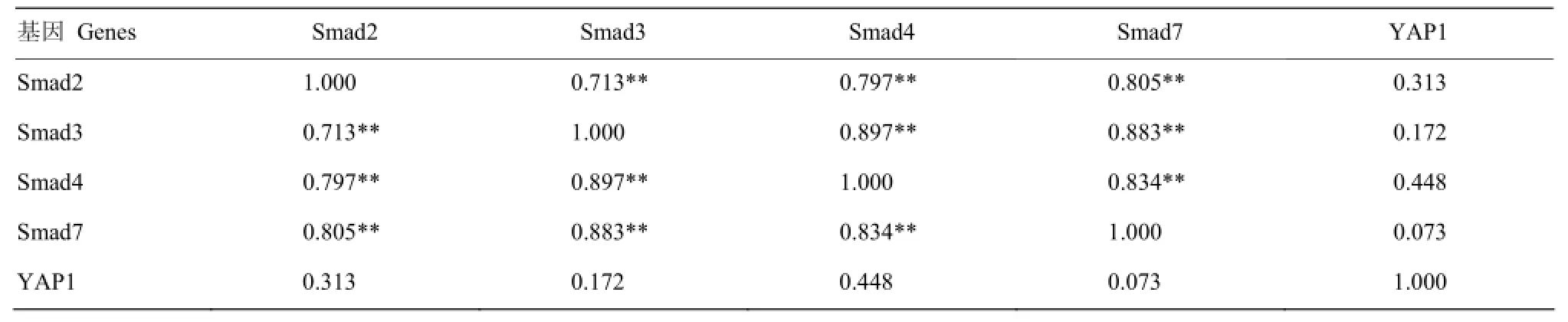
表2 Smads与YAP1基因在2日龄腓肠肌中表达的相关分析Table 2 Correlation of Smads and YAP1 genes expression in gastrocnemius muscle of 2-day-old
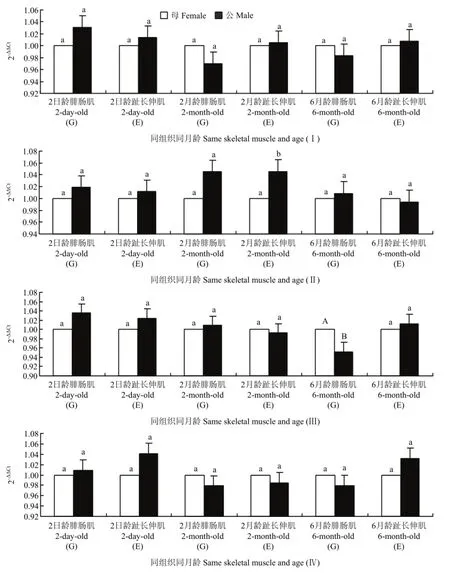
图4 湖羊Smads基因在不同性别表达的差异比较Fig. 4 The comparison of sheep Smads different expression in different sex
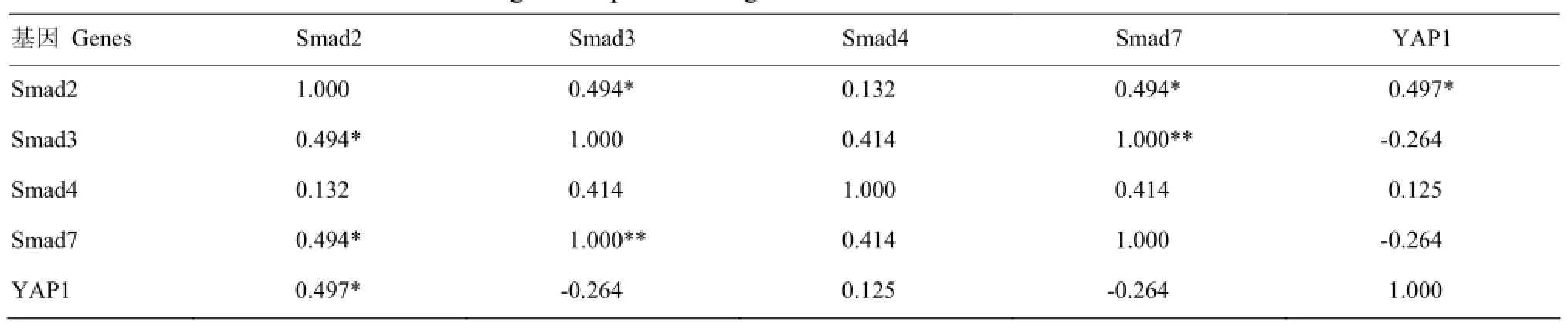
表3 Smads与YAP1基因在2月龄腓肠肌中表达的相关分析Table 3 Correlation of Smads and YAP1 genes expression in gastrocnemius muscles of 2-month-old
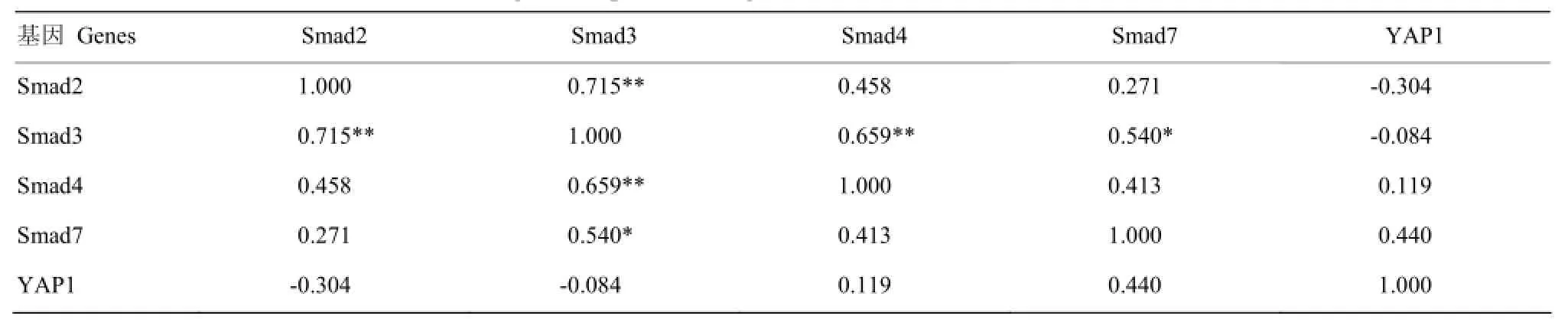
表4 Smads与YAP1基因在6月龄腓肠肌中表达的相关分析Table 4 Correlation of Smads and YAP1 genes expression in gastrocnemius dorsi muscles of 6-month-old
由表5可以看出,在腓肠肌中,Smad2的表达与Smad3、Smad4、Smad7存在极显著正相关(P<0.01);Smad3的表达与Smad4、Smad7存在极显著正相关(P <0.01),与 YAP1存在极显著负相关(P<0.01);Smad4与Smad7存在极显著正相关(P<0.01),Smad2、 Smad4、Smad7的表达与YAP1相关不显著(P>0.05)。
由表6可以看出,在2日龄趾长伸肌中,Smad2的表达与Smad3、Smad4、Smad7存在极显著正相关(P<0.01);Smad3的表达与Smad4、Smad7、YAP1存在极显著正相关(P<0.01);Smad4与Smad7存在极显著正相关(P<0.01);Smad2、Smad4、Smad7的表达与YAP1存在显著正相关(P<0.05)。
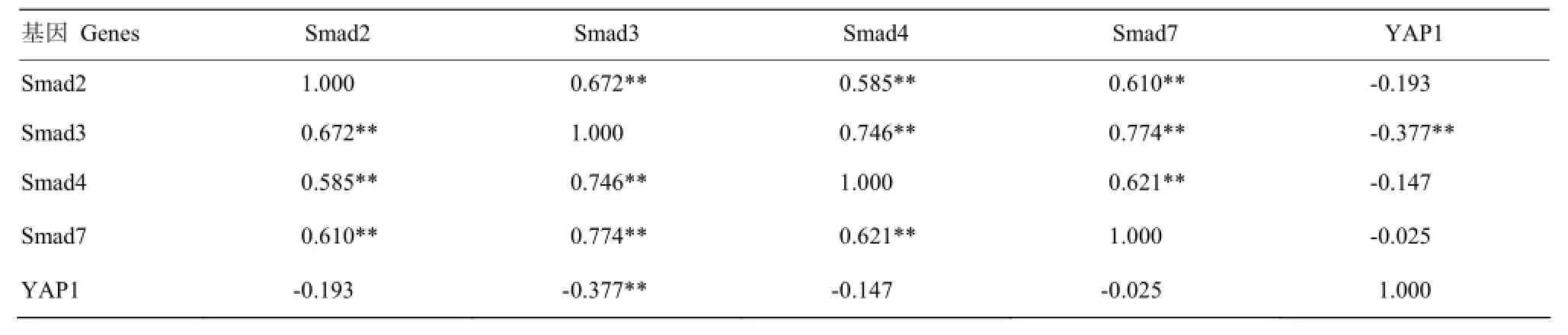
表5 Smads与YAP1基因在腓肠肌中表达的相关分析Table 5 Correlation of Smads and YAP1 genes expression in gastrocnemius muscle
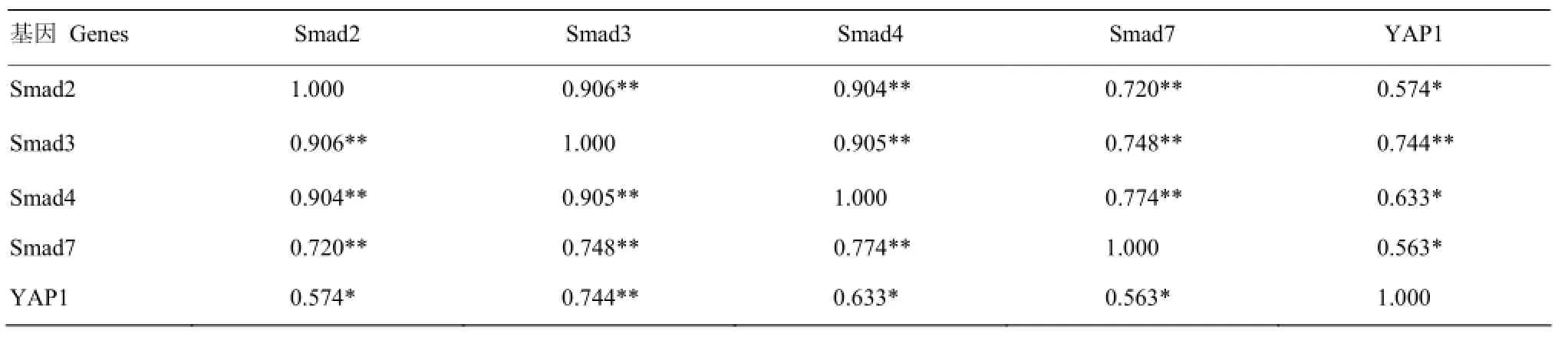
表6 Smads与YAP1基因在2日龄趾长伸肌中表达的相关分析Table 6 Correlation of Smads and YAP1 genes expression in extensor digitorum longus of 2-day-old
由表7可以看出,在2月龄趾长伸肌中,Smad2的表达与Smad3、Smad4 、Smad7存在极显著正相关(P<0.01);Smad3的表达与Smad7存在极显著正相关(P<0.01);Smad2、Smad3、Smad4、Smad7的表达与YAP1相关不显著(P>0.05)。
由表8可以看出,在6月龄趾长伸肌中,Smad2的表达与Smad3、Smad4存在极显著正相关(P<0.01);Smad3的表达与Smad4存在极显著正相关(P<0.01);Smad7与YAP1存在极显著正相关(P<0.01);Smad2、Smad3、Smad4的表达与YAP1相关不显著(P>0.05)。
由表9可以看出,在趾长伸肌中,Smad2的表达与Smad3、Smad4 、Smad7、YAP1存在极显著正相关(P<0.01);Smad3的表达与Smad4、Smad7、YAP1存在极显著正相关(P<0.01);Smad4与 Smad7、YAP1存在极显著正相关(P<0.01);Smad7与YAP1存在极显著正相关(P<0.01)。
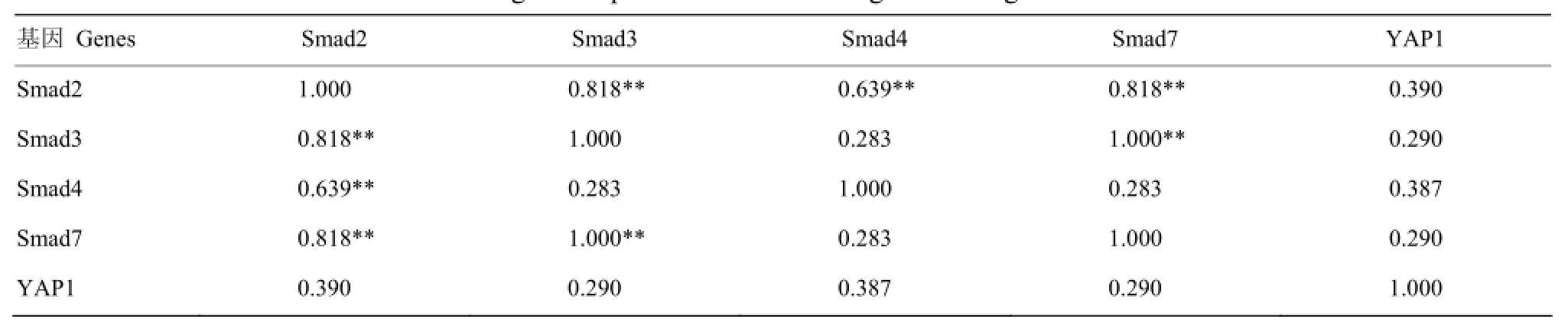
表7 Smads与YAP1基因在2月龄趾长伸肌中表达的相关分析Table 7 Correlation of Smads and YAP1 genes expression in extensor digitorum longus of 2-month-old
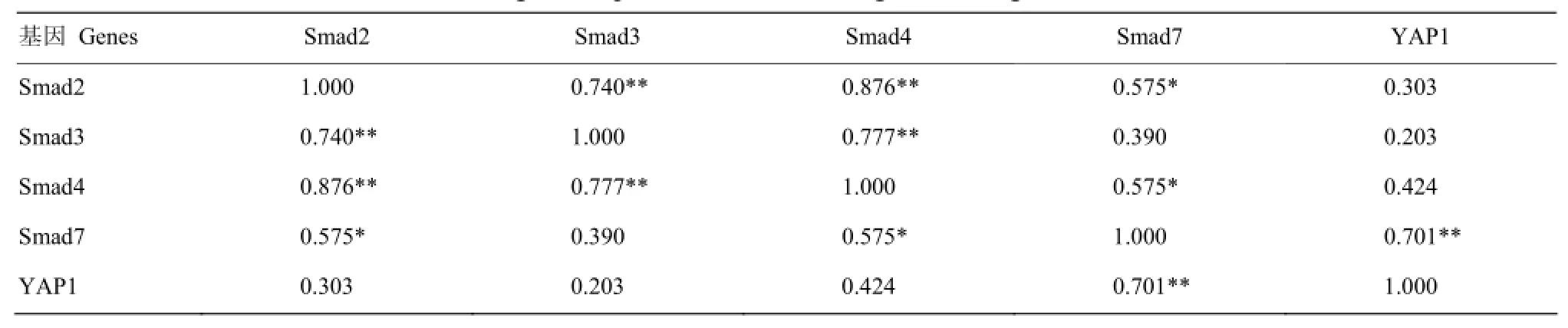
表8 Smads与YAP1基因在6月龄趾长伸肌中表达的相关分析Table 8 Correlation of Smads and YAP1 genes expression in extensor digitorum longus of 6-month-old
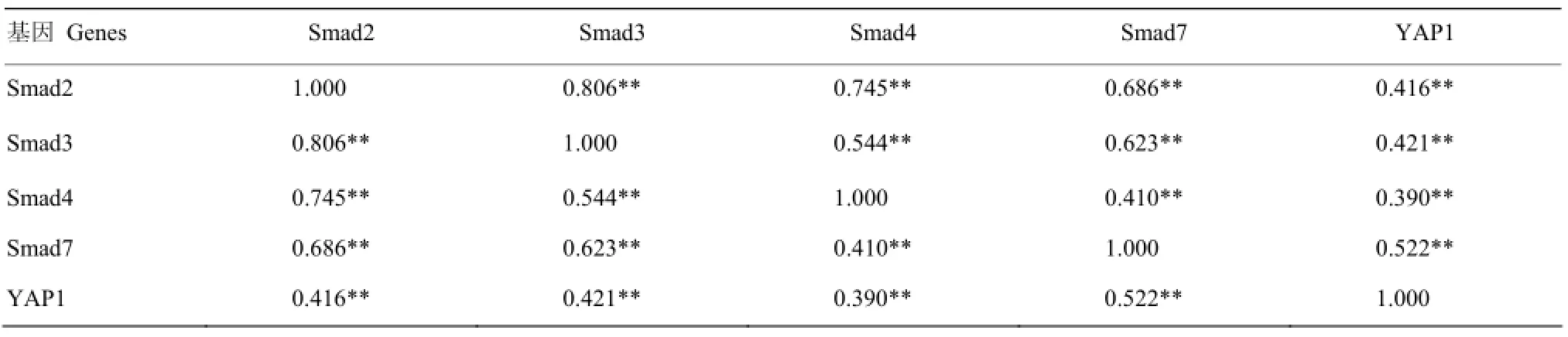
表9 Smads与YAP1基因在趾长伸肌中表达的相关分析Table 9 Correlation of Smads and YAP1 genes expression in extensor digitorum longus
3 讨论
转化生长因子 β(transforming growth factor-β,TGF-β)通过胞内信号分子Smads 蛋白转导信号,调节着骨骼肌的生长发育。研究发现 TGF-β/myostatin信号通路调节着羊、牛等所有哺乳动物体骨骼肌的生长发育、损伤再生以及运动生理等[18-19]。Hippo-YAP1信号通路中 YAP1作为转录共激活因子,可以与Smad7结合,参与SMADs蛋白的转录,从而对TGF-β参与的信号通路产生影响[20-22]。
TGF-β受体及受体底物 SMADs蛋白家族构成了 TGF-β/Smad通路。TGF-β与受体TGF-β-RⅡ结合后激活TGF-β-RⅠ受体,使Smad2、Smad3蛋白发生磷酸化;磷酸化Smad2和Smad3蛋白与Smad4形成异源复合物进入细胞核,通过与转录因子、共同抑制或激活因子相互作用调节靶基因的转录;Smad7是Ⅰ型受体的拮抗蛋白,可以与TGF-β-RⅠ牢固结合,阻止Smad2、Smad3磷酸化的发生,使TGF-β对目标基因的转录起到负反馈调节的作用[21,23],该通路通过调节细胞的增殖、分化、黏附、迁移及凋亡而在生物整体及各种器官的发育过程中起重要的作用[24]。
本研究通过对Smads家族部分基因在湖羊不同骨骼肌组织中的表达趋势及其与肌肉生长候选基因YAP1的表达关联分析,探索YAP1在调节湖羊肌肉发育中所起的作用。
3.1 湖羊肌肉TGF-β/smad信号通路中Smads基因时空表达规律
Nakao等研究发现Smad2、Smad3、Smad4能够有效参与TGF-β通道的信号转导,同时还发现Smad7 在 TGF-β通路中起一定的拮抗作用[21,25]。徐业芬[26]研究发现Smad2、Smad4、Smad7除在湖羊母羊卵巢、子宫、输卵管等生殖器官有表达外,在肌肉组织中也有表达,这与本文的研究结果一致。GOLDSTEIN[27]在以小鼠为对象研究TGF-β通路中Smad信号对肌肉萎缩的作用时,发现降低Smad4信号后,小鼠在12周龄时的体重和胫骨长度显著增加(P<0.05),股四头肌肌纤维平均直径更大(P<0.001)。COHEN等[28]研究发现在 TGF-β通道缺乏 Smad7时上调Smad2、Smad3信号会抑制肌肉生长,并认为Smad7是引起肌肉紊乱的原因。本研究中 Smads在腓肠肌(Ⅱ型纤维为主)中的表达高于趾长伸肌(Ⅱ型纤维为主),可能与这两种肌肉分属不同部位有关;Smad2、Smad3、Smad4均在2日龄的表达量高于其他月龄,而Smad7在2日龄的表达量低于6月。从这些研究结果中可以看出TGF-β信号通路中 Smads基因可在肌肉组织有效地进行表达。
3.2 湖羊肌肉TGF-β/smad信号通路中Smads、YAP1基因表达相关性
DROGURTT[23]研究发现虽然肌肉通常在 TGF-β通道的环境中形成,但是骨骼肌分化也受到TGF-β信号通路的强烈抑制,Smad2、Smad3、Smad4与抑制型Smad7在表达水平上没有差异,相反 TGF-β-RⅠ和TGF-β-RⅡ在骨骼肌分化过程中增加了,同时指出下调Smad蛋白及其TGF-β受体信号对于骨骼肌分化是及其重要的。FERRIGNO[15]在研究中发现,YAP1增强了Smad7与其关联性,促进Smad7对TGF-β-RⅠ的活化,Smad7对TGF-β信号转导通道的抑制活性也可被YAP1所加强。而GUO[29]用免疫组化法研究胰腺导管腺癌发现YAP65与Smad7或Smad4变异之间不存在相关。SUN[30]研究发现YAP1基因的表达与磷酸化Smad3的表达呈负相关,可促进肿瘤干细胞的增殖分化;在敲除小鼠YAP1基因后,乳腺肿瘤干细胞生长频率下降 200倍以上(P<0.01),并得出结论YAP1基因通过抑制Smad3信号促进乳腺肿瘤干细胞的增殖分化。本研究发现在湖羊腓肠肌Hippo通道中YAP1可能通过调控TGF-β/smad通路中Smad3的表达进行负反馈调节;在趾长伸肌中,Smad家族(Smad2、Smad3、Smad4、Smad7)的表达与YAP1存在极显著正相关(P<0.01),进一步说明在这两种不同肌肉组织中,YAP1可通过参与调控TGF-β/smad通路中Smads的表达来参与肌肉的增殖和分化过程。
4 结论
不同组织、生长阶段以及性别因素均可影响Smads在肌肉中的表达。在湖羊这两种不同肌肉组织中,Hippo通道中YAP1基因可通过参与调控TGF-β/smad通路而参与肌肉的增殖和分化过程。
References
[1] OVERHOLTZER M, ZHANG J, SMOLEN G A, MUIR B, LI W,SGROI D C, DENG C X, BRUGGE J S, HABER D A. Transforming properties of YAP, a candidate oncogene on the chromosome 11q22 amplicon. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(33):12405-12410.
[2] 史梦婕, 邵松军, 李洁媚, 周艳芳, 黄培春. Hippo通路与肿瘤相关性研究进展. 中国细胞生物学学报, 2014, 36(3):361-365. SHI M J, SHAO S J, LI J M, ZHOU Y F, HUANG P C. The advances in Hippo pathway association with cancer. Chinese Journal of Cell Biology, 2014, 36(3):361-365.(in Chinese)
[3] 张靖, 朱金水. Hippo-YAP信号通路与胃癌相关性研究. 国际消化病杂志, 2011, 31(4):207-215. ZHANG J, ZHU J S. The advances in Hippo signaling pathway association with gastric cancer. International Journal of Digestive Disease, 2011, 31(4):207-215.(in Chinese)
[4] NGUYEN L T, TRETIAKOVA M S, SILVIS M R, LUCAS J,KLEZOVITCH O, COLEMAN I, BOLOURI H, KUTYAVIN V I,MORRISSEY C, TRUE L D, NELSON P S, VASIOUKHIN V. ERG activates the YAP1 transcriptional program and induces the development of age-related prostate tumors. Cancer Cell, 2015, 27(6):797-808.
[5] MELFI S, COLCIAGO A, GIANNOTTI G, BONALUME V,CAFFINO L, FUMAGALLI F, MAGNAGHI V. Stressing out the Hippo/YAP signaling pathway: toward a new role in Schwann cells. Cell Death and Disease, 2015, 6:e1915. doi: 10.1038/cddis.2015.291.
[6] CAO X, PFAFF S L, GAGE F H. YAP regulates neural progenitor cell number via the TEA domain transcription factor. Genes and Development, 2008, 22(23):3320-3334.
[7] PLOUFFE S W, HONG A W, GUAN K L. Disease implications of the Hippo/YAP pathway. Trends in Molecular Medicine, 2015, 21(4):212-222.
[8] MOUSTAKAS A, SOUCHELNYTSKYI S, HELDIN C H. Smad regulation in TGF-beta signal transduction. Journal of Cell Science,2001, 114(Pt 24):4359-4369.
[9] XU P, LIU J, DERYNCK R. Post-translational regulation of TGF-β receptor and Smad signaling. Febs Letters, 2012, 586(14):1871-1884.
[10] MOUSTAKAS A, HELDIN C H. The regulation of TGFbeta signal transduction. Development, 2009, 136(22):3699-3714.
[11] WAKEFIELD L M, HILL C S. Beyond TGFβ: roles of other TGFβsuperfamily members in cancer. Nature Reviews Cancer, 2013, 13(5):328-341.
[12] IKUSHIMA H, MIYAZONO K. TGFbeta signalling: a complex web in cancer progression. Nature Reviews Cancer, 2010, 10(6):415-424.
[13] YAN X, LIAO H, CHENG M, SHI X, LIN X, FENG X H, CHEN Y G. Smad7 protein interacts with Receptor regulated Smads (R-Smads)-Smads to inhibit transforming growth factor-β(TGF-β)/Smad signaling. Journal of Biological Chemistry, 2016, 291: 382-392.
[14] LÖNN P, MORÉN A, RAJA E, DAHL M, MOUSTAKAS A. Regulating the stability of TGFbeta receptors and Smads. Cell Research, 2009, 19(1):21-35.
[15] FERRIGNO O, LALLEMAND F, VERRECCHIA F, L'HOSTE S,CAMONIS J, ATFI A, MAUVIEL A. Yes-associated protein (YAP65)interacts with Smad7 and potentiates its inhibitory activity against TGF-β/Smad signaling. Oncogene, 2002, 21(32):4879-4884.
[16] SCHILD L, LU Y, GAUTSCHI I, SCHNEEBERGER E, LIFTON R P, ROSSIER B C. Identification of a PY motif in the epithelial Na channel subunits as a target sequence for mutations causing channel activation found in Liddle syndrome. EMBO Journal, 1996, 15(10):2381-2387.
[17] 孙伟, 李达, 苏锐, 马月辉, 关伟军, 张有法, 陈玲, 吴文忠, 周洪.绵羊YAP1 基因全长cDNA 克隆及生物信息学分析. 中国农业科学, 2013, 46(8):1725-1735. SUN W, LI D, SU R, MA Y H, GUAN W J, ZHANG Y F, CHEN L,WU W Z, ZHOU H. Cloning and bioinformatics analysis of fulllength cDNA sequence of YAP1 gene in sheep. Scientia Agricultura Sinica, 2013, 46(8):1725-1735.(in Chinese)
[18] KOLLIAS H D, MCDERMOTT J C. Transforming growth factor-beta and myostatin signaling in skeletal muscle. Journal of Applied Physiology, 2008, 104(3):579-587.
[19] NAKAMURA R, KAYAMORI K, OUE E, SAKAMOTO K,HARADA K, YAMAGUCHI A. Transforming growth factor-β synthesized by stromal cells and cancer cells participates in bone resorption induced by oral squamous cell carcinoma. Biochemical and Biophysical Research Communications, 2015, 458(4):777-782.
[20] FUJII M, TOYODA T, NAKANISHI H, YATABE Y, SATO A,MATSUDAIRA Y, ITO H, MURAKAMI H, KONDO Y, KONDO E,HIDA T, TSUJIMURA T, OSADA H, SEKIDO Y. TGF-β synergizes with defects in the Hippo pathway to stimulate human malignant mesothelioma growth. Journal of Experimental Medicine, 2012,209(3): 479-494.
[21] NAKAO A, AFRAKHTE M, MORÉN A, NAKAYAMA T,CHRISTIAN J L, HEUCHEL R, ITOH S, KAWABATA M, HELDIN N E, HELDIN C H, TEN DIJKE P. Identification of Smad7, a TGF beta-inducible antagonist of TGF-beta signaLling. Nature, 1997,389(6651):631-635.
[22] BEPPU H. Smad7-modified alleles by various gene-targeting strategies. Journal of Biochemistry, 2013, 153(5):399-401.
[23] DROGUETT R, CABELLO-VERRUGIO C, SANTANDER C,BRANDAN E. TGF-beta receptors, in a Smad-independent manner,are required for terminal skeletal muscle differentiation. Experimental Cell Research, 2010, 316(15):2487-2503.
[24] FOURNIER P G, JUÁREZ P, JIANG G, CLINES G A, NIEWOLNA M, KIM H S, WALTON H W, PENG X H, LIU Y, MOHAMMAD K S, WELLS C D, CHIRGWIN J M, GUISE T A. The TGF-β signaling regulator PMEPA1 suppresses prostate cancer metastases to bone. Cancer Cell, 2015, 27(6):809-821.
[25] NAKAO A, IMAMURA T, SOUCHELNYTSKYI S, KAWABATA M,ISHISAKI A, OEDA E, TAMAKI K, HANAI J, HELDIN CH,MIYAZONO K, TEN DIJKE P. TGF-beta receptor-mediated signalling through Smad2, Smad3 and Smad4. EMBO Journal, 1997,16(17): 5353-5362.
[26] 徐业芬. Smad信号转导通路相关基因表达与湖羊高繁殖力关系的研究[D]. 南京: 南京农业大学, 2010. XU Y F. Gene expressions related to smad sigenaling molecule and its relationship with fecundity in Hu sheep[D]. Nanjing: Nanjing Agricultural University, 2010.(in Chinese)
[27] GOLDSTEIN J A, BOGDANOVICH S, BEIRIGER A, WREN L M,ROSSI A E, GAO Q Q, GARDNER B B, EARLEY J U,MOLKENTIN J D, MCNALLY E M. Excess SMAD signaling contributes to heart and muscle dysfunction in muscular dystrophy. Human Molecular Genetics, 2014, 23(25):6722-6731.
[28] COHEN T V, KOLLIAS H D, LIU N, WARD C W, WAGNER K R. Genetic disruption of Smad7 impairs skeletal muscle growth and regeneration. Journal of Physiology, 2015, 593(11):2479-2497.
[29] GUO J, KLEEFF J, ZHAO Y, LI J, GIESE T, ESPOSITO I,BÜCHLER M W, KORC M, FRIESS H. Yes-associated protein (YAP65) in relation to Smad7 expression in human pancreatic ductal adenocarcinoma. International Journal of Molecular Medicine, 2006,17(5):761-767.
[30] SUN J G, CHEN X W, ZHANG L P, WANG J, DIEHN M. Yap1 promotes the survival and self-renewal of breast tumor initiating cells via inhibiting Smad3 signaling. Oncotarget, 2015, doi: 10.18632/ oncotarget.6655.
(责任编辑 林鉴非)
The Temporal and Spatial Expression and Correlation Analysis of Smads and YAP1 Gene in the Hippo Pathway in Sheep Muscle Tissue
BAO Jian-jun1, SU Rui1, WANG Qing-zeng1, LÜ Xiao-yang1, GAO Wen1, YU Jia-rui1, WANG Li-hong1,CHEN Ling2, WU Wen-zhong2, SHENG Shui-xing2, ZHOU Hong3, SUN Wei1, DAI Guo-jun1
(1Animal Science and Technology College, Yangzhou University, Yangzhou 225009, Jiangsu;2Animal Science and Veterinary Medicine Bureau of Suzhou, Suzhou 215200, Jiangsu;3Forestation, Herding, Fishing Bureau of Suining Country of Xuzhou, Suining 221200, Jiangsu)
Abstract:【Objective】 In order to explore the expression pattern and inner connection between the different genes, the mRNA expression level was used to detect the spatial and temporal expression of genes in TGF-β/Smad signaling pathway of sheep muscle tissue. 【Method】 In this study, q-PCR was used to detect relative expression of Smads genes and Yes-associated protein 1(YAP1) in 2 different skeletal muscles (i.e., gastrocnemius muscle, extensor digitorum longus) and 3 different growth stages (i.e., 2-day-old, 2 and 6-month-old) of Hu Sheep, and analyze the relative expression between Smads(Smad2, Smad3, Smad4 and Smad7) and YAP1. 【Result】The results of the spatial and temporal expression of Smads in TGF-β/Smad signaling pathway showed that the expression of Smads in extensor digitorum longus were lower than in gastrocnemius muscle, which may be related to two different parts of the skeletal muscle. The expression of Smad2, Smad3 and Smad4 genes in the 2-day-old were higher than other growth stages, and Smad7 gene expression in the 2-day-old was lower than 6-month-old, and the expression in 2-month-old was the lowest. The expressions of Smads gene of ram in the 2-day-old was higher than ewe, and the expressions of Smad2, Smad4,and Smad7 genes of ram in 2-month-old and 6-month-old were lower than the ewe in 2-day-old, the expression of Smad3 gene of ram in 3 growth stages were higher than ewe. The correlation expression of Smads gene and YAP1 gene in TGF-β/smad signaling of sheep muscle was found that there was no significant correlation in 2-day-old of gastrocnemius muscle between YAP1 and smads (P>0.05) . The expression between YAP1 and Smad2 had a significant positive correlation (P<0.05) and the correlation of the expression between YAP1 and other Smads was not significant in 2-month-old of gastrocnemius muscle (P>0.05). There was a significant negative correlation between YAP1 and Smad3 in different growth stages of gastrocnemius muscle(P<0.01). YAP1 expression exhibited a high positive correlation with Smad3 and the expression of YAP1 with the others was significantiy correlated in extensor digitorum longus of 2-month-old (P<0.05). There was no significant correlation between YAP1 and Smads in 2-month-old of extensor digitorum longus (P>0.05). The expression between YAP1 and Smad7 had a high significant positive correlation (P<0.01) and the correlation of expression between YAP1 and other Smads was not significant in 6-month-old of extensor digitorum longus (P>0.05). There were highly significant negative correlations between YAP1 and Smads in different growth stages of extensor digitorum longus (P<0.01). 【Conclusion】 It was suggested that different tissues, growth stages and gender could affect the expression of Smads in muscle. YAP1 of Hippo pathway may participate in regulating the TGF-β/smad pathway and the process of muscle proliferation and differentiation in gastrocnemius muscle and extensor digitorum longus of Hu sheep.
Key words:Hu sheep; Smads; YAP1; Hippo pathway; TGF-β pathway
收稿日期:2015-12-03;接受日期:2016-03-18
基金项目:江苏省农业科技支撑计划(BE2012331)、江苏省工程技术研究中心项目(BM2012308)、科技部家养动物平台项目、江苏高校优势学科建设工程资助项目、国家星火计划重点项目(2012GA690003)、江苏省苏北科技计划(BN2014003,BN2015013,BN2015014)、江苏省农业科技自主创新项目(CX(14)2073)、江苏省研究生科研创新计划(KYLX15_1375)

