植物青枯菌LAMP检测方法的建立
黄 雯,徐 进,张 昊,许景升,丁 伟,冯 洁
(1西南大学植物保护学院,重庆 400716;2中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京 100193)
植物青枯菌LAMP检测方法的建立
黄雯1,2,徐进2,张昊2,许景升2,丁伟1,冯洁2
(1西南大学植物保护学院,重庆 400716;2中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京 100193)
摘要:【目的】由茄科雷尔氏菌(Ralstonia solanacearum,简称青枯菌)引起的青枯病(bacterial wilt of plants)是世界范围内危害最为严重的土传细菌病害之一,严重制约了多种经济作物的生产。建立高效、精准的早期诊断技术,是实现青枯病有效防控的基础。论文旨在建立一种能够特异检测青枯菌的环介导等温扩增方法(loop-mediated isothermal amplification, LAMP),实现青枯菌的田间快速检测。【方法】通过比对分析青枯菌的lpxC基因序列,并利用在线引物设计软件Primer Explorer Version 4.0得到4条LAMP特异性引物,F3(5′-CCTGTACGTGGTCGGCTAT-3′)、B3(5′-ACCGCAACACGGGATCA-3′)、FIP(5′-TACGCCGTTTCATCGGCCAGGTACACGGCGCACAAGT -3′)、BIP(5′-ATCGTCACGTTCGACAAGGTGGAATGCCGGCTGCAACTG-3′)。通过单因素变化试验对LAMP反应体系中的各参数进行优化,设置反应温度为60、61、62、63、64、65℃,设置镁离子浓度为2、4、6、8、10、12 mmol·L-1,设置内外引物浓度比为2∶1、4∶1、6∶1、8∶1、10∶1、12∶1,确定最优反应体系。以分离自不同寄主的24个青枯菌株为参试对象,5个非青枯菌株(Ralstonia mannitolilytica、Ralstonia pickettii、Enterobacter sp.、Acidovorax citrulli、Burkhoderia cepacia)为对照,验证LAMP检测方法的特异性。将青枯菌GMI1000菌株的基因组DNA进行10倍梯度系列稀释,以原液和101、102、103、104、105、106、107倍的稀释液为模板同步进行LAMP和普通PCR检测,比较两者的检测灵敏度。将马铃薯青枯病菌株Po41、姜青枯病菌株Z-Aq-1分别与马铃薯块茎和生姜根茎组织悬浮液混合,以LAMP检测方法对混合物进行检测,并以同样方法对表现典型萎蔫症状的人工接种番茄植株和健康植株以及田间马铃薯罹病块茎样品进行检测。反应结果直接通过观察产生的白色焦磷酸镁沉淀情况进行判定,或通过加入1 μL SYBR GreenⅠ荧光染料进行观察,阳性样品为绿色,阴性样品为橙色。【结果】建立了特异性检测青枯菌的 LAMP方法,优化后确立了检测体系中 FIP/BIP与 F3/B3的浓度比为 8∶1(1.6∶0.2 μmol·L-1),镁离子浓度为6 mmol·L-1,反应温度为63℃。特异性检测结果显示,仅参试青枯菌反应管中的反应液呈现绿色,表明建立的检测体系具有高度特异性。以青枯菌GMI1000菌株的DNA原液及不同梯度的稀释液为模板进行的LAMP和普通PCR检测结果显示,LAMP的检测灵敏度为1.42 pg,比普通PCR高10倍。能够快速准确地从植物组织悬浮液、罹病番茄植物组织及田间罹病样品中检测到青枯菌。【结论】建立的青枯菌LAMP检测方法,高效特异,操作简单,无需复杂仪器,肉眼可直接观察检测结果,适合基层和现场检测。
关键词:青枯菌;检测;环介导等温扩增
联系方式:黄雯,E-mail:wenhuang224@126.com。通信作者丁伟,E-mail:dwing818@163.com。通信作者冯洁,E-mail:jfeng@ippcaas.cn
0 引言
【研究意义】植物细菌性青枯病(bacterial wilt of plants)是由茄科雷尔氏菌(Ralstonia solanacearum,简称青枯菌)引起的一种世界性重大病害。青枯菌的群体遗传结构复杂多样,具有广泛的寄主和生态适应性,可侵染54个科的450余种植物[1],除茄科和豆科等双子叶草本植物外,还包括桑树、桉树和木麻黄等双子叶木本以及香蕉和生姜等单子叶植物[2];生态适应性广泛,体现在其作为动因引起的病害遍及热带、亚热带、温带乃至中高纬度地区。作为土壤习居菌,青枯菌可于土壤、水体、病残以及隐症寄主中长期存活,成为翌年的初侵染来源。在疫区青枯病可通过地表径流、根际接触和农事操作等多种途径进行扩散传播,而带菌植物材料则是青枯病远距离传播的主要途径。已有明确的流行学证据表明香蕉青枯病通过繁殖材料球茎传入菲律宾和澳大利亚昆士兰州[3];马铃薯青枯病通过加工薯和天竺葵鲜切花材料分别传入欧洲和北美地区。因此,建立快速、高效、轻简的检测技术有助于控制青枯病的蔓延及重大损失的发生。【前人研究进展】目前常用的青枯菌检测方法主要基于平板划线分离、血清学检测和分子检测技术。1954年,KELMAN[4]报道了青枯菌野生型菌株在 TZC (2,3,5-triphenyl-2H-tetrazolium chloride)培养平板上的菌落形态与自发突变株和非靶标菌间差异,并藉此建立了青枯菌的半选择分离技术。但该方法费时费力,要求操作人员具备准确识别青枯菌菌落形态的能力;酶联免疫吸附法(ELISA)是检测植物青枯菌的常用方法,但其多克隆抗体缺乏足够的特异性[5];1988年,JANSE[6]创立了间接免疫荧光染色法(IFAS)用于检测青枯菌,特异性和灵敏度虽有了较大提高,但血清的制备过程耗时耗力,且存在交叉反应,易造成假阳性检测结果;1997年,OPINA等[7]基于随机扩增片段长度多态性(random amplified polymorphism,RAPD)的分析结果,锚定了青枯菌lpxC及其上游部分序列,设计的PCR扩增引物Au759f/760r,因其在青枯菌种水平鉴定上具有高度的特异性和广泛的通用性,因此被国内外相关研究者广为采用,然而该方法还需要通过琼脂糖凝胶电泳进行结果验证,不能实现青枯菌的快速检测;Real-time PCR 检测技术灵敏、可靠,但需要特殊的仪器进行反应温度的控制[8]。环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)是NOTOMI等[9]于2000年发明的一种可于特定恒温条件下,实现对靶标序列高效扩增的技术。KUBOTA等分别报道了基于鞭毛蛋白FliC编码基因保守区域的青枯LAMP检测方法[10-11]; LENARCIC等[12]报道了基于egl的青枯菌LAMP检测方法。【本研究切入点】现有的青枯菌检测方法在生产实践中的应用仍具相当的局限性,本研究在靶标序列的选择(青枯菌种特异性鉴定靶标lpxC)和扩增结果的判断(扩增结果直接通过肉眼观察由扩增副产物(白色焦磷酸镁沉淀)引起的浊度变化[13],或加入染料的颜色变化进行判定)上进行了改进。【拟解决的关键问题】建立青枯菌的LAMP检测方法,优化扩增体系和反应条件,验证方法的特异性、通用性和灵敏度,探寻病样快速检测的可行性,以期为青枯病的田间快速精准诊断、植物繁殖材料带菌检测以及病害防控效果评价提供技术支撑。
1 材料与方法
试验于2015年7月至2016年1月在中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室完成。
1.1 材料、试剂与仪器
接种青枯菌2号小种Po82菌株后的罹病番茄植株、健康的番茄植株、市售健康马铃薯、生姜、田间马铃薯罹病块茎样品;供试菌株:24个青枯菌株(表1)、5个对照菌株(表2)由笔者实验室分离、保存。

表1 用于检测引物特异性的青枯菌菌株Table 1 Different strains of R. solanacearum used in this study to test the specificity of these primers

表2 用于检测引物特异性的非青枯菌菌株Table 2 Different strains of non R. solanacearum used in this study to test the specificity of these primers
Bst 2.0 DNA聚合酶购于 New England Biolabs (NEB)公司;dNTP Mixture购于TaKaRa公司;甜菜碱购于上海生工生物工程有限公司;SYBR GreenⅠ染料购于美国AB公司;细菌基因组DNA提取试剂盒购于北京百泰克生物科技有限公司。
NanoVue Plus核酸蛋白测定仪购于上海在途生物科技有限公司;VERITI PCR扩增仪为美国AB公司产品;TW2 水浴锅为德国JULABO公司产品。
1.2 试验方法
1.2.1 细菌培养基配制 NA(nutrient agar)培养基:牛肉浸膏3 g,葡萄糖10 g,蛋白胨5 g,酵母粉0.5 g,加水至1 L,调至pH 7.0,加入1.8%的琼脂,121℃下灭菌20 min;TZC培养基:100 mL NA培养基中加入0.5 mL 1%红四氮唑溶液;1%红四氮唑(C19H15ClN4)溶液:称取1 g红四氮唑溶于100 mL蒸馏水中,高压灭菌7—8 min,避光4℃保存。
1.2.2 供试菌株培养及 DNA提取 28℃条件下,于NA平板上培养48 h后的各供试菌株,根据细菌基因组DNA提取试剂盒说明书提取总DNA,-20℃冰箱保存备用。
1.2.3 引物设计和合成 以青枯菌的lpxC作为检测靶标,通过比对分析后,利用Primer Explorer Version 4.0(http://primerexplorer.jp/e/)在线设计4条LAMP特异性引物,其中F3(5′-CCTGTACGTGGTCGGC TAT-3′)和B3(5′-ACCGCAACACGGGATCA-3′)为外侧引物,FIP(5′-TACGCCGTTTCATCGGCCAGGT ACACGGCGCACAAGT-3′)和BIP(5′-ATCGTCAC GTTCGACAAGGTGGAATGCCGGCTGCAACTG-3′)为内侧引物。引物由生工生物工程技术服务有限公司合成。
1.2.4 LAMP反应体系的优化及扩增产物检测 以无菌水为空白对照,通过单因素变化试验对LAMP反应体系的各参数,包括镁离子浓度(终浓度变化范围为2—12 mmol·L-1)、内外引物浓度比(比值变化范围为2∶1—12∶1)等进行优化,并测定反应所需的最适温度(反应温度变化范围为60—65℃)。反应结束后可直接通过观察产生的白色焦磷酸镁沉淀情况判定检测结果,也可于反应前在PCR管内盖上加入1 μL SYBR GreenⅠ荧光染料,反应结束后瞬时离心,将染料与反应液混匀后观察颜色变化,若反应管中有目的 DNA的大量扩增,则反应管颜色呈现绿色,反之为橙色。
1.2.5 LAMP方法特异性检测 以不同寄主来源的24个青枯菌株为研究对象,5个非青枯菌株为对照材料,无菌水为空白对照,验证LAMP检测方法的特异性。以各菌株的DNA为模板,采用已优化的反应体系进行试验,结果通过直接观察白色焦磷酸镁沉淀或通过荧光染料法进行分析。
1.2.6 LAMP方法灵敏度检测 按照试剂盒说明书提取青枯菌GMI1000菌株的DNA,通过核酸蛋白测定仪测定其浓度为1.42×102ng·μL-1,对DNA提取液进行 10倍梯度稀释,对应的浓度依次为 1.42×101ng·μL-1、1.42×100ng·μL-1、1.42×102pg·μL-1、1.42×101pg·μL-1、1.42×100pg·μL-1、1.42×102fg·μL-1、1.42×101fg·μL-1,分别以各稀释梯度的DNA溶液为模板,以无菌水为空白对照,同步进行LAMP和普通PCR检测,比较二者的检测灵敏度差异。
普通PCR采用以青枯菌lpxC及其上游部分序列为检测靶标的扩增引物 Au759f/760r,引物序列:AU759f 5′-GTCGCCGTCAACTCACTTTCC-3′,AU760r 5′-GT CGCCGTCA GCAATGCGGAATCG-3′。
1.2.7 植物组织液及病株中青枯菌的LAMP检测 分别以灭菌手术刀切取小块表面消毒后的马铃薯和生姜内部植物组织,以研磨杵碾碎后悬浮于灭菌水中。随后分别于各组织悬浮液中加入新鲜配置的 Po41和Z-Aq-1菌悬液至菌体细胞终浓度约105cfu/mL,以无菌水为空白对照,使用LAMP方法进行检测。
分别取接种Po82菌株10 d后表现明显萎蔫症状的番茄植株和健康番茄植株各1株,截取其近根部约2 cm的茎组织,悬浮于5 mL无菌水中并剪碎,30 min后以该液体为模板,以无菌水为空白对照进行LAMP检测。
1.2.8 马铃薯罹病样品的LAMP检测 7份采集于云南疑似青枯病的马铃薯块茎样品经冲洗、表面消毒后纵向剖开,以灭菌手术刀切取小块维管束组织,悬浮于5 mL 无菌水中,30 min 后以悬浮液为模板,以无菌水为空白对照,同步进行LAMP和普通PCR检测。
2 结果
2.1 LAMP反应体系优化
2.1.1 反应温度优化 LAMP反应产物经加入SYBR GreenⅠ染料染色后表明,反应在60、61、62、63、64、65℃ 6个不同的反应温度下均有扩增,差异不显著,表明该引物的反应条件宽松(图 1),确定63℃为反应温度。

1—6:温度分别为60、61、62、63、64、65℃ Reaction temperatures were 60, 61, 62, 63, 64, and 65℃, respectively;7:空白对照Blank control图1 不同温度条件下的LAMP检测Fig. 1 LAMP detection with different amplification temperatures
2.1.2 镁离子浓度优化 LAMP反应产物经加入SYBR GreenⅠ染料染色后表明,当镁离子浓度在6—12 mmol·L-1时,反应产物均能呈现明显的绿色,根据效果相同,用量最少原则,确定该反应体系的最佳镁离子浓度为6 mmol·L-1(图2)。

1—6:Mg2+浓度分别为2、4、6、8、10、12 mmol·L-1Concentrations of Mg2+were 2, 4, 6, 8, 10, and 12 mmol·L-1, respectively;7:空白对照 Blank control图2 不同Mg2+浓度下的LAMP检测Fig. 2 LAMP detection with different concentrations of Mg2+
2.1.3 内外引物浓度比优化 LAMP反应产物经加入 SYBR GreenⅠ染料染色后表明,不同的内外引物浓度比下均能发生扩增反应,当内外浓度比为 6∶1(1.2∶0.2 μmol·L-1)及以下时,绿色较浅,而当内外浓度比为8∶1(1.6∶0.2 μmol·L-1)到12∶1(2.4∶0.2 μmol·L-1)时,绿色较亮,说明产生大量目的片段的扩增,因此选择8∶1作为该扩增体系的内外引物浓度比(图3)。

1—6:内外引物浓度比分别为2∶1、4∶1、6∶1、8∶1、10∶1、12∶1 Different concentration ratios of inner and outer primers were 2∶1,4∶1, 6∶1, 8∶1, 10∶1, and 12∶1, respectively;7:空白对照Blank control图3 不同内外引物浓度比的LAMP检测Fig. 3 LAMP detection with different concentration ratios of inner and outer primers
LAMP反应体系设定为25 μL:体系中内引物FIP 和BIP的浓度分别为1.6 μmol·L-1,外引物F3和B3的浓度分别为 0.2 μmol·L-1,dNTP的浓度为 1.4 mmol·L-1,甜菜碱1.0 mol·L-1,基础反应液(20 mmol·L-1Tris-HCl,10 mmol·L-1(NH4)2SO4,50 mmol·L-1KCl,6 mmol·L-1MgSO4,0.1% Tween-20),模板DNA 1 μL,然后加入8个单位的Bst 2.0 DNA聚合酶,补水至25 μL。混匀离心后,63℃孵育45 min。
2.2 LAMP方法特异性检测
相同反应条件下,分别以青枯菌菌株和非青枯菌菌株的DNA为模板进行LAMP扩增反应,反应结束后观察各反应管中颜色变化,其中青枯菌菌株反应管中反应液均呈现绿色,表明有大量目的DNA进行了扩增;而其他参比菌株及空白对照的反应液均保持橙色不变,表明本研究中所设计的引物不能使这些菌株发生扩增反应,且该检测过程未出现假阳性(图4)。
2.3 LAMP方法灵敏度检测
以提取的青枯菌GMI1000菌株的DNA原液及10倍梯度稀释后的稀释液为模板进行LAMP检测和普通PCR检测,琼脂糖凝胶电泳结果显示,普通PCR在105倍的稀释模板下无明显扩增反应(图5-a),表明其最低检测浓度为14.2 pg。荧光染料法结果显示,LAMP在 106倍的稀释模板下无明显扩增反应(图5-b),表明其最低检测浓度为1.42 pg。LAMP的检测灵敏度较普通PCR提高10倍。
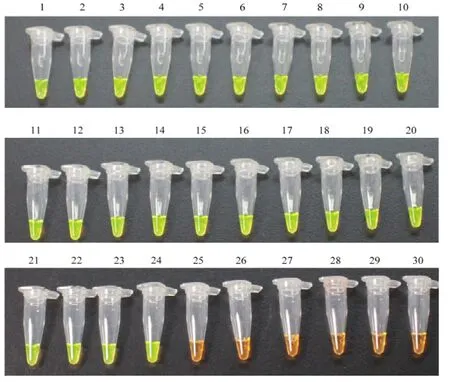
1—24:青枯菌菌株Different strains of R. solanacearum;25—29:非青枯菌菌株Different strains of non R. solanacearum;30:空白对照Blank control图4 LAMP方法特异性检测Fig. 4 Specificity test of LAMP

图5 普通PCR(a)与LAMP(b)方法灵敏度比较Fig. 5 Comparison between traditional PCR (a) and LAMP (b) in sensitivity for R. solanacearum
2.4 植物组织液及病株中青枯菌的LAMP检测
分别以混入青枯菌 Po41菌株的马铃薯组织浸出液和混入青枯菌 Z-Aq-1 菌株的姜组织浸出液为LAMP扩增模板进行检测,结果显示(图 6),反应液均呈现绿色,而空白对照的反应液保持橙色,表明该方法不受植物组织浸出液干扰,可灵敏地检测青枯菌。
以LAMP方法检测罹病番茄植株及健康植株,结果显示(图7),罹病植物的反应管中反应液为绿色,表明有大量靶标序列进行扩增,而健康植物和空白对照反应管中的反应液为橙色,表明未发生扩增反应,该方法可用于病株样品的检测。
2.5 马铃薯罹病块茎样品的LAMP检测
LAMP检测结果显示(图8-c),7份待检马铃薯块茎样品的反应液均呈绿色,对照管保持橙色;同步进行的普通PCR检测结果显示(图 8-b)7份样品均可扩增获得片段大小为282 bp条带。LAMP和PCR的检测结果均表明疑似罹病样品的青枯病检测结果为阳性。因此,本研究所建立的LAMP方法可特异、灵敏地检测出罹病样品中的青枯菌。

1:混入Po41菌株的马铃薯组织液Mixture of potato tissue and strain Po41;2:混入Z-Aq-1菌株的姜组织液Mixture of ginger tissue and strain Z-Aq-1;3:空白对照Blank control图6 植物组织液中青枯菌的LAMP检测Fig. 6 LAMP detection of R. solanacearum in the plant tissues

1:罹病植株The plant infected by R. solanacearum;2:健康植株The healthy plant;3:空白对照Blank control图7 病株中青枯菌的LAMP检测Fig. 7 LAMP detection of R. solanacearum in the diseased plant
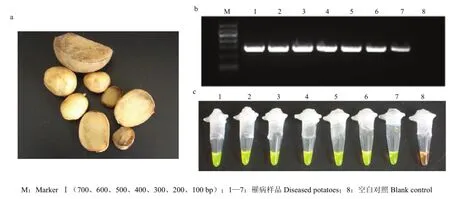
图8 马铃薯罹病样品(a)及其普通PCR(b)和LAMP(c)检测Fig. 8 Samples of diseased potatoes (a) and the detection of traditional PCR (b) and LAMP (c)
3 讨论
青枯病是常见、易发和传播迅速的重要土传细菌病害之一[14],中国目前南起20°N的海南省、北至42°N的河北坝上地区均有该病发生的报道[15]。青枯菌可随土壤、排溉水以及种苗、种薯(姜)等植物繁殖材料传播扩散。因此,建立准确、快速、高效的检测方法,及时检测出带菌种子、幼苗、水体或土壤,对阻止青枯菌的传播蔓延具有重要意义。21世纪初建立起来的环介导等温扩增法(LAMP)凭借特异性强、灵敏度高、检测成本低和操作步骤简单等优点,迅速被广泛应用于植物保护、食品安全和医学卫生等诸多领域[16],如苜蓿疫霉根腐病菌(Phytophthora medicaginis)[17]、禾谷镰孢(Fusarium graminearum)[18]等病原真菌的检测;根结线虫(Meloidogyne incognita)[19]、松材线虫(Bursaphelenchus xylophilus)[20]等植物病原线虫的检测;植物病毒多为RNA,针对植物病毒及类病毒的检测采用反转录环介导等温扩增技术(reverse transcription loop-mediated isothermal amplification,RT-LAMP),如烟草花叶病毒(Tobaccomosaic virus,TMV)[21]、葡萄 A 病毒(Grapevine virus A,GVA)[22]、菜豆荚斑驳病毒(Bean pod mottle virus,BPMV)[23]等;许多学者利用LAMP技术对难以培养的细菌、生化反应不明显及传统表型方法不能鉴定的细菌进行快速准确的鉴定[24],如空肠弯曲菌(Campylobacter jejuni)[25]、阪崎肠杆菌(Enterobacter sakazakii)[26]等。
本研究基于 lpxC基因序列设计了青枯菌LAMP检测的扩增引物,该基因作为青枯菌演化型复合PCR鉴定中的种特异性鉴定靶标,已被国内外青枯病相关领域的研究人员广为采用。因此,以其为靶序列设计引物可充分保证LAMP反应的高度特异性和广泛通用性。在KUBOTA等[10]的研究中,扩增结果通过琼脂糖凝胶电泳进行判断,由于LAMP反应产物高温条件下易造成气溶胶污染,使之后的检测出现较高的假阳性率,且通过电泳判断结果费时费力,无法实现青枯菌的田间快速检测。本研究采用反应前于PCR管内盖上加入染料[27],反应后通过离心与扩增产物混合,实现了无需开盖的样品快速可视化检测。在贾蒙骜等[11]的研究中,以胡萝卜果胶杆菌胡萝卜亚种(Pectobacterium carotovorum subsp. carotovorum)和大肠杆菌工程菌株为对照菌、烟草青枯病菌 FQY4菌株为参试菌验证LAMP反应的特异性,参试菌株量过少,不足以支撑检测结果。本研究以归属于 5个不同生理小种、涉及14种分离寄主的24个青枯菌株材料为参试对象,并以青枯菌的近缘种Ralstonia mannitolilytica、Ralstonia pickettii和Burkhoderia cepacia以及常见菌 Enterobacter sp.和 Acidovorax citrulli为对照菌,能够确保本研究所建立的检测方法具有高度的特异性和广泛的适用性。LENARCIC等[12]比对了以16S rRNA、fliC和egl为靶标建立的LAMP方法在检测特异性方面的差异,并与real-time PCR进行对比,最终基于egl建立了高效快速的LAMP检测方法,但该研究所采用菌株多分离于马铃薯等茄科和芭蕉科寄主,且检测过程需通过Genie Ⅱ等温扩增荧光检测系统进行监测,大大增加了检测成本,不适合在田间及基层推广。
较之其他检测方法,本研究建立的LAMP检测方法的优势在于:高效快捷,可于45 min内完成扩增反应;灵敏度高,DNA样品的检测阈值为1.42 pg;适用范围广,可直接用于带菌植物和田间罹病样品的检测,且不需要PCR仪等昂贵设备,仅用水浴锅或者保温杯即可实现该检测过程;成本低廉,与目前应用于田间青枯菌检测的阿格迪(Agdia®)试纸条相比,此方法在显著提高灵敏度的同时大大降低了成本,具有广阔的应用前景。
目前,青枯菌带菌土壤的检测方法主要包括平板分离培养、BIO-PCR、土壤DNA常规PCR和实时荧光定量PCR等,这些方法各有利弊,均可用于土壤样品的检测,但亦都存在耗时较长或需特殊仪器等不足,无法实现田间快速检测。本研究曾试图采用 LAMP法对疫区大田自然土悬浮液直接进行检测,但发现该方法与土样直接PCR检测法存在同样的制约瓶颈,即Bst酶(LAMP扩增体系)与Taq酶(PCR扩增体系)一样受到土壤中腐植酸等的抑制因子的干扰,无法有效完成对靶序列的扩增。因此,可将土壤DNA快速提取试剂盒与青枯菌LAMP检测方法相结合,实现大田土壤的青枯菌快速检测。
4 结论
优化了青枯菌的LAMP检测方法,可用于病原菌的快速、高效、特异的检测,适合科研单位和生产基层使用。在青枯病的早期诊断方面发挥作用,可为青枯病的科学防治提供技术保障。
References
[1] WICKER E, GRASSART L, CORANSON-BEAUDU R, MIAN D,GUILBAUD C, FEGAN M, PRIOR P. Ralstonia solanacearum strains from Martinique (French West Indies) exhibiting a new pathogenic potential. Applied and Environmental Microbiology, 2007,71(21): 6790-6801.
[2] XU J, PAN Z C, PRIOR P, XU J S, ZHANG Z, ZHANG H, ZHANG L Q, HE L Y, FENG J. Genetic diversity of Ralstonia solanacearum strains from China. European Journal of Plant Pathology, 2009,125(4): 641-653.
[3] 万方浩, 彭德良, 王瑞. 生物入侵: 预警篇. 北京: 科学出版社,2010: 521-553. WAN F H, PENG D L, WANG R. Biological Invasions: Risk Analysis and Early Prevention. Beijing: Science Press, 2010: 521-553. (in Chinese)
[4] KELMAN A. The relationship of pathogenicity in Pseudomonas solanacearum to colony appearance on a tetrazolium medium. Phytopathology, 1954, 44: 693-695.
[5] 王胜坤, 王军, 徐大平. 植物青枯菌检测方法研究进展. 南京林业大学学报 (自然科学版), 2007, 31(2): 118-122.WANG S K, WANG J, XU D P. Progress on detection methods of Ralstonia solanacearum. Journal of Nanjing Forestry University (Natural Sciences Edition), 2007, 31(2): 118-122. (in Chinese)
[6] JANSE J D. A detection method for Pseudomonas solanacearumin symptomless potato tubers and some data on its sensitivity and specificity. Bulletin OEPP, 1988, 18: 343-351.
[7] OPINA N, TAVNER F, HOLLWAY G, WANG J F, LI T H,MAGHIRANG R, FEGAN M, HAYWARD A C, KRISHNAPILLAI V, HONG W F. A novel method for development of species and strain-specific DNA probes and PCR primers for identifying Burkholderia solanacearum (formerly Pseudomonas solanacearum). Asia Pacific Journal of Molecular Biology and Biotechnology, 1997,5(1): 19-30.
[8] 陈柳, 尚巧霞, 陈笑瑜, 邢冬梅, 冉策, 魏艳敏, 赵晓燕, 刘正坪.草莓轻型黄边病毒 RT-LAMP 检测方法的建立. 中国农业科学,2015, 48(3): 613-620. CHEN L, SHANG Q X, CHEN X Y, XING D M, RAN C, WEI Y M,ZHAO X Y, LIU Z P. Detection of Strawberry mild yellow edge virus by RT-LAMP. Scientia Agricultura Sinica, 2015, 48(3): 613-620. (in Chinese)
[9] NOTOMI T, OKAYAMA H, MASUBUCHI H, YONEKAWA T,WATANABE K, AMINO N, HASE T. Loop-mediated isothermal amplification of DNA. Nucleic Acids Research, 2000, 28(12): e63.
[10] KUBOTA R, VINE B G, ALVAREZ A M, JENKINS D M. Detection of Ralstonia solanacearum by loop-mediated isothermal amplification. Bacteriology, 2008, 98(9): 1045-1051.
[11] 贾蒙骜, 陈兴江, 林叶春, 商胜华. 基于环式等温扩增的烟草青枯病病原菌快速检测方法. 中国农业大学学报, 2014, 19(1): 93-98. JIA M A, CHEN X J, LIN Y C, SHANG S H. Rapid and sensitive detection method for Ralstonia solanacearum based on loop-mediated isothermal amplification. Journal of China Agricultural University,2014, 19(1): 93-98. (in Chinese)
[12] LENARCIC R, MORISSET D, PIRC M, LLOP P, RAVNIKAR M,DREO T. Loop-mediated isothermal amplification of specific endoglucanase gene sequence for detection of the bacterial wilt pathogen Ralstonia solanacearum. PLoS ONE, 2014, 9(4): e96027.
[13] MORI Y, NAGAMINE K, TOMITA N, NOTOMI T. Detection of loop-mediated isothermal amplification reaction by turbidity derived from magnesium pyrophosphate formation. Biochemical and Biophysical Research Communications, 2001, 289: 150-154.
[14] 乔俊卿, 陈志谊, 刘邮洲, 刘永锋, 梁雪杰, 张磊. 茄科作物青枯病研究进展. 植物病理学报, 2013, 43(1): 1-10. QIAO J Q, CHEN Z Y, LIU Y Z, LIU Y F, LIANG X J, ZHANG L. Research progress on bacterial wilt of nightshade family. Acta Phytopathologica Sinica, 2013, 43(1): 1-10. (in Chinese)
[15] 徐进, 冯洁. 植物青枯菌遗传多样性及致病基因组学研究进展. 中国农业科学, 2013, 46(14): 2902-2909. XU J, FENG J. Advances in research of genetic diversity and pathogenome of Ralstonia solanacearum species complex. Scientia Agriculture Sinica, 2013, 46(14): 2902-2909. (in Chinese)
[16] 秦文韬, 王忠跃, 张昊. 环介导恒温扩增技术在植物病原物检测中的应用. 中国农业科技导报, 2013, 15(3): 169-174. QIN W T, WANG Z Y, ZHANG H. Application of loop-mediated isothermal amplification in detection plant pathogens. Journal of Agricultural Science and Technology, 2013, 15(3): 169-174. (in Chinese)
[17] 张裕君, 刘跃庭, 廖芳, 罗加凤, 黄国明. 基于LAMP方法的苜蓿疫霉根腐病菌分子检测研究. 中国植保导刊, 2011, 31(10): 7-9. ZHANG Y J, LIU Y T, LIAO F, LUO J F, HUANG G M. Research on molecular detection of Phytophthora medicaginis based on LAMP. China Plant Protection, 2011, 31(10): 7-9. (in Chinese)
[18] NIESSEN L, VOGEL R F. Detection of Fusarium graminearum DNA using a loop-mediated isothermal amplification (LAMP) assay. International Journal of Food Microbiology, 2010, 140: 183-191.
[19] NIU J H, GUO Q X, JIAN H, CHEN C L, YANG D, LIU Q, GUO Y D. Rapid detection of Meloidogyne spp. by LAMP assay in soil and root. Crop Protection, 2011, 30: 1063-1069.
[20] KIKUCHI T, AIKAWA T, OEDA Y, KARIM N, KANZAKI N. A rapid and precise diagnostic method for detecting the pinewood nematode Bursaphelenchus xylophilus by loop-mediated isothermal amplification. Phytopathology, 2009, 99(12): 1365-1369.
[21] LIU Y H, WANG Z D, QIAN Y M, MU J M, SHEN L I, WANG F L,YANG J G. Rapid detection of Tobacco mosaic virus using the reverse transcription loop-mediated isothermal amplification method. Archives of Virology, 2010, 155: 1681-1685.
[22] 张永江, 辛言言, 李桂芬, 乾义柯. 葡萄 A 病毒 RT-LAMP 检测方法的建立. 中国农业科学, 2016, 49(1): 103-109. ZHANG Y J, XIN Y Y, LI G F, QIAN Y K. Development of a RT-LAMP assay for detection of Grapevine virus A. Scientia Agricultura Sinica, 2016, 49(1): 103-109. (in Chinese)
[23] 闻伟刚, 杨翠云, 崔俊霞, 张颖. RT-LAMP技术检测菜豆荚斑驳病毒的研究. 植物保护, 2010, 36(6): 139-141. WEN W G, YANG C Y, CUI J X, ZHANG Y. Detection of Bean pod mottle virus by RT-LAMP. Plant Protection, 2010, 36(6): 139-141. (in Chinese)
[24] 王丽, 石磊, 李琳. DNA环介导的恒温扩增法在快速鉴定病原微生物中的应用. 生命的化学, 2006, 26(5): 462-465. WANG L, SHI L, LI L. Application of loop-mediated isothermal amplification in detection the DNA of plant pathogens. Chemistry of Life, 2006, 26(5): 462-465. (in Chinese)
[25] 林超, 梁成珠, 徐彪, 孙敏, 刘彩霞, 高宏伟. 空肠弯曲菌 LAMP快速检测方法的建立. 微生物学通报, 2009, 36(6): 923-928. LIN C, LIANG C Z, XU B, SUN M, LIU C X, GAO H W. Establishment of loop-mediated isothermal amplification (LAMP)method for Campylobacter jejuni detection. Microbiology, 2009,36(6): 923-928. (in Chinese)
[26] 徐晓可, 吴清平, 张淑红, 张菊梅, 郭伟鹏, 吴秀华. 阪崎肠杆菌LAMP、PCR与传统检测方法的比较. 现代预防医学, 2013, 40(9):1715-1717. XU X K, WU Q P, ZHANG S H, ZHANG J M, GUO W P, WU X H. Comparison of LAMP, PCR and traditional method for detection on Enterobacter sakazakii. Modern Preventive Medicine, 2013, 40(9):1715-1717. (in Chinese)
[27] 封立平, 倪新, 吴兴海, 伦才智, 吴翠萍, 栾晶. 玉米细菌性枯萎病菌的环介导恒温扩增(LAMP)检测方法. 植物保护学报, 2015,42(3): 347-352. FENG L P, NI X, WU X H, LUN C Z, WU C P, LUAN J. Loop-mediated isothermal amplification (LAMP) for detection of Pantoea stewartii subsp. stewartii. Journal of Plant Protection, 2015,42(3): 347-352. (in Chinese)
(责任编辑 岳梅)
Development of a LAMP Approach for Detection of Ralstonia solanacearum
HUANG Wen1,2, XU Jin2, ZHANG Hao2, XU Jing-sheng2, DING Wei1, FENG Jie2
(1College of Plant Protection, Southwest University, Chongqing 400716;2State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193)
Abstract:【Objective】Bacterial wilt of plants, caused by Ralstonia solanacearum, is one of the most devastating soil-bornediseases in the worldwide and severely restricts production of economically important crops. Simple and sensitive detection assay is the basis for effective prevention and control. The objective of this study is to establish a rapid and specific method for detection of R. solanacearum using an isothermal method known as loop-mediated isothermal amplification (LAMP), to make it possible for researchers and technical staff achieve simple detection of this pathogen. 【Method】 Four specific LAMP primers were designed to target the lpxC of R. solanacearum using online design software Primer Explorer Version 4.0, the inner primers are FIP (5′-TACGCCGTTTCATCGGCCAGGTACACGGCGCACAAGT-3′) and BIP (5′-ATCGTCACGTTCGACAAGGTGGAATGCCG GCTGCAACTG-3′) , the outer primers are F3 (5′-CCTGTACGTGGTCGGCTAT-3′) and B3 (5′-ACCGCAACACGGGATCA-3′). Single-factor experiments were conducted to optimize the parameters of the reaction system, the reaction temperatures were set ranging from 60 to 65℃, the concentrations of Mg2+were set ranging from 2 to 12 mmol·L-1, the concentration ratios of inner and outer primers were set ranging from 2∶1 to 12∶1. The specificity of LAMP was tested by using 24 strains of R. solanacearum isolated from different hosts and 5 different strains of non R. solanacearum (Ralstonia mannitolilytica, Ralstonia pickettii, Enterobacter sp., Acidovorax citrulli, Burkhoderia cepacia), of which 3 species are closely related to R. solanacearum and the others are common bacteria in nature. The sensitivities of LAMP and PCR for detecting R. solanacearum were compared by using ten-fold serially diluted DNA of GMI1000 as templates (including original DNA, 101, 102, 103, 104, 105, 106, and 107times of diluent). The LAMP method was used to detect the mixture of potato tissue and strain Po41, mixture of ginger tissue and strain Z-Aq-1, also to detect the wilted tomato plant inoculated with R. solanacearum strain Po82 and the health one. Furthermore, the samples of potatoes which may be infected by R. solanacearum were detected by LAMP method. The results of LAMP could be observed by the magnesium pyrophosphate precipitate produced during the reaction, or by the color changing after adding SYBR Green Ⅰ, the positive samples were green and negative ones were orange.【Result】The LAMP assay for rapidly and specifically detecting R. solanacearum was established. In this reaction system, the reacting temperature was determined as 63℃ and the concentrations of Mg2+was 6 mmol·L-1, the concentration ratios of inner and outer primers was 8∶1 (1.6∶0.2 μmol·L-1). The result of specificity test showed that only the reaction liquids with the DNA of R. solanacearum change green, which indicated this method had a good specificity. Sensitivity experiments indicated that LAMP could detect original DNA, 101, 102, 103, 104, and 105times of diluent, the sensitivity was 1.42 pg which is 10 times higher than conventional PCR. Also this assay could quickly and accurately detect R. solanacearum from plant tissue suspension, diseased plants as well as infected potato tubers sampled in the field. 【Conclusion】 The LAMP assay established in this study had advantages of high sensitivity, specificity, efficiency and low cost over traditional methods and conventional PCR, the reaction results could be directly observed by naked eyes. All the characteristics of LAMP made it suitable to be widely used in field and grass-roots units.
Key words:Ralstonia solanacearum; detection; LAMP
收稿日期:2016-02-15;接受日期:2016-04-17
基金项目:国家自然科学基金(31272008,31371908)、国家公益性行业(农业)科研专项(201303015)、 国家科技支撑计划(2015BAD08B03)

