灵芝多糖对番茄抗灰霉病的诱导效应
宁玉波,王红艳,乔 康,刘秀梅,王开运
(1山东农业大学植物保护学院,山东泰安 271018;2山东省农业科学院棉花研究中心,济南 250100)
灵芝多糖对番茄抗灰霉病的诱导效应
宁玉波1,王红艳2,乔康1,刘秀梅1,王开运1
(1山东农业大学植物保护学院,山东泰安 271018;2山东省农业科学院棉花研究中心,济南 250100)
摘要:【目的】诱导抗病剂可以诱导寄主植株产生系统抗病性,具有持效性和广谱性的特点。论文以番茄植株为模式植物,番茄灰霉菌(Botrytis cinerea)为目标菌,进行温室盆栽试验,以期明确灵芝多糖诱导剂对番茄灰霉病的诱导抗性。【方法】用一定质量浓度的灵芝多糖溶液(50、100、200和400 mg·L-1)喷雾处理盆栽番茄植株第1、2片真叶(正反面),每2 d喷施1次,共诱导3次,最后一次诱导2 d后全株喷雾接种供试菌孢子悬浮液((1—2)×106个孢子/mL),对照组施用等量清水代替灵芝多糖溶液,与各处理平行喷雾接种番茄灰霉菌孢子悬浮液。在接种孢子悬浮液之前用注射器将番茄苗茎基部刺伤,注意伤口不能太大。然后再罩上塑料薄膜保湿24 h,接种孢子悬浮液2 d内植株遮阴处理,并用加湿器提高温室内的相对湿度,相对湿度控制在不低于90%,温度控制在(15±5)℃,接种后第 3 天正常光照。通过调查植株病情指数,计算相对防治效果以评价灵芝多糖对番茄抗灰霉病的诱导效果,并且从防御酶活性、丙二醛(MDA)和叶绿素含量的变化角度评价其诱导抗性的作用机制。同时用一定质量浓度的灵芝多糖溶液(50、100、200和400 mg·L-1)处理番茄种子并育苗,20 d后测定番茄幼苗株高、鲜重等多项生长指标。【结果】与直接施用等量清水后挑战接菌的对照组病情指数49.25相比,灵芝多糖处理组的番茄植株病情指数明显下降,在 32.96—43.85。其中经400 mg·L-1灵芝多糖处理的番茄植株病情指数最低为32.96,相对防效达到33.07%。经灵芝多糖处理的番茄植株,其体内与抗病有关的防御酶活性也发生显著变化,过氧化氢酶(CAT)和多酚氧化酶(PPO)的活性在多糖诱导第3天达到最高,分别达到162和98 U·min-1·g-1FW,是对照组的2.13和1.71倍;过氧化物酶(POD)的活性在诱导后第4天达到最高值434 U·min-1·g-1FW,是对照处理组的3.29倍。灵芝多糖能够系统地诱导番茄体内 CAT、POD 及 PPO 活性,显著抑制了感染灰霉菌后番茄植株叶片叶绿素含量的下降。灵芝多糖处理组的MDA含量与对照组相比有所下降,对照处理组在取样期间内MDA含量持续上升,而灵芝多糖处理组在取样期间内MDA含量呈先上升后趋于平稳的变化趋势。各质量浓度灵芝多糖对番茄种子的发芽率、芽长和幼苗株高、植株的鲜重均有不同程度的促进作用。其中200 mg·L-1灵芝多糖浸泡的番茄种子发芽率最高,达87.3%,比对照组的发芽率77.3%提高了10.0%;且该处理对番茄幼苗的株高和地上部分鲜重的促进作用也最大,分别较对照增加了12.9%和33.3%;经100 mg·L-1灵芝多糖处理后番茄幼苗的芽长和地下部分鲜重变化最大,与对照组相比分别提高了0.16 cm和 0.33 g。【结论】灵芝多糖能够诱导番茄植株对灰霉病产生系统抗病性,同时对番茄种子发芽和番茄植株幼苗生长具有一定的促进作用。
关键词:灵芝多糖;番茄;灰霉病;诱导抗性;防御酶
联系方式:宁玉波,E-mail:nyb408908401@163.com。王红艳,E-mail:78931220@qq.com。宁玉波和王红艳为同等贡献作者。通信作者王开运,E-mail:kywang@sdau.edu.cn
0 引言
【研究意义】番茄灰霉病(致病菌为灰葡萄孢Botrytis cinerea)是中国番茄上发生的重要病害,每年都因该病的发生造成番茄大量减产,甚至绝产[1-2]。该病发病时间早,持续时间长,现已成为制约番茄生产的主要障碍。目前生产上防治番茄灰霉病以多菌灵、嘧霉胺和腐霉利等化学药剂为主,但是化学防治会带来农药使用量不断增大、花费成本高、环境污染严重等问题[3]。生物农药因其具有高效、无公害的特点,符合现代农业可持续发展的方向,所以倍受关注,已成为当前农药研究的热点。植物诱导剂作为生物农药的一种,具有持效性和广谱性的特点,可以诱导寄主植物获得系统抗病性,成为解决农业可持续发展的有效途径。【前人研究进展】生物多糖诱导子由于具有绿色无污染和广谱高效的特点被称为新型生物农药。灵芝(Ganoderma lucidum)为担子菌纲多孔菌科灵芝属真菌,含有多种生物活性成分,其中灵芝多糖是灵芝的关键药效成分[4-5],灵芝多糖主要构型特征为β-(1→3)-D-线性连接的骨架结构[6-7],与许多已经报道的真菌多糖结构相一致,同属于β-(1→3)-葡聚糖类[8]。研究表明海带多糖、壳寡糖、香菇多糖等多种功能糖能够通过刺激植株体内产生防御反应,增强植物对病害的抵抗能力,从而诱导植株对植物真菌和病毒病害产生抗性[9-11],王文霞等[12]将这类具有调节植物免疫功能的糖类定义为糖链植物疫苗。近年来,国内外学者对于灵芝多糖的研究主要致力于医学方面的功效[13-14],白丹等[15]采用纸片琼脂法测定了100 mg·mL-1灵芝多糖对供试菌的抑菌强度,结果表明灵芝多糖对细菌的抑菌活性强于真菌,同时指出灵芝多糖不能抑制灰葡萄孢的生长。【本研究切入点】关于灵芝多糖作为诱导子在植物抗病害上的应用目前尚未见报道。【拟解决的关键问题】以温室盆栽的番茄植株为研究对象,用灵芝多糖作为诱导子,探讨灵芝多糖对番茄抗灰霉病的诱导效果及其诱导抗性的作用机制,为灵芝多糖作为诱导剂的开发和在植物病害防治上的有效应用提供理论基础。
1 材料与方法
试验于 2014—2015年在山东农业大学植物保护学院完成。
1.1 供试材料
番茄(Solanum lycopersicum)品种为东风4号,购自山东省泰安市房村镇丰源种苗有限公司。
1.2 试验方法
供试培养基:PDA培养基(马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 L,分装,灭菌)。PD培养基(马铃薯200 g,葡萄糖20 g,蒸馏水1 L,分装,灭菌)。
供试菌种:从山东农业大学植物保护学院日光温室内的盆栽番茄植株上采集发病比较典型的番茄灰霉病叶,用无菌水冲洗叶片,剪取叶片发病部位浸于80%无水乙醇中1 min消毒处理,将消毒后的叶片贴放于无菌PDA培养基上培养,置于25℃恒温培养箱内培养,7 d后挑取菌落边缘的菌丝接于新的平板上继续培养。
孢子悬浮液的配置:打取直径7 mm上述供试菌饼,置于盛有100 mL PD培养基的三角瓶中,放于摇床中振荡培养10 d后,病原菌培养物用无菌水两层纱布过滤,将滤液经10 000 r/min离心10 min,去沉淀加适量蒸馏水稀释,在显微镜下用血球计数板统计滤液孢子数,最终配成孢子悬浮液浓度为(1—2)×106个孢子/mL,用于接种。
1.2.1 灵芝多糖的制备 以灵芝子实体粉末为原料,以水为溶剂,采用水提醇沉法提取灵芝多糖。称取粉碎后干燥灵芝子实体粉末100 g,加入15倍体积蒸馏水加热回流2 h,残渣加蒸馏水回流提取2次,合并上清液,过滤,真空浓缩至200 mL。采用Sevage法除去蛋白,浓缩液置于分液漏斗中,每100 mL浓缩液加20 mL氯仿正丁醇液(v∶v= 4∶1 ),振荡30 min后静止放置12 h,去除水相与溶剂相中间的白色胶状物,溶液离心15 min(12 000 r/min),去除杂质。向溶液中加入4倍体积无水乙醇,静置24 h后收集白色絮状物,用丙酮洗涤2次,所得白色絮状物在冷冻干燥箱中冷冻干燥即得粉末状粗多糖。采用苯酚-硫酸法测定灵芝多糖的含量。
(1)葡萄糖标准曲线的制备 准确量取0.1 mg·mL-1葡萄糖标准溶液0.1、0.2、0.3、0.4、0.5和0.6 mL置于10 mL试管中,加蒸馏水定容至1 mL,向每个试管中加入1 mL 现配的浓度为6%苯酚溶液,迅速加入5 mL浓硫酸溶液,摇匀,将所得溶液沸水浴显色15 min,冷水冷却至室温,于490 nm处检测吸光度值(OD)。以吸光度为纵坐标,葡萄糖含量为横坐标,绘制标准曲线,得出葡萄糖标准曲线方程。
(2)样品含量测定 称取灵芝多糖样品10 mg,定容至100 mL容量瓶中,吸取上述溶液1.0 mL,按上述步骤操作,在490 nm处测吸光度,以标准曲线计算多糖含量。
1.2.2 灵芝多糖对番茄抗灰霉病诱导作用的测定 番茄幼苗4叶期时,选取生长状态一致的番茄幼苗,将一系列质量浓度(50、100、200和400 mg·L-1)的灵芝多糖溶液(含0.03%的Tween-80)用喷雾法处理番茄第1、2片真叶(正反面),罩上塑料薄膜,每2 d喷施一次,共喷施3次。最后一次喷施2 d后全株喷雾接种供试菌孢子悬浮液((1—2)×106个孢子/mL),在接种孢子悬浮液之前用注射器将番茄苗茎基部刺伤,注意伤口不能太大。然后再罩上塑料薄膜保湿24 h,接种后2 d内植株遮阴处理,并用加湿器提高温室内的相对湿度,相对湿度控制在不低于90%,温度为(10±5)℃,第3天正常光照。接种后15 d调查番茄植株发病情况,计算病情指数和相对防效。对照组以蒸馏水代替灵芝多糖处理植株后接种孢子悬浮液,各个处理组均设3组重复,每组重复10株植株。番茄灰霉病发病程度分级标准参照陆家云等[16]的标准。0级:无病斑,叶片无症状,植株健康;1级:病斑面积占总叶片的10%以下,叶脉间黄化;2级:病斑面积占总叶片的10%—50%,叶脉变黄且萎蔫;3级:病斑面积占总叶片的50%以上,整个植株萎蔫;4级:植株死亡。

1.2.3 灵芝多糖浸种下番茄种子和幼苗生长活性的测定 选取籽粒饱满一致的番茄种子分别在50、100、200和400 mg·L-1灵芝多糖溶液中浸泡8 h后置于铺有3层滤纸的培养皿(内径9.0 cm)中,每个处理50粒种子,3次重复,加5 mL蒸馏水,对照组用等量蒸馏水处理,定时补充定量的蒸馏水保持滤纸湿润,在(25±1)℃恒温箱内催芽7 d后记录不同处理组番茄种子的发芽率和芽长。将不同处理组的番茄种子播种到育苗盘中育苗,当2片子叶完全展开后挑选生长一致的番茄幼苗移栽到塑料花盆中(育苗基质∶土壤=1∶1)。每个处理设置3次重复,每个重复10株番茄幼苗。番茄幼苗生长20 d后记录番茄幼苗的株高和鲜重等生长参数。
1.2.4 灵芝多糖对番茄相关防御酶活性影响的测定参照1.2.2的方法,选取诱导效果最佳浓度的灵芝多糖处理番茄植株以及2 d后接种供试菌种孢子悬浮液。对灵芝多糖诱导番茄抗灰霉病的生理机制进行研究,试验设计如下4个处理:清水(CK);不经灵芝多糖处理接种番茄灰霉菌(CK-接种);经灵芝多糖处理但不接种番茄灰霉菌(GLP);经灵芝多糖处理并接种番茄灰霉菌(GLP-接种)。粗酶液的制备参照刘太国等[17]略有改动。于植株接种番茄灰霉菌后1—7 d,分别取番茄植株第3—4片展开叶(未经诱导处理)用于测定过氧化氢酶(CAT)、多酚氧化酶(PPO)和过氧化物酶(POD)的活性。
(1)CAT活性的测定 参照邹琦[18]的方法。测定240 nm下的吸光度,以1 min内OD值变化0.01为1个酶活单位(U·min-1·g-1FW)。
(2)PPO活性的测定 参考邻苯二酚法[19]。PPO以每克叶片鲜质量每分钟OD值变化0.01为1个酶活单位(U·min-1·g-1FW)。
(3)POD活性的测定 参考愈创木酚法[20]。POD以每克叶片鲜质量每分钟OD值变化0.01为1个酶活单位(U·min-1·g-1FW)。
1.2.5 灵芝多糖对番茄丙二醛含量影响的测定 参照李合生[21]的方法采用硫代巴比妥酸法测定丙二醛的含量(μmol·g-1)。
1.2.6 灵芝多糖对番茄叶片叶绿素含量影响的测定叶绿素含量测定参考彭运生等[22]的方法,接种番茄灰霉菌后第15天取样测定叶绿素含量,包括叶绿素a、叶绿素b和总叶绿素含量。具体过程为取不同处理番茄植株同一部位叶片0.1 g(未经多糖诱导),液氮研磨后置于盛有9 mL丙酮和无水乙醇配置的混合浸提液(v∶v=2∶1)中,置于暗处观察叶片完全变白为准,以混合浸提液作为空白调零,测定663、645 nm处吸光度值。
1.3 数据处理
采用 Excel 2003和 SPSS16.0软件 One-Way ANOVA中LSD法对数据进行处理和分析。
2 结果
2.1 灵芝多糖含量的测定
葡萄糖标准曲线如图 1所示,线性回归方程为y=0.0088x+0.2929,线性方程相关系数为0.9933,线性关系良好。根据待测灵芝多糖溶液的吸光度0.52,计算灵芝多糖的有效含量为25.8%。

图1 葡萄糖标准曲线Fig. 1 Standard curve of glucose
2.2 灵芝多糖对番茄抗灰霉病的诱导作用
在50—400 mg·L-1灵芝多糖处理后,番茄感染灰霉病的程度有所降低,病情指数均较对照有所下降,但在较低浓度灵芝多糖范围内病情指数与对照组间差异不显著。其中400 mg·L-1灵芝多糖病情指数最小为32.96,相对防效达到33.07%,诱导效果最佳(表1)。
2.3 灵芝多糖浸种对番茄种子发芽和幼苗生长的影响
50—400 mg·L-1灵芝多糖对番茄种子发芽率、芽长、幼苗株高、植株质量均表现出一定的促进作用。其中 200 mg·L-1灵芝多糖浸泡的番茄种子发芽率最高,达87.3%,比对照的发芽率77.3%提高了10.0%;且该处理对番茄幼苗的株高和地上部分鲜重的促进作用也最大,分别较对照增加了12.9%和33.3%;经100 mg·L-1灵芝多糖处理后番茄幼苗的芽长和地下部分鲜重变化最大,分别比对照组提高了0.16 cm和0.33 g。但是经不同浓度多糖处理后的番茄种子芽长和地下部分鲜重之间差异性不显著(表2)。
2.4 灵芝多糖对番茄抗灰霉病诱导机制
2.4.1 灵芝多糖处理对番茄幼苗叶片保护酶活性的影响 由图2-A可知,在整个取样过程中,CK组的CAT活性变化平稳,变化范围在 60—85 U·min-1·g-1FW;在取样第2天,GLP处理组CAT活性达到最大(122 U·min-1·g-1FW),是CK组的1.69倍;在取样第3天,GLP-接种处理组CAT活性达到峰值(162 U·min-1·g-1FW),是CK组的2.13倍;之后缓慢下降,在取样的7 d内,GLP和GLP接种处理组CAT活性均明显高于CK组。表明GLP具有诱导CAT活性升高的作用,GLP-接种处理的诱导效果明显高于GLP单独处理。CK接种处理组CAT活性在前4 d比CK组增加,且在接种第2天达到峰值,是CK组的1.29倍,之后逐渐降低。可见接种病原菌可以短时间内刺激番茄植株体内CAT活性的表达,但是持续时间较短。
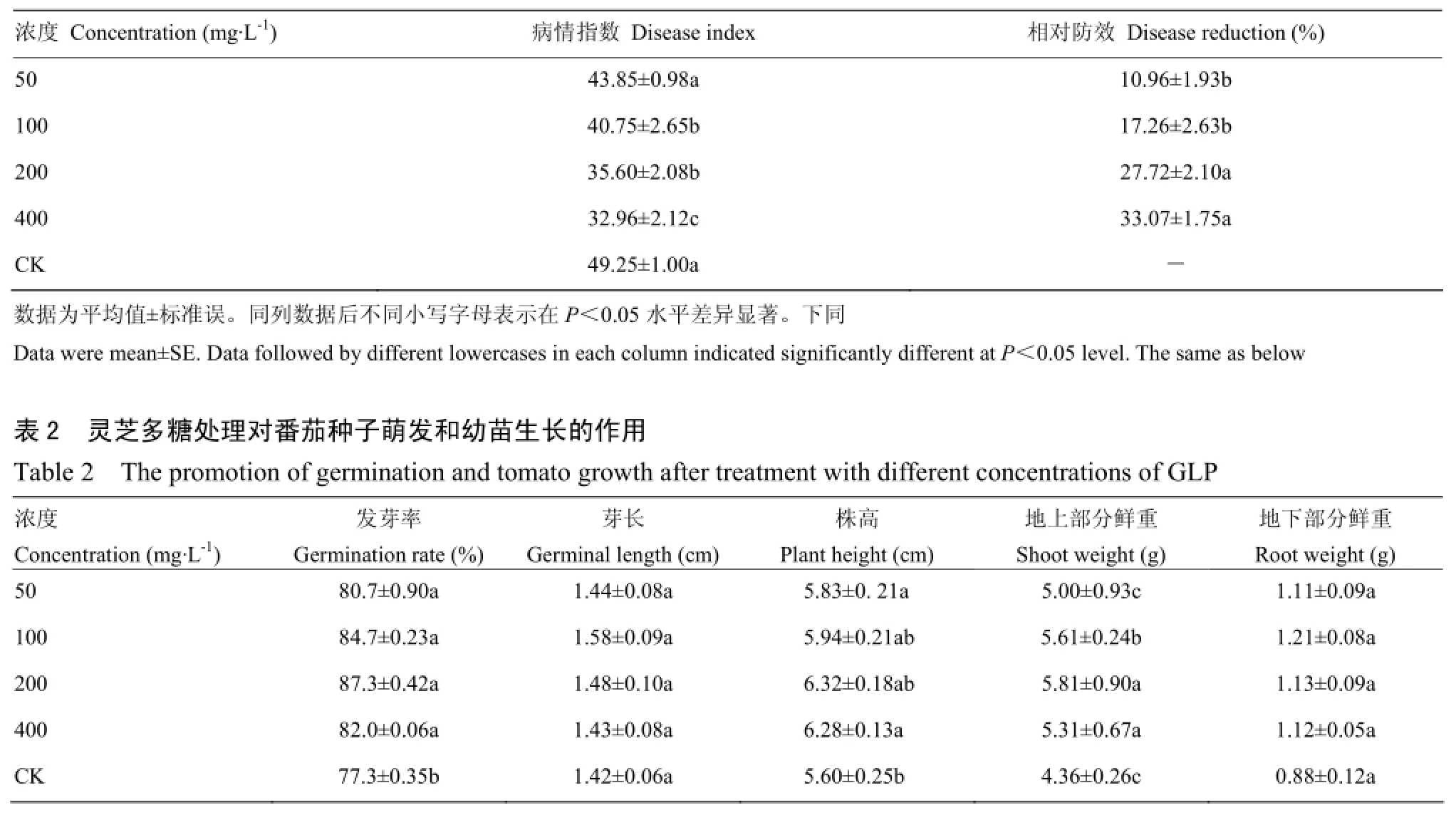
表1 不同浓度灵芝多糖的诱导效果Table 1 The induced resistance with different concentrations of GLP
由图2-B可知,在整个取样过程中,CK组的POD活性呈缓慢上升的趋势;在取样第4天,GLP-接种处理组POD活达到最大(434 U·min-1·g-1FW),是CK组的3.29倍。GLP处理组在整个处理过程中呈持续上升的趋势,但明显低于GLP-接种处理组的POD活性,两处理组在处理的7 d内,POD活性升高值比CK组高得多。表明GLP具有诱导POD活性升高的作用,GLP-接种处理的诱导效果明显高于 GLP单独处理,GLP-接种处理的最佳诱导时间为接种后第 4天;CK接种处理组POD活性变化显著,在取样的7 d,POD活性显著高于CK处理组,可见接种病原菌可以有效刺激番茄植株体内POD活性的表达。
由图2-C可知,在整个取样过程中,CK组的PPO活性呈先上升后下降的趋势,PPO活性变化范围在40 —60 U·min-1·g-1FW,保持在一个平稳的水平;在取样第 3天,GLP-接种处理组 PPO活性达到最大(98 U·min-1·g-1FW),是CK组的1. 71倍,之后略有下降,但基本上维持在恒定水平,第7 天时PPO活性为90 U·min-1·g-1FW。GLP处理组在处理第3天时,PPO活性达到最大(80 U·min-1·g-1FW),是CK组的1.37倍,之后PPO活性迅速下降,明显低于GLP-接种处理组的PPO活性,两处理组在处理的7 d内,PPO活性均明显高于CK组。表明GLP具有诱导PPO活性升高的作用,GLP-接种处理的诱导效果明显高于GLP单独处理,GLP-接种处理的最佳诱导时间为接种后第3天,经GLP-接种处理的番茄植株PPO活性的持效期明显比GLP单独处理的持效期长,在第7天取样时,PPO仍保持一定的活性;CK接种处理组PPO活性在处理3 d内变化显著,PPO活性较CK组迅速上升,于第3天达到峰值76 U·min-1·g-1FW,明显高于CK组PPO活性。之后PPO活性迅速下降,与CK组PPO活性基本一致。可见接种病原菌对番茄植株体内PPO的活性有明显的刺激作用,但是作用时间短,持续期不长。
2.4.2 灵芝多糖处理对番茄幼苗叶片丙二醛含量的影响 由图2-D可知,接种处理组中丙二醛的含量较未接种处理组变化显著,CK-接种处理组在取样期间内MDA含量持续上升,而GLP-接种处理组在取样期间内MDA含量呈先上升后趋于平稳的趋势变化,且CK-接种处理组在取样期间内MDA含量显著高于GLP-接种处理组的MDA含量。而未接种处理组CK、GLP处理组MDA含量变化平稳,在取样前5 d内,GLP处理组MDA含量较CK处理组有明显下降的趋势。

图2 灵芝多糖处理对番茄叶片保护酶活性及丙二醛含量的影响Fig. 2 Dynamic curve of protective enzyme activities and content of MDA after GLP treatment in tomato
2.4.3 灵芝多糖处理对番茄幼苗叶片叶绿素含量的影响 接种番茄灰霉菌处理组的叶片叶绿素含量明显低于未接种处理组,其中只接种灰霉菌(接种处理组)的叶绿素含量又明显低于经 GLP处理后又接种灰霉菌的植株(GLP-接种);未经GLP处理而接种番茄灰霉菌的植株叶片内叶绿素a、叶绿素b及总叶绿素含量比经 GLP处理后接种的植株分别下降 26.5%、33.3%和45.6%,而喷施灵芝多糖后接种的番茄植株叶绿素a、叶绿素b及总叶绿素含量比健康植株(CK组)处理组分别下降19%、6.6%和1.6%(图3)。
3 讨论
迄今为止,国内外已有许多文献报道食药菌多糖具有激活植物机体免疫、诱导植株自身产生抗病性,使植株获得系统抗病性(systemic acquired resistance,SAR)[23-27]。前期研究发现灵芝多糖与香菇多糖、壳寡糖等激发子具有同一基本骨架β-1,3 glucan结构,而β-1,3 glucan在对烟草花叶病、葡萄灰霉病的防治方面已表现出显著的诱导抗病活性。本文通过叶面喷雾法喷施不同浓度的灵芝多糖,均可有效诱导番茄对灰霉病的抗病性,400 mg·L-1的灵芝多糖诱导效果最佳,相对防效为33.07%,产生系统抗病性反应。番茄灰霉病是保护地番茄生产的毁灭性病害,在田间生产上已造成大面积的减产,严重威胁着番茄产业的发展。本研究通过喷施灵芝多糖能够对番茄抗灰霉病起到一定的诱导效应,提高了番茄叶片保护酶的活力,而番茄叶片保护酶活力的水平在一定程度上反映了植株的抗病能力。CAT和POD具有清除自由基,延缓植物衰老的功能[28-29]。PPO是植保素、木质素、酚类和醌类等物质的合成过程的关键酶,促使细胞壁木质化从而减少病原菌对植物的损伤[30],已有研究证明PPO活性的变化是植物抗病性的重要生理指标[31]。本试验中经灵芝多糖诱导后接种番茄灰霉病病原菌的植株体内CAT、POD和PPO活性均较对照组有所提高,相应增强了番茄植株防御灰霉病侵染的能力,在灵芝多糖诱导7 d内,番茄植株体内CAT、POD和PPO保持较高的活性,说明灵芝多糖的诱导作用不仅能够阻止番茄灰霉病菌对植株的侵染,同时还具有一定的持效性,这在一定程度上降低了灰霉病的发展,以便采取其他综合防治策略来控制病害。MDA是膜脂过氧化作用的产物之一,作为膜脂过氧化的一个重要指标,反映细胞膜损伤程度和植物对逆境条件反应的强弱[32]。本试验中经灵芝多糖诱导后接种番茄灰霉病病原菌的植株MDA含量明显低于CK接种处理组的含量,表明经灵芝多糖处理番茄植株接种病原菌后对MDA含量有一定的抑制作用,从而可减少膜质过氧化作用对细胞的伤害,提高植株对病害的抗逆能力,这一结果也与其他诱抗剂作用植株中MDA含量变化相一致[33-34];由于没有病原菌的作用,所以CK组与GLP处理组MDA含量变化不显著。本研究中,经灵芝多糖处理后,番茄叶片保护酶的活力有所提高并在一定程度上抑制了丙二醛含量的积累,而保护酶活性的增强和丙二醛含量的抑制均可减轻病原菌对番茄植株的损伤,从而起到诱导植株抗病的作用。植株叶绿素含量的高低直接反映着光合作用的强弱,含量越高,光合作用越强。光合作用是植株的重要代谢过程,是衡量植株抗病性强弱的一个重要指标[35]。本试验中经过灵芝多糖处理的番茄植株接种灰霉菌(GLP-接种组)15 d后,植株叶片内叶绿素a、叶绿素b和总叶绿素含量与对照接种组(CK-接种组)相比均有所上升,其原因可能是经灵芝多糖诱导后刺激了番茄体内木质素和植保素的合成,而木质素和植保素均可对病原菌的浸染起到保护作用,从而减小了真菌对植株组织叶绿体的破坏。医用灵芝多糖是从灵芝子实体中提取得到,因灵芝子实体既是医药原料[36-37],也是具有保健作用的食材[38],所以灵芝多糖作为抗病诱导剂及生物农药的开发,势必与前两者存在原料上的竞争性。为此,本研究还从栽培灵芝的废弃物菌糠中提取灵芝多糖进行了试验,成功从菌糠中提取制备了灵芝多糖,其提取率可达 0.36%,从灵芝子实体和菌糠中提取的灵芝多糖,在相同浓度下其诱导活性基本一致。提取灵芝多糖后的菌糠能用于有机肥生产,可形成灵芝栽培、多糖提取和菌糠充分利用的高效循环产业体系。不仅实现了资源的充分利用,还大大降低了制取灵芝多糖的成本,同时也为灵芝培养基废弃物的综合利用,变“废”为“宝”开辟一条新的途径,具有广阔的应用前景。
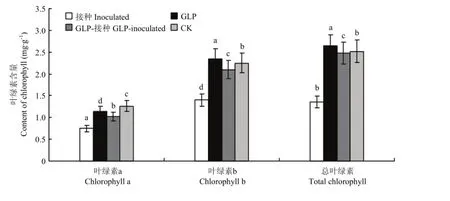
柱上不同小写字母表示各处理经LSD多重比较在P=0.05水平差异显著Means followed by different lowercases in each column indicated significant differences at P=0.05 level by LSD's multiple comparison图3 灵芝多糖处理对番茄叶片叶绿素含量的影响Fig. 3 Effects of GLP treatment in tomato leaves on the chlorophyll content
由于番茄灰霉病发病迅速,从发病到蔓延一般只需7—12 d。诱导剂的效果不易发挥,灵芝多糖作为抗病诱导剂单独使用防治番茄灰霉病效果不十分显著,实践证明香菇多糖诱导剂与杀菌剂氟醚菌酰胺混用,在黄瓜霜霉病的预防中比单独使用香菇多糖诱导剂或杀菌剂氟醚菌酰胺效果好,在达到相同防治效果的前提下,杀菌剂氟醚菌酰胺的用药量减少25%,不仅可以有效减少杀菌剂的使用量,还可以提高对有害生物的防治效果[39]。表明多糖类诱导剂与杀菌剂混用具有提高防效、减少杀菌剂用药量的显著效果。符合当代农业减少农药用量,降低产品中农药残留的发展战略,将成为将来病害防治的主要方向。
4 结论
对灵芝多糖的诱导活性试验证明一定质量浓度的灵芝多糖能够诱导番茄抗灰霉病,显著提高了番茄植株体内保护酶的活性;经灵芝多糖诱导的番茄植株体内叶绿素和丙二醛含量与对照组相比也有显著的变化;适量浓度的灵芝多糖对番茄种子发芽率和番茄幼苗生长均表现出一定的促进作用。
References
[1] ROMANAZZI G, SMILANICK J L, FELIZIANI E, DROBY S. Integrated management of postharvest gray mold on fruit crops. Postharvest Biology and Technology, 2016, 113: 69-76.
[2] CHAI A L, XIE X W, SHI Y X, WANG H J, LI B J. Grey mould caused by Botrytis cinerea on greenhouse-grown fennel in China. Canadian Journal of Plant Pathology, 2015, 37(2): 237-241.
[3] 李保聚, 朱国仁, 赵奎华, 乔勇. 番茄灰霉病在果实上的侵染部位及防治新技术. 植物病理学报, 1999, 29(1): 64-68. LI B J, ZHU G R, ZHAO K H, QIAO Y. Infection gates of grey mould of tomato fruits and a new technique for its controlling. Acta Phytopathologica Sinica, 1999, 29(1): 64-68. (in Chinese)
[4] CAO Y, WU S H, DAI Y C. Species clarification of the prize medicinal Ganoderma mushroom “Lingzhi”. Fungal Diversity, 2012,56(1): 49-62.
[5] HABIJANIC J, BEROVIC M, BOH B, PLANKL M, WRABER B. Submerged cultivation of Ganoderma lucidum and the effects of its polysaccharides on the production of human cytokines TNF-α, IL-12,IFN-γ, IL-2, IL-4, IL-10 and IL-17. New Biotechnology, 2015, 32(1):85-95.
[6] 何晋浙, 邵平, 孟祥河, 孙培龙. 灵芝多糖的结构特征分析. 分析化学, 2010, 38(3): 372-376. HE J Z, SHAO P, MENG X H, SUN P L. Analysis of structural characteristics of polysaccharide from Ganoderma lucidum. Chinese Journal of Analytical Chemistry, 2010, 38(3): 372-376. (in Chinese)
[7] WANG J, YUAN Y, YUE T. Immunostimulatory activities of β-D-glucan from Ganoderma lucidum. Carbohydrate Polymers, 2014,102: 47-54.
[8] SASAKI T, TAKASUKA N. Further study of the structure of lentinan,an anti-tumor polysaccharide from Lentinus edodes. Carbohydrate Research, 1976, 47(1): 99-104.
[9] 王杰, 王开运, 张骞, 朱玉坤, 姜莉莉. 海带多糖对烟草花叶病毒的抑制作用及其对烟草酶活性的影响. 植物保护学报, 2011, 38(6):532-538. WANG J, WANG K Y, ZHANG Q, ZHU Y K, JIANG L L. Inhibition of laminarin against TMV and effect on protective enzymes in tobacco. Acta Phytophylacica Sinica, 2011, 38(6): 532-538. (in Chinese)
[10] 张文清, 夏玮, 程俞, 张元兴. 不同分子量壳多糖对植物病菌的拮抗作用及其诱导提高寄主植物抗病性. 植物保护学报, 2004, 31(3):235-240. ZHANG W Q, XIA W, CHENG Y, ZHANG Y X. Bacteriostatic effect of chitosans with different molecular weights to phytopathogenic fungic and inducing defense responses. Acta Phytophylacica Sinica,2004, 31(3): 235-240. (in Chinese)
[11] WANG J, WANG H Y, XIA X M, LI P P, WANG K Y. Synergistic effect of Lentinula edodes and Pichia membranefaciens on inhibition of Penicillium expansum infections. Postharvest Biology and Technology, 2013, 81: 7-12.
[12] 王文霞, 赵小明, 杜昱光, 尹恒. 寡糖生物防治应用及机理研究进展. 中国生物防治学报, 2015, 31(5): 757-769. WANG W X, ZHAO X M, DU Y G, YIN H. Progress on application and mechanism of oligosaccahrides in plant biocontrol response. Chinese Journal of Biological Control, 2015, 31(5): 757-769. (in Chinese)
[13] GOKCE E C, KAHVECI R, ATANUR O M, GÜRER B, AKSOY N, GOKCE A, SARGON M F, CEMIL B, ERDOGAN B, KAHVECI O. Neuroprotective effects of Ganoderma lucidum polysaccharides against traumatic spinal cord injury in rats. Injury, 2015, 46(11):2146-2155.
[14] LIU Z G, XING J, HUANG Y, BO R N, ZHENG S S, LUO L, NIU YL, ZHANG Y, HU Y L, LIU J G, WU Y, WANG D Y. Activation effect of Ganoderma lucidum polysaccharides liposomes on murine peritoneal macrophages. International Journal of Biological Macromolecules, 2016, 82: 973-978.
[15] 白丹, 常迺滔, 李大海, 刘继霞, 尤雪颜. 灵芝多糖抑菌活性初探.华北农学报, 2008, 23(增刊): 282-285. BAI D, CHANG N T, LI D H, LIU J X, YOU X Y. Antiblastic activitiy of Ganoderma lucidum polysaccharides. Acta Agriculturae Boreali-Sinica, 2008, 23(S1): 282-285. (in Chinese)
[16] 陆家云, 佘长夫, 鞠理红, 方中达. 江苏省棉花黄萎病菌(Verticillium dahliae) 致病力的分化. 南京农学院学报, 1983, 6(1): 36-43. LU J Y, SHE C F, JU L H, FANG Z D. Studies on differentiation of the Verticillium dahliae Kleb. in Jiangsu Province. Journal of Nanjing Agricultural College, 1983, 6(1): 36-43. (in Chinese)
[17] 刘太国, 石延霞, 文景芝, 李永镐. 水杨酸诱导烟草对 TMV的抗性和PAL活性变化研究. 植物病理学报, 2003, 33(2): 190-191. LIU T G, SHI Y X, WEN J Z, LI Y H. Changes of the PAL activity and induced resistance to TMV in tobacco treated with SA and inoculated with TMV. Acta Phytopathologica Sinica, 2003, 33(2):190-191. (in Chinese)
[18] 邹琦. 植物生理生化试验指导. 北京: 中国农业出版社, 1995. ZOU Q. Experimental Guidance of Plant Physiology and Biochemistry. Beijing: China Agriculture Press, 1995. (in Chinese)
[19] 王锋, 高仁君, 李健强, 吴学宏, 耿平田.醚唑种衣剂对小麦幼苗生长及抗病性相关酶活性的影响. 植物病理学报, 2000, 30(3):213-216. WANG F, GAO R J, LI J Q, WU X H, GENG P T. Effect of difenoconazole on the growth and activities of disease resistancerelated enzymes in wheat seedlings from treated seeds. Acta Phytopathologica Sinica, 2000, 30(3): 213-216. (in Chinese)
[20] 郝再彬, 苍晶, 徐仲. 植物生理实验. 哈尔滨: 哈尔滨工业大学出版社, 2004. HAO Z B, CANG J, XU Z. Plant Physiology Experiment. Harbin:Harbin Institute of Technology Press, 2004. (in Chinese)
[21] 李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社,2000. LI H S. The Experiment Principle and Technique for Plant Physiology and Biochemistry. Beijing: Higher Education Press, 2000. (in Chinese)
[22] 彭运生, 刘恩. 关于提取叶绿素方法的比较研究. 北京农业大学学报, 1992, 18(3): 247-250. PENG Y S, LIU E. The comparative study of chlorophyll extraction method. Acta Agriculturae Universitatis Pekinensis, 1992, 18(3):247-250. (in Chinese)
[23] RYAN C A. Oligosaccharide signals: from plant defense to parasite offense. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(1): 1-2.
[24] 朱英波, 史凤玉, 张瑞敬, 吴楠, 宋士青. 壳寡糖和钕复合处理诱导黄瓜对枯萎病的抗性. 中国生物防治学报, 2014, 30(4): 528-533. ZHU Y B, SHI F Y, ZHANG R J, WU N, SONG S Q. Effects of chitosan oligosaccharides in combination with neodymium on resistance of cucumbers to fusarium wilts. Chinese Journal of Biological Control, 2014, 30(4): 528-533. (in Chinese)
[25] HE P Q, TIAN L, CHEN K S, HAO L H, LI G Y. Induction of volatile organic components of Lycopersicon esculentum Mill. and its resistance to Botrytis cinerea Pers. by burdock oligosaccharise. Journal of Integrative Plant Biology, 2006, 48(5): 550-557.
[26] WANG J, WANG H Y, XIA X M, LI P P, WANG K Y. Inhibitory effects of sulfated lentinan and lentinan against Tobacco mosaic virus (TMV) in tobacco seedings. International Journal of Biological Macromolecules, 2013, 61: 264-269.
[27] 侯艳杰, 刘娜, 李翠香, 卫雁南. 牛蒡寡糖诱导对小麦白粉病抗性的影响. 麦类作物学报, 2009, 29(3): 540-542. HOU Y J, LIU N, LI C X, WEI Y N. Effect of induction by burdock oligosaccharide on powdery mildew resistance in wheat. Journal of Triticeae Crops, 2009, 29(3): 540-542. (in Chinese)
[28] PARK M S, GO P G, CHOI Y K, AN K W, CHOI C Y. Characterization and mRNA expression of Mn-SOD and physiological responses to stresses in the Pacific oyster Crassostrea gigas. Marine Biology Research, 2009, 5(5): 451-461.
[29] BURONATUIO R, TORRE D G, MONTALBINI P. Soluble superoxide dismutase (SOD) in susceptible and resistant host-parasite complexes of Phaseolus vulgaris and Uromyces phaseoli. Physiological and Molecular Plant Pathology, 1987, 31: 173-184.
[30] LI Y N, HOU L G, QI C Y, SUN H J, LIU L, SUI P J, GUO X M,ZHAO G C. Effects of different levels of phosphorus nutrient on the photosynthesis characteristic of rice flag leaf. Agricultural Science & Technology, 2010, 11(6): 11-14.
[31] MISHRA B B, GAUTAM S, SHARMA A. Purification and characterisation of polyphenol oxidase (PPO) from eggplant (Solanum melongena). Food Chemistry, 2012, 134(4): 1855-1861.
[32] SONG M Z, FAN S L, PANG C Y, WEI H L, YU S X. Genetic analysis of the antioxidant enzymes, methane dicarboxylic aldehyde (MDA) and chlorophyll content in leaves of the short season cotton (Gossypium hirsutum L.). Euphytica, 2014, 198(1): 153-162.
[33] 翟彩霞, 马春红, 王立安, 陈霞, 郭秀林, 崔四平, 李广敏. 玉米在诱导抗病过程中丙二醛 (MDA) 含量的变化. 玉米科学, 2005, 13(1): 77-78, 82. ZHAI C X, MA C H, WANG L A, CHEN X, GUO X L, CUI S P, LI G M. The changes of malondialdenyde concentration of the induced disease-resistance. Journal of Maize Sciences, 2005, 13(1): 77-78, 82. (in Chinese)
[34] 孙翠红, 徐翠莲, 赵铭钦, 黄元炯, 黄海棠, 朱金峰. 壳寡糖衍生物纳米银微粒诱导烟株产生 TMV 抗性. 中国烟草学报, 2015, 21(6): 59-64. SUN C H, XU C L, ZHAO M Q, HUANG Y J, HUANG H T, ZHU J F. Study on TMV resistance of tobacco plants induced by chitosan oligosaccharide derivatives silver nanoparticles. Acta Tabacaria Sinica, 2015, 21(6): 59-64. (in Chinese)
[35] SRIVASTAVA A, STRASSER R J, GOVINDJEE. Differential effects of dimethylbenzoquinone and dichlorobenzoquinone on chlorophyll fluorescence transient in spinach thylakoids. Journal of Photochemistry & Photobiology B Biology, 1995, 31(3): 163-169.
[36] LIU Y J, DU J L, CAO L P, JIA R, SHEN Y J, ZHAO C Y, XU P,YIN G J. Anti-inflammatory and hepatoprotective effects of Ganoderma lucidum polysaccharides on carbon tetrachloride-induced hepatocyte damage in common carp (Cyprinus carpio L.). International Immunopharmacology, 2015, 25(1): 112-120.
[37] LI A M, SHUAI X Y, JIA Z J, LI H Y, LIANG X B, SU D M, GUO W H. Ganoderma lucidum polysaccharide extract inhibits hepatocellular carcinoma growth by downregulating regulatory T cells accumulation and function by inducing microRNA-125b. Journal of Translational Medicine, 2015, 13(1): 100.
[38] BATRA P, SHARMA A K, KHAJURIA R. Probing Lingzhi or Reishi medicinal mushroom Ganoderma lucidum (higher Basidiomycetes): a bitter mushroom with amazing health benefits. International Journal of Medicinal Mushrooms, 2013, 15(2): 127-143.
[39] 李鹏鹏. 香菇多糖诱导黄瓜抗霜霉病的作用及与氟醚菌酰胺混效作用的研究[D]. 泰安: 山东农业大学, 2014. LI P P. The effect of lentinan on induce cucumber against downy mildew and mix with LH-2010A[D]. Taian: Shandong Agricultural University, 2014. (in Chinese)
(责任编辑 岳梅)
Induced Resistance by Polysaccharides Isolated from Ganoderma lucidum in Tomato Against Gray Mold
NING Yu-bo1, WANG Hong-yan2, QIAO Kang1, LIU Xiu-mei1, WANG Kai-yun1
(1College of Plant Protection, Shandong Agriculture University, Tai'an 271018, Shandong;2Cotton Research Center, Shandong Academy of Agricultural Sciences, Jinan 250100)
Abstract:【Objective】The systemic long-lasting and broad-spectrum resistance was induced with natural or synthetic compounds. The objective of this study is to investigate the induced resistant effect of polysaccharide extracted from the fruiting body of Ganoderma lucidum (GLP) in tomato against gray mold.【Method】The 1-2 true leaf of tomato plants were sprayed with polysaccharides (50, 100, 200 and 400 mg·L-1)for 3 times once every 2 days and inoculated spore suspension of Botrytis cinerea after 2 days later of the last time GLP treatment ((1-2)×106spores/mL), meanwhile, the plants treated with the same volume of distilled water used as control instead of GLP solution and inoculated spore suspension of B. cinerea. A syringe stabbed the stem of tomato plant before inoculated spore suspension. Covering plastic film in order to moisturize 24 h and keeping humidity the 2 days of inoculating spore suspension of B. cinerea, the greenhouse relative humidity was not less than 90% and temperature was (15±5) ℃,normal light was recovered 3 days later. The disease index and disease reduction against gray mold in tomato plants was investigated. Simultaneously, the tomato seedlings were soaked in the concentration (50, 100, 200 and 400 mg·L-1) of polysaccharides and then cultivated in pots. The germination rate, root length and plant height, shoot weight, fresh weight of tomato seedlings were measured 20 days after treatment with polysaccharides. 【Result】Compared with the clear water control's disease index 49.25, the GLP treatment groups' disease index were between with 32.96-43.85, significantly reduced, it was found that the lowest disease index 32.96 at the concentration of 400 mg·L-1GLP treatment and the disease reduction was 33.07%. The activity of protective enzyme in leaves showed different dynamic changes after GLP treatment, catalase (CAT) and polyphenoloxidase (PPO) activities remarkably increased, and the activities reached the highest peak after 3 days of induction. The highest CAT (162 U·min-1·g-1FW) and PPO (98 U·min-1·g-1FW) were 2.13 and 1.71 times compared with the control group, respectively. Peroxidase (POD) activity reached the highest peak after 4 days of induction then decreased gradually, significantly higher than the control. The highest POD (434 U·min-1·g-1FW) was 3.29 times compared with the control groups. MDA content after application of GLP showed a down trend compared to that of control. When the seed was treated with polysaccharides, the germination rate, root length and plant height, shoot weight, root weight of tomato seedlings all increased to a certain degree. The treatment at the concentration of 200 mg·L-1GLP showed the highest germination rate 87.3%, 10.0% higher than the control group germination rate 77.3%. Simultaneously, the treatment at the concentration of 200 mg·L-1GLP showed the highest promotion in the tomato plant height and shoot weight,enhanced 12.9% and 33.3% respectively than the control. The tomato seed germinal length and root weight enhanced 0.16 cm and 0.33 g respectively than the control at the concentration of 100 mg·L-1GLP.【Conclusion】GLP at appropriate concentration had the ability to induce systematic resistance against gray mold. In addition, GLP promoted the growth of tomato seedlings.
Key words:Ganoderma lucidum polysaccharides; tomato; gray mold; induced resistance; defensive enzymes
收稿日期:2016-01-25;接受日期:2016-03-25
基金项目:国家科技支撑计划(2014BAD05B03)、山东省自然科学基金青年基金(ZR2015CQ024)

