大豆和膨化大豆主要抗营养因子分析
姚怡莎,谷 旭,商方方,邱 静,李军国,李 俊
(1中国农业科学院饲料研究所,北京 100081;2中国农业科学院农业质量标准与检测技术研究所,北京 100081)
大豆和膨化大豆主要抗营养因子分析
姚怡莎1,谷旭1,商方方1,邱静2,李军国1,李俊1
(1中国农业科学院饲料研究所,北京 100081;2中国农业科学院农业质量标准与检测技术研究所,北京 100081)
摘要:【目的】大豆含有丰富的营养物质,除了作为食品原料外也是重要的饲料原料,但大豆所含抗营养因子限制了其在食品及饲料行业中的应用。挤压膨化工艺能够在基本保持大豆营养成分的基础上,降低其抗营养因子的含量,从而减小对人和动物健康的负面作用。调查分析市售大豆和膨化大豆中主要几种抗营养因子的差异,分析挤压膨化加工工艺对大豆中主要抗营养因子的消除降解作用,并对这几种主要抗营养因子的含量及活性给出置信范围,为膨化企业实际生产应用中选择优质原料及优化加工工艺提供参考,并对动物饲料的配方设计提供指导。【方法】采集市场上不同地区及厂家的大豆20批次和膨化大豆19批次,检测其中胰蛋白酶抑制因子、抗原蛋白(包括大豆球蛋白和β-伴大豆球蛋白)、低聚糖(包括水苏糖和棉籽糖)等抗营养因子的含量和脲酶活性,并与在膨化加工企业采集的2批次大豆原料和在不同加工条件下制备的8批次膨化大豆中相应抗营养因子的含量进行比较分析。其中胰蛋白酶抑制因子和抗原蛋白采用酶联免疫法测定;低聚糖采用高效液相色谱法(HPLC)测定,示差检测器检测。同时通过提取方式、活性炭用量、提取液浓度、料液比单因素试验,对苏糖和棉籽糖两种低聚糖的提取方法进行优化。综合分析检测结果,研究挤压膨化工艺对大豆主要抗营养因子含量或活性的影响。【结果】优化后的提取方法如下:称取一定质量的样品以料液比 1∶25加入体积分数为70%乙醇水溶液,微波辅助提取,离心浓缩,定容至25 mL,涡旋混匀,取2 mL离心检测。膨化大豆中胰蛋白酶抑制因子、抗原蛋白的含量及脲酶活性均显著低于大豆原料,而大豆和膨化大豆中的低聚糖含量没有显著差异。膨化大豆中脲酶活性基本为 0,比大豆的脲酶活性低 99%以上,胰蛋白酶抑制因子含量比大豆约降低66%,大豆球蛋白的含量约降低67%,β-伴大豆球蛋白含量降低 90%以上,水苏糖和棉籽糖的总含量基本保持不变。推断市场上大豆原料中的胰蛋白酶抑制因子的含量范围为32.5—89.6 mg·g-1,大豆球蛋白含量范围为91.0—143.1 mg·g-1,β-伴大豆球蛋白的含量范围为161.1—268.7 mg·g-1,棉籽糖含量范围为 3.3—8.78 mg·g-1,水苏糖的含量范围在 21.4—34.16 mg·g-1,脲酶活性范围为3.6—9.42 U·g-1;膨化大豆样品中胰蛋白酶抑制因子含量范围为10.7—31.1 mg·g-1,大豆球蛋白含量范围为17.7—64.5 mg·g-1,β-伴大豆球蛋白含量范围为9.3—57.5 mg·g-1,棉籽糖含量范围为4.25—10.21 mg·g-1,水苏糖的含量范围为17.68—34.15 mg·g-1,脲酶活性范围为0.00—0.02 U·g-1。【结论】挤压膨化过程能显著降低大豆中主要抗营养因子的含量,从而减少这些因子带来的不良反应,并能提高大豆营养物质的利用率。
关键词:大豆;膨化大豆;挤压膨化;抗营养因子;营养成分
联系方式:姚怡莎,E-mail:yaoyisha521@163.com。通信作者李俊,E-mail:Lijun08@caas.cn
0 引言
【研究意义】大豆是人类重要的食品来源,蛋白质和脂肪的含量很高,分别为 36%—40%和 18%—22%,含有人体需要的多种必需氨基酸和必需脂肪酸,用做饲料也是动物营养成分和能量的重要来源[1],但大豆中含有的多种抗营养因子(Antinutritional factors,ANFs)限制了大豆在饲料中的应用。这些抗营养因子主要包括胰蛋白酶抑制因子(Trypsin inhibitor,TI)、抗原蛋白(Antigen protein)、低聚糖(Oligosaccharide,OS)、脲酶(Urease)、大豆凝集素(Soybean agglutinin)、植酸(Phytic acid)和单宁(Tannin)。胰蛋白酶抑制因子能够抑制机体内胰蛋白酶和糜蛋白酶的活性,导致蛋白质消化率和利用率降低,动物生长迟缓,饲料转化率降低,胰腺肥大和增生,消化吸收功能紊乱,严重时出现腹泻,甚至导致肿瘤发生[2]。大豆中的抗原蛋白对动物尤其是幼龄动物(如仔猪、犊牛等)的消化道具有很强的致敏作用,可引起犊牛等产生过敏反应,使犊牛肠道结构损伤,消化吸收障碍,继发产生过敏性腹泻等不良反应。其中大豆球蛋白(Glycinin)和β-伴大豆球蛋白(β-conglycinin)的免疫原性最强,这两种蛋白占大豆总蛋白的65%—80%,降低这两种蛋白的含量对提高大豆蛋白质利用率有很重要[3-4]。低聚糖被称为“胀气因子”,主要包括棉籽糖(Raffinose)和水苏糖(Stachyose),不能被胃和肠上段的消化酶消化,而是被结肠中的细菌发酵产生气体从而引起动物胀气、腹泻等不良反应,对不同种属及不同年龄的动物有差异[5]。大豆凝集素的热敏性很高,在高温下活性迅速降为零。植酸和单宁的含量很低,一般不作为主要抗营养因子研究[6-7]。降低抗营养因子的含量或活性对于提高大豆营养成分的利用率有很大作用,挤压膨化技术是目前国内外饲料主要的加工新技术之一,其加工过程产生的高温高压和高剪切力等作用,不但能使饲料原料中的抗营养因子失活,而且有利于提高营养成分的消化利用率,同时还能改善其风味。近年来对这项技术的研究日趋增多,膨化大豆产品已经广泛应用于食品、宠物食品、畜禽水产饲料中,研究大豆膨化过程中抗营养成分的变化规律,对膨化大豆的实际应用有重要意义[8]。【前人研究进展】相关研究表明大豆膨化后主要抗营养因子的失活能提高饲料营养成分的利用率,并能减少动物的不良反应[9]。目前对大豆中抗营养因子膨化前后变化研究较多的是热敏性的脲酶和胰蛋白酶抑制因子。张翔等[10]研究报道大豆原料中的脲酶活性为5.36 U·g-1,膨化温度达到120℃以上时,脲酶活性降至国家标准规定的上限值0.3 U·g-1以下,合适的膨化压力和水分含量也能使脲酶活性降低。李素芬等[11]研究发现膨化温度在110—130℃条件下,膨化处理大豆中脲酶活性为0.38—0.06 U·g-1,胰蛋白酶抑制因子含量为14.85—5.59 mg·g-1,胰蛋白酶抑制因子失活率为68.7%—88.2%,且脲酶和胰蛋白酶抑制因子含量均随温度的升高而降低,且存在显著的相关性,但对热敏感程度存在差异。抗原蛋白和低聚糖属于热稳定性抗营养因子,低聚糖的热稳定性比抗原蛋白更高,高温下一般也不发生分解。目前生产企业对膨化大豆产品基本不检测抗原蛋白的含量,对抗原蛋白的相关研究也较少。谯仕彦[12]、席鹏彬[13]、王红云[14]等研究发现膨化加工能够降低大豆中的抗原性物质,以膨化全脂大豆作为断奶仔猪日粮能够显著降低仔猪腹泻率和腹泻时间。【本研究切入点】对部分膨化大豆生产企业的考察发现,目前各企业的膨化工艺、设备及参数并不完全相同,市场上的膨化大豆产品必然出现品质不一的状况,且企业一般只检测脲酶活性,很少检测胰蛋白酶抑制因子、抗原蛋白和低聚糖的含量,但仅通过脲酶活性的变化很难全面评价膨化大豆中其他抗营养因子的消除状况。【拟解决的关键问题】本研究采集市售大豆和膨化大豆样品,检测分析其中的胰蛋白酶抑制因子、抗原蛋白、低聚糖的含量和脲酶活性,并与在膨化大豆生产企业按一定工艺参数制备的不同批次的膨化大豆进行对比,综合评价膨化大豆的主要抗营养因子的消除程度,分析造成大豆和膨化大豆抗营养因子含量差异的可能原因,并对主要抗营养因子的含量或活性给出参考值,为饲料配方中膨化大豆的添加提供参考。
1 材料与方法
试验于2015年3—8月在中国农业科学院饲料研究所进行。
1.1 仪器和试剂
高效液相色谱仪(LC-15C,配备RID-10A示差检测器,日本岛津公司),ZORBAX NH2色谱柱(150 mm×4.6 mm,5 μm,美国Agilent公司),旋转蒸发仪(RE-2000,上海亚荣生化仪器厂),高功率数控超声波清洗器(KQ-400KDE,昆山市超声仪器有限公司),微波炉(G70F23NIP-M8,格兰仕微波炉电器有限公司),双层恒温培养振荡器(SPH-2012C,上海世平实验设备有限公司),高速离心机(CR22G,日本日立公司),恒温水浴箱(SB-9,日本EYELA公司);pH计(Orion Star A211,美国Thermo公司)。
胰蛋白酶抑制因子试剂盒、大豆球蛋白试剂盒、β-伴大豆球蛋白试剂盒,购自北京龙科方舟生物工程技术有限公司;水苏糖和棉籽糖标准品(纯度为99.5%),购自德国Dr. Ehrenstorfer公司;乙腈、甲醇为HPLC纯,购自美国Thermo Fisher Scientific公司;试验用水为Millipore纯水系统(美国Millipore公司)制得的超纯水;氢氧化钠、尿素、盐酸、乙醇为分析纯。
1.2 样品来源
市售样品:大豆样品来源于中国黑龙江省、安徽省、陕西省和美国、巴西等国家,共20个批次;膨化大豆样品来源于黑龙江、上海、河南、广西不同生产企业以进口大豆或国产大豆为原料生产的膨化大豆产品,共19批次。
自制样品:生产企业为河南省神农膨化饲料有限公司;原料为进口美国大豆,2批次;膨化大豆样品为不同日期采集的不同批次的产品,其中喂料速度15—30 Hz,调质压力 0.35—0.50 MPa,膨化温度100—120℃,共8批次。
1.3 样品检测方法
1.3.1 胰蛋白酶抑制因子和抗原蛋白的测定 样品中的TI和抗原蛋白,采用ELISA法进行定量检测,该试剂盒采用间接竞争法。由于试剂盒受室温影响较大,每次试验均需回温至室温25℃,试验反应过程在生化培养箱中恒温(37℃)进行。称取一定量的样品(TI为0.1 g,抗原蛋白为0.3 g,精确至0.1 mg)于50 mL离心管中,加入30 mL提取液,于25℃振荡提取16 h,静置2 min,4 000 r/min离心5 min取上层液体,取上清液用1倍样品稀释工作液稀释70倍。取出酶标板条,将样品盒标准品对应微孔按序编号,每个样品和标准品做2孔平行,经过加样、洗板、加酶标试剂、显色,加终止液后于 450/630 nm双波下读取OD值。按照公式:百分吸光率(%)=B/B0×100%,计算吸光率,其中B是标准品或样品的平均吸光度值,B0是标准品(空白对照)的平均吸光度值。
校准曲线的绘制:以标准品百分吸光率为纵坐标,以标准品浓度的对数为横坐标,绘制标准曲线,将样品的百分吸光率带入到标准曲线中,从标准曲线上读出对应的浓度,乘以稀释系数,即为样品中TI和抗原蛋白的实际浓度。
1.3.2 脲酶活性 参照《饲料用大豆制品中尿素酶活性的测定》(GB/T 8622—2006)。考虑到全脂大豆脲酶活性较高,将称样量调整为0.05 g(精确至0.1 mg);考虑到膨化大豆中脲酶活性较低,将称样量调整为0.50 g(精确至0.1 mg)。
1.3.3 低聚糖的测定1.3.3.1 HPLC 色谱条件 色谱柱:Agilent ZORBAX NH2色谱柱(150 mm×4.6 mm,5 μm);检测器:示差检测器;流动相:A为乙腈,B为超纯水,A∶B= 70∶30(V/V);进样量:20 μL;流速:1 mL·min-1;柱温:35℃。
1.3.3.2 标准曲线的绘制 以去离子水为溶剂配制浓度为 0.1、0.25、0.5、1.0、2.0、4.0、8.0 mg·mL-1棉籽糖和水苏糖混合标准溶液,在上述色谱条件下分析,以浓度(mg·mL-1)为横坐标,峰面积为纵坐标,绘制标准曲线。
1.3.3.3 样品前处理方法的优化 样品提取参照周泉城[15]、刘立洋[16]等的研究,并在实验室条件下进行单因素优化。
对低聚糖的浸提方式、活性炭用量、提取液(乙醇)浓度、料液比进行单因素试验优化,每个处理做3个平行。由标准曲线计算得到提取液浓度,分析后确定最终的前处理方法。其中单因素试验优化方案及提取液浓度见表1。
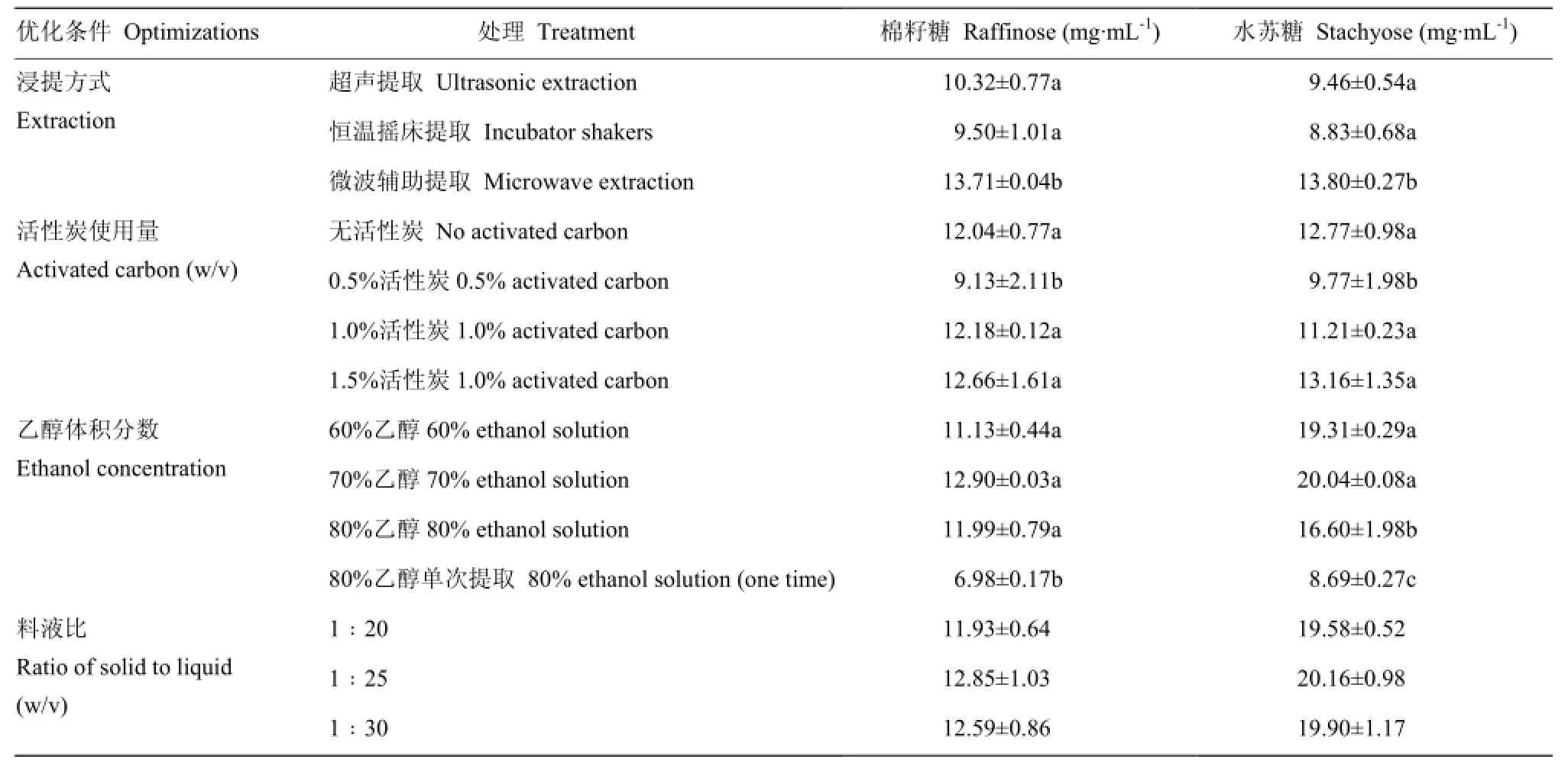
表1 低聚糖前处理条件优化方案及结果Table 1 The optimizations and results of pretreatment of oligosaccharides
通过对试验结果不同处理组进行单因素方差分析,提取方式中微波辅助提取组的提取率显著高于另外两种;使用活性炭组,虽然 1.5%使用量的提取率最高,但与不使用活性炭组没有显著性差异。为简化操作过程,提高操作效率选择不使用活性炭;体积分数为70%的乙醇溶液组的提取率显著高于其他组;料液比各组的提取率差异不显著,料液比为1∶25时提取率最高。最终确定的前处理方法如下:称取2.0 g(精确至0.1 mg)粉碎后的豆粕样品(由于豆粕是大豆脱脂后的产品,低聚糖相对含量提高),按照1∶25 g·mL-1的料液比加入体积分数为70%乙醇水溶液,置于微波炉中加热至沸腾,取出冷却至室温,在转速5 000 r/min下离心10 min,倒出上清液,重复以上步骤,合并两次上清液,旋转蒸发浓缩至 5—10 mL,用去离子水定容至25 mL,涡旋混匀,取1 mL置于2 mL离心管中,转速4 000 r/min下离心10 min。过0.22 μm滤膜,供上机使用。
1.4 数据处理
数据处理与统计分析采用SPSS 19.0软件进行。
2 结果
2.1 主要抗营养因子检测方法的标准曲线
胰蛋白酶抑制因子、抗原蛋白、低聚糖和脲酶这几种主要抗营养因子中,除脲酶活性的检测不需要经过标准曲线拟合检测结果外,其他几种抗营养因子都需要拟合标准曲线,并根据标准曲线计算出浓度,各因子的标准曲线及相关系数见表2。
2.2 抗营养因子检测结果
2.2.1 胰蛋白酶抑制因子 大豆和膨化大豆中TI的检测结果见表3和表4。市场采集的大豆品种来源复杂,含量差异较大,中位数和平均值基本保持一致,表明TI在大豆中的含量呈均匀分布,选择P5(5%的含量小于该值,下同)—P95(95%的含量小于该值,下同)为置信区间,制备样品大豆原料的TI含量在此区间内,且接近平均值,表明原料具有代表性。对比市场采集膨化大豆和制备的膨化大豆中TI的含量,并选择上述相同的置信区间,制备的膨化大豆的含量区间在市场采集膨化大豆的含量区间内,且两者的中位数和平均值基本一致,表明制备样品具有代表性。由于不同生产企业加工工艺、设备和加工参数的不同使TI的含量呈现差异。综上分析,可认为市场上大豆中TI的含量范围在32.5—89.6 mg·g-1,膨化大豆中TI含量范围在10.7—31.1 mg·g-1。
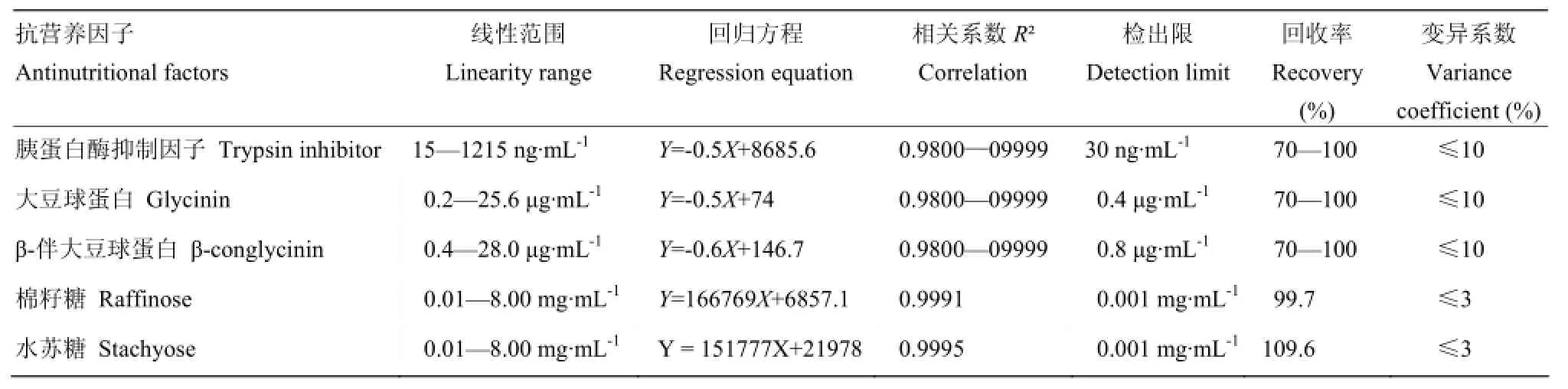
表2 抗营养因子标准曲线Table 2 The standard curves of antinutritional factors
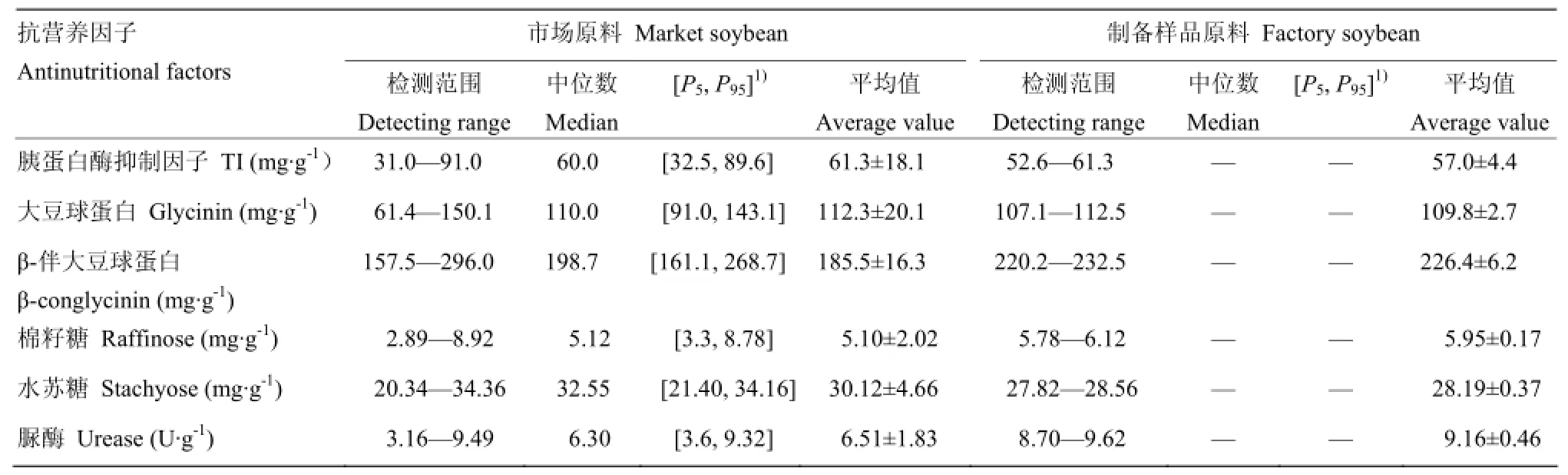
表 3 大豆中抗营养因子的含量分析Table 3 Analysis of the content of antinutritional factors in soybean

表4 膨化大豆样品中抗营养因子的含量分析Table 4 Analysis of the content of antinutritional factors in extruded soybean
2.2.2 抗原蛋白 大豆和膨化大豆中抗原蛋白的检测结果见表3和表4。对比市场大豆原料和制备样品的原料中两种抗原蛋白的含量,差异均较大,可能与大豆的来源及品种相关。市场大豆原料的两种抗原蛋白含量中位数和平均值基本保持一致,表明抗原蛋白在不同大豆中的含量呈均匀分布,并选择 P5—P95为置信区间,制备样品大豆原料的抗原蛋白含量也在此区间内,其中大豆球蛋白的含量接近市场大豆原料平均值,而β-伴大豆球蛋白含量高于市场大豆原料的平均值,但在置信区间内,这可能与制备样品大豆原料品种单一有关。对比市场采集膨化大豆和制备膨化大豆中抗原蛋白的含量,并选择相同的置信区间,后者的含量区间在前者含量区间内,其中大豆球蛋白的中位数和平均值基本一致,除了与大豆原料本身含量较高外,也与膨化加工过程中不同的加工工艺相关。综上分析,可认为市场上大豆中大豆球蛋白的含量范围在91.0—143.1 mg·g-1,β-伴大豆球蛋白的含量范围在161.1—268.7 mg·g-1,膨化大豆中大豆球蛋白含量范围在 17.7—64.5 mg·g-1,β-伴大豆球蛋白量范围在9.3—57.5 mg·g-1。
2.2.3 低聚糖 大豆和膨化大豆中低聚糖的检测结果见表3和表4。市场采集大豆的两种低聚糖含量范围较宽,这可能与大豆的品种有关。与大豆相比,膨化大豆中低聚糖含量未见降低,可见膨化大豆的低聚糖含量差异是由于大豆原料本身的差异引起的。大豆和膨化大豆低聚糖含量的平均值与中位数基本保持一致,说明大豆中的低聚糖含量呈均匀分布。制备样品原料和膨化大豆中低聚糖的含量均在市场采集大豆和样品的含量区间内,取P5至P95为置信区间,可认为市场上大豆中的棉籽糖含量范围在3.3—8.78 mg·g-1,水苏糖的含量范围在21.4—34.16 mg·g-1,膨化大豆中的棉籽糖含量范围在4.25—10.21 mg·g-1,水苏糖的含量范围在17.68—34.15 mg·g-1。
2.2.4 脲酶活性 大豆和膨化大豆中脲酶活性的检测结果见表3和表4。对比市场采集大豆和制备样品大豆原料,市场采集大豆的脲酶活性范围较大,制备样品大豆原料在市场大豆的脲酶活性范围内,可能与大豆的品种有关。膨化大豆中脲酶活性基本降为 0,取P5—P95为置信区间,可认为市场上大豆中的脲酶活性在3.6—9.32 U·g-1,膨化大豆的脲酶活性在0—0.02 U·g-1。
3 讨论
3.1 抗营养因子结果分析
由检测结果可知,膨化大豆中TI的含量比大豆中TI的含量明显降低,平均失活率约为66%,说明挤压膨化加工过程中的高温、高压及高剪切力能够有效降低大豆中胰蛋白酶抑制因子的含量。目前研究已经发现二硫键在维持蛋白质三级结构稳定性方面有很大作用。大豆中胰蛋白酶抑制因子主要包括两种:Kunitz型胰蛋白酶抑制因子(KTI)和Bowman-Birk型胰蛋白酶抑制因子(BBTI),它们在大豆中的含量分别为1.6%和0.4%。其中,KTI分子结构是中含有两个二硫键和一个活性中心,1∶1作用于胰蛋白酶;BBTI分子中含有较多的半胱氨酸,共形成七个二硫键,有两个活性中心,可与胰蛋白酶和糜蛋白酶作用[17]。二硫键的数目差异是这两种胰蛋白酶抑制因子的稳定性差异的主要因素,BBTI分子对热、酸、碱的稳定性比KTI强,相关研究发现BBTI在105℃干燥状态下或其0.02%水溶液在100℃下加热10 min仍能保持活性,而KTI在90℃短时加热即发生不可逆失活[18]。通过本研究的市场样品及自制样品的检测结果表明,TI平均失活率约为66%,与Kunitz型胰蛋白酶抑制因子占总TI的比率(约80%)接近,推断失活的胰蛋白酶抑制因子主要为热不稳定性的 Kunitz型胰蛋白酶抑制因子。
与大豆原料相比,膨化大豆中大豆球蛋白的含量比大豆平均低67%,β-伴大豆球蛋白的含量比大豆中的含量平均低 90%以上,自制样品中两者含量分别降低约65%和90%,基本与市场调查结果一致。膨化大豆中两种抗原蛋白的含量最低可降到10 mg·g-1以下,说明膨化加工技术能够有效地使抗原蛋白含量大幅度降低,且β-伴大豆球蛋白的对于膨化加工过程稳定性比大豆球蛋白的稳定性低,更易受加工温度及其他条件影响而失活,这与两者分子结构相关。大豆球蛋白中有6个碱性亚基和6个酸性亚基之间通过二硫键连接,酸性亚基和碱性亚基交互作用形成比较稳定的结构,二级结构中有25%的α-螺旋、25%的β-折叠、42% 的 β-转角和 8%的无规则卷曲;β-伴大豆球蛋白的 3个亚基为 α、α、β,稳定性依次增大,分子结构中很少有二硫键,二级结构中α-螺旋、β-折叠、不规则卷曲分别占5%、35%、60%。二级结构和三级结构的差别使大豆球蛋白在高温和各种作用力下的稳定性比β-伴大豆球蛋白的稳定性高[19]。本检测结果大豆球蛋白的失活率比β-伴大豆球蛋白的失活率低23%以上,根据两者之间结构的差异,推测主要与大豆球蛋白中二硫键的存在和二级结构中α-螺旋的数量较多有关。
与TI、大豆球蛋白和β-伴大豆球蛋白不同,大豆膨化后棉籽糖和水苏糖的含量没有降低,反而小幅度升高,计算分析两种糖的总量,棉籽糖和水苏糖总量在大豆中平均为 35.22 mg·g-1,膨化大豆平均含量为36.91 mg·g-1,总量基本接近,可能原因是膨化过程中大豆水分的损失使低聚糖占膨化大豆干物质相对比例略增高。棉籽糖和水苏糖的结构很稳定,单糖之间通过糖苷键结合,在 100℃高温下也不易分解,对热很稳定,仅在酸性条件下稳定性稍降低,挤压膨化过程中的高温高压以及剪切力的作用不足以破坏棉籽糖和水苏糖的结构,故含量基本不变。
膨化大豆的脲酶活性都低于0.02 U·g-1,远远低于国家标准规定的0.3 U·g-1,由此可见挤压膨化加工过程能够使大豆中脲酶接近 100%失活,原因是由于酶类对热敏感,挤压膨化加工的膨化温度一般在 100℃以上,脲酶随温度上升迅速发生不可逆失活,这与相关研究的结果一致[10, 20]。
3.2 膨化加工过程中抗营养因子钝化情况
膨化加工过程是高温、高压、高剪切力及物料与螺杆和膨化腔之间的摩擦对物料本身产生作用,挤压温度起决定性因素,温度的高低决定了产品的质量[21]。自制样品的加工参数是在一定范围内浮动,是由于不同客户对产品质量要求的不同产生的,即使原料相同也必然造成热敏性抗营养因子的含量或活性在一定范围内浮动。而不同生产企业的设备条件和工艺参数以及客户要求均不尽相同,使市售样品各抗营养因子的含量呈现差异。同时,由于分子结构不同,各抗营养因子对挤压膨化过程中的高温高压作用的稳定性也存在差异。本研究表明,膨化后低聚糖含量不会降低,TI平均失活率为66%,大豆球蛋白平均失活率为67%,β-伴大豆球蛋白平均失活率达到90%以上,脲酶失活率接近 100%,膨化过程中稳定性从高到低依次为:低聚糖>胰蛋白酶抑制因子>大豆球蛋白>β-伴大豆球蛋白>脲酶。
3.3 挤压膨化对提升大豆利用价值的作用
大豆中的抗营养因子中胰蛋白酶抑制因子、大豆球蛋白、β-伴大豆球蛋白及脲酶是大豆在应用中导致幼龄动物产生过敏反应、肠道健康及消化吸收率的主要影响因素。根据相关文献报道,大豆膨化后这几种抗营养因子的大幅度失活,能够使大豆营养成分利用率提高,并降低这些抗营养因子带来的危害[22-24]。另外,挤压膨化过程使大豆蛋白质变性,游离氨基酸含量上升,蛋白质的消化率提高,溶解度下降,油细胞破裂使膨化大豆的香味和适口性增加,能够提高动物食欲。虽然低聚糖的含量没有降低,由于低聚糖含量较少,且对不同动物的作用有差异,只要添加比例合理就能使不良影响降到最低。综上所述,挤压膨化加工能使大豆的利用价值显著提高。
3.4 脲酶活性对评价膨化大豆品质的合理性
由于脲酶活性有快速检测方法,即半固体法[25],生产企业常用脲酶活性来评价大豆加工程度是否合适。前人研究认为,脲酶活性失活的程度和胰蛋白酶抑制因子及蛋白质溶解度的变化有一定的线性关系,以上结果大部分是基于试验型设备得到的,而实际生产中脲酶活性基本降为0时,胰蛋白酶抑制因子和抗原蛋白依然有较强的活性,因此,仅依靠脲酶的失活来间接评价其他抗营养因子的失活程度是不合理的。
4 结论
挤压膨化技术能显著降低引起动物不良反应的大豆胰蛋白酶抑制因子和抗原蛋白的含量,并使脲酶基本失活。由于大豆原料差异,膨化加工工艺、设备和参数的不同,使膨化大豆产品中的各主要抗营养因子降低的程度也不同。脲酶并不能替代其他抗营养因子作为评价大豆品质的主要指标,建议评价大豆品质时要检测脲酶活性、胰蛋白酶抑制因子、大豆球蛋白和β-伴大豆球蛋白4个指标。推断市场上大豆原料中的胰蛋白酶抑制因子的含量范围为 32.5—89.6 mg·g-1,大豆球蛋白含量范围为91.0—143.1 mg·g-1,β-伴大豆球蛋白的含量范围为 161.1—268.7 mg·g-1,脲酶活性范围为3.60—9.42 U·g-1;膨化大豆样品中胰蛋白酶抑制因子含量范围为 10.7—31.1 mg·g-1,大豆球蛋白含量范围为17.7—64.5 mg·g-1,β-伴大豆球蛋白含量范围为9.3—57.5 mg·g-1,脲酶活性范围为0.00—0.02 U·g-1,研究结果对生产企业有一定的参考价值。
References
[1] 韩立德, 盖钧镒, 张文明. 大豆营养成分研究现状. 种子, 2003(5):57-59. HAN L D, GAI J Y, ZHANG W M. The reseach status of nutritional ingredient in soybean. Seed, 2003(5): 57-59. (in Chinese)
[2] 张国龙, 李德发. 大豆中胰蛋白酶抑制因子的生化性质和抗营养作用. 动物营养学报, 1995(4): 50-60. ZHANG G L, LI D F. The biochemical property and anti-nutrient action of trypsin ihhibitor in soybean. Acta Zoonutrimenta Sinica,1995(4): 50-60. (in Chinese)
[3] 张建中, 卢建军. 大豆抗原蛋白对断奶仔猪生长性能及肠道免疫因子的影响. 浙江农业学报, 2010(6): 843-847. ZHANG J Z, LU J J. Effects of soybean antigenprotein on the growth performance of weaning pig lets. Acta Agriculturae Zhejiangensis. 2010(6): 843-847. (in Chinese)
[4] 孙泽威, 秦贵信, 高云航. 大豆球蛋白、β-伴大豆球蛋白对反刍前犊牛致敏作用的研究. 中国畜牧杂志, 2006, 42(15): 38-41. SUN Z W, QIN G X, GAO Y H. Studies of Glycinin and β-conglycinin on the sensitization of pre-ruminant calf. Chinese Journal of Animal Science. 2006, 42(15): 38-41. (in Chinese)
[5] 秦贵信, 赵元, 鲍男. 不同种属动物对大豆中主要抗营养因子反应敏感性的比较//张宏福. 饲料营养研究进展, 北京: 中国农业科学技术出版社, 2010. QIN G X, ZHAO Y, BAO N. Comparative study on the sensitivity to the main antinutritional factors in soybean responsed by different animal//ZHANG H F. Advanced Research in Feed Nutrition, Beijing:China Agricultural Science and Technology Publishing House, 2010. (in Chinese)
[6] 徐奇友, 许红, 马建章. 大豆中营养因子和抗营养因子研究进展.中国油脂, 2006, 31(11): 17-20. XU Q Y, XU H, MA J Z. Research progress in nutrition and antinutritional factors of soybean. China Oils and Fats, 2006, 31(11):17-20. (in Chinese)
[7] 周红蕾, 李春玲, 王贵平, 侯加法. 大豆中抗营养因子及其去除方法概述. 饲料工业, 2006(3): 23-25. ZHOU H L, LI C L, WANG G P, HOU J F. Overview on antinutritional factors in soybean and resolved methods. Feed Industry,2006(3): 23-25. (in Chinese)
[8] 宋青龙, 秦贵信. 饲料中的抗营养因子及其消除方法. 国外畜牧学(猪与禽), 2003(3): 9-12. SONG Q L, QIN G X. Antinutritional factors in feed and eliminating methods. Guo Wai Xumu Xue (Pigs and Poultry), 2003(3): 9-12. (in Chinese)
[9] 周安国. 大豆膨化加工与营养质量. 饲料广角, 2006(18): 32-33, 38. ZHOU A G. Soybean expanding process and nutritional quality. Feed China, 2006(18): 32-33, 38. (in Chinese)
[10] 张祥, 程秀花, 赵国琦. 不同挤压条件对大豆中脲酶活性的影响.江西饲料, 2005(1): 20-24. ZHANG X, CHENG X H, ZHAO G Q. Effect of different extrusion conditions on the urease activity of soybean. Jiangxi Feed, 2005(1):20-24. (in Chinese)
[11] 李素芬, 杨丽杰, 霍贵成. 膨化处理对全脂大豆抗营养因子及营养价值的影响. 畜牧兽医学报, 2001(3): 193-201. LI S F, YANG L J, HUO G C. Effect of expanding treatment on antinutritional factors and nutritional value of soybean. Acta Veterinaria Et Zootechnica Sinica, 2001(3): 193-201. (in Chinese)
[12] 谯仕彦, 李德发. 不同加工处理大豆产品对早期断奶仔猪的过敏反应、腹泻和粪中大肠杆菌影响的研究. 动物营养学报, 1996(3):1-8. QIAO S Y, LI D F. Effect of different processed soybean products on diarrhea hypersensetivity and pathogenic E. coli in feces for early weaned piglets. Acta Zoonutrimenta Sinica, 1996(3): 1-8. (in Chinese)
[13] 席鹏彬, 张宏福, 方路, 侯先志. 不同温度湿法挤压膨化加工对全脂大豆化学成分及抗营养因子的影响. 饲料工业, 2000(11): 32-34. XI P B, ZHANG H F, FANG L, HOU X Z. Effect of different temperature extusion process on chemical component and antinutritional factors in soybean. Feed Industry, 2000(11): 32-34. (in Chinese)
[14] 王红云. 大豆膨化参数的选择及膨化大豆在断奶仔猪日粮中的应用[D]. 河北保定: 河北农业大学, 2002. WANG H Y. The selection of soybean extrusion parameters and theapplication of its products to the diets of weanling piglets [D]. Baoding, Hebei: Hebei Agricultural University, 2002. (in Chinese)
[15] 周泉城, 申德超, 区颖刚. 超声波辅助提取膨化大豆粕中低聚糖工艺. 农业工程学报, 2008(5): 245-249. ZHOU Q C, SHEN D C, QU Y G. Ultrasonic assisted extraction of oligosaccharide from defatted soybean meal after extrusion. Transactions of the CSAE, 2008(5): 245-249. (in Chinese)
[16] 刘立洋, 金龙国, 刘章雄, 郝再彬, 常汝镇, 邱丽娟. 微波和超声两种技术提取大豆低聚糖的效果. 大豆科学, 2008(5): 838-844. LIU L Y, JIN L G, LIU Z X, HAO Z B, CHANG R Z, QIU L J. Extraction of soybean oligosaccharides by microwave and ultrasonic technique. Soybean Science, 2008(5): 838-844. (in Chinese)
[17] 谷春梅, 韩玲玲, 曲洪生, 秦贵信. 大豆胰蛋白酶抑制因子的研究进展. 大豆科学, 2012(1): 149-151. GU C M, HAN L L, QU H S, QIN G X. Recent advances in soybean trypsin inhibitor. Soybean Science, 2012(1): 149-151. (in Chinese)
[18] 于炎湖. 饲料中胰蛋白酶抑制剂的研究状况. 饲料工业, 2001(6):1-4. YU Y H. Recent reaserches on feed trypsin inhibitor. Feed Industry,2001(6): 1-4. (in Chinese)
[19] 周瑞宝, 周兵. 大豆7S和11S球蛋白的结构和功能性质. 中国粮油学报, 1998(6): 41-44. ZHOU R B, ZHOU B. The stracture and functional properties of soybean 7S and l1S globulin protein. Journal of the Chinese Cereals and Oils Association, 1998(6): 41-44. (in Chinese)
[20] 周兵, 李树文, 张宏玲, 简丽, 程宗佳. 不同膨化温度下膨化大豆中脲酶活性和蛋白质溶解度变化趋势浅析. 饲料广角, 2006(6):35-36. ZHOU B, LI S W, ZHANG H L, JIAN L, CHENG Z J. Effect of diffirent expanded temperature on the urease activity and protein solubility trend of extruded soybean. Feed China, 2006(6): 35-36. (in Chinese)
[21] 刘海军, 穆玉云, 李亮. 挤压膨化参数对膨化大豆质量及营养成分的影响. 饲料工业, 2013(3): 8-10. LIU H J, MU Y Y, LI L. Effect of extrusion parameters on the extruded soybean quality and nutrient component. Feed Industry,2013(3): 8-10. (in Chinese)
[22] NWABUEZE T U. Effect of process variables on trypsin inhibitor activity (TIA), phytic acid and tannin content of extruded African breadfruit-corn-soy mixtures: A response surface analysis. LWT-Food Science and Technology, 2007, 40(1): 21-29.
[23] LOBATO L P, ANIBAL D, LAZARETTI M M, GROSSMANN M V E. Extruded puffed functional ingredient with oat bran and soy flour. LWT - Food Science and Technology, 2011, 44(4): 933-939.
[24] ABD EL-HADY E A, HABIBA R A. Effect of soaking and extrusion conditions on antinutrients and protein digestibility of legume seeds. LWT-Food Science and Technology, 2003, 36(3): 285-293.
[25] 李芝银. 膨化大豆两种脲酶活性定性测定方法及比较. 饲料与畜牧(新饲料), 2009(1): 42-43. LI Z Y. Two methods of qualitative determination of urease activity and comprision of them in extruded soybean. Feed and Husbandry (New Feed), 2009(1): 42-43. (in Chinese)
(责任编辑 赵伶俐)
Investigation and Analysis of Main Antinutritional Factors in Soybean and Extruded Soybean
YAO Yi-sha1, GU Xu1, SHANG Fang-fang1, QIU Jing2, LI Jun-guo1, LI Jun1
(1Feed Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100081;2Institute of Quality Standard and Testing Technology for Agro-products, Chinese Academy of Agricultural Sciences, Beijing 100081)
Abstract:【Objective】Soybean is an important food material as well as feed material for its abundant nutriments, but someantinutritional factors (ANFs) in soybean limit its application in the food and feed industries. As a widely used processing technique, the extrusion process can reduce the side-effect of ANFs in soybean to human and animals causing the content of ANFs to decrease while the content of nutrilite remains about the same. This research is aimed at investigating and analyzing the difference of main antinutritional factors in soybean and extruded soybean and discussing the effect of the extrusion process to these ANFs in soybean, so as to provide a reference for expanded enterprises to choose high quality raw materials and optimize the processing technique in the actual production, and provide some guidance to the design of animal feed formula. 【Method】In this research, 20 batches of soybean and 19 batches of extruded soybean from different areas of the manufacturer were collected,and the content or activity of the main anti-nutritional factors, including trypsin inhibitor, antigenic protein (glycinin and β-conglycinin), oligosaccharide (raffinose and stachyose) and urease, were detected. And these results were compared with 2 batches of soybean and 8 batches of extruded soybean that were produced in one manufacturer. The concentrations of trypsin inhibitor and antigenic protein were analyzed using ELISA. The concentrations of oligosaccharide were determined by HPLC with a differential detector. At the same time the extraction methods of oligosaccharides were optimized. Single factor optimize experiments were the way of extraction, the dosage of activated carbon, volume percentage of ethanol, and solid-liquid ratio. The solution was detected by HPLC after through filter membrane. Through comprehensive analysis of the data, the effect of extrusion technology on the content or activity of main antinutritional factors in soybean was studied.【Result】 The extraction method is as follows: adding 70% ethanol solution to the samples (solid-liquid ratio: 1∶25), and then centrifuging and concentrating the extracting solution after using microwave assisted extraction, diluting the concentrated solution with water to 25 mL, centrifuging the solution (2 mL) after blending. In comparison the content of the main antinutritional factors in soybean (22 batches) with the content in extruded soybean (27 batches), the content of trypsin inhibitor and antigenic protein and urease activity in soybean is significantly lower than those in extruded soybean while the content of oligosaccharides has no significant difference between them. The urease activity of most of extruded soybeans is near zero and lower by 99% than the activity of soybeans. The content of trypsin inhibitor, glycinin and β-conglycinin decreased respectively in 66%, 67% and 90%, while the content of raffinose and stachyose remained largely unchanged. From this research the content or activity of trypsin inhibitor, glycinin, β-conglycinin, raffinose, stachyose and urease in the soybean is respectively 32.5-89.6 mg·g-1, 91.0-143.1 mg·g-1, 161.1-268.7 mg·g-1, 3.3-8.78 mg·g-1, 21.4-34.16 mg·g-1and 3.6-9.42 U·g-1, in the extruded soybean is respectively 10.7-31.1 mg·g-1, 17.7-64.5 mg·g-1, 9.3-57.5 mg·g-1, 4.25-10.21 mg·g-1, 17.68-34.15 mg·g-1and 0.00-0.02 U·g-1. 【Conclusion】 The extrusion process can significantly reduce the content of the main antinutritional factors in soybean and side effects caused by these factors and can improve the utilization rate of nutrition. This study presents the reference range of the main ANFs in content or activity in soybean and extruded soybean.
Key words:soybean; extruded soybean; extrusion; antinutritional factors; nutrient composition
收稿日期:2015-10-30;接受日期:2016-02-25
基金项目:国家公益性行业(农业)科研专项(201203015)、国家现代农业产业技术体系北京市家禽创新团队专项资金项目(CZ1108)

