点阵激光辅助自体成纤维细胞经皮递送的初步研究
吴红巾,周炳荣,张炜明,张家安,谢淑芬,马立文,张婷,刘娟,王申,栗丹,易飞,陶艳玲,苗颖颖,张丽超,骆丹(南京医科大学第一附属医院,南京 210029)
点阵激光辅助自体成纤维细胞经皮递送的初步研究
吴红巾,周炳荣,张炜明,张家安,谢淑芬,马立文,张婷,刘娟,王申,栗丹,易飞,陶艳玲,苗颖颖,张丽超,骆丹
(南京医科大学第一附属医院,南京210029)
摘要:目的观察点阵激光辅助自体成纤维细胞经皮递送对真皮的长期作用。方法选用健康满月家猪,取耳缘皮肤分离培养成纤维细胞,传至三代后收集。取幼猪胸背部皮肤,随机分成空白对照组,点阵激光组,点阵激光联合细胞组,点阵激光联合磷酸盐缓冲液(PBS)组。3个月后取已处理皮肤活检病理检查,以苏木精和伊红(HE)染色、Masson染色法检测各组胶原纤维分布情况,以实时荧光定量聚合酶链式反应(RT-PCR)检测各组Ⅰ型胶原、Ⅲ型胶原mRNA表达情况。结果HE染色、Masson染色法显示点阵激光组、点阵激光联合细胞组、点阵激光联合PBS组胶原纤维含量较空白对照组增多,排列更紧密;点阵激光联合细胞组胶原纤维含量增多最高;实时荧光定量检测点阵激光联合细胞组与点阵激光组、空白对照组比较,其Ⅰ型胶原、Ⅲ型胶原表达最高。结论点阵激光辅助自体成纤维细胞经皮递送后产生持续刺激真皮胶原增生作用。
关键词:点阵激光;自体成纤维细胞;经皮递送;Ⅰ型胶原;Ⅲ型胶原
点阵激光近年广泛应用于皮肤科,其促进药物渗透吸收作用经大量研究报道,并应用于临床治疗中[1]。有研究证实点阵激光辅助细胞经皮递送[2],但研究只观察短期细胞存活状况,进入皮肤后其功能表现仍需进一步观察。组织填充术[3]已大量应用于临床治疗,如改善皱纹、填充萎缩性瘢痕和局部凹陷等。填充剂种类多样,如自体脂肪移植、自体胶原蛋白、硅制剂、透明质酸等。自体成纤维细胞填充技术能够刺激产生内源性人体胶原,可避免排斥反应,Weiss等[4]将2 mL自体成纤维细胞悬液[(1~2)×107/mL]注射至受试者脸颊,共3次,每次间隔14 d,结果表明自体成纤维细胞填充治疗是安全有效的。组织填充治疗前常需联合皮肤磨削术。点阵激光的工作原理既可以剥脱表皮,同时热刺激胶原,产生持久的胶原增生作用[5]。本实验设想观察点阵激光联合自体成纤维细胞是否可以达到更好的疗效,因而进行如下实验验证。
1 材料与方法
1.1材料
1.1.1器材与试剂盒点阵激光使用微雕点阵王(美国科医人公司);胰酶购于美国Amresco公司,DMEM培养基购于美国Gibco公司,小牛血清购于杭州四季青生物工程材料有限公司,Masson染色试剂盒产自上海碧云天生物技术有限公司,实时荧光定量PCR试剂盒产自日本Toyobo公司,引物由南京金斯瑞科技有限公司合成。
1.1.2实验动物健康满月家猪,雌性1只,购自南京清龙山实验动物中心。
1.2方法
1.2.1点阵激光参数设定MultiModeTMDeep Fractional深层点阵模式20 mJ,点密度10%。
1.2.2实验动物处理猪术前12 h禁食,4 h禁水,称取体质量,将猪俯卧位固定在手术台上,采用氯胺酮4 mg/kg肌注,3%戊巴比妥钠1 mL/kg静脉注射联合麻醉。在幼猪背部皮肤以纹身的形式做好标记,并予碘伏消毒3遍,生理氯化钠溶液擦拭1遍,随机分4组:空白对照组、点阵激光组、点阵激光联合细胞组、点阵激光联合PBS组,每组包括5例样本,每处皮肤面积取2cm×2cm,各组间间隔超过5cm。
1.2.3细胞分离、培养与传代:选取幼猪耳缘皮肤,修剪去除皮下、软骨组织,剪成0.5 cm×0.5 cm皮块,聚维酮碘浸泡,生理氯化钠溶液冲洗3次,加入0.5%分散酶,4℃消化18~20 h后分离表、真皮。真皮部分以消化液37℃消化5 min后,加入DMEM培养基,吹打、过滤,过滤后将细胞液离心,弃上清,加入含15%胎牛血清、0.99 U/mL青霉素和链霉素的高糖DMEM培养基,混匀并转移至培养皿中,于37℃、5%CO2的培养箱中培养细胞,细胞接种于直径10cm的培养皿中接种密度为1.0×106个/皿,取3~4代对数生长期细胞进行实验。最后予1mL PBS缓冲液(氯化钠80 g、氯化钾2 g、磷酸氢二钠28.84 g、磷酸二氢钾2 g、蒸馏水10 000 mL调至PH 7.0~7.4)收集细胞数20×106联合点阵激光处理皮肤。
1.2.3HE染色法组织切片脱腊至水,染色,脱水、透明、封片。
1.2.4Masson染色法切片常规脱蜡,苏木素染色5~10 min,盐酸酒精分化,流水蓝化,蒸馏水洗,丽春红酸性品红液中染5 min,蒸馏水洗,1%磷钼酸中染1~3 min,入苯胺蓝液5 min,置60℃温箱中烘干,二甲苯透明,封固,镜下观察。
1.2.5实时荧光定量PCR法取约30~50 mg组织样本于冰冷的组织匀浆器中,加入1mL预冷的TRIzol,冰上研磨至无颗粒透明状溶液,提取总RNA,纯化后逆转录为cDNA,稀释10倍后按20 μL反应体系扩增,引物序列由Primer5.0软件设计,见表1。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,根据循环值(2-ΔΔCT)计算Ⅰ型胶原和Ⅲ型胶原mRNA的相对表达量。

表1 Ⅰ型胶原和Ⅲ型胶原以及内参照甘油醛-3-磷酸脱氢酶(GAPDH)的引物序列
2 结果
2.1不同处理组HE染色及Masson染色比较与空白对照组相比较,点阵激光组、点阵激光联合PBS组以及点阵激光联合细胞组皮肤胶原纤维均增多、排列更紧密。点阵激光联合细胞组比单纯点阵激光组、点阵激光联合PBS组胶原纤维增多更明显,胶原排列更致密规则。见图1。
2.2不同处理组幼猪皮肤Ⅰ型胶原和Ⅲ型胶原基因表达水平比较点阵激光组、点阵激光联合PBS组及点阵激光联合细胞组与空白对照组比较,Ⅰ型胶原基因Ⅲ型胶原基因表达均升高,差异均有统计学意义(P<0.05)。点阵激光组与点阵激光联合PBS组比较,差异无统计学意义(P>0.05)。点阵激光联合细胞组与点阵激光组、点阵激光联合PBS组比较,Ⅰ型胶原基因表达含量高于2组,差异均有统计学意义(P<0.05)。点阵激光组、点阵激光联合PBS组及点阵激光联合细胞组与空白对照组比较,Ⅲ型胶原基因表达均升高,差异均有统计学意义(P<0.05)。见表2。

图1 各组HE染色和Masson染色。
表2 各组Ⅰ型胶原和Ⅲ型胶原基因表达水平比较 (±s,n=5)
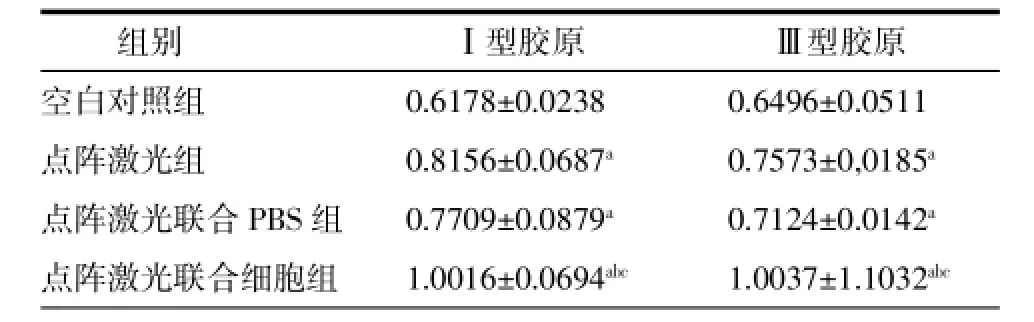
表2 各组Ⅰ型胶原和Ⅲ型胶原基因表达水平比较 (±s,n=5)
注:a:与空白对照组比较,P<0.05;b:与点阵激光组比较,P<0.05;c:与点阵激光+PBS比较,P<0.05。
组别 Ⅰ型胶原 Ⅲ型胶原空白对照组 0.6178±0.0238 0.6496±0.0511点阵激光组 0.8156±0.0687a 0.7573±0,0185a点阵激光联合PBS组 0.7709±0.0879a 0.7124±0.0142a点阵激光联合细胞组 1.0016±0.0694abc 1.0037±1.1032abc
3 讨论
真皮胶原纤维由Ⅰ型和Ⅲ型胶原构成,一般Ⅰ型胶原约占胶原总量的85%~90%,Ⅲ型胶原约占10%~15%。胶原纤维是皮肤张力和充盈的物质基础,研究发现在人体老化进程中,无论是内在的自然老化还是外部环境造成的光老化,都可见Ⅰ型、Ⅲ型胶原数量上的减少和质量上的降低,最终造成皮肤粗糙、皱纹、毛细血管扩张和不规则色素沉着等表现[6]。一些炎症反应也会导致胶原纤维的断裂、抑制胶原蛋白生成,皮肤真皮胶原纤维减少,遗留萎缩性瘢痕。组织填充术常用来解决此类问题,但临床中仍常见一些注射过程中出现的不良反应[7],如注射层次不易掌握,局部注射不均匀,低于或大于需要量导致填充不全或适得其反;还有可能注射进去的细胞大部分坏死凋亡,可能诱发炎症,局部出现红肿水疱反应;还包括注射疼痛感较明显、甚至注射入血管造成严重反应等。
点阵激光的局灶光热作用原理启动皮肤创伤修复机制,可以直接降解真皮中损伤的胶原,同时其光热作用刺激真皮成纤维细胞活化,刺激新生胶原蛋白的产生,促进胶原的不断合成、分泌和更新以及重塑胶原纤维排列[8],而不断改善和修复真皮组织的结合和强度。未受破坏的瘢痕以外正常皮肤组织同时帮助修复瘢痕组织,促进创面愈合。Naouri等[9]研究发现一次点阵CO2激光术后使用皮肤超声进行测定发现真皮的厚度增加25%,本实验发现与空白对照组比较,点阵激光组与点阵激光联合细胞组处理皮肤3个月后,HE染色及Masson染色可见真皮胶原增多,排列更紧密。Orringer等[10]研究发现Ⅰ型和Ⅲ型前胶原蛋白mRNA的表达与术前相比,在点阵激光术后21 d及术后至少6个月分别高达7.5和8.9倍,本实验发现,与空白对照组比较,点阵激光组与点阵激光联合细胞组处理皮肤3个月后,Ⅰ型胶原和Ⅲ型胶原基因表达水平均增加。周炳荣等[11]研究发现外用脂肪干细胞培养上清液可以改善点阵激光术后不良反应,同时可以促进皮肤修复。Georgette等[2]研究发现点阵激光处理后外敷脂肪干细胞4 h后,即可在激光通道处发现标记的间充质干细胞,48 h可在真皮浅层发现大量标记的脂肪干细胞。
笔者研究发现,点阵激光联合自体成纤维细胞组刺激真皮胶原纤维增生程度高于单独点阵激光组,同时其Ⅰ型胶原和Ⅲ型胶原基因表达水平高于单独点阵激光组。点阵激光处理后产生均匀点阵状通道,促进自体成纤维细胞均匀渗入皮肤;通过调整激光能量参数,设定激光穿透深度,从而控制细胞进入皮肤水平;同时点阵激光的光热作用联合自体成纤维细胞长久刺激真皮胶原增生。因此本实验的结果有助于了解点阵激光更多的临床应用范围。
参考文献:
[1]吴红巾,周炳荣,骆丹.点阵激光辅助局部用药的研究进展[J].国际皮肤性病学志,2015,41(3):153-155.
[2]Oni G,Lequeux C,Cho MJ,et al.Transdermal delivery of adipocyte-derived stem cells using a fractional ablative laser[J]. Aesthet Surg J,2012,33:109-116.
[3]Baumann L.Dermal fillers[J].J Cosmet Dermatol,2004,3:249-250.
[4] Weiss RA,Weiss MA,Beasley KL,et al.Autologous cultured fibroblast injection for facial contour deformities:a prospective,placebo-controlled,PhaseⅢclinical trial[J].Dermatol Surg,2007,33:263-268.
[5] Cohen SR,Henssler C,Johnston J.Fractional photothermolysis for skin rejuvenation[J].Plast Reconstr Surg,2009,124:281-290.
[6] Zhang JA,Yin Z,Ma LW,et al.The protective effect of baicalin against UVB irradiation induced photoaging:an in vitro and in vivo study[J].PLoS One,2014,9:e99703.
[7]Feller-Heppt G,Haneke E,Heppt M.Diagnosis and management of filler adverse effects:an algorithm[J].Facial Plast Surg,2014,30:647-655.
[8]Manstein D,Herron GS,Sink RK,et al.Fractional photothermolysis:a new concept for cutaneous remodeling using microscopic patterns of thermal injury[J].Laser Surg Med,2004,34:426-438.
[9]Naouri M,Atlan M,Perrodeau E,et al.High-resolution ultrasound imaging to demonstrate and predict efficacy of carbon dioxide fractional resurfacing laser treatment[J].Dermatol Surg,2011,37:596-603.
[10]Orringer JS,Kang S,Johnson TM,et al.Connective tissue remodeling induced by carbon dioxide laser resurfacing of photodamaged human skin[J].Arch Dermatol,2004,140:1326-1332.
[11]周炳荣,许阳,徐妍,等.外用脂肪干细胞培养上清液对二氧化碳点阵激焕肤术后伤口愈合的影响[J].中国中西医结合皮肤性病学杂志,2013,12(5):277-280.
Transdermal Delivery of Autologous Fibroblast by Fractional Ablative Laser
WU Hongjin,ZHOU Bingrong,ZHANG Weiming,ZHANG Jiaan,XIE Shufen,Ma Liwen,ZHANG Ting,LIU Juan,WANG Shen,Li Dan,YI Fei,TAO Yanling,MIAO Yingying,ZHANG Lichao,LUO Dan
First Affiliated Hospital of Nanjing Medical University,Nanjing 210029,China
Abstract:ObjectiveTo study the effect on dermis with combined treatment of fractional ablative laser and autologous fibroblast.MethodsOne healthy domestic piglet was selected to establish animal model.Ear skin was isolated and cultured fibroblasts.After the third generation the cells was collected.The abdomens of the piglet randomly divided into four groups:control group,fractional ablative laser group,fractional ablative laser with phosphate buffer solution(PBS)group and combination treatment of fractional ablative laser and autologous fibroblast group.Three months later,a biopsy was performed. By hematoxylin-eosin(HE)staining,Masson staining and real-time quantitative polymerase chain reaction,we analyzed collagen fiber arrangement and the mRNA and protein levels of type I collagen,type III collagen.ResultsAccording to HE staining and Masson staining,the amount of collagen in the fractional laser group,fractional laser with PBS group and fractional laser with autologous fibroblast group were much more than in the control group,and arranged more closely;fractional laser with autologous fibroblast group increased highest;real-time quantitative polymerase chain reaction showed the same results,the collagen expression levels of typeⅠandⅢcollagen in the fractional laser with autologous fibroblast group were highest. ConclusionTransdermal delivery of autologous fibroblast using a fractional ablative laser can stimulate and increase the synthesis of collagen.
Key words:Fractional ablative laser;Autologous fibroblasts;Transdermal delivery;TypeⅠcollagen;TypeⅢcollagen
中图分类号:R758.1
文献标识码:A
文章编号:1672-0709(2016)01-0006-04
通信作者:周炳荣,E-mail:bingrong.2002@163.com;骆丹,E-mail:daniluo2005@163.com
收稿日期:(2015-07-30)

