瓦埠湖底栖动物群落结构及其与环境因子之间的关系
潘成荣,张 萍,李 堃
(1.合肥工业大学资源与环境工程学院,安徽合肥 230009;2.安徽省环境科学研究院,安徽合肥 230009)
瓦埠湖底栖动物群落结构及其与环境因子之间的关系
潘成荣1,2,张 萍1,李 堃2
(1.合肥工业大学资源与环境工程学院,安徽合肥 230009;2.安徽省环境科学研究院,安徽合肥 230009)
摘要[目的]明确瓦埠湖底栖动物生态学。[方法]于2012年对瓦埠湖底栖动物群落结构及时空分布进行调查,并对获得的底栖动物数据和环境因子数据进行典范对应分析。[结果]共发现底栖动物37种,其中水生昆虫类、寡毛类、软体动物和其他类群分别为15种(占总物种数的40.54%)、12种(32.43%)、6种(16.22%)和4种(10.81%);优势种(Y≥0.02)为寡鳃齿吻沙蚕(Nephtys obigobranchia)、摇蚊(Compteromesa sp.)和苏氏尾鳃蚓(Branchiura sowerbyi)。底栖动物年平均密度为428.2 个/m2,年平均生物量为39.6 g/m2,不同季节底栖动物的平均生物量和平均密度存在显著差异。Shannon-Wiener指数均值为(0.765±0.499)~(1.181±0.590);Margalef指数均值为(0.518±0.192)~(0.740±0.448);Pielou指数(0.501±0.339)~(0.763±0.197),Shannon-Wiener多样性指数和Margalef物种丰富度指数在季节上呈现为夏季>秋季>冬季>春季的变化趋势;Pielou均匀度指数表现为冬季>夏季>秋季>春季。水温、透明度、硝氮、溶解氧是影响瓦埠湖大型底栖动物的主要环境因子。[结论]研究结果为瓦埠湖水质保护与治理提供了理论依据。
关键词瓦埠湖;底栖动物;多样性;典型对应分析
底栖动物指由软体动物、环节动物和水生昆虫等类群组成,具有生命周期长、区域性强、迁移能力弱等特点,在水生生态系统物质循环和能量流动中具有不可替代的作用[1-2]。其群落指标(如丰富度、组成结构、耐污类群和敏感类群的比例以及不同功能摄食类群的结构特征等)可从不同侧面反映水质的好坏[3],同时,通过大型底栖动物群落结构的调查可评价水体污染的程度[4]。因此,对大型底栖动物群落与水体环境因子之间相互关系的研究也是水质生物评价的一个重要内容[5-7]。
瓦埠湖位于安徽省中部,淮河中游南岸,地处寿县城东南,区地理位置为32°13′14″~32°32′51″ N和116°27′00″~117°04′ E,涉六安、合肥、淮南3市,湖面狭长,滩多水浅,南北长51 km,平均宽4 km,最宽处6 km,平水面积160 km2,丰水面积168 km2,枯水面积156 km2,丰水位18.9 m,枯水位15.5 m,最大深度4.5 m,湖底高程15.5 m。瓦埠湖是淮河中游较大的湖泊之一,属河流型湖泊,具有防洪、灌溉、养殖、饮用水及旅游等多种功能,其流域总控制面积4 193.0 km2,东淝闸位于瓦埠湖的出口段东淝河上,距入淮口2.5 km,是瓦埠湖蓄洪区的控制工程。随着社会经济的高速发展,人类对瓦埠湖的开发强度也不断上升,自然生态和水环境开始呈现出恶化趋势,湖泊面积减少,湖泊生态环境存在着较大的潜在压力。我国应用底栖动物群落结构对流域进行生态学评价主要集中在长江流域、太湖流域、淮河流域等[8],而针对瓦埠湖底栖动物生态学研究资料有限。鉴于此,笔者以瓦埠湖大型底栖动物为研究对象,分析了底栖动物的空间分布及其与环境因素之间的关系,旨在为瓦埠湖水质保护与治理提供理论依据。
1材料与方法
1.1研究样点于2012年3、6、9、12月分别对瓦埠湖底栖动物进行定量调查,调查期间在主湖区共设置样点14个(WZ01~WZ14),河口设置4个点(WH01~WH04),样点分布见图1。

图1 瓦埠湖湖区和出入湖河流样点分布Fig.1 Sampling sites distribution of Wabu Lake and rivers inflowing into or out of the lake
1.2采样方法对每个样点分别进行定量、定性采集。定量样品用1/16 m2的加重的彼得生采泥器采集,泥样经420 μm的铜筛筛洗后,置于解剖盘中将动物捡出,个体较小的底栖动物用湿漏斗法分离。捡出的动物用10%福尔马林固定,然后进行种类鉴定、计数,部分样品现场用解剖镜及显微镜进行活体观察。湿重的测定方法是先用滤纸吸干水分,然后在电子天平上称重。
1.3数据处理大型底栖动物的优势种[9]、Shannon多样性指数(H′)[10]、Margalef物种丰富度指数(D)[11]和均匀度指数(J)[12]分别按照参考文献中的方法进行计算。采用典范对应分析(CCA)解析底栖动物群落分布与环境因子间的关系,CCA排序采用国际通用软件CANOCO 4.5进行分析。
2结果与分析
2.1底栖动物群落组成及优势种调查期间,在瓦埠湖共采集到大型底栖动物37种,其中,水生昆虫类、寡毛类、软体动物和其他类群分别为15、12、6和4种,分别占物种总数量的40.54%、32.43%、16.22%和10.81%。
通过优势度计算得到的全年优势种(Y≥0.02)为寡鳃齿吻沙蚕(Nephtysobigobranchia)、摇蚊(Compteromesasp.)和苏氏尾鳃蚓(Branchiurasowerbyi);全年常见种(0.02≥Y≥0.01)为霍甫水丝蚓(Limnodrilushoffmeisteri)、多毛管水蚓(Aulodriluspluriseta)和长足摇蚊(Tanypusspp.)。底栖动物优势种在四季时空变化较大,春季和冬季的优势种为摇蚊和寡鳃齿吻沙蚕,摇蚊耐有机污染,为湖泊富营养化的常见种;夏季优势种为寡鳃齿吻沙蚕、苏氏尾鳃蚓、羽摇蚊(Chironomusplumosus)、长足摇蚊和小摇蚊(Microchironomussp.),长足摇蚊亦是富营养水体的特征生物;秋季优势种为多毛管水蚓、霍甫水丝蚓、长足摇蚊、寡鳃齿吻沙蚕、苏氏尾鳃蚓和皮氏管水蚓,霍甫水丝蚓、长足摇蚊、苏氏尾鳃蚓是很好的有机污染(富营养)指示生物[13-17]。四季中从优势种组成来看,湖泊达到了富营养化水平。其中,春季和冬季底栖动物优势种类单一,夏季和秋季优势种类较复杂和均匀,可能是由于夏、秋季节瓦埠湖大范围的围网养殖,底栖动物面临鱼类强大的捕食压力,导致优势种类的发展受到限制,促进了其他种类的发展。
2.2底栖动物密度和生物量的时空变化瓦埠湖底栖动物年平均密度为428.2 个/m2,底栖动物密度季节差异显著,呈现春季>夏季>秋季>冬季的变化态势,平均密度分别为656.9、456.9、391.1和208.0个/m2。底栖动物年平均生物量为39.6 g/m2,底栖动物生物量季节差异呈现冬季>秋季>夏季>春季的变化态势,平均生物量分别为91.3、31.6、20.4、15.3 g/m2。底栖动物密度和生物量的变化趋势并不一致,这可能是由于构成4个季度优势种类的差异造成的。底栖动物生物量较密度空间变化差异更大,生物量最大空间差异出现在春季,最高值达到最低值的5.96倍。

图2 瓦埠湖底栖动物生物密度相似性系数的等级聚类分析Fig.2 Hierarchy clustering analysis of similarity coefficient of macrobenthos biological density in Wabu Lake
瓦埠湖总磷含量为0.028~0.198 mg/L,均值为0.073 mg/L,超过地表水Ⅲ类标准,北部湖区平均浓度为0.050 mg/L,南部湖区平均浓度为 0.076 mg/L;全湖总氮含量为0.244~2.430 mg/L,平均浓度为0.880 mg/L,属于地表水Ⅲ类标准,北部湖区平均浓度为0.890 mg/L,南部湖区平均浓度为 1.170 mg/L。聚类分析表明(图2),在85%的相似水平上[13],底栖动物生物密度的等级聚类分析可将瓦埠湖不同采样点聚为4类:第1类生物多样性高,有WH01~WH04、WZ01~WZ02及WZ11~WZ14共10个点;第2类生物多样性处于中等水平,有WZ03、WZ10、WZ08共3个点,聚为一类;第3类生物多样性低,有WZ04~WZ06及WZ09共4个点;第4类生物多样性极低,在3个季节未发现底栖动物,有WZ07点。根据聚类分析的结果,在空间分布上,瓦埠湖水环境表现为北部水域的生物多样性水平最高,水质相对较好。2.3瓦埠湖大型底栖动物群落生物多样性由表1可知,在区域分布上,四季中大型底栖动物群落生物多样性河口>湖区;在时空分布上,各季节多样性指数差异不明显,Shannon-Wiener指数均值为(0.765±0.499)~(1.181±0.590);Margalef指数均值为(0.518±0.192)~(0.740±0.448);Pielou指数(0.501±0.339)~(0.763±0.197);Shannon-Wiener指数和Margalef指数都在夏季最高,秋季其次,冬季较低,春季最低;Pielou指数在冬季最高,夏季其次,秋季较低,春季最低。
表1瓦埠湖大型底栖动物的多样性指数季节变化
Table 1Seasonal variation of diversity indices of the macrobenthos in Wabu Lake

季节Season断面SectionShannon-Wiener多样性指数Shannon-WienerdiversityindexMargalef物种丰富度指数MargalefspeciesrichnessindexPielou均匀度指数Pielouevennessindex春季河口1.059±0.4040.824±0.1950.631±0.316Spring湖区0.471±0.5950.327±0.4130.371±0.362夏季河口1.548±0.3510.897±0.3350.914±0.079Spring湖区0.814±0.8290.582±0.5610.450±0.349秋季河口1.278±0.1100.594±0.1250.879±0.107Spring湖区0.771±0.4140.441±0.2580.646±0.287冬季河口1.603±0.2360.940±0.2230.916±0.042Winter湖区0.620±0.5130.361±0.3040.529±0.417
2.4瓦埠湖底栖动物与环境因子之间的关系由表2可知,CCA的所有排序轴均呈显著性差异,CCA的前两轴特征值分别为0.674 0和0.580 0,种类与环境因子排序轴的相关系数高达0.913 0和0.825 0,且物种-环境关系累积变化百分率为27.100 0,即排序图较好地反映了大型底栖动物与环境因子之间的关系。在排序图中,与第1轴相关性较大的前4个环境因子分别是溶解氧、水温、硝氮和电导率。溶解氧、硝氮和电导率均位于左侧,呈负相关,相关系数分别为0.749 0、0.667 8和0.612 1;水温位于左侧,呈正相关,相关系数为0.723 9。与第2轴相关性较大的环境因子是透明度、氨氮、总磷与总浊度。透明度位于坐标轴下方,呈负相关,相关系数为-0.701 2;氨氮、总磷与总浊度位于坐标轴上方,呈正相关,相关系数分别为0.505 3、0.422 2和0.394 1。
表2排序轴特征值、种类与环境因子排序轴的相关系数
Table 2Axis eigenvalue and correlation coefficients between species and environment factor
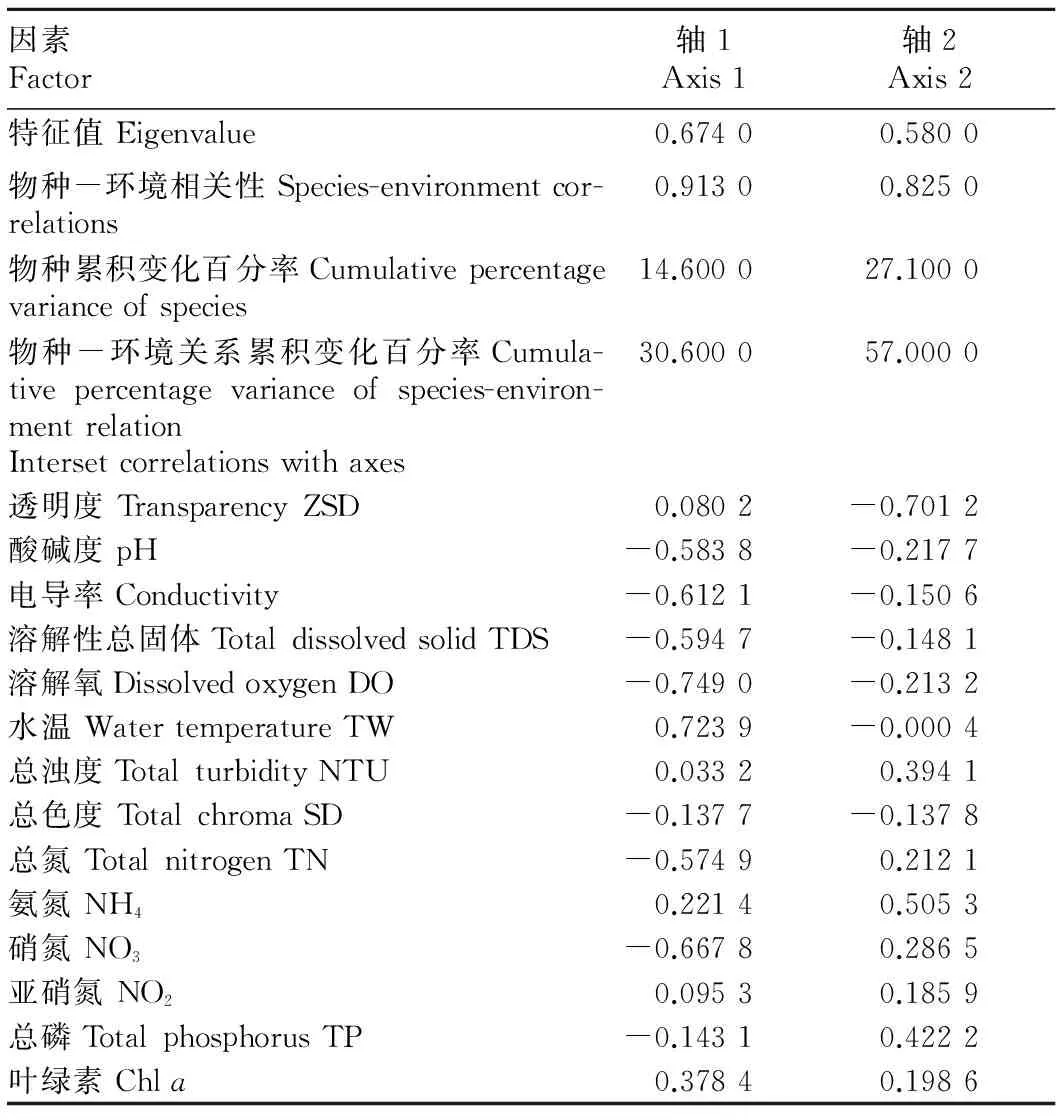
因素Factor轴1Axis1轴2Axis2特征值Eigenvalue0.67400.5800物种-环境相关性Species-environmentcor-relations0.91300.8250物种累积变化百分率Cumulativepercentagevarianceofspecies14.600027.1000物种-环境关系累积变化百分率Cumula-tivepercentagevarianceofspecies-environ-mentrelation30.600057.0000Intersetcorrelationswithaxes透明度TransparencyZSD0.0802-0.7012酸碱度pH-0.5838-0.2177电导率Conductivity-0.6121-0.1506溶解性总固体TotaldissolvedsolidTDS-0.5947-0.1481溶解氧DissolvedoxygenDO-0.7490-0.2132水温WatertemperatureTW0.7239-0.0004总浊度TotalturbidityNTU0.03320.3941总色度TotalchromaSD-0.1377-0.1378总氮TotalnitrogenTN-0.57490.2121氨氮NH40.22140.5053硝氮NO3-0.66780.2865亚硝氮NO20.09530.1859总磷TotalphosphorusTP-0.14310.4222叶绿素Chla0.37840.1986
图3反映了大型底栖动物分布与环境因子之间的关系,在CCA排序图中,环境因了用带有箭头的线段矢量表示,连线的长短表示物种的分布与该环境因子关系的大小[18],可以看出水温、透明度、硝氮、溶解氧是影响瓦埠湖大型底栖动物的主要环境因子。
在CCA排序图第四象限,长角涵螺(9)、河蚬(11)、寡鳃齿吻沙蚕(22)处在透明度环境轴附近,与透明度呈正相关;在第三象限,长足摇蚊(18)与温度呈负相关关系,与溶解氧、电导率等呈正相关,表明该类群仅出现冬季且数量较少;在第二象限,指鳃尾盘虫(7)、一种摇蚊(14)、多足摇蚊(17)、线形动物门(23)与温度呈负相关关系,与总氮、总磷呈现较强的正相关关系,该类群生物常在温度较低且水质肥沃的水域大量出现,如Compteromesasp.即为冬季的优势种之一;其余种类出现在第一象限,与水温、氨氮、总氮、总磷和叶绿素水平呈明显正相关关系,与透明度、溶解氧等呈负相关关系,该类群生物种类和数量均较多,常在温度较高、水质肥沃的水体中大量出现,在瓦埠湖水生态系统中占有重要位置。

注:1.有栉管水蚓(A.pectinatus);2.皮氏管水蚓(A.pigueti);3.多毛管水蚓(A.pluriseta);4.苏氏尾鳃蚓(B.sowerbyi);5.霍甫水丝蚓(L.hoffmeisteri);6.巨毛水丝蚓(L.grandisetosus);7.指鳃尾盘虫(D.digitata);8.泥蚓属(Ilyodrilus sp.);9.长角涵螺(A.longicornis);10.环棱螺 (Bellamya sp.);11.河蚬(C.cumingii);12.羽摇蚊(C.plumosus);13.一种摇蚊 (Cladopelma sp.);14.一种摇蚊(Compteromesa sp.);15.蛤摇蚊(Harnischia sp.);16.小摇蚊(Microchironomus sp.);17.多足摇蚊(Polypedilum sp.);18.长足摇蚊(Tanypus sp.);19.长足摇蚊 (Tanypus spp.);20.双翅目蛹(Diptera sp.);21.水甲科 (Hygrobiidae sp.);22.寡鳃齿吻沙蚕(N.obigobranchia);23.线形动物门(Nematomorpha sp.)。Note:1.A.pectinatus;2.A.pigueti;3.A.pluriseta;4.B.sowerbyi;5.L.hoffmeisteri;6.L.grandisetosus;7.D.digitata;8.Ilyodrilus sp.;9.A.longicornis;10.Bellamya sp.;11.C.cumingii;12.C.plumosus;13.Cladopelma sp.;14.Compteromesa sp.;15.Harnischia sp.;16.Microchironomus sp.;17.Polypedilum sp.;18.Tanypus sp.;19.Tanypus spp.;20.Diptera sp.;21.Hygrobiidae sp.;22.N.obigobranchia;23.Nematomorpha sp..图3 大型底栖动物与环境因子的CCA排序Fig.3 CCA ordination diagram between macrobenthos and environmental factors
3结论与讨论
20世纪70年代,瓦埠湖底栖动物优势种群主要是河蚬(占90%以上),该研究瓦埠湖的底栖动物优势类群为寡鳃齿吻沙蚕、等叶裸须摇蚊和苏氏尾鳃蚓,河蚬仅零星出现。导致优势种群发生变化的原因:一方面可能是瓦埠湖建闸引起的湖泊水文情势的改变,水体流动性差、交换率下降,而底质也由砂质变为淤泥,导致河蚬栖息环境发生了变化;另一方面由于湖泊水质下降,湖泊富营养化导致,其中优势种苏氏尾鳃蚓是很好有机污染(富营养)指示生物。
瓦埠湖底栖动物密度季节差异显著,呈现春季>夏季>秋季>冬季的变化态势,底栖动物生物量季节差异呈现冬季>秋季>夏季>春季的变化态势,底栖动物密度和生物量的变化趋势并不一致,与4个季度优势种类的差异相关。
底栖动物的物种多样性与营养水平呈相反趋势,富营养化导致多样性明显降低[17]。瓦埠湖调查结果表明,Shannon-Wiener多样性指数和Margalef物种丰富度指数均呈现夏季>秋季>冬季>春季的变化趋势;Pielou均匀度指数则呈冬季>夏季>秋季>春季。不同断面底栖动物多样性差异较大,河口断面在Shannon-Wiener多样性指数、Margalef物种丰富度指数和Pielou均匀度指数方面均显著高于湖区断面。
不同的时空尺度对大型底栖动物群落产生影响的环境因子不尽相同,但各种环境因子可归纳为3类:①物理因素,包括盐度、水深和温度等;②富营养化因素,包括N、P以及沉积物中的总有机碳含量;③底质类型,包括沉积物粒度参数等[9]。该研究中,底栖动物群落结构和环境因子的相关分析表明,解释瓦埠湖大型底栖动物群落结构差异最好的环境因子组合是溶解氧、温度、透明度和硝氮;溶解氧、硝氮呈负相关,相关系数分别为0.749 0、0.667 8;水温呈正相关,相关系数为0.723 9;透明度呈负相关,相关系数为0.701 2。
参考文献
[1] 董贯仓,李秀启,师吉华,等.南四湖底栖动物群落结构特征及其与环境因子的关系[J].湖泊科学,2013,25(1):119-130.
[2] ROSENBERG D M,RESB V H.Freshwater biomonitoring and benthic macroinvertebrates[M].New York:Chapman & Hall,1993:1-488.
[3] 汪星,郑丙辉,刘录三,等.洞庭湖典型断面底栖动物组成及其与环境因子的相关分析[J].中国环境科学,2012,32(12):2237-2244.
[4] 迟国梁,赵颖,官昭瑛,等.广东横石水河大型底栖动物群落与环境因子的关系[J].生态学报,2010,30(11):2836-2845.
[5] COVICH A P,PALMER M A,CROWL T A.The role of benthic invertebrate species in freshwater ecosystems:Zoobenthic species influence energy flows and nutrient cycling[J].Bio Science,1999,49(2):119-127.
[6] LINDEGAARD C.The role of zoomacrobenthos in energy flow in deep,oligotrophic Lake Thingvallavatn,Iceland[J].Hydrobiologia,1992,243(1):185-195.
[7] LINDEGAARD C.The role of zoomacrobenthos in energy flow in two shallow lakes[J].Hydrobiologia,1994,275(1):313-322.
[8] 高峰,尹洪斌,胡维平,等.巢湖流域春季大型底栖动物群落生态特征及与环境因子关系[J].应用生态学报,2010,21(8):2132-2139.
[9] 廖一波,寿鹿,曾江宁,等.三门湾大型底栖动物时空分布及其与环境因子的关系[J].应用生态学报,2011,22(9):2424-2430.
[10] 陆强,陈慧丽,邵晓阳,等.杭州西溪湿地大型底栖动物群落特征及与环境因子的关系[J].生态学报,2013,33(9):2803-2815.
[11] ZAMORA-MUNOZ C,ALBA-TERECDOR J.Bioassessment of organically polluted Spanish rivers,using a biotic index and multivariate methods[J].Journal of the North American benthological society,1996,15(3):332-352.
[12] TAKAMURA N,ITO T,UENO R.Environmental gradients determining the distribution of benthic macroi-nvertebrates in Lake Takkobu,Kushiro wetland,northern Japan[J].Ecological research,2009,24(2):371-381.
[13] 蔡永久,龚志军,秦伯强,等.太湖大型底栖动物群落结构及多样性[J].生物多样性,2010,18(1):50-59.
[14] 沈会涛,刘存歧.白洋淀浮游植物群落及其环境因子的典范分析[J].湖泊科学,2008,20(1):773-779.
[15] 许木启,张知彬.我国无脊椎动物生态学研究[J].动物学报,2002,48(5):689-694.
[16] 龚志军.长江中下游浅水湖泊大型底栖动物的生态学研究[D].武汉:中国科学院水生生物研究所,2002.
[17] 龚志军,谢平,唐汇娟,等.水体富营养化对大型底栖动物群落结构及多样性的影响[J].水生生物学报,2001,25(3):210-216.
[18] 曹同,郭水良,高谦,等.应用排序分析藓类植物分类群分布与气候因素的关系[J].应用生态学报,2000,11(5):680-686.
基金项目环境保护部“良好湖泊生态环境保护专项”。
作者简介潘成荣(1966-),男,安徽合肥人,正高级工程师,硕士生导师,从事水环境保护与环境规划研究。
收稿日期2016-03-16
中图分类号X 176
文献标识码A
文章编号0517-6611(2016)13-008-04
Macrobenthos Community Structure and Its Relationships with Environmental Factors in Wabu Lake
PAN Cheng-rong1,2, ZHANG Ping1, LI Kun2
(1. School of Resources and Environmental Engineering, Hefei University of Technology, Hefei, Anhui 230009; 2. Anhui Institute of Environmental Science, Hefei, Anhui 230009)
Abstract[Objective] To research the macrobenthos ecology in Wabu Lake. [Method] We researched the community structure and spatial-temporal distribution of macrobenthos in Wabu Lake in 2012. [Result] A total of 37 benthonic animal were identified, including 15 species (40.54% of the total) of aquatic insects, 12 species (32.43%)of oligochaetas, 6 species (16.22%)of mollusks, and 4 species (10.81%)of others. Among them, Nephtys obigobranchia, Compteromesa sp. and Branchiura sowerbyi were the dominant species (Y≥0.02). The annual average density of macrobenthos was 428.2/m2; and the annual average biomass was 39.6 g/m2. There were significant differences between average biomass and average density of benthic community. Average value of Shannon-Wiener index was from (0.765±0.499) to (1.181±0.590); average value of Margalef species richness index was from (0.518±0.192) to (0.740±0.448); and Pielou index was from (0.501±0.339) to (0.763±0.197). Shannon-Wiener diversity index and Margalef species richness index showed a change trend of winter > summer > autumn > spring. Canonical correspondence analysis of the obtained macrobenthos data and environmental factor data showed that water temperature, transparency, and DO were the major environmental factors affecting the distribution of macrobenthos. [Conclusion]This research provides theoretical foundation for the water quality protection and control of Wabu Lake.
Key wordsWabu Lake; Macrobenthos; Diversity; Canonical correspondence analysis

