藏鸡磷酸酪氨酸互作结构域 1(PID1)的克隆及组织表达谱研究
聂晓庆,林亚秋,徐亚欧,赵燕英,吕 明,左璐璐,张小玉,李 想
(西南民族大学 生命科学与技术学院,成都 610041)
藏鸡磷酸酪氨酸互作结构域 1(PID1)的克隆及组织表达谱研究
聂晓庆,林亚秋*,徐亚欧*,赵燕英,吕明,左璐璐,张小玉,李想
(西南民族大学 生命科学与技术学院,成都 610041)
本研究旨在阐明藏鸡PID1基因在不同组织与时序表达谱,并研究PID1基因表达与肌内脂肪含量(IMF)的关系。利用RT-PCR技术克隆藏鸡PID1基因,用相关软件预测PID1蛋白的结构和功能,采用荧光定量PCR研究PID1基因在藏鸡不同组织、不同日龄的表达谱,并分析其与IMF的相关性。结果显示,克隆得到藏鸡PID1基因序列长度为654 bp(GenBank 登录号:KT000001),共编码217个氨基酸,是具有PTB结构域的不稳定亲水酸性蛋白质;有14个磷酸化位点、4个O-糖基化位点、1个N-糖基化位点、7种保守特异性蛋白激酶结合位点、3个二硫键;预测其二级结构中α-螺旋占26.73%,β折叠占20.74%,无规则卷曲占52.53%,属于混合型蛋白且主要存在于细胞质中。荧光定量PCR结果显示,PID1基因在藏鸡的不同组织中均存在表达,且在脂肪组织中表达水平最高(P<0.01);时序表达谱结果显示,PID1基因在1日龄公藏鸡胸肌中表达水平最高。在210 日龄的公鸡腿肌的表达量极显著高于其他日龄的表达水平(P<0.01),在119 日龄母鸡腿肌的表达量极显著高于其他日龄表达水平(P<0.01)。在119和154 日龄公鸡脂肪组织中表达水平较高,在210 日龄母鸡脂肪组织中的表达量最高(P<0.01)。相关性分析结果显示,PID1 mRNA的表达量与藏鸡胸肌的IMF含量存在显著相关(P<0.05)。结果提示,PID1基因可能是影响藏鸡IMF沉积的候选基因。
藏鸡;磷酸酪氨酸互作结构域 1;克隆;组织表达;时序表达;肌内脂肪
藏鸡是中国青藏高原特有的鸡种,属蛋肉兼用型,主产于中国青藏高原的西藏、四川的甘孜、阿坝等地[1]。其体貌与习性与家鸡的祖先原鸡极为相似,具有肉质鲜美、高蛋白低脂肪、耐粗放、抗病力强、体型轻小等特点[2],备受人们推崇。因此阐明该基因优良的肉质性状具有重要的理论与实际意义。动物脂肪沉积由内因和外因共同决定,但主要受遗传因素制约,由多基因控制,过量的脂肪沉积影响动物产品的风味和品质。适量的肌内脂肪(Intramuscular fat,IMF)含量可调节肉的嫩度、风味与多汁性[3]。
磷酸酪氨酸互作结构域 1(Phosphotyrosine interaction domain containing 1,PID1)是以抑制性消减杂交(Suppression subtractive hybridization,SSH)技术从肥胖患者腹膜后脂肪组织中筛选差异表达基因时发现的新基因[4-5],并且研究发现,动物体内游离的脂肪酸可增加PID1基因的表达,作为信号分子通过MAPK信号通路调节脂肪细胞的生成和分化[6-7]。但目前关于PID1多集中于人类肥胖病的研究[8-9]及治疗[10]等方面,在畜禽上研究尚不深入,且有研究表明,PID1基因与肌内脂肪沉积密切相关[11],并发现PID1基因过表达能增加与肉质性状相关基因PGC-lα和UCP的表达[12]。但关于该基因在藏鸡方面的研究尚未见报道,其是否与藏鸡IMF沉积有关尚不清楚。因此本研究旨在克隆得到藏鸡PID1基因序列,并阐明该基因在不同组织和时期的mRNA表达水平,并与IMF含量进行相关性分析,为研究PID1基因对藏鸡肉质性状的作用提供重要数据,并为藏鸡种质资源的保护及品种的培育提供新思路。
1 材料与方法
1.1试验材料
本试验选用1、81、119、154和210日龄来自成都益生康健农业有限公司藏鸡养殖基地的健康藏鸡,该基地位于四川省彭州市新兴镇狮山村老虎崖,属于龙门山脉的高山地区。试验选择采样时间点主要根据优质肉鸡和本地鸡出栏时间及本实验室前期摸索所设定。在屠宰之前每组禁食12 h,然后通过放血法屠宰,屠宰后迅速取其右侧胸肌、腿肌和皮下脂肪组织;并同时采集154日龄公、母鸡的心、肝、脾、肺、肾、脑、胸肌、腿肌及皮下脂肪等组织。所有样品用锡箔纸包好迅速冷冻于液氮中,置于-80 ℃冰箱保存备用。
1.2生化试剂
Trizol(Invitrogen)、pMD19-T载体及iQTM SYBR®Green Supermix提取试剂购自大连TaKaRa公司;反转录试剂盒(Thermo Scientific)购自Themro公司;Taq酶及DH5α感受态细胞购自天根生化科技有限公司;凝胶回收试剂盒购自Axygen公司;其他均为国产分析纯。
1.3方法
1.3.1藏鸡PID1基因克隆用Trizol法提取藏鸡脂肪组织总RNA,溶解于RNAase-free水中。用BioSpec-nano检测其浓度等符合后续试验要求后对总RNA进行反转录。根据GenBank中登录的原鸡PID1基因序列(NM_001178144),用Premier5.0设计克隆引物[13](表1),送上海生物工程股份有限公司合成。克隆扩增体系共25 μL:ddH2O 9.5 μL,cDNA 1 μL,Taq聚合酶12.5 μL,上下游引物各1 μL。PCR反应程序:94 ℃预变性5 min;94 ℃ 变性30 s,58℃ 退火30 s,72 ℃延伸 45 s,共35个循环;72 ℃延伸5 min。取5 μL PCR产物,用1.2%琼脂糖凝胶对扩增产物进行检测后纯化回收。采用TA克隆的方法,将纯化后的产物与pMD19T载体进行连接,转化至E.coliDH5α感受态细胞中,用菌落PCR鉴定后,挑选3个阳性克隆,送上海生物工程股份有限公司测序。
表1引物信息
Table 1The primer information

基因Gene引物序列(5'-3')Primersequence退火温度/℃(产物长度/bp)Annealingtemperature(Productslength)用途PurposePID1F:ATGTGGCAGCCGGCCACGGAGR:TCAGCCATCATCAGATTCAAAT58(654)PCRamplificationPID1F:GAAGAAGCATACACTTGCCAGGR:GACTGTTGCCTCGCCTTTGA66(112)qRT-PCRGAPDHF:CTGCCCAGAACATCATCCCAR:CGGCAGGTCAGGTCAACAAC62(139)qRT-PCR
F.正义链引物;R.反义链引物。GAPDH.3-磷酸甘油醛脱氢酶
F.Sense primer;R.Antisense primer.GAPDH.Glyceraldehyde 3-phosphate dehydrogenase
1.3.2序列分析通过NCBI网站中的ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)寻找开放阅读框(Open reading frame,ORF);将获得的cDNA序列用NCBI网站上BLAST软件进行同源比对,用DNAMAN进行序列比对。采用MEGA5.0和clustalx1.83构建进化树。1.3.3PID1蛋白分析通过ProtParam在线分析编码蛋白的理化性质;采用PortScale进行疏水性预测;采用NetPhos 2.0、NetOGlyc 4.0、NetNGlyc 1.0、NetPhosK 1.0 、SignalP 4.1 Server分析预测PID1蛋白磷酸化位点、O-糖基化位点、N-糖基化位点、保守特异性蛋白激酶作用位点以及信号肽;NCBI在线分析(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)该蛋白的结构域;PredictProtein、PHYRE2 Server分别预测PID1蛋白的二级结构、三级结构;DiANNA 1.1web server对PID1蛋白的二硫键进行预测。
1.3.4藏鸡PID1基因的组织表达采用Trizol法提取藏鸡各个组织样的总RNA(公母各5只)。根据克隆所得到的PID1基因序列,设计特异检测引物,选取 3-磷酸甘油醛脱氢酶(Glyceraldehyde 3-phosphate dehydrogenase,GAPDH)为内参基因,设计特异引物(表1),实时荧光定量PCR检测PID1在心、肝、脾、肺、肾、脑、胸肌、腿肌和脂肪组织中的相对表达情况。反应体系为20 μL:SYBRGreen10 μL,cDNA 1 μL,上、下游引物各 1 μL,RNase Free dH2O 7 μL。PCR反应条件:95 ℃预变性3 min;95 ℃变性10 s,66℃退火 20 s,72 ℃延伸30 s,39个循环;每个待测样本设3个重复。用2-ΔΔCt法计算荧光定量结果[14]。
1.3.5藏鸡PID1基因的时序表达采用Trizol法提取藏鸡各个时期胸肌、腿肌和脂肪组织样的总RNA(每个阶段公母各8只,共240个样品)。以GAPDH为内参基因,设计特异引物(表1),实时荧光定量PCR检测PID1的相对表达情况。PCR反应体系和反应条件同上。用2-ΔΔCt法计算荧光定量结果[14]。
1.3.6藏鸡肌内脂肪含量的测定与数据分析利用索氏抽提法(GB/T 5009.6-2003)测定公藏鸡与母藏鸡在81~210日龄胸肌与腿肌肌内脂肪含量(每个阶段公母各12只,共192个样品),数据结果均以“平均数±标准差”表示。采用SPSS 19.0进行单因素方差分析和相关分析。
2 结 果
2.1藏鸡PID1基因克隆鉴定
通过1.2%琼脂糖凝胶电泳检测(图1),得到克隆产物条带与预期目的片段大小相符。送交上海生物工程有限公司测序获得654 bp的序列,并提交NCBI(登录号:KT000001)。

M.DL-2000 marker;1.PID1图1 藏鸡PID1 基因扩增结果Fig.1 Amplification of PID1 gene in Tibetan chicken
2.2生物信息学分析
2.2.1PID1基因序列分析克隆得到的藏鸡PID1基因序列长为654 bp,编码217个氨基酸(图2),其中Leu残基(9.2%)所占频率最高。且带负电荷的氨基残基(Asp+Glu=28)多于带正电荷的氨基酸残(Arg+Lys=25)。在DNAMAN上进行藏鸡、原鸡的核苷酸与氨基酸序列CDS区的比对,结果显示,分别在T229C、A234G、A270G、A353G这4个位点存在核苷酸突变。其中229 bp处的T/C突变导致Cys半胱氨酸(酸性)变为Arg精氨酸(碱性正电荷),353 bp处的A/G突变导致Lys赖氨酸(碱性)变为Arg精氨酸(碱性),突变位于预测的PTB结构域内(图2)。其余位点的突变不引起氨基酸的改变。
2.2.2PID1蛋白理化性质及修饰PID1蛋白分子式为C1100H1727N303O323S15,总原子数3 474,分子质量为24.92 ku,等电点为6.49。氨基酸序列N末端为M,预测的半衰期为30 h。消光系数(M-1cm-1γ=280 nm)为29 825,不稳定指数为42.62,说明该蛋白属于不稳定酸性蛋白质。藏鸡PID1蛋白存在4个主要的疏水区:第42~47位、70~75位、99~109位和129~135位,除此之外PID1的大部分氨基酸序列被亲水区占据。其中最高值为第146位I(1.222),最低值为第198位R(-2.20)从整体来看,亲水性氨基酸均匀分布在整个肽链中。因此,PID1蛋白表现出亲水性的特征,亲水性总平均值-0.393,脂肪族系数75.99。分析预测PID1蛋白潜在的磷酸化位点共14个,分别为Ser159、Ser171、Ser192、Ser195、Ser203、Ser204、Ser205、Ser209、Thr24、Thr56、Thr78、Thr122、Tyr97、Tyr160;O-糖基化潜在位点4个,分别位于第14、61、203、204位点;在第202位点有潜在的N-糖基化位点1个;保守特异性蛋白激酶作用位点最强在Ser192残基处(P=0.82)且无信号肽、跨膜结构域。预测PID1蛋白有3个二硫键,分别位于Cys44和Cys58、Cys77和Cys169、Cys136和Cys164。PID1蛋白的二级结构见图3。
PID1蛋白的结构中,α螺旋占26.73%,β折叠占20.74%,无规则卷曲占52.53%。由此可知,PID1属于混合型蛋白,且主要存在于细胞质中。蛋白与蛋白共存在10个结合位点,分别位于1~2、28~29、54、88、94~95、156、158、160~161、163、168位点。
2.3PID1基因同源性分析
将克隆得到的藏鸡PID1核苷酸序列、氨基酸序列与原鸡等物种在NCBI上进行同源性分析(表2),并用MEGA5.0和clustalx1.83构建氨基酸系统进化树。由图4可知,藏鸡与原鸡处于同一进化枝,两者亲缘关系最近;虎皮鹦鹉、火鸡与绿头鸭处于一枝;哺乳动物人、鼠、牛、羊等处于一枝。
表2藏鸡PID1基因与其他已知物种的核苷酸、氨基酸序列比对结果Table 2Comparison of amino acid sequence and nucleotide sequence ofPID1 gene in Tibetan chicken and the other species

物种Species核苷酸同源性/%Nucleotide登录号GenBank氨基酸同源性/%Aminoacid登录号GenBank原鸡Gallusgallus99NM_001178144.199NP_001171615.1火鸡Meleagrisgallopavo98XM_010716414.1100XP_010714716.1绿头鸭Anasplatyrhynchos97XM_005010880.197XM_005010880.1虎皮鹦鹉Melopsittacusundulatus96XM_005147041.199XP_005147098.1扬子鳄Alligatorsinensis92XM_006033833.197XP_006033894.1野猪Susscrofa85NM_001173520.194NP_001166991.1绵羊Ovisaries84XM_012156503.193XP_004005036.1野牛Bisonbisonbison84XM_010837023.193XP_010835325.1人Homosapiens83NM_001100818.194NP_001094288.1小家鼠Musmusculus82NM_001003948.292NP_001003948.2

阴影部分为预测的藏鸡PTB结构域(T56~K194);加粗斜体部分为突变碱基及氨基酸The shaded indicate the predicted PTB domain(T56-K194) of Tibetan chicken;Bold and italic characters indicate the mutation bases or amino acids图2 PID1基因CDS区藏鸡与原鸡的同源性分析Fig.2 Alignment of Tibetan chicken(upper line)and Gallus gallus(lower line)

图3 PID1蛋白预测的二级结构和蛋白结合位点Fig.3 Predicted secondary structure and protein binding sites of PID1 protein
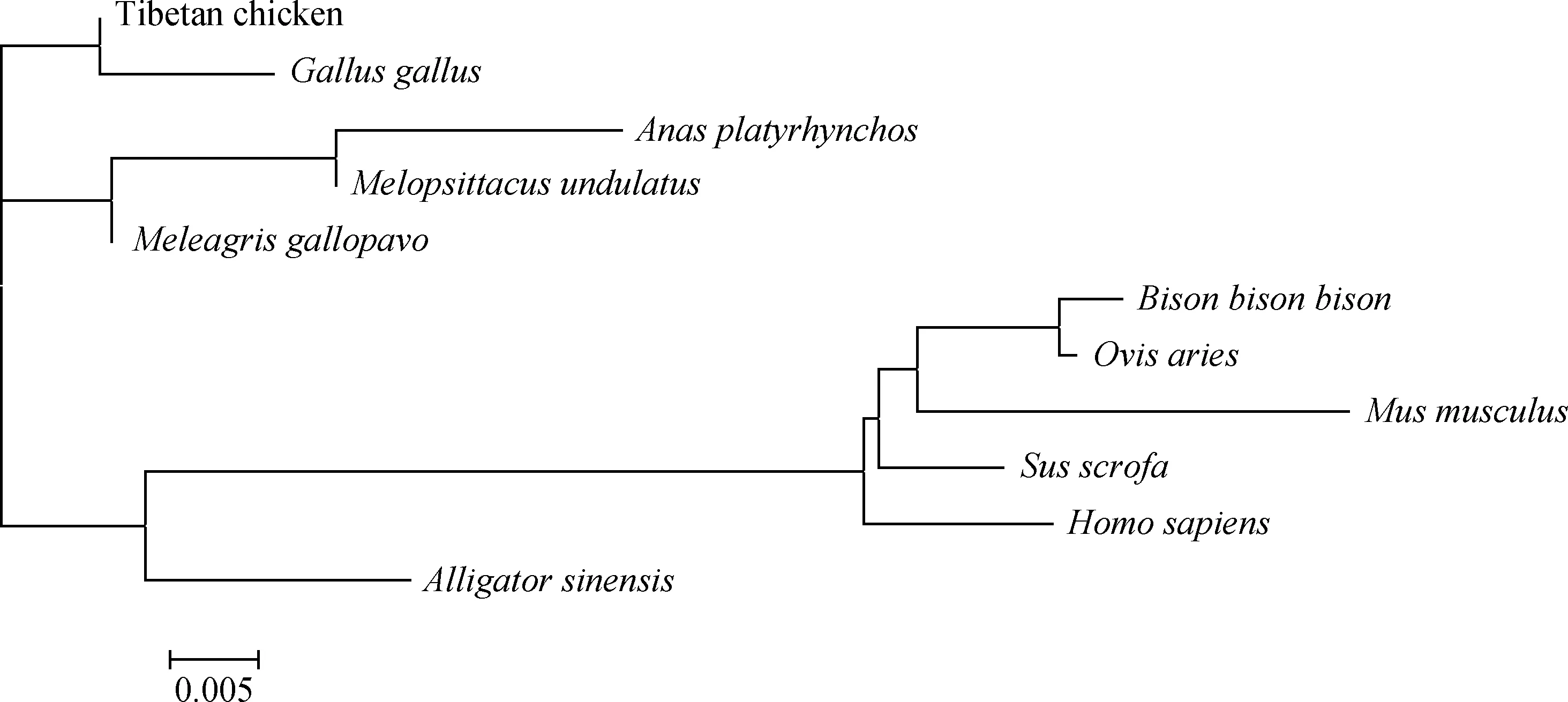
图4 藏鸡PID1氨基酸系统进化树Fig.4 The amino acid phylogenetic tree of PID1 of Tibetan chicken
2.4藏鸡PID1基因表达分析
2.4.1不同组织的表达分析以GAPDH作为内参基因,采用荧光定量PCR检测PID1基因在藏鸡154日龄不同组织中的表达情况。以脾组织为对照,结果显示(图5),PID1基因在公藏鸡和母藏鸡的9个组织中均存在表达,并且均在脂肪组织中表达最高,极显著高于其他组织(P<0.01),在脾和肺中亦存在较高水平的表达,均极显著或者显著高于其他各个组织。
不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)Different superscript lowercase and capital letters indicate significant difference (P<0.05) and extremely significant difference (P<0.01),respectively图5 PID1基因在藏鸡不同组织相对表达量Fig.5 Relative expression of PID1 mRNA in different tissues of Tibetan chicken
2.4.2不同日龄的表达分析PID1基因在不同日龄藏鸡胸肌、腿肌和脂肪组织的表达变化见图6和图7,均以1日龄的表达水平作为对照。由图6可知,在公藏鸡胸肌1 日龄的表达量极显著高于81、119和154 日龄的表达水平(P<0.01),并且210日龄极显著高于81日龄的表达水平(P<0.01);210 日龄的公藏鸡腿肌的表达量极显著高于其他日龄的表达水平(P<0.01),119日龄的表达极显著高于1、81、154日龄的表达水平(P<0.01);在119 和154 日龄公藏鸡脂肪组织中表达水平较高,极显著高于1 日龄的表达水平(P<0.01),并且210日龄的表达水平显著高于1日龄的表达水平(P<0.05)。
由图7可知,PID1基因在母藏鸡胸肌1 日龄的表达量极显著高于其他日龄的表达水平(P<0.01);母藏鸡腿肌119 日龄的表达量极显著高于其他日龄表达水平(P<0.01),并且154、210日龄的表达量均显著高于81日龄的表达水平(P<0.05);在210 日龄母藏鸡脂肪组织中的表达量最高,极显著高于其他日龄表达水平(P<0.01)。

图6 PID1基因在公藏鸡不同时期和组织的相对表达量Fig.6 Relative expression of PID1 mRNA in different tissues and at different ages of male Tibetan chicken

图7 PID1基因在母藏鸡不同时期和组织的相对表达量Fig.7 Relative expression of PID1 mRNA in different tissues and at different ages of female Tibetan chicken
综上分析,PID1基因在不同日龄藏鸡胸肌中的表达不存在公母差异,但在腿肌和脂肪组织中的表达均存在公母差异。并对同一日龄的同一组织进行了公母表达差异分析,结果发现,1日龄腿肌组织公母差异极显著(P<0.01),其余各日龄公母无差异,胸肌与脂肪组织公母间无差异。
2.5PID1 mRNA与藏鸡肌内脂肪含量的相关性分析
藏鸡不同日龄肌内脂肪含量测定结果显示(表3),随日龄的增加IMF的含量总体呈现增长趋势,腿肌IMF含量高于胸肌IMF含量。PID1 mRNA 表达量与IMF的相关性分析结果得出,在119~210 d阶段公鸡胸肌PID1 mRNA 表达量与IMF含量的相关性达到显著正相关(r=0.435*;P=0.043);在154~210 d母鸡胸肌的PID1 mRNA表达量与IMF含量呈显著负相关(r=-0.556*;P=0.039)。在其他阶段PID1 mRNA表达量与IMF含量均存在相关性,但未达到显著性水平。
表3藏鸡各个日龄不同部位的肌内脂肪含量
Table 3IMF content in different tissues and at different ages in Tibetan chicken

%
3 讨 论
3.1藏鸡PID1基因克隆与序列分析
研究表明,PID1基因在哺乳动物中是含有PTB结构域的蛋白,在信号转导(PTB结构域最基本的特征是作为一种适配器蛋白)[15]、器官形成[16]、细胞增殖和神经发育[17]等方面起重要作用。
本研究成功获得了藏鸡PID1基因序列,并且发现与原鸡序列相比存在4个核苷酸突变位点,其中有2个是同义突变,有2个是非同义突变,分别是229、353 位点的Cys、Lys均突变为Arg,且这2个突变位于藏鸡PTB结构域,这些突变有可能会导致该基因功能的变化。有研究证实,β3-肾上腺素能受体(β3-AR)基因第190位碱基突变,导致第64位氨基酸发生Trp64Arg变异,可引起脂质和能量代谢异常[18]。并且同源性分析发现,核PID1基因在不同物种间进化保守性较高,这与C.Man等[13]的报道相一致,可能是因为该蛋白含有的一个特殊结构域-PTB(PH结构域超家族成员)决定了基因的进化[19]及功能。
藏鸡PID1蛋白生物信息学分析结果显示,该蛋白属于不稳定亲水酸性蛋白质且分子量是24.92 ku,与鸡25.00 ku不同,可能是与PID1蛋白氨基酸突变有关。藏鸡氨基酸组成与人[8]相比,均是Leu所占比例最高,可能因为不同物种间氨基酸差异不大所致。分析预测藏鸡PID1蛋白有14个潜在磷酸化位点,4个潜在O-糖基化位点,1个潜在N-糖基化位点,3个二硫键,7种保守特异性蛋白质激酶结合位点且最强在Ser192残基(P=0.82),10个蛋白与蛋白作用位点。蛋白质翻译后的修饰对蛋白的正确折叠[20]等方面起重要作用。PID1蛋白二级结构α-螺旋占26.73%,β折叠占20.74%,无规则卷曲占52.53%。最大量的结构元件为α-螺旋和无规则卷曲。本研究还发现,PID1蛋白主要存在于细胞质中,通过绿色荧光标记蛋白转染3T3-L1前体脂肪细胞和293T细胞也发现了该现象[4],说明该蛋白无信号肽、不存在跨膜结构域[8],并有沿质膜内侧区域性聚集现象[13],与本研究预测结果相似。
3.2PID1基因在藏鸡各组织中的表达分析
组织表达分析显示,藏鸡PID1基因在各个组织中存在广泛表达,在脂肪组织中表达最高,并且在整个发育阶段的脂肪组织中呈不同程度的表达,推测该基因在藏鸡脂肪细胞分化过程中发挥作用。有研究表明,3T3-L1前体脂肪细胞转变为脂肪细胞的过程中PID1的表达呈上调趋势[21],说明PID1基因在成脂过程中发挥重要作用。同时本试验发现,PID1基因在肺组织中也存在较高水平的表达,可能是因为藏鸡处于高海拔、气候寒冷的环境中,肺组织需要沉积较多的脂肪。胸肌中表达不高,这与A.S.Da Costa等[22]报道的肌肉组织是肌内脂肪沉积最重要的组织相一致。对鸡的研究表明,各个组织间没有表达的差异性,却有一些微小RNA的靶位点[13]。在猪上研究发现,表达最高的是肝组织,其次是脂肪[23-24],不同品种间猪的表达具有差异性;在羊上高表达组织为肝和腹肌,低表达组织为脾和肺[25]。说明该基因表达具有物种的特异性、组织的广泛性,并且该基因的表达受多种因素共同决定。因为藏鸡生活在高海拔地区,经过藏族人民长期的培育,其遗传基因、生活环境等与陆地动物有所不同,可能因此造成了PID1基因表达的差异。下一步可以高原环境等作为切入点深入了解该基因的表达。
3.3PID1基因在藏鸡不同发育阶段肌肉组织的时序表达及与IMF沉积的相关性
本研究发现,PID1基因在1~210日龄藏鸡的胸肌和腿肌中均存在表达,在1日龄胸肌及119日龄腿肌中存在高表达。同时分析显示,PID1基因在各个阶段藏鸡胸肌中的表达无性别差异,但在腿肌中的表达却存在性别差异。说明PID1基因的表达存在日龄、性别的差异。有研究表明,PID1基因在山羊6~24月龄期间背最长肌的表达水平呈增长的趋势[26]。在牦牛上研究发现,PID1基因在0.5和9岁牛背最长肌的表达极显著高于3.5~5.5岁的牛[27]。与本试验结果不同的原因可能是不同物种所致。
本研究中,PID1基因的表达量与IMF含量的相关性分析结果表明,119~210日龄公藏鸡胸肌PID1基因的表达量与IMF含量呈显著正相关(P<0.05),但154~210日龄母鸡胸肌IMF含量呈显著负相关(P<0.05),造成公母差异的原因可能是154~210日龄母鸡处于产蛋阶段,对其IMF沉积有影响。钱源等和徐洪刚指出在猪不同品种间的肝、脂肪和肌肉组织及天府肉羊背最长肌中PID1基因mRNA表达量与IMF含量呈显著正相关[23,25]。同时有研究报道,利用精子介导法制备RNA干扰PID1转基因兔模型发现,PID1基因与肌内脂肪沉积密切相关[11]。因此推测PID1基因可能作为IMF沉积的候选基因。但本试验结果指出,PID1基因表达水平与IMF含量沉积存在部位差异性,原因可能是藏鸡处于高海拔地区,与陆地生长的其他物种在相关性、能量代谢等方面有差异。
4 结 论
本研究成功克隆了藏鸡PID1基因序列654 bp,共编码217个氨基酸,属于不稳定亲水酸性混合蛋白质。与原鸡亲缘关系最近,且存在4个位点的碱基突变,其中2个突变引起氨基酸的改变,并位于PTB结构域。PID1基因在心、肝、脾、肺、肾、脑、胸肌、腿肌、皮下脂肪都有表达,且在脂肪组织中表达最高。同时发现PID1基因的表达有日龄、性别、组织的差异,且该基因表达水平与IMF含量呈不同程度相关。本研究为进一步了解PID1基因的功能及其在肌内脂肪沉积中的作用提供一定理论基础。
[1]陈国宏,王克华,王金玉,等.中国禽类遗传资源[M].上海:上海科学技术出版社,2004:72-73.
CHEN G H,WANG K H,WANG J Y,et al.Poultry genetic resources in China[M].Shanghai:Shanghai Scientific and Technical Publishers,2004:72-73.(in Chinese)
[2]国家畜禽遗传资源委员会.中国畜禽遗传资源志家禽志[M].北京:中国农业出版社,2011:331-333.
China National Commission of Animal Genetic Resources.Animal Genetic Resources in China Poultry[M].Beijing:China Agriculture Press,2011:331-333.(in Chinese)
[3]WANG Y H,BYRNE K A,REVERTER A,et al.Transcriptional profiling of skeletal muscle tissue from two breeds of cattle[J].MammGenome,2005,16(3):201-210.
[4]WANG B,ZHANG M,NI Y H,et al.Identification and characterization of NYGGF4,a novel gene containing a phosphotyrosine-binding (PTB) domain that stimulates 3T3-L1 preadipocytes proliferation[J].Gene,2006,379:132-140.
[5]QIU J,NI Y H,GONG H X,et al.Identification of differentially expressed genes in omental adipose tissues of obese patients by suppression subtractive hybridization[J].BiochemBiophysResCommun,2007,352(2):469-478.
[6]BOST F,AOUADI M,CARON L,et al.The extracellular signal-regulated kinase isoform ERK1 is specifically required forinvitroandinvivoadipogenesis[J].Diabetes,2005,54(2):402-411.
[7]ZHAO Y,ZHANG C,CHEN X,et a1.Overexpression of NYGGF4(PIDl)induces mitochondrial impairment in 3T3-L1 adipocytes[J].MolCellBiochem,2010,340(1-2):41-48.
[8]邱洁,郭锡熔,李晓南,等.新基因NYGGF4在肥胖患儿脂肪组织中的表达验证及生物信息学分析[J].实用儿科临床杂志,2008,23(7):495-497.
QIU J,GUO X R,LI X N,et al.Expression and bioinformatics analysis of a novel gene NYGGF4 in adipose tissue of obese children[J].JournalofAppliedClinicalPediatrics,2008,23(7):495-497.(in Chinese)
[9]FAJAS L.Adipogenesis:a cross-talk between cell proliferation and cell differentiation[J].AnnMed,2003,35(2):79-85.
[10]YU Z,GUO X.NYGGF4 as a new therapeutic target for obesity-associated insulin resistance[J].MedHypotheses,2012,78(4):432-434.
[11]徐正刚,杨伦,曾勇庆,等.RNA干扰沉默PID1基因肉兔模型的构建[J].畜牧兽医学报,2014,45(5):750-756.
XU Z G,YANG L,ZENG Y Q,et al.Construction of transgenic rabbit model by RNA interferencingPID1 gene[J].ActaVeterinariaetZootechnicaSinica,2014,45(5):750-756.(in Chinese)
[12]陈小玲,黄志清,贾刚,等.磷酸酪氨酸互作结构域l基因对肉质性状的调控[J].动物营养学报,2012,24(4):591-594.
CHEN X L,HUANG Z Q,JIA G,et al.Phosphotyrosine interaction domain containing l gene:Regulation on meat quality[J].ChineseJournalofAnimalNutrition,2012,24(4):591-594.(in Chinese)
[13]MAN C,LI X,ZHAO D.Cloning,sequence identification,and tissue expression analysis of novel chicken NYGGF4 gene[J].MolCellBiochem,2011,346 (1-2):117-124.
[14]LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CTmethod[J].Methods,2001,25(4):402-408.
[15]RAVICHANDRAN K S.Signaling via Shc family adapter proteins[J].Oncogene,2001,20(44):6322-6330.
[16]BEDIRIAN A,BALDWIN C,ABE J,et al.Pleckstrin homology and phosphotyrosine-binding domain-dependent membrane association and tyrosine phosphorylation of Dok-4,an inhibitory adapter molecule expressed in epithelial cells[J].JBiolChem,2004,279(18):19335-19349.
[17]UHLIK M T,TEMPLE B,BENCHARIT S,et al.Structual and evolutionary division of phosphotyrosine binding (PTB) domains[J].JMolBiol,2005,345(1):1-20.
[18]姜秀云,陈丽,傅艺凌.β3-AR基因变异与山东汉族人糖尿病视网膜病变的相关性研究[J].山东医药,2005,45(13):40-41.
JIANG X Y,CHEN L,FU Y L.Association analysis ofβ3-ARgene mutation with diabetic retinopathy in Shandong Ethnic Han[J].ShandongMedicalJournal,2005,45(13):40-41.(in Chinese)
[19]SHI N,YE S,BARTLAM M,et al.Structural basis for the specific recognition of RET by the Dok1 phosphotyrosine binding domain[J].JBiolChem,2004,279(6):4962-4969.
[20]CHEN G,HOWE A G,XU G,et al.Mature N-linked glycans facilitate UT-A1 urea transporter lipid raft compartmentalization[J].FASEBJ,2011,25(12):4531-4539.
[21]ZHAO Y P,ZHANG C M,ZHU C,et al.NYGGF4 homologous gene expression in 3T3-L1 adipocytes:regulation by FFA and adipokines[J].MolBiolRep,2010,37(7):3291-3296.
[22]DA COSTA A S,PIRES V M,FONTES C M,et al.Expression of genes controlling fat deposition in two genetically diverse beef cattle breeds fed high or low silage diets[J].BMCVetRes,2013,9:118.
[23]钱源,曾勇庆,杜金芳,等.猪PID1基因CDS区的克隆及其mRNA表达与肌内脂肪沉积关系[J].遗传,2010,32(11):1153-1158.
QIAN Y,ZENG Y Q,DU J F,et al.CDS cloning and relationship between intramuscular fat content and mRNA expression ofPID1 gene in pig[J].Hereditas,2010,32(11):1153-1158.(in Chinese)
[24]钱源,曾勇庆,崔景香,等.莱芜猪PID1基因的功能分析及表达谱研究[J].畜牧兽医学报,2011,42(5):621-628.
QIAN Y,ZENG Y Q,CUI J X,et al.Functional analysis and tissue specific expression profile ofPID1 gene in Laiwu pig[J].ActaVeterinariaetZootechnicaSinica,2011,42(5):621-628.(in Chinese)
[25]徐洪刚.天府肉羊MYLPF和PID1基因克隆、表达及其与肌内脂肪含量关系研究[D].成都:四川农业大学,2013.
XU H G.Studies on cloning and expression of Tianfu goatMYLPFandPID1 gene and their relationship with intramuscular fat content[D].Chengdu:Sichuan Agricultural University,2013.(in Chinese)
[26]XU H G,XU G Y,WANG D H,et al.Molecular cloning and tissue distribution of the phosphotyrosine interaction domain containing 1 (PID1) gene in Tianfu goat[J].Gene,2013,515(1):71-77.
[27]LIN Y Q,ZHAO Y Y,LI R W,et al.Cloning and expression profile of PID1 in yak[J].JAnimVetSci,2015,2(1):1-5.
(编辑郭云雁)
Research on Cloning and Tissue Expression Profile of Phosphotyrosine Interaction Domain Containing 1(PID1)in Tibetan Chicken
NIE Xiao-qing,LIN Ya-qiu*,XU Ya-ou*,ZHAO Yan-ying,LÜ Ming,ZUO Lu-lu,ZHANG Xiao-yu,LI Xiang
(CollegeofLifeScienceandTechnology,SouthwestUniversityforNationalities,Chengdu610041,China)
In the present study,PID1 mRNA expression profile in several tissues of Tibetan chicken during different growth phases and the correlation betweenPID1 mRNA expression and intramuscular fat (IMF) content were investigated.PID1 gene of Tibetan chicken was cloned using RT-PCR and the structure as well as function of PID1 protein was predicted using relevant softwares.Furthermore,the expression profile ofPID1 gene was investigated by qRT-PCR and the relationship betweenPID1 mRNA expression and IMF content in chicken muscles were analyzed.The results showed thatPID1 gene was 654 bp encoding a unstable,hydrophilic,acidic protein with 217 amino acids and a PTB (phosphotyrosine binding) domain.There were 14 phosphorylation sites,4 O-glycosylation sites,1 N-glycosylation site,7 protein kinase phosphorylation sites,and 3 disulfide bonds within the PID1 protein.The predicted secondary structure of PID1 protein was composed of alpha helix (26.73%),beta fold (20.74%) and random coil (52.53%),belonging to one of mixed proteins in cytoplasm.qRT-PCR results showed thatPID1 mRNA could be expressed in various tissues,with the highest expression level in fat (P<0.01).The temporal expression showed that the expression level ofPID1 gene was the highest in breast muscle of 1 day Tibetan chicken,and was the highest in leg muscle of the 210thday cocks (P<0.01),while the highest in leg muscle of the 119thday hens (P<0.01).For fat tissues,the highest expression level appeared in the 119thday and the 154thday cocks,and the 210thday hens,respectively.The correlation analysis indicated that there was a significant correlation betweenPID1 mRNA expression and breast muscle IMF content in Tibetan chicken(P<0.05).These results suggested that thePID1 gene might play an important role in the IMF deposition of Tibetan chicken.
Tibetan chicken;Phosphotyrosine interaction domain containing 1(PID1);cloning;tissue expression;temporal expression;intramuscular fat(IMF)
10.11843/j.issn.0366-6964.2016.06.004
2015-08-17
四川应用基础项目(2013JY0044);四川省畜禽育种攻关项目 (2011NZ0099-6);西南民族大学项目(2012NFW001)
聂晓庆(1989-),女,河南新乡人,硕士生,主要从事动物遗传育种研究,E-mail:n_x_qing@163.com
林亚秋,研究员,博士,主要从事动物遗传育种研究,E-mail:linyq1999@163.com;徐亚欧,教授,硕士生导师,主要从事动物遗传育种研究,E-mail:xuyaou@163.com
S831.2
A
0366-6964(2016)06-1102-10

