急性冠脉综合征患者血清高迁移率族蛋白B1的表达及阿托伐他汀干预治疗的影响
孟祥娟,许静,程爱娟
药物临床观察
急性冠脉综合征患者血清高迁移率族蛋白B1的表达及阿托伐他汀干预治疗的影响
孟祥娟1,2,许静2,程爱娟2
摘要:目的探讨急性冠脉综合征(ACS)患者血清高迁移率族蛋白B1(HMGB1)及超敏C反应蛋白(hs-CRP)的表达及阿托伐他汀干预治疗对其影响。方法选择临床确诊为ACS的患者90例和对照组90例,所有患者均于治疗前抽取空腹肘正中静脉血,检测HMGB1及hs-CRP;将ACS组患者按随机数字表法分为标准组(45例)和强化组(45例),分别给予阿托伐他汀20 mg每天1次和40 mg每天1次,治疗1周后再次抽取空腹肘正中静脉血,检测HMGB1及hs-CRP。结果ACS组患者血清HMGB1及hs-CRP水平高于对照组(P<0.01)。ACS组患者血清HMGB1水平与hs-CRP水平呈正相关(r=0.389,P<0.01)。治疗前,标准组与强化组患者血清HMGB1及hs-CRP基线水平差异无统计学意义;治疗后1周,2组患者血清HMGB1及hs-CRP水平较治疗前均降低,且强化组较标准组降低更明显(均P<0.05)。结论HMGB1和hs-CRP相互影响,在动脉粥样硬化的发生、发展中发挥重要作用。强化阿托伐他汀治疗能显著降低HMGB1表达,减轻ACS患者的炎症反应,稳定冠脉粥样硬化斑块。
关键词:急性冠状动脉综合征;高迁移率族蛋白质类;C反应蛋白质;阿托伐他汀;高迁移率族蛋白B1;超敏C反应蛋白
急性冠脉综合征(ACS)是一组包含不同临床表现、危险性及预后的急性血管综合征,其共同的主要致病机制是不稳定斑块的纤维帽破裂和内膜的浅表糜烂[1]。有研究指出,炎症反应在易损斑块的形成中发挥着关键作用[2],并可导致不稳定斑块破裂[3]。高迁移率族蛋白B1(HMGB1)是新近发现的一种非特异性的炎症因子[4],其在动脉粥样硬化病变的坏死核心区高表达[5]。长期应用他汀类药物可抗动脉粥样硬化、稳定粥样斑块。但他汀类药物能否通过影响HMGB1水平发挥其抗炎、稳定粥样斑块的研究尚少见。本研究通过观察阿托伐他汀对ACS患者血清HMGB1及超敏C反应蛋白(hs-CRP)表达的影响,进一步探讨阿托伐他汀抗炎、稳定粥样斑块的作用。
1 对象与方法
1.1研究对象参照2014美国心脏病学会(ACC)/美国心脏协会(AHA)非ST段抬高型急性冠脉综合征诊治指南或2013美国心脏病学会基金会(ACCF)/AHA ST段抬高心肌梗死指南,选取2014年10月—2015年6月就诊于本院的ACS患者90例,其中不稳定型心绞痛(UA)患者29例,非ST段抬高型心肌梗死(NSTEMI)患者26例,ST段抬高型心肌梗死(STEMI)患者35例,男69例,女21例,年龄30~81岁,平均(59.03±9.84)岁。排除标准:既往有严重肝肾功能不全及心衰者;伴严重感染性疾病、风湿免疫性疾病及恶性肿瘤者;对他汀类药物过敏者;入院前3个月内曾服用过他汀类或非他汀类调脂药物者。所有入选者均签署知情同意书。将入选的ACS患者按随机数字表法分为标准组和强化组。另外入选同一时段因胸痛原因待查入住我院,心电图、心肌坏死标志物、生化全项及影像学检查均正常,并经冠脉造影检查除外冠心病的患者90例,作为对照组。
1.2研究方法所有入选的ACS患者在抗血小板聚集、抗凝、抗心绞痛等常规治疗的基础上,标准组和强化组分别给予阿托伐他汀(辉瑞制药)20 mg每天1次和40 mg每天1次治疗;所有入组患者于治疗前采集空腹肘正中静脉血5 mL,置促凝管内,于4℃、3 000 r/min离心10 min,分离上层血清,应用全自动生化分析仪检测同型半胱氨酸(Hcy)和血脂,其余血清标本置于-80℃冰冻保存待检;ACS组患者于治疗后1周再次采集清晨空腹肘正中静脉血5 mL,操作方法同上。血清HMGB1、hs-CRP检测采用酶联免疫吸附试验(ELISA),两种试剂盒均同批购自上海蓝基生物科技有限公司,并严格按照说明书进行操作。
1.3统计学方法应用SPSS 20.0软件包进行统计学处理。符合正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用两独立样本资料t检验,方差不齐的组间比较采用t′检验,组内治疗前后指标的比较采用配对t检验;不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Wilcoxon秩和检验;计数资料以例(%)表示,组间比较采用Χ2检验。双变量正态资料的线性相关采用Pearson分析。P<0.05为差异有统计学意义。
2 结果
2.1临床资料比较ACS组有糖尿病病史、吸烟史的比例和Hcy水平高于对照组,HDL-C低于对照组,差异均有统计学意义(均P<0.01),见表1。治疗前,标准组与强化组临床资料比较差异均无统计学意义,见表2。
2.2ACS组与对照组血清HMBG1与hs-CRP基线水平比较ACS组血清HMBG1与hs-CRP水平高于对照组(P<0.01),见表3。
2.3HMBG1与hs-CRP相关性治疗前,ACS组患者血清HMBG1与hs-CRP水平呈正相关(r=0.389,P<0.01)。

Tab.1 Comparison of general clinical date between ACS group and control group表1 ACS组与对照组临床基本资料比较 (n=90)

Tab.2 Comparison of general clinical date between standard group and intensive group表2 标准组与强化组临床基本资料比较 (n=45)

Tab.3 Comparison of serum HMBG1 and hs-CRP baseline concentrations between ACS group and control group表3 ACS组与对照组血清HMBG1与hs-CRP基线水平比较 (μg/L,x±s)
2.4治疗前后标准组与强化组血清HMGB1及hs-CRP水平变化治疗前标准组与强化组血清HMGB1及hs-CRP水平差异无统计学意义。治疗后1周2组患者血清HMGB1及hs-CRP较治疗前均降低,且强化组较标准组降低更明显(均P<0.05),见表4。
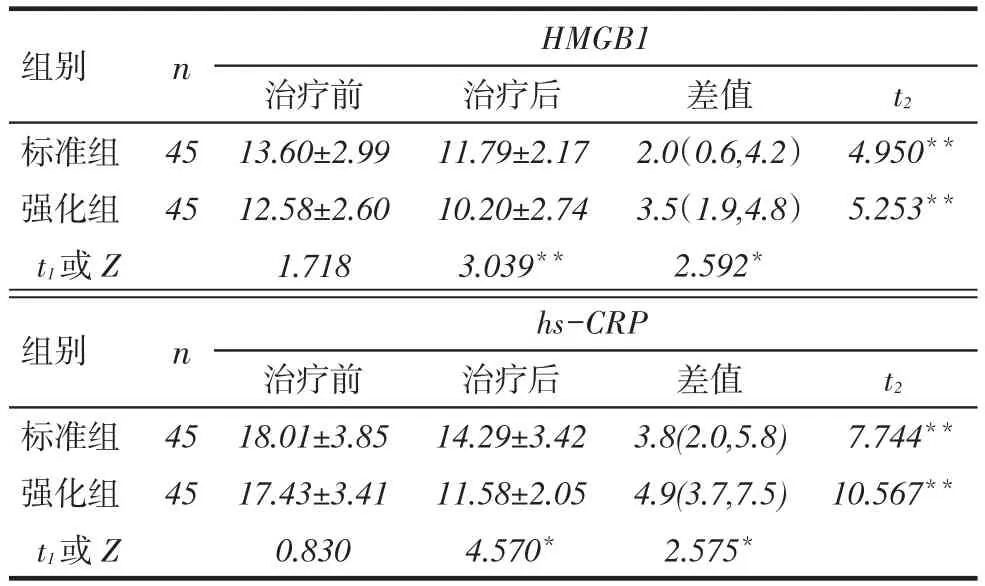
Tab.4 Comparison of HMBG1 and hs-CRP before and after treatment between two groups表4 2组患者治疗前后HMBG1与hs-CRP比较 (μg/L,x±s)
3 讨论
有研究证据指出,炎症可通过减薄纤维帽、增强脂质的涌入、扩大脂质核心以及刺激新血管的生成,在促使易损斑块形成中发挥关键作用[2]。炎症反应可导致不稳定斑块破裂并诱发血栓形成,导致随后的急性缺血事件的发生[3]。ACS是急性心肌缺血事件中最常见的一组临床疾病,其共同的主要致病机制是冠脉不稳定斑块的纤维帽破裂和内膜的浅表糜烂[1]。
炎症因子在冠状动脉狭窄的过程中产生并释放,它们可以反过来促进冠状动脉狭窄的进一步发展,形成一种恶性的循环。高迁移率族蛋白(HMG)是一种低分子非组蛋白染色体核蛋白,其富含电荷,在聚丙烯酰胺凝胶电泳中具有快速的迁移率。HMGB1则是HMG家族中含量最丰富且唯一能够被释放到细胞外,发挥其生物学活性的蛋白质,其几乎存在于所有真核细胞中。既往有研究显示HMGB1是一种新型的敏感性、非特异性的炎症因子[4],HMGB1作为一种促炎症因子,在动脉粥样硬化炎症反应中发挥着重要作用[6]。HMGB1高表达于动脉粥样硬化斑块病变的坏死核心中,并由坏死细胞释放,诱发局部炎症[5]。在多种非特异性炎症反应中,组织细胞的坏死、损伤可引起活化的巨噬细胞和平滑肌细胞主动分泌HMGB1,其在细胞外可直接刺激炎症细胞产生hs-CRP、肿瘤坏死因子(TNF)和干扰素(IFN)等炎症因子,而这些炎症因子同样可以反过来促进HMGB1的生成,形成级联放大的炎症反应[7],从而促进动脉粥样硬化及不稳定斑块的形成,甚至导致不稳定型斑块的破裂,引发冠状动脉严重的完全性或不完全性阻塞,导致ACS及其他急性心血管事件的发生。近年来,Kohno等[8]研究发现急性心肌梗死(AMI)后HMGB1可迅速释放到细胞外,并在梗死发生后12 h达高峰,这种高水平的状态可维持至梗死后1周。Hashimoto等[9]研究显示,ACS患者血清HMGB1水平高于对照组,高水平的HMGB1可能是UA或NSTEMI发病1 d内预测心血管死亡率潜在的独立危险炎症因子。
hs-CRP可促进冠状动脉粥样斑块内巨噬细胞对内源性LDL-C的摄取,诱导泡沫细胞的产生,在冠脉粥样硬化的发生、发展中起着关键作用;还可以促使白细胞释放蛋白酶,加速降解粥样硬化斑块纤维帽,导致斑块纤维帽变薄、破裂,继发血栓形成,是心血管事件的重要炎症标志物之一[10]。近年来研究显示,hs-CRP水平在ACS患者中明显升高,可反映冠脉斑块内炎症强度的大小及冠心病的严重程度[10-11]。
Hashimoto等[9]和 Seo等[12]的研究显示血清HMGB1及hs-CRP水平在ACS患者中均较对照组患者升高。本研究与之相符,提示HMGB1水平可能与冠脉斑块的稳定性有关。ACS患者冠脉内的易损斑块破裂、血管内皮受损,导致血小板激活并黏附聚集,从而形成血栓,导致冠脉管腔严重狭窄或闭塞,引发心肌缺血。在急性缺血阶段,HMGB1由受损或坏死的心肌细胞、血管内皮细胞、泡沫细胞和活化的巨噬细胞等释放,增加炎症或组织的损伤[13]。本研究还显示ACS患者血清HMBG1与hs-CRP呈正相关,和Yao等[14]研究相近,提示HMGB1和hs-CRP作为炎症因子可相互促进,在冠状动脉粥样硬化的发生、发展中发挥重要作用。
近年来,有研究显示他汀类药物在降脂的同时还具有抗炎、抗氧化、改善内皮功能及抗动脉粥样硬化的作用[15],长期应用可阻止冠脉粥样硬化斑块的进展。短期强化阿托伐他汀治疗具有抗炎、稳定斑块的作用[16]。但阿托伐他汀能否通过影响HMGB1水平发挥其抗炎及稳定粥样硬化斑块的研究报道尚少见。本研究显示强化阿托伐他汀治疗能降低ACS患者HMGB1的表达,稳定冠脉粥样硬化斑块,发挥其抗炎、抗氧化作用。本研究时间短、样本量小,未能对长期大剂量阿托伐他汀治疗对冠脉斑块的稳定性及安全性作进一步观察,有待于进一步证实。
参考文献
[1]Libby P.Mechanisms of acute coronary syndromes and their implications for therapy[J].N Engl J Med,2013,368(21):2004-2013. doi:10.1056/NEJMra1216063.
[2]Bentzon JF,OtsukaF,Virmani R,et al.Mechanisms of plaque formation and rupture[J].Circ Res,2014,114(12):1852-1866.doi:10.1161/ CIRCRESAHA.114.302721.
[3]Liang Y,Hou Y,Niu H,et al.Correlation of high-sensitivity C-reactive protein and carotid plaques with coronary artery disease in elderly patients[J].Exp Ther Med,2015,10(1):275-278.
[4]Hu X,Jiang H,Bai Q,et al.Inceased serum HMGB1 is related to the severity of coronary artery stenosis[J].Clin Chim Acta,2009,406(1/2):139-142.doi:10.1016/j.cca.2009.06.016.
[5]Kalinina N,Agrotis A,Antropova Y,et al.Increased expression of the DNA-binding cytokine HMGB1 in human atherosclerotic lesions:role of activated macrophages and cytokines[J].Arterioscler Thromb Vasc Biol,2004,24(12):2320-2325.
[6]de Souza AW,Westra J,Limburg PC,et al.HMGB1 in vascular diseases:Its role in vascular inflammation and atherosclerosis[J]. Autoimmun Rev,2012,11(12):909-917.doi:10.1016/j.autrev. 2012.03.007.
[7]Inoue K,Kawahara K,Biswas KK,et al.HMGB1 expression by activated vascular smooth muscle cells in advanced human atherosclerosis plaques[J].Cardiovasc Pathol,2007,16(3):136-143.
[8]Kohno T,Anzai T,Naito K,et al.Role of high-mobility group box 1 protein in post-infarction healing process and left ventricular remodelling[J].Cardiovasc Res,2009,81(3):565-573.doi:10.1093/cvr/cvn291.
[9]Hashimoto T,Ishii J,KitagawaF,et al.Circulatinghigh-mobility group box 1 and cardiovascular mortality in unstable angina and non-ST-segment elevation myocardial infarction[J].Atherosclerosis,2012,221 (2):490-495.doi:10.1016/j.atherosclerosis.2012.01.040.
[10]Cimmino G,Ragni M,Cirillo P,et al.C-reactive protein induces expression of matrix metalloproteinase-9:a possible link between inflammation and plaque rupture[J].Int J Cardiol,2013,168(2):981-986.doi:10.1016/j.ijcard.2012.10.040.
[11]Jung CH,Lee WY,Kim BY,et al.The risk of metabolic syndrome according to the white blood cell count in apparently healthy Korean adults[J].Yonsei Med J,2013,54(3):615-620.doi:10.3349/ ymj.2013.54.3.615.
[12]Seo HS.The role and clinical significance of high-sensitivity C-reactive protein in cardiovascular disease[J].Korean Circ J,2012,42 (3):151-153.doi:10.4070/kcj.2012.42.3.151.
[13]Xu H,Yao Y,Su Z,et al.Endogenous HMGB1 contributes to ischemia-reperfusion-induced myocardial apoptosis by potentiating the effect of TNF-α/JNK[J].Am J Physiol Heart Circ Physiol,2011,300(3):H913-921.doi:10.1152/ajpheart.00703.2010.
[14]Yao HC,Zhao AP,Han QF,et al.Correlation between serum highmobility group box-1 levels and high-sensitivity C-reactive protein and troponin I in patients with coronary artery disease[J].Exp Ther Med,2013,6(1):121-124.
[15]Zucker IH,Keehan KH.The American Journal of Physiology-Heart and Circulatory Physiology:a long history,a bright future[J].Am J Physiol Heart Circ Physiol,2014,306(8):H1103-1104.doi:10.1152/ajpheart.00106.2014.
[16]Shan R,Wu SQ,Cheng AJ.Effects of loading dose of atorvastatin on inflammatory cytokines in acute myocardial infarction patients undergoing emergency percutaneous coronary intervention[J].Tianjin Med J,2015,43(3):285-287.[单瑞,吴尚勤,程爱娟.围术期强化阿托伐他汀治疗对AMI患者急诊PCI术后Lp-PLA2及炎症因子的影响[J].天津医药,2015,43(3):285-287].doi:10.3969/ j.issn.0253-9896.2015.03.017.
(2015-08-23收稿2015-12-08修回)
(本文编辑李国琪)
The expression of high mobility group box-1 in patients with acute coronary syndrome and the treatment of atorvastatin
MENG Xiangjuan1,2,XU Jing2,CHENG Aijuan2
1 Graduate School of Tianjin Medical University,Tianjin 300070,China;2 Department of Cardiology,Tianjin Chest Hospital Corresponding AuthorE-mail:tjxkyyjuan@sina.com
Abstract:ObjectiveTo investigate the expressions of high mobility group box-1(HMGB1)and high sensitivity C-reactive protein(hs-CRP)in patients with acute coronary syndrome(ACS)and the effects of atorvastatin on the two inflammatory cytokines.MethodsA total of 90 patients with ACS and 90 cases of normal control subjects were selected in this study.The serum concentrations of HMGB1 and hs-CRP were measured before treatment in patients of ACS.Patients were randomly divided into two groups:control group(n=45)and atorvastatin group(n=45).Atorvastatin was given 20 mg/24 h and 40 mg/24 h.Blood samples were obtained from the patients for detection of HMGB1 and hs-CRP one week after treatment with atorvastatin.ResultsThere were significantly higher serum levels of HMGB1 and hs-CRP in patients with ACS than those of control subjects(P<0.01).The level of HMGB1 was positively correlated with the level of hs-CRP in patients of ACS(r=0.389,P<0.01).Before treatment,there were no significant diffferences in level of HMGB1 and hs-CRP in patients with ACS between the two groups.After treatment with atorvastatin,the levels of HMGB1 and hs-CRP were decreased in the two groups of ACS,and those were significantly lower in the intensive group than the standard group(P<0.05).ConclusionHMGB1 could stimulate the secretion of hs-CRP and other inflammatory cytokines,playing an important role in the process of occurrence and development of atherosclerosis.High loading dose of atorvastatin may reduce the expression of HMGB1 and decrease the inflammation,and stabilize the plaques in patients with acute coronary syndrome.
Key words:acute coronary syndrome;high mobility group proteins;C-reactive protein;atorvastatin;high mobility group box-1;hs-CRP
中图分类号:R541.4
文献标志码:A
DOI:10.11958/20150127
基金项目:天津市卫生行业重点攻关项目(12KG126);天津市卫生局科技基金(2011KZ61)
作者单位:1天津医科大学研究生院(邮编300070);2天津市胸科医院心内科
作者简介:孟祥娟(1988),女,硕士在读,主要从事心血管疾病基础与临床研究
通讯作者E-mail:tjxkyyjuan@sina.com

