植物细胞悬浮培养中次生代谢产物积累的研究进展
陈月华,朱 艳,张 翔,秦民坚*
(中国药科大学1. 中药资源学教研室; 2.天然药物活性组分与药效国家重点实验室,江苏 南京210009)
植物细胞悬浮培养中次生代谢产物积累的研究进展
陈月华1,2,朱 艳1.2*,张 翔1,2,秦民坚1,2*
(中国药科大学1. 中药资源学教研室; 2.天然药物活性组分与药效国家重点实验室,江苏 南京210009)
摘要我国是植物资源最丰富的国家之一。植物的活性成分主要为其次生代谢产物,并大多依赖于天然植物资源中直接提取获得。但由于自然环境的破坏、植物资源的过度开发及其栽培困难等原因,许多天然植物资源正在以惊人的速度消失。为了既能满足社会对植物次生代谢物的需求,又能合理开发利用自然植物资源和保护生态环境,悬浮细胞培养技术为生产药用植物活性成分提供了一条全新途径。但受目的产物含量低的限制,能用悬浮细胞培养技术生产的天然活性物质种类也十分有限。因此,进一步研究植物悬浮细胞培养合成活性成分的高产调控技术具有重要的意义。本文综述了近年来国内外应用悬浮细胞培养技术生产次生代谢产物及调控因素研究进展。
关键词悬浮细胞;次生代谢;诱导子;基因工程;调控
次生代谢产物是植物在长期进化过程中与环境相互作用建立防御机制的结果。植物次生代谢产物种类繁多,如酚类、黄酮类、生物碱、香豆素、木质素、糖苷、萜类、甾类、皂苷、有机酸等,这些天然产物在社会生产和生活中占有重要的位置,被加工成药品、香料、食品添加剂、化妆品、农药、染料等。次生代谢产物大多依赖于天然植物资源中直接提取获得,但由于生态环境的破坏、长期无计划的砍伐、栽培困难等原因,许多天然药用植物资源正在以惊人的速度消失。自从1956年,Routine和Nickel首次成功运用植物细胞培养技术生产目的次生代谢产物以来,吸引了众多国内外研究。在中药现代化飞速发展的时代,用细胞培养技术进行药用植物有效成分的生产取得了很大进展。据不完全统计应用植物细胞培养研究过的药用植物超过400 种,分离到的次生代谢物 600 种以上, 其中 60 多种药用植物次生代谢物含量超过或等于原植物的含量[1]。许多重要的药用植物如人参、紫草、长春花、黄连等细胞培养十分成功,少数基本实现了工业化生产。但真正实现植物次生代谢物大规模生产仍有许多问题亟待解决,本文就植物悬浮细胞培养中生产次生代谢物的重要影响因素及调控若干重要问题进行探讨,以期推动我国植物悬浮细胞培养技术的发展和为研究次生代谢物调控过程及机制提供技术手段。
1植物高产细胞系的筛选
在植物细胞悬浮培养体系中,细胞形态分化受到抑制或者染色体发生变异等都会导致次生代谢物产量的降低[2],因此选择生长性状稳定、生产次生代谢产物能力强的细胞系是细胞培养的基本环节。高产细胞系筛选的过程如图1所示,获得高产细胞系从选择富含目的产物的植物品种开始。Ramesha等[3]人研究喜树碱高产植株系时发现不同品种的植株,即喜树、洛氏喜树、云南喜树和青脆枝,其中有效活性成分喜树碱的含量(0.03%~0.4%)差异甚大;同时也注意到在青脆枝的不同部位内的喜树碱的积累也不同,叶、茎皮和根皮含有喜树碱的量也依次递增。高产植株筛选后通过愈伤组织的诱导,从中再筛选出富含目的产物的细胞系做种子细胞培养。因此,选育高产细胞系,选择合适的物种和特定部位也是必不可少的。
筛选高产细胞系是解决植物细胞培养生产次生代谢物产量低的有效的手段之一。常用的方法有目视法、放射免疫法(RIA)、酶联免疫法(ELISA)、流动细胞测定仪、高效液相色谱法 (HPLC)等。过去的几十年主要采用目视法,由于色素的变异通常在愈伤组织和悬浮细胞中就表现出来,因而目视法对含色素的细胞系筛选具有通用性,如花青素、萘醌、类胡萝卜素和叶绿素等,但比较粗放。RIA方法被认为是最灵敏和最精确的,但由于仪器贵、合成放射性标记抗原困难、安全性差等原因,应用较少。ELISA测定方便、灵敏,在大规模筛选中前景广阔。流动细胞测定法局限于被测定细胞中次生代谢产物在激光处理后能发出荧光的一类化合物[4]。目前筛选高产细胞系常用的是色谱、光谱定量分析,如紫外-可见分光光度法(UV-VIS)、HPLC和核磁共振等分析技术在细胞培养的状态下就能提供细胞的定性定量信息。Pasqua等[5]运用TLC和UV-HPLC方法成功筛选出贯叶连翘悬浮细胞中的高产细胞系。邵利[6]建立何首乌悬浮细胞系后通过HPLC-MS检测不同细胞团的二苯乙烯苷,最终获得高含量二苯乙烯苷的细胞系,比原细胞系提高了29.59%。
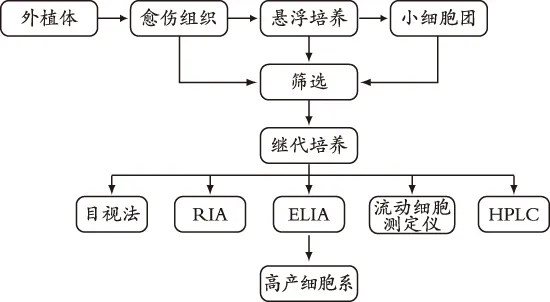
图1 高产细胞系筛选的过程
2培养基的组分对次生代谢产物的影响
培养基的组成是细胞生长和次生代谢物的产生过程中最直接、最重要的影响因素。培养基中碳源、氮源、生长调节剂以及其他有机添加物不仅是植物细胞生长以及营养物质合成的物质基础,而且很多都能促进次生代谢产物的积累。
碳源作为细胞的主要能量来源,可以调节培养环境的渗透压,最近研究[7]认为糖还可以作为信号分子影响悬浮细胞的生长代谢。最常用的碳源虽是蔗糖,但其它碳源对生长和次生代谢产物积累方面也有着重要的影响。研究碳源对迷迭香悬浮细胞系迷迭香酸积累的影响中发现,30g·L-1蔗糖处理的悬浮培养细胞迷迭香酸含量高出 70g·L-1麦芽糖处理的228倍,但还是略低于40g·L-1葡萄糖处理[8]。可见悬浮细胞对于不同碳源的反应是不一样的。在悬浮细胞培养中,基本培养基MS、LS、B5均含有硝酸盐和铵盐作为氮源,它们分别提供硝态氮和铵态氮,两者相对比例对次生代谢产物的积累带来显著影响。Sivakumar等[9]研究得到铵态氮的比例较小时更有利于人参皂苷的合成。如上所述,细胞的次生代谢物合成与碳源及氮源有关,要得到较高的次生代谢产物积累量,碳源和氮源的组成和浓度都是要考虑的重要影响因素。
在植物悬浮细胞培养过程中,植物生长调节剂的浓度是影响次生代谢产物积累的关键因子。阮氏钏等[10]通过控制基本培养基的种类和激素配方,初步筛选出有利于青钱柳悬浮细胞总黄酮积累的MS基本培养基,同时还得出1.0mg·L-1NAA+ 0.5mg·L-1KT利于青钱柳悬浮细胞总黄酮的积累;1.0mg·L-1IBA+ 0.5mg·L-1TDZ利于青钱柳悬浮细胞多糖的积累;0.5mg·L-12,4 -D+ 0.3mg·L-1NAA利于青钱柳悬浮细胞的总三萜积累。植物生长调节剂的种类和质量浓度对细胞的生长、分化以及次生代谢产物的合成都会产生重要影响,应根据植物的品种和目的次生代谢产物的类型,添加适宜的激素种类和浓度来提高细胞次生代谢物产量。
3培养条件对次生代谢产物的影响
对于植物悬浮细胞培养来说,环境中的许多物理因素对细胞的生长和次生代谢产物的累积具有很大的影响。如温度、光照、pH值、通气状况、接种密度等,能有效地调控这些外界因子是植物细胞生长及次生代谢产物积累的必要条件。
温度既影响植物细胞分裂速度,也影响次生代谢途径中酶的活性。对于植物细胞悬浮培养,最适温度通常为( 25 ± 2) ℃。Hoopen等[11]曾对长春花细胞培养过程分别进行温度的阶段性调控,结果很大程度上提高了产物的产率。值得注意的是,不同植物的最适温度不同,且植物细胞生长和次生代谢产物的合成所需的温度很多时候并不一致,因此选择合理的培养温度并进行相应的调控对于细胞生长以及产物合成十分关键。
光是影响植物生理功能的重要环境因子,还是参与调控植物的生长发育的重要信号来源。不同光质刺激植物生长发育的效应不一样。植物在长期进化中形成了多种光感受系统,用于感知周围环境的光强、光质和光周期,并对其变化做出响应。Chan等[12]研究光强对多花野牡丹细胞培养中花青素累积的影响,结果显示中等强度的白光(300~600lx)显著提高花青素的产量,而黑暗条件下花青素产量最低;张进杰等[13]研究了不同光质、光强和光期对悬浮培养黄芩细胞的生长及黄芩苷含量的影响,结果发现白光、紫外光和蓝光对黄芩苷的积累具有诱导促进作用,其中紫外光的促进作用最强,而红光照射对黄芩苷的积累有一定的抑制作用。每天 8h光照强度为 60μmol·m-2·s-1的紫外光、16h光照强度为 50μmol·m-2·s-1的红光交替处理,在培养 12 天后,细胞的鲜重和黄芩苷含量为黑暗的 1.16 和 3.2 倍。Tassoni等[14]也发现红光照射会降低葡萄细胞悬浮液中花青素的积累。这些结果说明次生代谢产物的积累受不同光强、光质和光周期的调控。
培养基的酸碱度对次生代谢物的分泌很重要,植物的细胞培养都要求一定的pH值,通常高压灭菌前都在5.6~6.0。不同pH值对不同植物细胞的影响会有差异。如降低培养基的pH值,可有效提高高山红景天悬浮细胞中红景天苷的释放[15];而Malik等[16]研究却发现较高的pH对新疆紫草悬浮细胞生长及紫草宁衍生物合成有促进作用。pH调控与温度相同,需要在不同的阶段控制不同的值。
通气状况是在大规模细胞培养中至关重要,主要有3个作用,即提供细胞所需氧气、解吸挥发性代谢产物,清除代谢热[17]。Thanh等[18]研究氧气供应对人参细胞培养的影响,发现40%的溶氧量利于细胞生物量和人参皂苷的累积。Han等[19]研究了氧分压对三七细胞生长以及人参皂苷和多糖合成的影响,发现高的氧分压抑制细胞生长,同时也不利于次生代谢物的合成。合适的供氧量能显著影响植物悬浮细胞的生长和次生代谢产物的积累。
植物悬浮培养细胞生长的启动需要有一个最低的起始密度,细胞密度太低,细胞生长缓慢还浪费空间资源;细胞密度过高,细胞生长速度过快,竞争养分激烈,致使一部分细胞褐变,不利于次生代谢产物的合成。李铁军等[20]研究初始接种量对人参细胞皂苷合成的影响时发现接种量在6g时人参皂苷含量最高,高于或低于6g时不利于人参皂苷含量的提高。
植物细胞悬浮培养中,许多理化因子都可能对细胞的生长及次生代谢物累积产生影响和调控,如摇床转速、细胞生长继代周期、细胞的分散程度、渗透压及有机添加物等。因此,针对特定的植物细胞需要通过系统的实验探讨各因素与细胞生长及次生代谢产物积累之间的关系,以便筛选出最适宜的培养条件。
4植物悬浮细胞两相系统培养技术
植物细胞两相培养是指在植物细胞悬浮培养中,加入萃取次生代谢产物的有机化合物(与培养液不溶的液体)或多聚化合物,使培养体系形成有机相与水相两相,也就是说细胞外创造一个储藏次生代谢产物单元。从而打破原有产物在细胞内、外水相的平衡,可很大程度提高次生代谢产物的产量。采用两相培养技术可以减少次生代谢产物的反馈抑制作用,保护次生代谢产物免受酶的分解,简化下游加工处理过程降低生产成本,除去培养基中的非目的有害次生代谢产物[21]。建立和利用两相培养技术的关键是选择满足要求的萃取剂或吸附剂,即对植物细胞无毒害作用、对产物有较大的分配系数、所加有机相与培养水相易分离、高度的吸收或吸附选择性。所加的吸附剂主要是离子交换树脂XAD-7[23-26]和XAD-4[27-28],所加的萃取剂主要是十六烷[29],目前国内植物悬浮细胞两相培养的研究报道非常少(表1),具有很好的研究前景。
5前体或诱导子对次生代谢产物合成积累的调控
5.1前体饲喂
在植物悬浮细胞中,前体物可作为底物或催化代谢途径中关键酶而发挥作用来提高次生代谢物产量。因此,前体饲喂也是调节次生代谢产物合成和积累的重要调控因子。不同类型次生代谢物的代谢
途径不同,应根据目标产物饲喂前体物。所加入的前体物要根据次生代谢产物的合成途径确定,要求对细胞生长无明显抑制作用,又要促进目的产物的合成。值得注意的是植物代谢途径是个连续的过程,次生代谢物的合成也就存在时间和空间上的变化,前体物的饲喂也必将存在一个最适时间和最适饲喂量的问题,在具体的实验中应重视最适时间和最佳浓度的确定。通常前体在培养初始时饲喂,并且添加的浓度与接种细胞的量有关[22]。近年来,愈来愈多的研究证明最适时间和浓度下对悬浮细胞饲喂前体来提高目的产物量是非常有效的。应用较多的前体物主要有苯丙氨酸、酪氨酸、肉桂酸等参与黄酮的合成。具体研究见表2。

表1 植物悬浮细胞两相培养实例
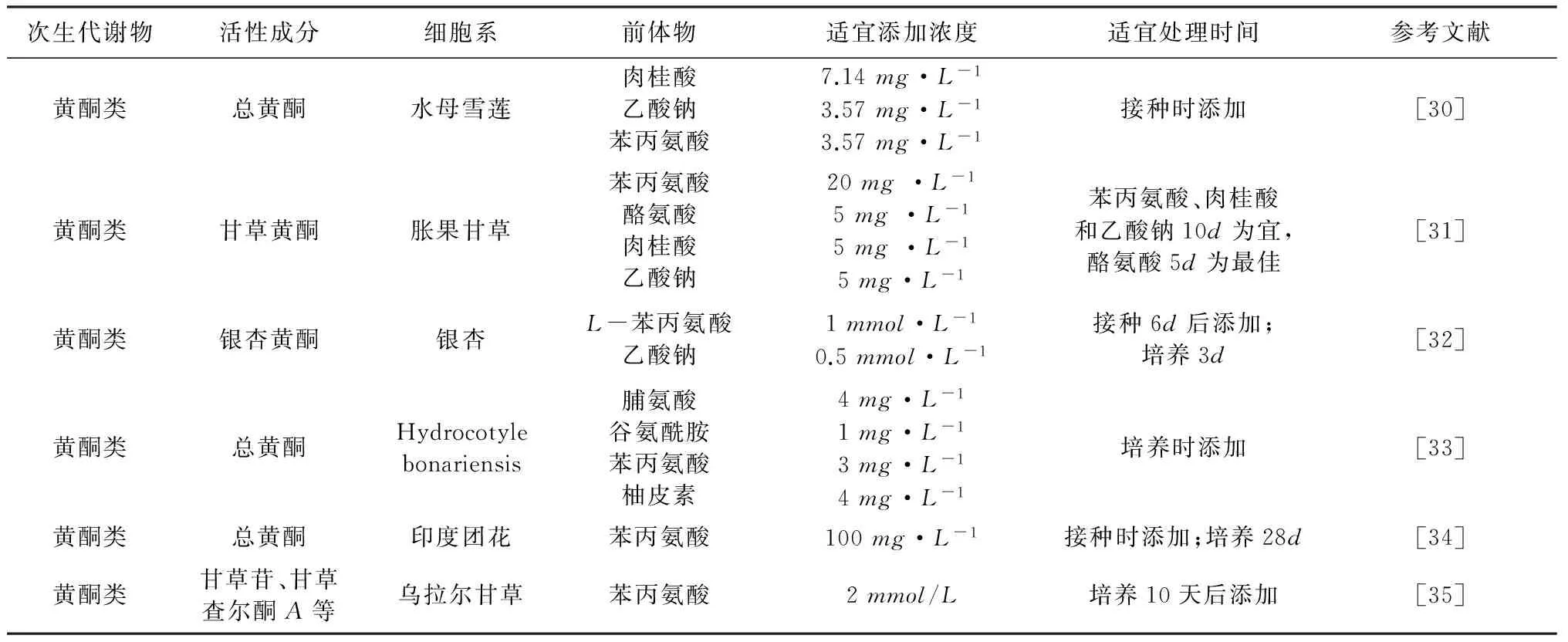
表2 前体饲喂对植物次生代谢物生物合成与积累的影响
5.2诱导子添加
植物次生代谢产物的合成具有全能性和多条代谢途径,凡能引起植物产生次生代谢产物的胁迫因子统称为诱导子,是一类特殊的触发因子,它能够开启合成次生代谢产物过程中关键酶的活性,并刺激表达,提高次生代谢产物的含量。根据来源诱导子可分为生物诱导子和非生物诱导子两类。生物诱导子主要是来自真菌的诱导子,包括真菌菌体、菌丝、菌液提取物和菌液浓缩物等。非生物诱导子是指理化因素如水杨酸(salicylicacid,SA)、茉莉酸甲酯(methyljasmonate,MJ)、渗透剂、紫外线、高温、低温、重金属、盐胁迫等[36]。现有的单一的生物诱导子或非生物诱导子诱导的方法,存在作用弱、产量较低等缺点,而联合使用可以对蒽醌类、生物碱类、黄酮类和萜类等次生代谢物的诱导作用增强,为通过植物细胞大规模培养生产次生代谢活性成分提供了有益的途径[37]。目前利用诱导子调控植物次生代谢物的合成与积累方面已成为国内外的研究热点,并取得了较多成果。近十年国内外研究进展具体实例见表3、表4。

表3 生物诱导子对植物次生代谢物积累的影响

表4 非生物诱导子对植物次生代谢物积累的影响
6植物悬浮细胞生物转化技术
生物转化(biotransformation)是指以外源性的有机化合物为底物,添加微生物细胞或酶,在适宜的条件下培养,对外源性底物进行结构修饰,从而获得目的产物。该技术具有反应条件温和、副产物少、低毒、低污染、后处理简单等优点,更重要的是,重现性好、细胞增殖快、次生代谢物产量大[54]。因此,生物转化在悬浮细胞培养体系中已成为获取次生代谢活性产物的重要途径。目前已知植物悬浮培养体系的生物转化具有诸如羟基化、氧化还原反应、糖基化和水解等多种反应类型,其中羟基化是主要反应类型。虽然植物细胞培养拥有生产高产量特定次生代谢物的巨大潜能,但由于自身代谢的原因,目的产物的积累有时就满足不了人们的需求。然而,悬浮细胞可利用植物细胞的酶系统对外源底物进行修饰生产有意义的化合物。有研究[55]利用人参悬浮细胞培养对芍药醇进行生物转化反应得到具有清除自由基活性的人参皂苷。Li等[56]以杨桃悬浮培养细胞为体系进行生物转化研究,选择二氢去氧青蒿素B为底物,发生两个羟基化转化反应,转化产物为7α-羟基二氢去氧青蒿素B和 3α-羟基二氢去氧青蒿素B,其中 7α-羟基二氢去氧青蒿素B为新化合物。两个产物对肿瘤细胞系K562 和HeLa均有较好的抑制作用。
由于悬浮细胞培养受环境因子制约,易被污染,特别是体细胞克隆容易变异导致生物转化不稳定,从而限制了部分植物悬浮细胞体系的生物转化在工业生产上的大规模应用。因此,今后应继续研究较为重要的培养体系中酶系统种类以及外源底物本身的结构特点外,也需优化投入底物的时间、底物浓度、共培养时间、基本的细胞培养环境,并结合基因重组技术,发挥生物转化的优势,相信生物转化研究将在有效活性成分合成和结构修饰中继续发挥重要作用。
7植物次生代谢相关功能基因的研究
近年来,随着分子生物学技术的发展,基因调控越来越多地被引入植物细胞培养。从分子水平上研究有关次生代谢物生物合成的机理并从基因水平上对其生物合成进行调控,可有效的增加次生代谢物合成过程中关键酶基因的表达量,增加悬浮细胞次生代谢物的累积,筛选出高产、稳产的细胞系,从而彻底解决植物悬浮细胞培养次生代谢物产量低、不稳定的问题。目前,在次生代谢产物合成途径中涉及的相关功能基因的克隆和调控是研究的重点。
黄酮类化合物具有很好的抗氧化活性,研究者把目光主要聚焦到调控这类次生代谢物的生物合成途径上。已研究得到通过植物代谢生物合成途径中的基因过表达来实现花色的调控,还有黄酮合成途径中的査耳酮合酶过表达可显著提高黄酮类化合物的产量。刘飞等[57]建立了红花的悬浮细胞培养体系,并利用该体系研究黄酮类化合物的生物合成;克隆得到红花黄酮类化合物生物合成途径中的关键酶基,添加50μmol/L的MJ到悬浮细胞体系中对CtCHI3626 基因的表达量进行测量。结果显示,MJ能有效提高编码查尔酮异构酶基因 CtCHI3626的表达量。并对红花进行遗传转化成功获得了转 CHI 的红花转基因植株,发现CHI的转入,促进了红花中黄酮类化合物产量的显著增加。目前,功能基因克隆黄酮类合成酶、酚类合成酶等基因的克隆相对较多,如紫杉醇、长春花碱、紫草宁、青蒿素以及吗啡等多种次生代谢产物紧密相关的合成关键酶基因。
8总结与展望
在植物细胞悬浮培养中调控培养基的组分、植物生长调节剂水平、碳源与氮源的水平、酸碱度、光质、光强、诱导子与前体种类与浓度等等来提高次生代谢物的积累已经取得了不错的进展,然而只有人参、紫草、黄连等少数几种植物的悬浮细胞培养达到了商业化生产规模。主要原因是一些植物目的次生代谢产物含量低,后提取困难,缺乏经济的可行性;植物的代谢机制复杂,很多有效成分的次生代谢物的生物合成途径不明,难以从根本上解决问题,这就需要借助于生物转化技术以及基因工程技术等。今后,应该在建立与完善高产细胞系筛选的基础上,从分子水平上研究有关次生代谢物生物合成的机理并从基因水平上对其生物合成进行调控:通过导入有效次生代谢物生物合成途径中单个或多个关键酶基因,使宿主细胞中该酶的催化活性提高,从而催化更多的前体物质合成下游目标次生代谢产物;运用基因沉默(反义RNA、RNAi) 技术抑制竞争性代谢途径,使更多的前体物质流向目的产物的通路;也可以在生物合成途径中增加新基因调节次生代谢[58]。伴随着生物转化技术以及基因工程技术研究的深入,我们有理由相信更多植物悬浮细胞培养实现工业化和产业化,以满足社会发展对次生代谢产物的需求。
参考文献:
[1]王娟, 高文远, 尹双双, 等. 药用植物细胞悬浮培养的研究进展[J]. 中国中药杂志, 2012, 37(24): 3683-3685.
[2]李燕, 王春兰, 郭顺星, 等. 植物组织和细胞培养物中黄酮类物质积累影响因素的研究进展[J]. 中国药学杂志, 2006, 41(9): 651-655.
[3]RAMESHABT,AMNAT,RAVIKANTHG,etal.ProspectingforcamptothecinesfromNothapodytes nimmonianaintheWesternGhats,SouthIndia:identificationofhigh-yieldingsourcesofcamptothecinandnewfamiliesofcamptothecines[J].JournalofChromatographicScience, 2008, 46(4): 362-368.
[4]郭肖红, 高文远, 陈海霞, 等. 药用植物培养高产细胞系的选育[J]. 世界科学技术: 中医药现代化, 2005, 7(1): 60-66.
[5]PASQUAG,AVATOP,MONACELLIB,etal.Metabolitesincellsuspensioncultures,calli,andinvitroregeneratedorgansofHypericum perforatumcv.Topas[J].PlantScience, 2003, 165(5): 977-982.
[6]邵利. 何首乌悬浮细胞系的建立和稳定同位素示踪研究二苯乙烯苷合成路径[D]. 广州:华南理工大学, 2012.
[7]PRAVEENN,MURTHYHN.SynthesisofwithanolideAdependsoncarbonsourceandmediumpHinhairyrootculturesofWithania somnifera[J].IndustrialCropsandProducts, 2012, 35(1): 241-243.
[8]曲丹, 王慧梅, 任洁. 碳源对迷迭香悬浮培养细胞的生长, 迷迭香酸积累及抗氧化酶活性的影响[J]. 植物研究, 2015, 35(4): 623-627.
[9]SIVAKUMARG,YUKW,PAEKKY.ProductionofbiomassandginsenosidesfromadventitiousrootsofPanax ginsenginbioreactorcultures[J].EngineeringinLifeSciences, 2005, 5(4): 333-342.
[10]阮氏钏, 杨万霞, 方升佐, 等. 培养基种类及激素配方对青钱柳悬浮细胞次生代谢物质积累的影响[J]. 南京林业大学学报 (自然科学版), 2015(2): 8.
[11]TENHOOPENHJG,VINKEJL,MORENOPRH,etal.InfluenceoftemperatureongrowthandajmalicineproductionbyCatharantus roseussuspensioncultures[J].EnzymeandMicrobialTechnology, 2002, 30(1): 56-65.
[12]CHANLK,KOAYSS,BOEYPL,etal.EffectsofabioticstressonbiomassandanthocyaninproductionincellculturesofMelastoma malabathricum[J].BiologicalResearch, 2010, 43(1): 127-135.
[13]张进杰, 徐茂军, 周桂飞. 光质对悬浮培养黄岑细胞生长及黄芩苷积累的影响[J]. 热带亚热带植物学报 2007,5(2): 135-140.
[14]TASSONIA,DURANTEL,FERRIM.Combinedelicitationofmethyl-jasmonateandredlightonstilbeneandanthocyaninbiosynthesis[J].JournalofPlantPhysiology, 2012, 169(8): 775-781.
[15]许建峰, 刘传斌. 高山红景天细胞悬浮培养中pH值对红景天苷胞外释放及细胞活性[J]. 植物学报(英文版), 1997, 39(11): 1022-1029.
[16]MALIKS,BHUSHANS,SHARMAM,etal.Physico‐chemicalfactorsinfluencingtheshikoninderivativesproductionincellsuspensionculturesofArnebia euchroma (Royle)Johnston,amedicinallyimportantplantspecies[J].CellBiologyInternational, 2011, 35(2): 153-158.
[17]GEORGIEVMI,WEBERJ,MACIUKA.Bioprocessingofplantcellculturesformassproductionoftargetedcompounds[J].AppliedMicrobiologyandBiotechnology, 2009, 83(5): 809-823.
[18]THANHNT,MURTHYHN,YUKW,etal.EffectofoxygensupplyoncellgrowthandsaponinproductioninbioreactorculturesofPanax ginseng[J].JournalofPlantPhysiology, 2006, 163(12): 1337-1341.
[19]HANJ,ZHONGJJ.EffectsofoxygenpartialpressureoncellgrowthandginsenosideandpolysaccharideproductioninhighdensitycellculturesofPanax notoginseng[J].EnzymeandMicrobialTechnology, 2003, 32(3): 498-503.
[20]李铁军, 廉美兰, 于丹, 等. 几种因素对悬浮培养人参细胞生长和皂苷积累的影响[J]. 中国中药杂志, 2013, 38(23): 66-70.
[21]KIMJH,KANGIS,CHOIHK,etal.Anovelprepurificationforpaclitaxelfromplantcellcultures[J].ProcessBiochemistry, 2002, 37(7): 679-682.
[22]谷荣辉, 洪利亚, 龙春林. 植物细胞培养生产次生代谢物的途径[J]. 植物生理学报, 2013, 49(9): 869-881.
[23]KLVANAM,LEGROSR,JOLICOEURM.InsituextractionstrategyaffectsbenzophenanthridinealkaloidproductionfluxesinsuspensionculturesofEschscholtzia californica[J].BiotechnologyandBioengineering, 2005, 89(3): 280-289.
[24]CHAKRABORTYA,CHATTOPADHYAYS.StimulationofmentholproductioninMentha piperitacellculture[J].InVitroCellular&DevelopmentalBiology-Plant, 2008, 44(6): 518-524.
[25]KOMARAIAHP,RAMAKRISHNASV,REDDANNAP,etal.EnhancedproductionofplumbagininimmobilizedcellsofPlumbago roseabyelicitationandinsituadsorption[J].JournalofBiotechnology, 2003, 101(2): 181-187.
[26]GAOMB,ZHANGW,RUANC.SignificantlyimprovedtaxuyunnanineCproductionincellsuspensionculturesofTaxus chinensisbyprocessintensificationofrepeatedelicitation,sucrosefeeding,andinsituadsorption[J].WorldJournalofMicrobiologyandBiotechnology, 2011, 27(10): 2271-2279.
[27]PAVLOVA,ILIEVAM,MINCHEVAM.ReleaseofrosmarinicacidbyLavandula veraMMcellsuspensionintwo-phaseculturesystems[J].WorldJournalofMicrobiologyandBiotechnology, 2001, 17(4): 417-421.
[28]CHIANGL,ABDULLAHMA.Enhancedanthraquinonesproductionfromadsorbent-treatedMorinda ellipticacellsuspensionculturesinproductionmediumstrategy[J].ProcessBiochemistry, 2007, 42(5): 757-763.
[29]PRAKASHG,SRIVASTAVAAK.IntegratedyieldandproductivityenhancementstrategyforbiotechnologicalproductionofazadirachtinbysuspensioncultureofAzadirachta indica[J].Asia‐PacificJournalofChemicalEngineering, 2011, 6(1): 129-137.
[30]高丽华, 胡显文, 胥照平, 等. 喂饲前体提高悬浮培养水母雪莲细胞的黄酮产量[J]. 高技术通讯, 2007, 17(4):418-423.
[31]杨英, 何峰, 季家兴, 等. 四种前体对胀果甘草细胞悬浮培养生产[J]. 武汉植物学研究, 2007, 25(5): 484-489.
[32]胡燕梅, 韩晓红, 周全. 银杏液体悬浮细胞培养产生黄酮的研究[J]. 江西农业大学学报, 2011, 33(2): 360-363.
[33]MASOUMIANM,ARBAKARIYAA,SYAHIDAA,etal.EffectofprecursorsonflavonoidproductionbyHydrocotyle bonariensiscallustissues[J].AfricanJournalofBiotechnology, 2013, 10(32): 6021-6029.
[34]INDUS,VIJAYAL,MEETAB,etal.ProductionofflavonoidsincalluscultureofAnthocephalus indicusA.Rich[J].AsianJournalofPlantSciences, 2013, 12(1): 40-45.
[35]GUOS,MANS,GAOW,etal.ProductionofflavonoidsandpolysaccharidebyaddingelicitorindifferentcellularcultivationprocessesofGlycyrrhiza uralensisFisch.[J].ActaPhysiologiaePlantarum, 2013, 35(3): 679-686.
[36]张瑞芬, 李培琴, 周立刚. 真菌诱导子对植物培养物生长和次生代谢产物合成影响之研究进展[J]. 中国农学通报, 2008, 9.
[37]叶龙飞, 王金海, 张景红. 联合诱导子提高药用植物代谢产物产量的研究进展[J]. 广东化工, 2014, 41(10): 207-208.
[38]ASHTIANISR,HASANLOOT,MOHAMMADRB.UsingyeastextractasanapproachtoincreaseflavonolignanscontentincellsuspensioncultureofMilk Thistleplantviaelicitationmechanism[J].JournalofMedicinalPlants, 2009, 8(32): 108-119, 184.
[39]SILJAPK,GISHAGP,SATHEESHKUMARK.EnhancedplumbaginaccumulationinembryogeniccellsuspensionculturesofPlumbago roseaL.followingelicitation[J].PlantCell,TissueandOrganCulture, 2014, 119(3): 469-477.
[40]GOYALS,RAMAWATKG.IncreasedisoflavonoidsaccumulationincellsuspensionculturesofPueraria tuberosabyelicitors[J].IndianJBiotechnol, 2008, 7: 378-382.
[41]潘学武, 董妍玲, 石亚亚. 真菌诱导子和抗褐变剂对喜树悬浮细胞生长及喜树碱生物合成的影响[J]. 中国农学通报, 2010, 26(20): 21-26.
[42]KOMARAIAHP,AMRUTHARN,KISHORPBK,etal.ElicitorenhancedproductionofplumbagininsuspensionculturesofPlumbago roseaL.[J].EnzymeandMicrobialTechnology, 2002, 31(5): 634-639.
[43]陶金华, 汪冬庚, 濮雪莲, 等. 一氧化氮和水杨酸依次介导内生真菌诱导子促进苍术细胞中苍术素生物合成的信号转导[J]. 中草药, 2014, 45(5): 701-708.
[44]刘英甜, 王晓东, 周文洋, 等. 多胺介导真菌诱导子促进白桦三萜积累的初步研究[J]. 中草药, 2014, 5: 21.
[45]郝岗平, 杜希华, 史仁玖.NO对银杏悬浮细胞生长及黄酮类物质合成的影响[J]. 西北植物学报, 2007, 27(2): 272-277.
[46]KORSANGRUANGS,SOONTHORNCHAREONNONN,CHINTAPAKORNY,etal.EffectsofabioticandbioticelicitorsongrowthandisoflavonoidaccumulationinPueraria candolleivar. candolleiandP. candolleivar. mirificacellsuspensioncultures[J].PlantCell,TissueandOrganCulture, 2010, 103(3): 333-342.
[47]刘连成, 董娟娥, 张婧一, 等.Ca2+对丹参培养细胞中迷迭香酸合成及其相关酶活性的影响[J]. 生物工程学报, 2012, 28(11): 1359-1369.
[48]RUANJ,ZHANGJ,LIM,etal.DependenceofUV-B-inducedcamptothecinproductiononnitratereductase-mediatednitricoxidesignalinginCamptotheca acuminatasuspensioncellcultures[J].PlantCell,TissueandOrganCulture, 2014, 118(2): 269-278.
[49]杨静, 孙皓. 不同诱导子对黄芪悬浮培养细胞中黄芪多糖积累的影响[J]. 安徽农业科学, 2014, 42(26): 8954-8956.
[50]JALALPOURZ,SHABANIL,AFGHANIL,etal.StimulatoryeffectofmethyljasmonateandsqualestatinonphenolicmetabolismthroughinductionofLOXactivityincellsuspensioncultureofyew[J].TurkishJournalofBiology, 2014, 38(1): 76-82.
[51]BOTAC,DELIUC.TheeffectofcoppersulphateontheproductionofflavonoidsinDigitalislanatacellcultures[J].Farmacia, 2011, 59(1): 113-118.
[52]PENGX,HEJY.TheinhibitoryeffectofCa2+ontheflavonoidproductionofTetrastigma hemsleyanumsuspensioncellsinducedbymetalelicitors[J].InVitroCellular&DevelopmentalBiology-Plant, 2013, 49(5): 550-559.
[53]杨兆春, 袁媛, 陈敏, 等.PEG胁迫对黄芩黄酮类有效成分积累及相关基因表达的影响[J]. 中国中药杂志, 2011, 36(16): 2157-2161.
[54]严春艳, 于荣敏. 植物生物转化技术与中药活性化合物研究[J]. 食品与药品, 2005, 7(10A): 4-8.
[55]LIW,KOIKEK,ASADAY,etal.BiotransformationofpaeonolbyPanax ginsengrootandcellcultures[J].JournalofMolecularCatalysisB:Enzymatic, 2005, 35(4): 117-121.
[56]LIX,YANGL,YUR,etal.Biotransformationofdihydro-epi-deoxyarteannuinBbysuspension-culturedcellsofAverrhoa carambola[J].AfricanJournalofBiotechnology, 2014, 11(7): 1724-1728.
[57]刘飞. 红花黄酮类化合物生物合成途径关键酶基因的克隆与功能验证[D]. 上海:第二军医大学, 2014.
[58]JAWAHARG,MADHAVID,AMRUTHARN,etal.Currentapproachesforenhancingsecondaryplantproductioninvitro[J].AnnalsofPhytomedicine, 2014, 3(2): 26-34.
ResearchProgressinPlantCellSuspensionCultureforProductionofSecondaryMetabolites
ChenYuehua,2,ZhuYan1,2*,ZhangXiang1,2,QinMinjian1,2*
(1.DepartmentofResourcesScienceofTraditionalChineseMedicines; 2.StateKeyLaboratoryofNaturalMedicines,ChinaPharmaceuticalUniversity,Nanjing210009,China)
AbstractChinaisrichinplantresources.Theactiveconstituentsofplantsaremainlysecondarymetabolites,andmostofthemdependonthedirectextractionfromtheplants.However,becauseofthedestructionofenvironment,theexcessiveexploitationofplantsandthedifficultyofcultivation,manyplantresourcesaredisappearingatanalarmingrate.Inordertomeettheneedsofplantsecondarymetabolitesandavoidoverconsumptionofplantresources,thesuspensioncellculturetechnologyhavearisenandprovidedanewwayfortheproductionofactiveconstituents.Nevertheless,duetothelowproductivityoftargetproductsbythistechnology,thesuccessfulexamplesofproducingactivesubstancesarelimited.Therefore,itishighlyimportanttodevelopnewtechnologyofregulatingplantstoproducemoreactiveconstituents.Inthispaper,wereviewedtheprogressofthesecondarymetabolitesproductionwithsuspensioncellculturetechnologyandtheimportantfactorsofregulatingthesynthesisofsecondarymetabolitesinrecentyears.
Keywordssuspensioncell;secondarymetabolites;elicitors;geneticengineering;regulation
收稿日期:2015-09-28
基金项目:国家自然科学基金项目(81373918);国家“十二五”规划科技重大专项创新药物研究(2012ZX09304006);中央高校科研业务费项目(JKQ2011038)。
作者简介:陈月华,女,硕士生,研究方向:药用植物资源与质量研究。E-mail:chenyuehua527@126.com *通讯作者:秦民坚,男,教授,博士生导师,研究方向:中药资源与开发。E-mail:minjianqin@163.com; 朱艳,女,博士,研究方向:药用植物种质资源与生物技术。E-mail:cpuzy@126.com
中图分类号:Q943.1;Q946.8
文献标识码:A
文章编号:1006-9690(2016)03-0041-07
doi:10.3969/j.issn.1006-9690.2016.03.015

