血清 NSE 和 S100B 蛋白对急性脊髓损伤程度及预后的相关性研究
鹿鹏 孙天胜 张建政 张志成 侯景明
血清 NSE 和 S100B 蛋白对急性脊髓损伤程度及预后的相关性研究
鹿鹏 孙天胜 张建政 张志成 侯景明
【摘要】目的 探讨血清神经元特异性烯醇化酶(NSE)和 S100 calcium binding protein(S100B)蛋白同急性脊髓损伤的关系,并观察这两个生物标记物与急性脊髓损伤患者神经功能改善的关系。方法共纳入27例急性脊髓损伤患者,检测患者损伤后当天、2、3、4、5、6、7、8、9、10天时血清NSE和S100B蛋白水平,同时评价入院时和随访6个月时神经功能。根据损伤后6个月时患者的感觉和运动功能恢复情况,将27例分为恢复较好组(A组,n=9)和恢复一般组(B组,n=18),选年龄、性别相匹配的25名健康成人志愿者作为健康对照组(C组)。结果C组血清NSE和S100B蛋白水平分别为:(14.38±1.12)μg/L、0.89±0.13)μg/L。伤后2天B组患者血清NSE水平升至高峰[(109.56±13.24)μg/L,t=34.98,P<0.05],随后呈下降趋势;伤后3天A组患者的血清NSE水平升至高峰[(70.48±10.42)μg/L,t=25.48,P<0.05]。在伤后7天内,A组患者每天的血清NSE水平依次为[(28.29±10.89)μg/L,t=6.47,P<0.05;(45.26±9.21)μg/L,t=16.88,P<0.05;(70.48±10.42)μg/L,t=27.23,P<0.05;(43.25±8.51)μg/L,t=17.02,P<0.05;(40.18±7.89)μg/L,t=16.34,P<0.05;(37.59±11.56)μg/L,t=10.19,P<0.05;(29.25±8.98)μg/L,t=8.33,P<0.05],均明显高于C组。在伤后7天内,B组患者每天的血清NSE水平依次为:[(46.34±11.25)μg/L,t=14.16,P<0.05;(109.56±13.24)μg/L,t=35.91,P<0.05;(98.37±8.64)μg/L,t=48.25,P<0.05;(90.35±10.33)μg/L,t=36.62,P<0.05;(73.55±10.45)μg/L,t=28.20,P<0.05;(80.34±9.75)μg/L,t=33.66,P<0.05;(71.56±11.49)μg/L,t=28.42,P<0.05]也均明显高于C组。在伤后7天内,A组患者每天的血清S100B蛋白水平依次为[(1.36±0.49)μg/L,t=4.46,P<0.05;(2.24±0.62)μg/L,t=10.52,P<0.05;(2.92±0.54)μg/L,t=17.79,P<0.05;(2.35±0.38)μg/L,t=16.82,P<0.05;(2.11±0.33)μg/L,t=15.47,P<0.05;(1.92±0.39)μg/L,t=11.64,P<0.05;(1.81±0.41)μg/L,t=5.43,P<0.05],均明显高于C组。B组患者每天的血清S100B蛋白水平依次为:[(2.24±0.45)μg/L,t=14.28,P<0.05;(3.21±0.62)μg/L,t=18.25,P<0.05;(4.02±0.51)μg/L,t=29.55,P<0.05;(3.76±0.53)μg/L,t=26.15,P<0.05;(3.26±0.46)μg/L,t=24.58,P<0.05;(3.32±0.45)μg/L,t=25.71,P<0.05;(3.12±0.47)μg/L,t=22.68,P<0.05]也均明显高于C组。患者血清NSE:A组(70.48±10.42)μg/L,B组(109.56±13.24)μg/L,(t=7.41,P<0.05);S100B蛋白:A组(2.92±0.54)μg/L,B组(4.02±0.51)μg/L,(t=5.03,P<0.05)。血清NSE与急性脊髓损伤患者入院时ASIA感觉功能评分及感觉恢复率存在负相关(r=-0.70,P=0.04;r=-0.86,P<0.01);血清NSE与急性脊髓损伤患者入院时ASIA运动功能评分及运动恢复率存在负相关(r=-0.59,P<0.01;r=-0.93,P<0.01)。血清S100B蛋白与急性脊髓损伤患者入院时ASIA感觉功能评分及感觉恢复率存在负相关(r=-0.72,P=0.03;r=-0.85,P<0.01);血清S100B蛋白与急性脊髓损伤患者入院时ASIA运动功能评分及运动恢复率存在负相关(r=-0.71,P<0.01;r=-0.92,P<0.01)。结论血清NSE和S100B蛋白水平可较好地反映急性脊髓损伤的程度,对于评价急性脊髓损伤预后有较大价值。
【关键词】脊髓损伤;磷酸丙酮酸水合酶;预后;S100B 蛋白;神经元特异性烯醇化酶
脊髓损伤(spinal cord injury,SCI)是一种严重的致残性疾病,常导致损伤平面以下感觉及运动功能障碍,需要终身护理和康复治疗,给患者及其家庭带来沉重的经济和社会负担。由于目前对脊髓损伤后复杂的病理、生理机制理解有限,脊髓损伤的治疗和康复至今仍是一个世界性的难题[1]。最近几十年的研究重点多集中在外科减压治疗、脊髓损伤修复、预防和减轻继发性损伤、康复治疗等方面,对于脊髓损伤的治疗虽然已经取得了较大的进展,但目前仍然没有一种可以彻底治愈脊髓损伤的方法。对于脊髓损伤严重程度及其预后的评价临床上多依赖如CT、MRI等形态学方面的影像检查资料,目前尚缺乏有实用价值的定量指标用于脊髓损伤严重程度及其预后的评价。有研究表明,相关生物标记物的检测有助于脊髓损伤预后评价及外科医生针对不同损伤时期选择相应的治疗措施[2-3]。能否检测脊髓损伤后相关生物标记物以评估脊髓损伤的严重程度及预后,并且有可能提高急性脊髓损伤的治疗效果。神经元特异性烯醇化酶(neuronspecific enolase,NSE)主要位于中枢神经元内,胶质细胞等其它神经组织不含 NSE,它是中枢神经元的一种特异性酶[4]。S100 calcium binding protein(S100B)主要存在于中枢神经的胶质细胞内,是一种神经胶质细胞特异性蛋白[5-6]。目前关于 NSE 和 S100B 蛋白应用于脑部损伤的伤情判断及预后的研究较多[7-10],但对于脊髓损伤的相关研究鲜有报道,由于NSE、S100B蛋白在中枢神经分布的差异,加之脊髓损伤时除神经元损伤外,胶质细胞等神经组织均可有不同程度损害[11],仅测定其中之一不能全面判断脊髓损伤程度,两者结合可较全面地反映脊髓损伤情况。为此,笔者检测了我院收治的27例急性脊髓损伤患者血清 NSE 和 S100B蛋白水平,用于评价急性脊髓损伤的程度及其预后,现将结果报告如下。
资料与方法
一、纳入标准与排除标准
1.纳入标准:(1)年龄≥18岁;(2)入院时间为脊髓损伤后24h内;(3)损伤节段包括颈、胸、腰、骶脊髓;(4)所有病例均为器质性脊髓损伤,且未出现脊髓部分或完全性离断;(5)病程中无脊髓损伤部位或全身性感染;(6)病程中无创伤性或低血压性休克。
2. 排除标准:(1)年龄<18岁;(2)脊髓损伤后超过24h入院;(3)亚急性或慢性脊髓损伤急性加重者,如脊髓型脊椎病患者因外力等因素导致急性脊髓损伤时;(4)排除马尾神经或神经根损伤病例;(5)排除并发脊髓损伤部位或其它部位感染的病例;(6)排除脊髓部分或完全性离断病例,如火器伤、刀刺伤等;(7)合并创伤性脑损伤、严重胸部损伤、腹腔脏器损伤及严重四肢、骨盆骨折的患者均排除在外;(8)所有患者均行CT及MRI扫描,明确有无器质性脊髓损伤,排除脊髓休克、脊髓震荡等功能性损伤;(9)合并有可导致NSE和S100B蛋白升高的其它疾病,如脑部感染性疾病、脑部或脊髓肿瘤、小细胞肺癌、阿尔兹海默病、精神系统疾病等;(10)无法进行完整随访者。
二、临床资料
本组共纳入27例急性脊髓损伤患者,男19例,女8例,平均年龄(45.6±18.5)岁,其中交通伤15例,跌落伤10例,其它原因损伤2例。
1. 脊髓损伤残损分级:采用脊髓损伤神经学分类国际标准(American spinal injury association,ASIA)2011 版[12]对患者的神经功能损伤程度进行残损分级,并利用 ASIA 感觉和运动评分量化脊髓损伤严重程度。评定时间点为入院当天和损伤后6个月,并根据损伤后6个月时患者的感觉和运动恢复情况将样本分为 2组:恢复较好组(A组)和恢复一般组(B组)。
A组9例,男6例,女3例,平均年龄(41.7±15.1)岁,其中交通伤6例,跌落伤3例。B组18例,男13例,女5例,平均年龄(48.7±12.3)岁,其中交通伤9例,跌落伤7例,其它原因损伤2例。
健康对照组(C组)选取年龄、性别相匹配的25名健康成人志愿者作为对照组。C组男17例,女8例,平均年龄(43.7±11.7)岁。
所有受试者在受试前均签订知情同意书。对所有受试者进行完整的神经系统检查(包括颅神经、感觉神经、运动神经、神经反射和自主神经检查),以排除中枢神经系统和周围神经系统疾病。
2.评定标准:A组为损伤后6个月时,ASIA评级有1个或1个以上好转;B组为损伤后6个月时,ASIA 评级无明显改变。
三、实验方法
A、B两组患者,分别于损伤后当天、2、3、4、5、6、7、8、9、10天分别采集患者的静脉血。室温25℃静置10min凝固后,离心机3000r/min×10min(离心半径10cm)离心,取上清液于-80℃冰箱中保存待测。C组分别抽取晨起空腹静脉血,以同样的方法离心,保存。
1.NSE和S100B蛋白测定:采用酶联免疫吸附法(ELISA)对NSE和S100B蛋白进行测定。严格按照说明书操作。对每个病例各个时间点的样本进行2次测定。试剂盒由北京军区总医院全军骨科研究所购入。
2. 疗效评价:采用 ASIA 感觉评分[12]量化患者感觉功能损伤严重程度。感觉评分为检查身体两侧每个皮节的针刺觉和轻触觉评分相加即产生针刺觉总分和轻触觉总分。每种状态的正常情况为 2分,每侧共28个关键点,则身体一侧针刺觉总分和轻触觉总分分别为56分,两者共112分,因此感觉功能正常评分为224分。计算损伤后6个月时的感觉恢复率,即采用ASIA运动评分[12]量化患者运动功能损伤严重程度。运动评分主要评估左右两侧上下肢共10组关键肌节的肌力,根据肌力0~5级的评级情况,依次对应评分为0~5分,因此正常运动功能评分满分为100分,其中评分越高代表肌肉功能越佳。计算损伤后 6个月时的运动恢复率,即采用ASIA 残损分级[12]对患者损伤程度进行分组。A级为完全损伤,即鞍区S4~5无任何感觉或运动功能保留。B级为不完全感觉损伤,即神经平面以下包括鞍区 S4~5无运动但有感觉功能保留,且身体任何一侧运动平面以下无3个节段以上的运动功能保留。C级为不完全运动损伤,即神经平面以下有运动功能保留,且单个神经损伤平面以下超过一半的关键肌肌力<3级。D级为不完全运动损伤级,即神经平面以下有运动功能保留,且神经平面以下至少有一半以上的关键肌肌力≥3 级。E级为正常。即所有节段的感觉和运动功能均正常,当患者既往有神经功能障碍,则分级为E。
四、统计学处理
采用SPSS21.0软件对3组间的年龄进行方差分析,性别比较采用卡方检验,组间对比应用秩和检验,连续数用x-±s表示,检验水准α值取0.05。
结 果
一、基本资料比较
A组、B组和C组3组的性别、年龄比较,差异无统计学意义(均P>0.05,表1)。
二、ASIA残损分级比较
1.入院时ASIA残损:A、B两组2例,入院时ASIA残损分级如下:A级12例,B级6例,C级6例,D级2例,E级0例。
2.随访6个月最终ASIA残损:随访6个月最终ASIA残损分级如下:A级11例,B级5例,C级3例,D级6例,E级2例。9例有神经功能改善,18例无神经功能改善。
A组入院时ASIA残损分级:A级1例,B级2例,C级4例,D级2例,E级0例;损伤后6个月时残损分级:A级0例,B级1例,C级1例,D级5例,E级2例(表2)。ASIA 评分入院时感觉(115.52±13.27)分、运动(68.35±14.83)分,损伤后6个月时感觉(168.15±10.25)分、运动(83.41±7.15)分(表3、4)。
B组入院时ASIA残损分级:A级11例,B级4例,C级2例,D级1例,E级0例(表 2);损伤后6个月时残损分级未见明显改善。ASIA评分入院时感觉评分为(96.23±27.35)分、运动评分为(51.26±24.32)分,损伤后6个月时感觉评分为(137.62±18.46)分、运动评分为(62.62±16.25)分(表3、4)。
3.A组和B组ASIA评分(感觉、运动):(1)入院时ASIA评分(感觉、运动):A、B两组差异有统计学意义(t=2.92,P<0.01;t=2.64,P=0.01)。(2)损伤后6个月ASIA评分(感觉、运动),A、B两组差异有统计学意义(t=4.59,P<0.01;t=3.64,P<0.01)。损伤后6个月时,A组感觉和运动恢复率分别为 48.51%、31.65%,明显高于B组32.39%、23.31%,两者差异有统计学意义(t=6.06,P<0.01;t=4.30,P<0.01)(表3,4)。
三、血清NSE水平
C 组血清 NSE 水平为(14.38±1.12)μg/L。B 组血清 NSE 水平在损伤后 2 天升至最高[(109.56±13.24)μg/L,t=34.98,P<0.05],随后开始逐渐下降;损伤后6天时再次升高[(80.34±9.75)μg/L,t=33.60,P<0.05],随后开始下降,直至损伤后第10天[(35.35±7.15)μg/L,t=34.98,P<0.05 ]测定,差异有统计学意义。

表1 A、B、C三组患者的临床基本资料(x- ± s)Tab.1 Clinical data statistics of SCI group and healthy control group(x- ± s)

表2 A组入院时和损伤后6个月时ASIA评级Tab.2 ASIA grades of AIS improvement group on admission and 6 months after injury
表3 脊髓损伤患者入院时和损伤后 6 个月时 ASIA 感觉评分比较(± s)Tab.3 Comparison of SCI patie-nts on admission and 6 months after injury of ASIA sensation score(± s)

表3 脊髓损伤患者入院时和损伤后 6 个月时 ASIA 感觉评分比较(± s)Tab.3 Comparison of SCI patie-nts on admission and 6 months after injury of ASIA sensation score(± s)
组别 例数 入院时 损伤后 6 个月时 恢复率(%)A 组 9 115.52±13.27 168.15±10.25 48.51±7.25 B 组 18 96.23±17.35 137.62±18.46 32.39±9.35 t 值 - 2.92 4.59 4.52 P 值 - < 0.01 < 0.01 < 0.01
表4 脊髓损伤患者入院时和损伤后 6 个月时 ASIA 运动评分比较(± s)Tab.4 Comparison of SCI p-atients on admission and 6 months after injury of ASIA motor score(± s)
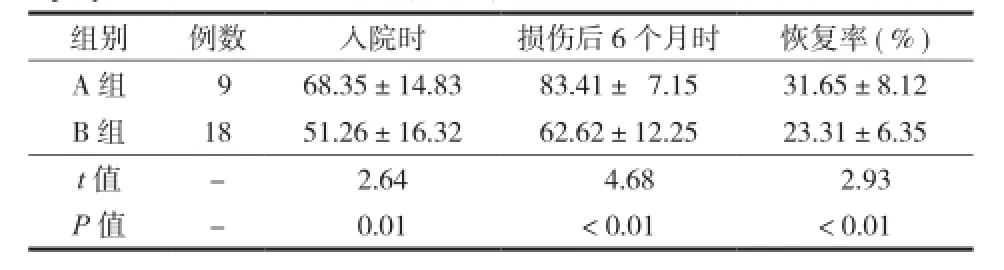
表4 脊髓损伤患者入院时和损伤后 6 个月时 ASIA 运动评分比较(± s)Tab.4 Comparison of SCI p-atients on admission and 6 months after injury of ASIA motor score(± s)
组别 例数 入院时 损伤后 6 个月时 恢复率(%)A 组 9 68.35±14.83 83.41± 7.15 31.65±8.12 B 组 18 51.26±16.32 62.62±12.25 23.31±6.35 t 值 - 2.64 4.68 2.93 P 值 - 0.01 < 0.01 < 0.01
与C组比较,A组血清NSE水平在损伤后3天升至最高[(70.48±10.42)μg/L,t=25.48,P<0.05],随后开始逐渐下降,直至损伤后10天[(12.60±3.48)μg/L,t=0.21,P>0.05]时测定,差异有统计学意义。A组与B组相比,前者的血清NSE水平明显低于后者,两组间血清NSE水平差异有统计学意义[(70.48±10.42)μg/L,(109.56±13.24)μg/L,t=7.41,P<0.05 ](图1)。
四、血清 S100B 水平
C 组血清S100B蛋白水平为(0.89±0.13)μg/L。A组与B组血清S100B蛋白水平均在损伤后当天即开始逐渐升高,至3天达到高峰[(2.92±0.54)μg/L,t=17.78,P<0.05;(4.02±0.51)μg/L,t=29.41,P<0.05],随后开始逐渐下降。B 组A组血清S100B蛋白水平相比,前者血清S100B蛋白水平明显高于后者,两组间血清S100B蛋白水平差异有明显统计学意义[(4.02±0.51)μg/L,(2.92±0.54)μg/L,t=5.03,P<0.05](图2)。
五、血清NSE和S100B蛋白水平与ASIA评分相关性
血清NSE和S100B蛋白水平与患者入院时ASIA感觉、运动评分呈明显负相关(图3~6);血清NSE和S100B蛋白水平与患者的感觉、运动恢复率存在明显负相关(图7~10)。
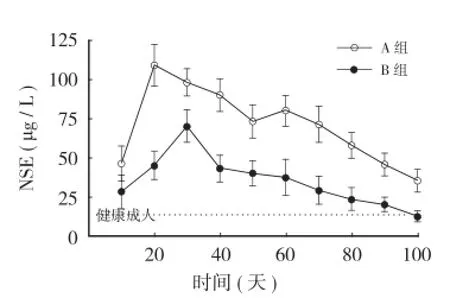
图1 脊髓损伤后不同时间血清NSE变化趋势Fig.1 Serum NSE trends over time after SCI

图2 脊髓损伤后不同时间血清S100B蛋白变化趋势Fig.2 Serum NSE and S100B protein trends over time after SCI

图3 血清NSE水平与入院时ASIA感觉评分相关性分析

图4 血清NSE水平与入院时ASIA运动评分相关性分析

图5 血清S100B蛋白水平与入院时ASIA感觉评分相关性分析

图6 血清S100B蛋白水平与入院时ASIA运动评分相关性分析
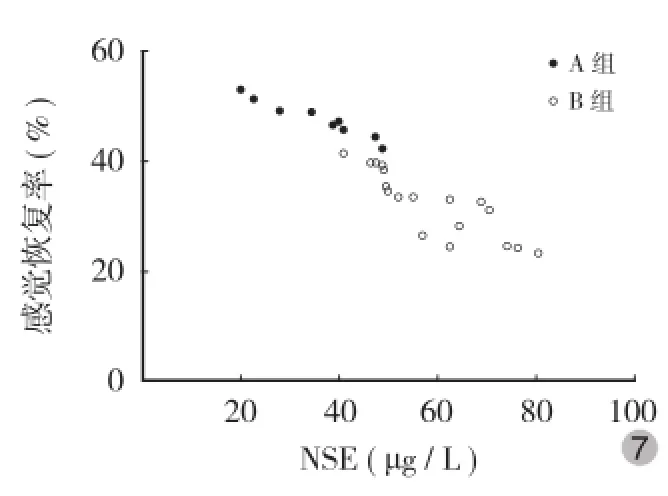
图7 血清NSE水平与ASIA感觉恢复率相关性分析
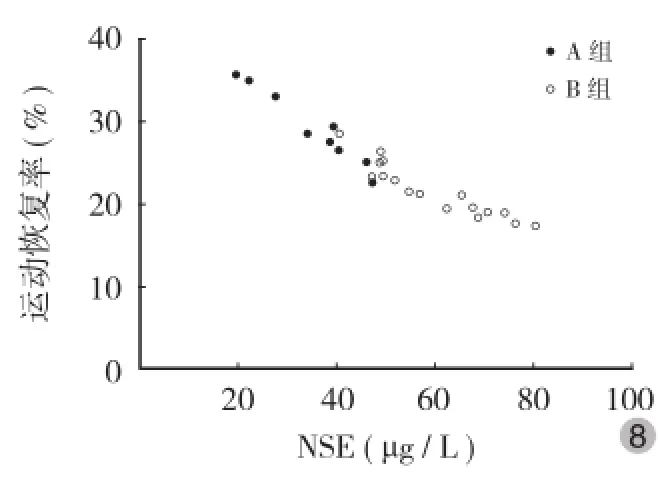
图8 血清NSE水平与ASIA运动恢复率相关性分析

图9 血清S100B蛋白水平与ASIA感觉恢复率相关性分析

图10 血清S100B蛋白水平与ASIA运动恢复率相关性分析
讨 论
本研究用ELISA法测定了急性脊髓损伤患者不同时间点血清NSE和S100B蛋白水平和正常成人血清NSE和S100B蛋白水平结果显示:A组和B组患者血清NSE和S100B蛋白水平在急性脊髓损伤后均明显高于正常对照组,差异有统计学意义;B组患者血清NSE水平在损伤后2天升至最高,随后呈下降趋势;A组患者的血清NSE水平在损伤后3天升至最高,比B组达到高峰的时间要晚一些。本研究结果显示B组较A组患者血清NSE和S100B蛋白水平明显升高,且相关性分析表明急性脊髓损伤患者的血清NSE和S100B蛋白水平越高,入院时ASIA感觉、运动评分越低,感觉、运动恢复率越低,则脊髓损伤程度越严重,神经功能恢复越差,反之血清NSE和S100B蛋白水平越低,入院时ASIA感觉、运动评分越高,感觉、运动恢复率越高,则脊髓损伤程度越低,神经功能恢复越好。Cao等[13]通过研究大鼠急性脊髓损伤模型,发现急性脊髓损伤后CSF和血清NSE和S100B蛋白均明显增高,且恢复较好组明显低于恢复一般组。这与本研究结果一致。Pouw 等[14]研究了16例急性胸段脊髓损伤NSE和S100B蛋白的表达,发现急性脊髓损伤后血清NSE和S100B蛋白明显升高。与本研究结果相同,不同的是Pouw的研究结果表明血清NSE和S100B蛋白水平在恢复较好组和恢复一般组无明显差异,这可能是由于以下原因造成的:(1)样本量过小,样本资料不尽相同;(2)只测定一次,且测定时间不一致。Ahadi等[15]研究了急性脊髓损伤后的相关生物标记物,测定了急性脊髓损伤后的多种生物标记物表达,并且显示急性脊髓损伤后血清NSE水平明显升高。这与本研究结果一致,但是没有测定血清S100B蛋白水平。Lee等[16]测定了急性脊髓损伤后血清S100B蛋白水平,发现急性脊髓损伤后血清S100B 蛋白水平明显升高,这与本研究结果一致。Lee等还发现伴随椎体骨折的急性脊髓损伤较无椎体骨折的急性脊髓损伤血清S100B蛋白水平更高。与本研究不同的是,Ahadi等和Lee等的研究只测定一次,并且各个样本的采集不是在同一时间段。
鉴于上述结果,笔者推断:血清NSE和S100B蛋白水平越高提示脊髓损伤程度越严重,预后结果越差,反之血清NSE和S100B蛋白水平越低提示脊髓损伤程度越轻,预后结果相对较好;急性脊髓损伤后血清NSE水平过早升高可能是神经功能预后不良另一信号。需要指出的是,本研究结果没有显示较高水平的血清NSE和S100B蛋白会加重神经功能损伤和预后。因此,笔者认为血清NSE和S100B蛋白水平可较好地反映急性脊髓损伤的程度,同时对于评价急性脊髓损伤预后结果有较大价值,有利于探索潜在的治疗急性脊髓损伤的方法。
由于样本的局限性,本研究只能采集患者的静脉血作为检测物,并且只能显示一过性的血清NSE和S100B蛋白水平,但是不知道结果是否反映病变的时间差异,这将是进一步研究的重点。本研究的另一局限性为样本量较小、人群资料不尽相同。由于收集的样本量较小,故没有必要再依据ASIA分类,因为这会使得依据生物标记物表达作为判断损伤预后的价值不十分清楚,更大样本量的调查可能会得出不同的结论。值得一提的是,有学者认为ASIA分类在评估神经功能改善方面存在一定缺陷[17]。另外有相关文献表明脊髓损伤后存在自发性的ASIA分级改善[18],在将来的研究中应考虑避免类似的上述干扰因素。
参 考 文 献
[1]Marquardt G, Setzer M, Theisen A, et al. Experimental subacute spinal cord compression: correlation of serial S100B and NSE serum measurements, histopathological changes, and outcome. Neurol Res, 2011, 33(4):421-426.
[2]Currie HN, Loos MS, Vrana JA, et al. Spatial cytokine distribution following traumatic injury. Cytokine, 2014, 66(2):112-118.
[3]Pape HC, Schmidt RE, Rice J, et al. Biochemical changes after trauma and skeletal surgery of the lower extremity:quantification of theoperative burden. Crit Care Med, 2000,28(10):3441-3448.
[4]Sun J, Li J, Cheng G, et al. Effects of hypothermia on NSE and S-100 protein levels in CSF in neonates following hypoxic/ischaemic brain damage. Acta Paediatr,2012,101(8):316-320.
[5]Michetti F, Corvino V, Geloso MC, et al. The S100B protein in biological fluids: more than a lifelong biomarker of brain distress. J Neurochem, 2012, 120(5):644-659.
[6]Zhu L, Okano S, Takahara M, et al. Expression of S100 protein family members in normal skin and sweat gland tumors. J Dermatol Sci, 2013, 70(3):211-219.
[7]Bloomfield SM, McKinney J, Smith L, et al. Reliability of S100B in predicting severity of central nervous system injury. Neurocrit Care, 2007, 6(2):121-138.
[8]Bouvier D. Interest of S100B protein blood level determination in severe or moderate head injury. Ann Biol Clin(Paris), 2013,71(2):145-150.
[9]Beaudeux JL. S100B protein: a novel biomarker for the diagnosis of head injury. Ann Pharm Fr, 2009, Biol Clin(Paris),67(3):187-194.
[10]Stälnacke BM, Sojka P. S100B for diagnosis and prognosis of sequelae following minor head injury. Contradictory results according to studies. Lakartidningen, 2008, 105(24-25):1840-1845.
[11]Patil S, Raza WA, Jamil F, et al. Functional electrical stimulation for the upper limb in tetraplegic spinal cord injury:a systematic review. J Med Eng Technol, 2014, 39(7):419-423.
[12]李建军, 王方永. 脊髓损伤神经学分类国际标准(2011年修订). 中国康复理论与实践, 2011, 17(10):963-972.
[13]Cao F, Yang XF, Liu WG, et al. Elevation of neuron-specifc enolase and S-100beta protein level in experimental acute spinal cord injury. J Clin Neurosci, 2008,15(5):541-544.
[14]Pouw MH, Kwon BK, Verbeek MM, et al. Structural biomarkers in the cerebrospinal fluid within 24h after a traumatic spinal cord injury: a descriptive analysis of 16 subjects. Spinal Cord, 2014(52):428-433.
[15]Ahadi R, Khodagholi F, Daneshi A, et al. Diagnostic value of serum levels of GFAP, pNF-H, and NSE compared with clinical fndings in severity assessment of human traumatic spinal cord injury. Spine, 2015, 40(14):823-830.
[16]Lee SJ, Kim CW, Lee KJ, et al. Elevated serum S100B levels in acute spinal fracture without head injury. Emerg Med J, 2010,27(3):209-212.
[17]Gündoğdu I, Akyüz M, Öztürk EA, et al. Can spinal cord injury patients show a worsening in ASIA impairment scale classification despite actually having neurological improvement? The limitation of ASIA Impairment Scale Classifcation. Spinal Cord, 2014(52):667-670.
[18]Spiess MR, Müller RM, Rupp R, et al. Conversion in ASIA impairment scale during the first year after traumatic spinal cord injury. J Neurotrauma, 2009, 26(11):2027-2036.
(本文编辑:李贵存)
. 脊柱脊髓损伤 Spinal and spinal cord injuries .
DOI:10.3969/j.issn.2095-252X.2016.06.002中图分类号:R683.2
作者单位:030001 太原,山西医科大学第二临床医学院(鹿鹏);100070 北京,陆军总医院骨科(鹿鹏、孙天胜、张建政、张志成、侯景明)
通信作者:孙天胜,Email: suntiansheng-@163.com
收稿日期:(2016-02-17)
Correlation between serum neuron-specifc enolase(NSE)and S100B protein and the severity and prognosis of acute spinal cord injury
LU Peng, SUN Tian-sheng, ZHANG Jian-zheng, ZHANG Zhi-cheng, HOU Jing-ming.Corresponding author: SUN Tian-sheng, Email: suntiansheng-@163.com
The Second Hospital of Shanxi Medical University, Taiyuan, Shanxi, 030001, PRC
【Abstract】Objective To determine the levels of neuron-specific enolase(NSE)and S100B protein in patients with acute spinal cord injury and observe a possible relationship between the improvements of neurological function and biomarker levels. Methods The subjects of this study included 27 patients with acute spinal cord injury,serum levels of NSE and S100B protein were measured on the day of injury and 2 to 10 days after injury once daily,and evaluated neurological function on admission and during a 6-month follow-up. According to the functional recovery of sensory and motor 6 months after the injury,27 cases were divided into Group A(with AIS improvement group,n=9)and Group B(without AIS improvement group,n=18). Twenty-fve healthy adult volunteers whose age and sex matched with the patients were chosen as Group C. Results Serum NSE and S100 calcium binding protein B(S100B protein)levels of the normal control group were(14.38 ± 1.12)μg/L and(0.89 ± 0.13)μg/L. In group A,serum NSE levels rose to the highest on day 2[(109.56±13.24)μg/L,t=34.98,P<0.05]after injury,then overall declined. In group B, serum NSE levels rose to the highest on day 3[(70.48±10.42)μg/L,t=25.48,P<0.05]after injury. Within 7 days after the injury, the serum NSE level of each monitoring point in the group A were:[(28.29±10.89)μg/L,t=6.47,P<0.05;(45.26±9.21)μg/L,t=16.88,P<0.05;(70.48±10.42)μg/L,t=27.23,P<0.05;(43.25±8.51)μg/L,t=17.02,P<0.05;(40.18±7.89)μg/L,t=16.34,P<0.05;(37.59±11.56)μg/L,t=10.19,P<0.05;(29.25±8.98)μg/L,t=8.33,P<0.05],and were signifcantly higher than the group C. Within 7 days after the injury, the serum NSE level of each monitoring point in the group B were:[(46.34±11.25)μg/L,t=14.16,P<0.05;(109.56±13.24)μg/L,t=35.91,P<0.05;(98.37±8.64)μg/L,t=48.25,P<0.05;(90.35±10.33)μg/L,t=36.62,P<0.05;(73.55±10.45)μg/L,t=28.20,P<0.05;(80.34±9.75)μg/L,t=33.66,P<0.05;(71.56±11.49)μg/L,t=28.42,P<0.05],and were signifcantly higher than the group C. Within 7 days after the injury, the serum S100B protein level of each monitoring point in the group A were:[(1.36±0.49)μg/L,t=4.46,P<0.05;(2.24±0.62)μg/L,t=10.52,P<0.05;(2.92±0.54)μg/L,t=17.79,P<0.05;(2.35±0.38)μg/L,t=16.82,P<0.05;(2.11±0.33)μg/L,t=15.47,P<0.05;(1.92±0.39)μg/L,t=11.64,P<0.05;(1.81±0.41)μg/L,t=5.43,P<0.05],and were signifcantly higher than the group C. Within 7 days after the injury, the serum S100B protein level of each monitoring point in the group B were:[(2.24±0.45)μg/L,t=14.28,P<0.05;(3.21±0.62)μg/L,t=18.25,P<0.05;(4.02±0.51)μg/L,t=29.55,P<0.05;(3.76±0.53)μg/L,t=26.15,P<0.05;(3.26 ± 0.46)μg/L,t=24.58,P<0.05;(3.32 ± 0.45)μg/L,t=25.71,P<0.05;(3.12±0.47)μg/L,t=22.68,P<0.05],and were significantly higher than the group C.Patients in the group B had signifcantly higher NSE levels compared with patients in the group A[(109.56±13.24)μg/L,(70.48±10.42)μg/L,t=7.41, P<0.05]. Patients in the group B had signifcantly higher S100B protein levels compared with patients in the group A[(4.02±0.51)μg/L,(2.92 ± 0.54)μg/L,t=5.03,P<0.05]. Serum NSE protein level were negatively correlated with the American Spinal Injury Association(ASIA)sensation score of patients admitted to hospital, and negatively correlated with the recovery rate of sensation, and the correlation was statistically signifcant(r=-0.70,P=0.04;r=-0.86,P<0.01). Serum NSE protein levels were negatively correlated with the ASIA motor score of patients admitted to hospital, and negatively correlated with the recovery rate of motor,and the correlation was statistically signifcant(r=-0.59, P<0.01; r=-0.93,P<0.01). Serum S100B protein levels were negatively correlated with the ASIA sensation score of patients admitted to hospital, and negatively correlated with the recovery rate of sensation,and the correlation was statistically signifcant(r=-0.72,P=0.03;r=-0.85,P<0.01). Serum S100B protein level was negatively correlated with the ASIA motor score of patients admitted to hospital, and negatively correlated with the recovery rate of motor, and the correlation was statistically signifcant(r=-0.71,P<0.01;r=-0.92,P<0.01). Conclusions Measuring serum levels of NSE and S100B protein over time is useful for evaluating the severity and prognosis of acute spinal cord injury.
【Key words】Spinal cord injuries; Phosphopyruvate hydratase; Prognosis; S100B; Neuron-specifc enolase

