肛管癌治疗进展
李宁 金晶
•青年专家论坛•
肛管癌治疗进展
李宁 金晶

李宁 中国医学科学院肿瘤医院放射治疗科主治医师。毕业于北京协和医学院,担任中国医疗保健交流促进会神经内分泌肿瘤分会秘书、北京医学会放射肿瘤治疗分会胃肠学组秘书等学术职务。发表国内核心期刊论文数篇,投稿多次被CSTRO年会以及美国ASTRO年会接收。
【摘要】肛管癌的发病在过去几十年明显升高,并且未来也将呈持续升高态势。随着对于肛管癌生物学行为的认识深入,治疗模式发生了根本性的改变。主要的治疗手段已经不再是有创的手术切除,放射治疗同步化疗不仅可以达到根治目的,而且避免了腹会阴联合切除术给患者带来人工肛门的困扰。同步放化疗作为一线治疗,其应用越来越广泛。5氟尿嘧啶+丝裂霉素在肛管癌的治疗中有明确的作用,可以提高完全缓解率、提高保肛率和无病生存率。当患者在同步放化疗结束后仍有肿瘤残存时,可以尝试挽救性同步放化疗或密切随诊,如果随诊肿瘤进展再行手术挽救。IMRT技术的应用,利于提高肛门区癌的剂量,同时保护小肠、膀胱、皮肤和股骨头等周围器官从而降低治疗副反应,减少治疗中断时间。靶向药物的应用给肛门癌的治疗带来了新的选择,但是有效性和安全性,需要更多研究数据支持。
【关键词】肛管; 治疗; 同步放化疗; 进展
肛门区癌发病率占直肠肛管恶性肿瘤的4%,占所有胃肠道恶性肿瘤的1.5%[1-2]。其中,肛管癌占75%,中位发病年龄60岁~65岁,女性略多见于男性,并呈地域性分布。研究数据表明,西班牙裔男性的肛管癌发病率低于非西班牙裔男性,但在女性人群中并没有发现上述规律。黑人男性发病率高于白人男性,黑人女性则低于白人女性[3]。1997年~2009年肛门鳞癌发病率与1973年~1996年比较骤然上升(危险度:2.2;95%CI,2.1~2.3)。欧洲发病情况类似[3-5]。来自丹麦的数据显示,1943年~1997年间,由全部人群仅0.2/10万上升至男性0.5/10万和女性1.0/10万[1]可见,随着社会文化和生活行为的多元化,肛管癌的发病在过去几十年以及将来可能均呈持续升高态势。同时,随着对于肛管癌生物学行为更深入的认识,其筛查、早期诊断得到了长足的进步,治疗模式也发生了根本性的改变。主要的治疗手段已经不再是有创的手术切除,放射治疗同步化疗不仅可以达到根治目的,而且避免了腹会阴联合切除术给患者带来人工肛门的困扰。1974年,Nigro等人的里程碑式的研究中,3例肛管癌病例,经过放化疗后均获得病理完全缓解[6]。随后,越来越多的研究结果证实了放化疗的安全性和有效性,同步放化疗已成为肛门区癌的标准治疗方案。放疗技术的进步,进一步降低了同步放化疗的毒副反应,从而让患者并不需要牺牲生活质量治愈癌病。新的研究应用了新的技术和药物治疗肛管癌。
一、手术治疗
单纯手术治疗肛管癌,5年局部复发率为27%~47%,生存率为50%~70%。但是,由于腹壁造瘘对于生活质量的影响,目前手术已经不再是肛管癌首选的治疗手段。初诊的肛门区上皮内瘤样病变可考虑直接接受手术切除,早期浸润性癌也可考虑局部切除。局部切除手术创伤小,并发症发生率低,但是需要严格把握适应证。研究认为,高分化并且肿瘤<2 cm的病变淋巴结转移率<5%[7-9]。因此,局部手术切除仅适用于病灶较小、高分化、未侵犯括约肌、齿状线以下的病例。但是,如果局部切除术后切缘阳性或者不足,应建议术后行放疗或者同步放化疗。T2以上的浸润性癌则首选不考虑手术。然而,由于5%左右的患者因原发病变侵犯肛门括约肌导致功能完全丧失,同步放化疗虽然可能达到完全缓解并且保留了器官,但是括约肌已被纤维化或者坏死组织替代,其功能无法恢复。这些患者则建议采取手术+术前/术后同步放化疗的治疗策略。
初诊腹股沟淋巴结转移的患者5年总生存率较差,放疗虽然对转移淋巴结有效,但是高剂量可能导致下肢淋巴回流障碍。是否需要接受腹股沟淋巴结切除术,目前多个研究进行了探索。文献报道,腹股沟淋巴结切除术后+放疗的区域控制率可以达到80%以上[10-11],并且腹股沟淋巴结区域放疗的剂量通常可以限制在50~54 Gy。因此,手术切除+放疗在保证疗效的基础上可能降低了下肢水肿的发生率。
二、同步放化疗与单纯放疗
上世纪70年代,放疗逐渐成为治疗肛管癌的主要手段后,学者们进一步探索了同步放化疗的疗效和安全性。英国癌症研究协作组(United Kingdom Coordinating Committee for Cancer Research,UKCCCR)和欧洲癌症研究与治疗组织(European Organization for Research and Treatment of Cancer,EORTC)的研究对同步放化疗和单纯放疗进行了比较,两个研究设计方案类似,结果均证实同步放化疗改善了患者局部区域控制率和无结肠造瘘生存率,但是总生存在早期结果中未体现显著差异。上述两个前瞻性随机对照研究最终确定了同步放化疗在肛管癌治疗的地位(表1)。
UKCCCR研究中,共入组577例患者,其中肛管癌占75%,肛周癌占23%。全组患者随机分为单纯放疗组(n=292)和同步放化疗组(n=285)。两组患者均给予放疗45 Gy/20~25次/4~5周完成。同步化疗组接受5氟尿嘧啶连续滴注,分别于放疗第一周和最后一周给予;同时静脉推注丝裂霉素,化疗第一天给予。同步放化疗接受6周评估,如果原发肿瘤残存>50%则进行手术挽救,如果残存≤50%则给予会阴区局部加量(15 Gy/6次或25 Gy/2~3天铱-192粒子植入)。结果显示,全组89%患者残存≤50%,进而接受了进一步放疗加量。近期疗效无显著差异(P=0.08)。单纯放疗组和同步放化疗组3年局部区域复发率分别为61%和39%(P<0.001),总生存率分别为58%和65%(P=0.25),治疗相关死亡率分别为0.7%和2%。急性毒性、晚期毒性反应两组无显著差异。UKCCCR后来的报告中,中位随访时间延长至13年,结果令人鼓舞,无论在局部区域控制率、无结肠造瘘生存率、无病生存率或者总生存率,同步放化疗组患者均显著优于单纯放疗组。同步放化疗降低5年、12年死亡风险分别为5.1%、5.6% (HR)[12-13]。EORTC的研究共入组103例,全部病例为局部晚期肛管癌。放疗给予45 Gy/25次/5周。同步化疗组给予5氟尿嘧啶和丝裂霉素。治疗完成6周后进行疗效评价,如果达到临床完全缓解,则给予15 Gy加量;如果达到部分缓解,给予20 Gy加量。该方案的结果表明,同步放化疗组患者在第一阶段治疗后,肿瘤CR率显著高于单纯放疗组(80% vs 54%)。单纯放疗组和同步放化疗组5年局部区域复发率分别为48%和32%(P<0.02),总生存率分别为53%和58%(P=NS),1例患者死于同步放化疗治疗相关毒性反应。急性毒性、晚期毒性反应两组无显著差异[14]。
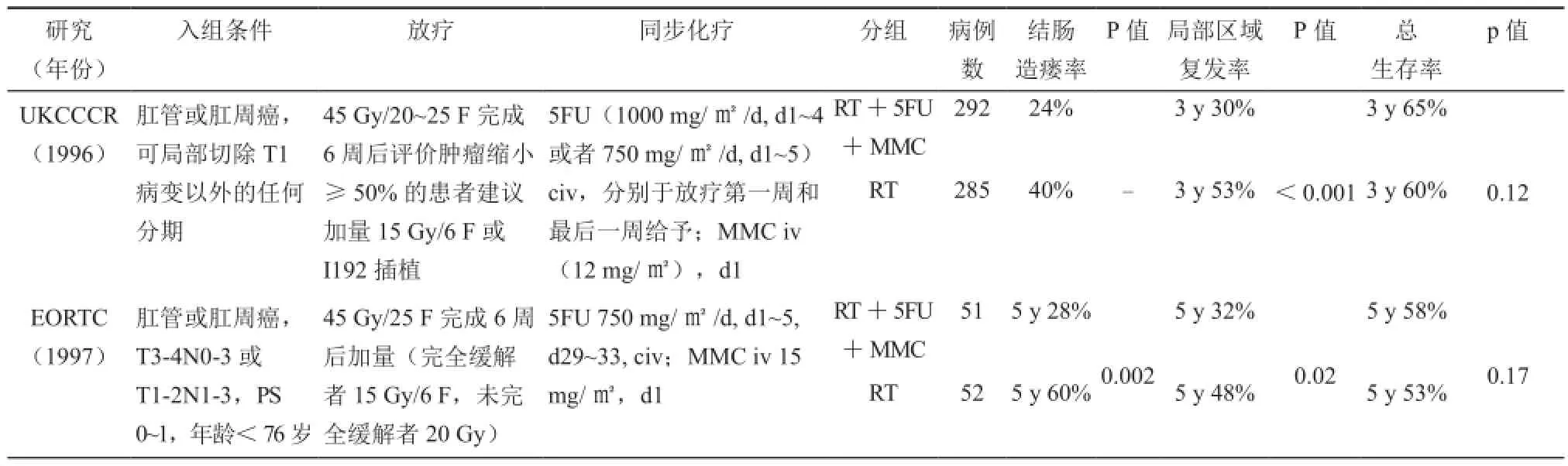
表1 同步放化疗与单纯放疗比较的研究表
上述两个研究建立了同步放化疗作为一线治疗的研究基础,其应用越来越广泛。一些患者可能由于其他内科疾病或者其他原因无法接受化疗,临床也可以建议其行单纯放疗。这类患者中,如果原发病灶3~4 cm以内,仍可获得较好的局部控制率。
三、同步化疗方案
UKCCCR和EORTC的研究奠定了同步放化疗的基础,两个研究中,同步化疗方案一致选择了5氟尿嘧啶和丝裂霉素。为了避免丝裂霉素造成的血液学毒性,随后的研究讨论了同步化疗药物的选择问题,学者们试图更换丝裂霉素甚至5氟尿嘧啶单药方案,但是,研究结果并没有发现其他方案疗效优于5氟尿嘧啶和丝裂霉素(表2)。
北美放射治疗研究组(Radiation Therapy Oncology Group,RTOG)和东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)的随机对照研究RTOG8704/ECOG1289中,比较了5FU+MMC与5FU两种不同的化疗方案同步放疗的疗效和毒性反应[15]。全组291例肛管癌患者入组,接受放疗剂量50.4 Gy/25~28次/5周,同步2周期5FU化疗,MMC组分别于5FU化疗周期第1天给予静脉推注1次。治疗结束6周后进行活检,单药组和双药组活检阳性率分别为15%和8%(P=0.14)。活检阳性组患者再次接受了9 Gy/5次放疗同步5FU+顺铂。双药组和单药组4年局部复发率、总生存率分别为16%和34% (P=0.0008)、76%和67%。两组总生存无明显差异,但是双药组4年无病生存率达到73%,远高于单药组51%(P=0.0003)。尽管第一阶段同步放化疗后两组的病例活检阴性率无显著差别,但是如果原发肿瘤最大径小于5 cm,双药组活检阴性率显著高于单药组(93% vs 83%,P=0.02)。研究中没有分析不同方案对肿瘤局部控制的结果,但是将腹壁造瘘术发生率进行了分析。双药组腹壁造瘘术发生率显著低于单药组(9% vs 23%,P=0.002)。双药组13例患者接受了腹壁造瘘术,其中11例由于局部失败,2例由于同步放化疗引起的不良反应。单药组32例患者接受了腹壁造瘘术,其中23例为局部失败,2例为不良反应导致,另外1例原因不详。研究还发现,早期病变患者中,腹壁造瘘术发生率无显著差别(P=0.141),而晚期病变组,双药组腹壁造瘘术发生率显著低于单药组(P=0.019)。双药组血液学毒性发生率高于单药组,其他毒性反应两组无显著差异。4例(2.7%)双药组患者死于治疗相关毒性反应,单药组发生1例。
RTOG8704/ECOG1289随机对照研究,得出以下结论:MMC在肛管癌的治疗中有明确的作用,可以提高完全缓解率、提高保肛率和无病生存率;无论患者是否有淋巴结转移,5FU+MMC均可提高疗效;当患者在同步放化疗结束后仍有肿瘤残存时,可以尝试挽救性同步放化疗或密切随诊,如果随诊肿瘤进展再行手术挽救。
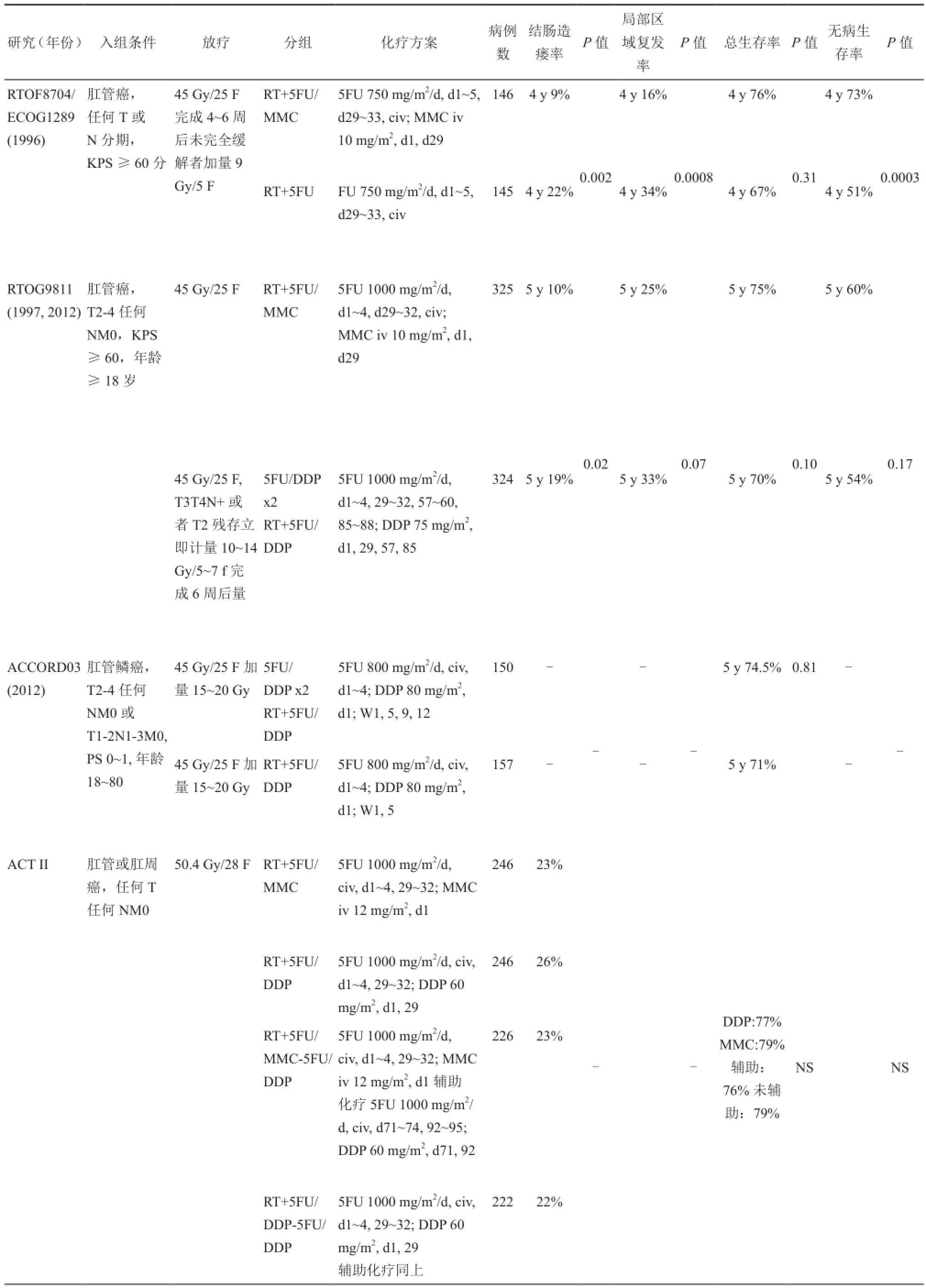
表2 放疗同步不同化疗方案比较的研究表
近年来,学者们没有放弃寻找更为有效、更为简化的同步化疗方案。多个II期临床研究试图寻找更为有效、毒副反应更低的药物组合。英国的一个研究,将5FU、MMC和CDDP三种药物同时与放疗同步治疗肛管癌,由于毒性过大,研究未按计划完成[16]。英国国家癌症研究中心肛门癌组报道的II期临床研究中,将卡培他滨替代5FU,与MMC联合同步放疗(50.4 Gy/28次/5.5周)。研究共31例患者入组,治疗完成率58%。结果发现全组完全缓解率77.4%,部分缓解率12.9%,并且该方案副反应可接受[17]。目前有研究评估了卡培他滨联合奥沙利铂的有效性和安全性。研究结果尚未正式发表,但是初步结果令人鼓舞。其他一些探索性研究中,做了更多的尝试。瑞典研究中将博来霉素作为同步方案,结果并没有发现获益[18-20]。
四、调强适形放射治疗
调强适形放疗(IMRT)可以使靶区适形度更好,剂量更均匀,并且可以降低周围正常组织器官的剂量[15,21]。IMRT技术的应用,利于提高肛门区癌的剂量,同时保护小肠、膀胱、皮肤和股骨头等周围器官从而降低治疗副反应,减少治疗中断时间。Jose等人的研究,比较了46名患者的IMRT和常规放射的治疗结果。研究发现,常规放射组治疗中断发生率显著高于IMRT组(88% vs 34.5%,P=0.001),中断时间也更长(12天 vs 1.5天,P<0.001)。疗中常规组>2度血液学毒性发生率高于IMRT组(65% vs 21%,P=0.003)。长期随访结果认为,IMRT组生存优于常规组。因此,研究结论提示IMRT可以降低毒副反应,缩短治疗中断,提高生存。但是,既往大样本前瞻性的临床研究均未应用IMRT技术,ACCORD 03研究中放疗甚至采用了二维技术[22]。多个回顾性研究认为IMRT可以降低急性毒性反应。RTOG0529前瞻性II期研究将RTOG9811毒性反应发生率作为基线比较,结果提示IMRT技术显著降低了2度及以上的血液学毒性,3度及以上皮肤和胃肠道反应,并且IMRT的应用缩短了治疗中断时间。加拿大的前瞻性研究,共入组58例肛门癌患者,全组接受IMRT同步5FU+MMC化疗。结论认为IMRT保证疗效的基础上,降低了3度级以上血液学和胃肠道毒性反应。
五、靶向药物
西妥昔单抗是EGFR抑制剂,对于KRAS野生型肿瘤作用明显。研究认为,肛门癌EGFR表达率高,KRAS突变率很低。因此,西妥昔单抗理论上可能成为治疗肛门癌非常有前景的药物。II期临床研究ECOG3205和AMC045近期发表了结果[19-20,23-25]。研究评价了5FU+DDP联合西妥昔单抗治疗肛门鳞癌的安全性和有效性。ECOG3205的入组患者为免疫功能正常人群,AMC045研究对象为HIV阳性人群。研究主要目的是3年局部区域复发率。前期报道的结果中,HIV阴性患者和阳性患者的2年无进展生存分别为92%(95%CI,81%~100%)和80%(95%CI,61%~90%)。该研究毒性反应可接受。但是ACCORD 16的研究采用了同样的方案,却因毒副反应无法耐受,被迫提前终止[24]。靶向药物的应用给肛门癌的治疗带来了新的选择,但是有效性和安全性,需要更多大样本前瞻性随机对照研究数据证实。
六、预后因素
既往研究结果显示,原发肿瘤大小、区域淋巴结转移情况和盆腔外转移状态都是影响预后的重要因素。在1985年~2000年间NCDB记录的19199例病例中,5年总生存率为58%。有无远地转移患者的5年生存率分别为18.7%和59.4%。有无区域淋巴结转移的5年生存率分别为37.4%和62.9%。按照AJCC分期,T1、T2、T3和T4病变的5年生存率分别为68.5%、58.9%、43.1%和34.3%。
RTOG9811研究入组644例肛管癌患者,分析发现肿瘤直径>5 cm与结肠造瘘发生率相关(风险比1.8;P=0.008)。肿瘤直径>5 cm和临床淋巴结转移均与5年无病生存和总生存相关。EORTC22861研究发现皮肤溃疡和淋巴结受累影响局部控制率和总生存。近期的ACT I研究多因素分析结果显示淋巴结阳性与局部失败、癌症相关死亡相关。中国医学科学院肿瘤医院分析的31例肛门癌结果发现,临床分期和T分期是影响预后的最主要因素。此外,RTOG9811、EORTC22861和ACT I研究结果还发现男性为预后不良因素。其他预后不良因素还包括年龄、一般情况、血红蛋白水平、吸烟以及人种。但是上述结果尚缺乏大样本研究证实。近年,生化和分子标记物的研究越来越多,一些研究也发现了一些标记物与预后的关系,这些因子包括:p53、Ki67、B细胞核转录因子、5HH、Gli-1和MCM7蛋白[25-27]。在未来的几年,随着相关研究的成熟发展,一些标记物可能会成为预测预后和疗效的金标准。
综上所述,肛管癌发病率低,但由于社会文化和生活方式的多元性发展,目前发病呈上升态势。同步放化疗已成为肛管癌的首选治疗方案。放疗同步化疗方案以5氟尿嘧啶和丝裂霉素为首选。NCCN指南中建议同步化疗方案为5氟尿嘧啶联合丝裂霉素或者卡培他滨联合丝裂霉素。放射治疗技术的发展,调强适形放疗可以使靶区适形度更好,剂量更均匀,并且可以降低周围正常组织器官的剂量。IMRT技术的应用,利于提高肛门区癌的剂量,同时保护小肠、膀胱、皮肤、股骨头等周围器官从而降低治疗副反应,减少治疗中断时间。靶向药物的应用给肛门癌的治疗带来了新的选择,但是有效性和安全性,需要更多研究数据支持。
参 考 文 献
[ 1 ] Martin, F.T., D. Kavanagh, R. Waldron.Squamous cell carcinoma of the anal canal. Surgeon, 2009, 7(4): 232-237.
[ 2 ] Siegel R, Ward E, Brawley O, et al. Cancer statistics, 2011: the impact of eliminating socioeconomic and racial disparities on premature cancer deaths. CA Cancer J Clin, 2011, 61(4): 212-236.
[ 3 ] Metildi C, McLemore EC, Tran T, et al. Incidence and survival patterns of rare anal canal neoplasms using the surveillance epidemiology and end results registry. Am Surg, 2013. 79(10): 1068-1074.
[ 4 ] Melbye M, Rabkin C, Frisch M,et al. Changing patterns of anal cancer incidence in the United States, 1940-1989. Am J Epidemiol,1994, 139(8): 772-780.
[ 5 ] Johnson LG, Madeleine MM, Newcomer LM, et al. Anal cancer incidence and survival: the surveillance, epidemiology, and end results experience, 1973-2000. Cancer, 2004, 101(2): 281-288.
[ 6 ] Nigro ND, Vaitkevicius VK, Considine B Jr. Combined therapy for cancer of the anal canal: a preliminary report. Dis Colon Rectum,1974. 17(3): 354-356.
[ 7 ] Myerson RJ, Karnell LH, Menck HR.The National Cancer Data Base report on carcinoma of the anus. Cancer, 1997, 80(4): 805-815.
[ 8 ] Frost DB, Richards PC, Montague ED,et al. Epidermoid cancer of the anorectum. Cancer, 1984, 53(6): 1285-1293.
[ 9 ] Bilimoria KY, Bentrem DJ, Rock CE,et al. Outcomes and prognostic factors for squamous-cell carcinoma of the anal canal: analysis of patients from the National Cancer Data Base. Dis Colon Rectum,2009, 52(4): 624-631.
[ 10 ] Ortholan C, Resbeut M, Hannoun-Levi JM, et al. Anal canal cancer:management of inguinal nodes and benefit of prophylactic inguinal irradiation (CORS-03 Study). Int J Radiat Oncol Biol Phys, 2012,82(5): 1988-1995.
[ 11 ] Cummings BJ, Keane TJ, O’Sullivan B, et al. Epidermoid anal cancer: treatment by radiation alone or by radiation and 5-fluorouracil with and without mitomycin C. Int J Radiat Oncol Biol Phys, 1991,21(5): 1115-1125.
[ 12 ] UKCCCR Anal Cancer Trial Working Party.Epidermoid anal cancer:results from the UKCCCR randomised trial of radiotherapy alone versus radiotherapy, 5-fluorouracil, and mitomycin. UKCCCR Anal Cancer Trial Working Party. UK Co-ordinating Committee on Cancer Research. Lancet, 1996, 348(9034): 1049-1054.
[ 13 ] Northover J, Glynne-Jones R, Sebag-Montefiore D,et al.Chemoradiation for the treatment of epidermoid anal cancer:13-year follow-up of the first randomised UKCCCR Anal Cancer Trial (ACT I). Br J Cancer, 2010, 102(7): 1123-1128.
[ 14 ] Bartelink H, Roelofsen F, Eschwege F,et al. Concomitant radiotherapy and chemotherapy is superior to radiotherapy alone in the treatment of locally advanced anal cancer: results of a phase III randomized trial of the European Organization for Research and Treatment of Cancer Radiotherapy and Gastrointestinal Cooperative Groups. J Clin Oncol, 1997, 15(5): 2040-2049.
[ 15 ] Flam M, John M, Pajak TF,et al. Role of mitomycin in combination with fluorouracil and radiotherapy, and of salvage chemoradiation in the definitive nonsurgical treatment of epidermoid carcinoma of the anal canal: results of a phase III randomized intergroup study. J Clin Oncol, 1996, 14(9): 2527-2539.
[ 16 ] Matzinger O, Roelofsen F, Mineur L, et al. Mitomycin C with continuous fluorouracil or with cisplatin in combination with radiotherapy for locally advanced anal cancer (European Organisation for Research and Treatment of Cancer phase II study 22011-40014). Eur J Cancer, 2009, 45(16): 2782-2791.
[ 17 ] Glynne-Jones R, Meadows H, Wan S,et al. EXTRA--a multicenter phase II study of chemoradiation using a 5 day per week oral regimen of capecitabine and intravenous mitomycin C in anal cancer. Int J Radiat Oncol Biol Phys, 2008, 72(1): 119-126.
[ 18 ] Friberg B, Svensson C, Goldman S, et al. The Swedish National Care Programme for Anal Carcinoma-implementation and overall results. Acta Oncol, 1998, 37(1): 25-32.
[ 19 ] Goldman S, Glimelius B, Glas U,et al.Management of anal epidermoid carcinoma-an evaluation of treatment results in two population-based series. Int J Colorectal Dis, 1989, 4(4): 234-243.
[ 20 ] Nilsson PJ, Svensson C, Goldman S,et al.Epidermoid anal cancer:a review of a population-based series of 308 consecutive patients treated according to prospective protocols. Int J Radiat Oncol Biol Phys, 2005, 61(1): 92-102.
[ 21 ] Ajani JA, Winter KA, Gunderson LL, et al. Fluorouracil, mitomycin,and radiotherapy vs fluorouracil, cisplatin, and radiotherapy for carcinoma of the anal canal: a randomized controlled trial. JAMA,2008, 299(16): 1914-1921.
[ 22 ] Tournier-Rangeard L, Mercier M, Peiffert D,et al. Radiochemotherapy of locally advanced anal canal carcinoma: Prospective assessment of early impact on the quality of life (randomized trial ACCORD 03). Radiotherapy and Oncology, 2008, 7(3): 391-397.
[ 23 ] NIH Clinical Trials Registry. Available at: http://clinicaltrials.gov/.
[ 24 ] Levy A, Azria D, Pignon JP,et al. Low response rate after cetuximab combined with conventional chemoradiotherapy in patients with locally advanced anal cancer: Long-term results of the UNICANCER ACCORD 16 phase II trial. Radiother Oncol, 2015, 14(3): 415-416.
[ 25 ] Tanum G, Hannisdal E, Stenwig B. Prognostic factors in anal carcinoma. Pathology, 2002. 34(6): 573-578.
[ 26 ] Ajani JA, Wang X, Izzo JG, et al. Molecular Biomarkers Correlate with Disease-Free Survival in Patients with Anal Canal Carcinoma Treated with Chemoradiation. Digestive Diseases and Sciences,2010, 5(4): 1098-1105.
[ 27 ] Bruland O, Fluge O, Immervoll H, et al. Gene expression reveals two distinct groups of anal carcinomas with clinical implications. British Journal of Cancer, 2008, 8(7): 1264-1273.
(本文编辑:杨明)
李宁, 金晶. 肛管癌治疗进展[J/CD]. 中华结直肠疾病电子杂志, 2016, 5(1): 27-32.
The progress in the treatment of anal canal cancer
Li Ning, Jin Jing. Department of Radiotherapy, Cancer Hospital, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100021, China Corresponding author: Jin Jing, Email: jingjin1025@163.com
【Abstract】The incidence of anal cancer has increased significantly in the past few decades, and it will present a rising trend in the future. As for deeper understanding of the biological behavior of anal cancer,the treatment modality has changed. Primary treatment is no longer invasive surgical resection, concurrent chemo-radiotherapy could not only achieve the curative purpose, but also avoid the abdominal perineal resection of patients with poor quality of life. Concurrent chemo-radiotherapy as first-line treatment of anal cancer,which has been proven by many studies, is applied more and more widely. 5-fluorouracil and mitomycin C as concurrent chemotherapy regimen could improve the complete remission rate, sphincter preservation rate and disease-free survival rate. Residual tumor after concurrent chemo-radiotherapy could be treated by salvage surgery. The application of IMRT technology could improve the dosimetry of radiotherapy, while protectingthe small intestine, bladder, skin and the femoral head to reduce the side effects of treatment, to minimize the interruption of treatment. Molecular targeted drugs added to the treatment of anal cancer has brought new options, but the effectiveness and safety of the combination need more results from more prospective studies.
【Key words】Anal canal; Treatment; Concurrent chemo-radiotherapy; Progress
DOI:10.3877/cma.j.issn.2095-3224.2016.01.06
基金项目:国家自然科学基金资助项目(81272510)
作者单位:100021 北京,中国医学科学院 北京协和医学院肿瘤医院放疗科
通信作者:金晶,Email:jingjin1025@163.com
收稿日期:(2016-2-14)

