山羊STAT3基因克隆、生物信息学分析及甲基化修饰研究
贾文超,刘亮亮,吴贤锋,赵钊艳,王 珂,王 毛,高 静,
王立强1,陈 宏1,潘传英1,蓝贤勇1*
(1.西北农林科技大学 动物科技学院/生命科学学院,陕西省农业分子生物学重点实验室,杨凌 712100;2.江苏科技大学 计算机科学与工程学院,镇江 212003)
山羊STAT3基因克隆、生物信息学分析及甲基化修饰研究
贾文超1#,刘亮亮2#,吴贤锋1,赵钊艳1,王珂1,王毛1,高静1,
王立强1,陈宏1,潘传英1,蓝贤勇1*
(1.西北农林科技大学 动物科技学院/生命科学学院,陕西省农业分子生物学重点实验室,杨凌 712100;2.江苏科技大学 计算机科学与工程学院,镇江 212003)
摘要:本研究利用RT-PCR、TA克隆和重亚硫酸盐测序(BSP)等方法,旨在克隆、分析山羊STAT3基因完整编码区,并解析该基因甲基化修饰水平及其与体重的关系。结果表明,山羊STAT3基因编码区全长2 313 bp,编码770个氨基酸;与绵羊、牛、野猪、小鼠、大鼠和人的氨基酸序列一致性分别为99.7%、99.6%、99.4%、99.2%、99.4%和99.5%。山羊高体重组与低体重组之间甲基化差异研究发现,高体重组STAT3基因启动子区甲基化水平显著高于低体重组(P=0.020),提示该基因甲基化修饰对体重具有显著影响,可作为标记辅助选择(MAS)的有效表观遗传标记。这些结果为研究山羊肉用性能的遗传与表观遗传机制提供了科学资料。
关键词:山羊;STAT3基因;分子克隆;序列分析;DNA甲基化
羊肉较猪肉更细嫩,而且脂肪与胆固醇含量更少,为此,近年来,羊肉越来越受到消费者的青睐。当前,进一步提升山羊产肉性能已成为现代养羊业发展的关键问题,故对山羊产肉调控机制进行研究显得极其重要。目前,关于山羊产肉调控的表观遗传机制的研究很少,其中山羊重要基因表观遗传修饰的研究则更是鲜见报道[1]。
信号转导与转录激活因子(STATs)是一类活化后能转入细胞核、并与相应DNA结合的蛋白家族,具有信号转导和转录调控的双重功能[2]。STATs家族包括7个成员,即STAT1-STAT4、STAT5a、STAT5b和STAT6,均含有SH2同源结构域和C端酪氨酸磷酸化位点[2]。作为STATs家族成员之一,STAT3 于1994年作为白细胞介素-6(IL-6)信号传递中的急性期反应因子(APRF) 被纯化,它在调节肝急性期蛋白和抑制单核细胞生长等方面具有重要作用[3-5],不仅能调节细胞自噬[6],还能影响胚胎早期发育[7]。动物STAT3通过调控催乳素(PRL)和生长激素(GH)的表达来影响体重等生产性能[8-9]。据此推测,STAT3基因对体重等生产性状有重要遗传效应,故该基因是研究现代山羊产业中影响产肉性能的重要候选基因。
所谓表观遗传就是指在DNA 序列不改变的情况下基因表达与调控的可遗传变化,主要包括DNA甲基化、组蛋白修饰、染色质重塑和非编码RNA等。作为最主要的表观遗传修饰方式之一,DNA甲基化具有时空特异性的特点,常见于基因CpG岛的CG二核苷酸位点[1,10]。尽管DNA甲基化不涉及DNA序列的改变,但它却能影响基因的表达调控,它可以通过有丝分裂和减数分裂稳定地将DNA甲基化信息传递给后代,是一种新的表观遗传标记[10]。目前,关于山羊STAT3基因甲基化修饰及其与产肉性能关系的研究尚未见报道。
因山羊STAT3基因编码区未被克隆,其氨基酸信息未知,故不利于其功能的深入解析;同时,因山羊STAT3基因甲基化模式未知,故其甲基化功能研究也无法深入。为此,本研究旨在克隆STAT3基因编码区(CDS),并分析其序列特征,同时还解析该基因启动子区甲基化修饰对体重的影响,期望为山羊产肉调控的遗传与表观遗传机制研究提供科学资料。
1材料与方法
1.1试验材料
山羊样品包括两类:一类是用于基因克隆的组织样品,另一类是用于DNA甲基化分析的耳组织样品。其中,组织样品来源于6只健康的2~3岁左右布尔山羊和海南黑山羊肝组织,用于山羊STAT3基因的克隆研究;耳组织样品来源于284只成年海南黑山羊,用于DNA甲基化修饰研究。在DNA甲基化研究中,基于数理统计的概率知识,参考C.Y.Pan等[11]和赵海谕[12]的方法,对收集的海南黑山羊群体的体重进行分类,将高于群体均值1.96倍标准差(Mean+1.96SD)的个体设为高体重组(H),而低于群体均值1.96倍标准差(Mean-1.96SD)的个体设为低体重组(L)。
1.2主要试剂
Trizol 购自 Invitrogen 公司(USA);RevertAid First Strand cDNA Synthesis Kit、DNA重亚硫酸氢盐处理试剂盒EZ®DNA Methylation-GoldTM Kit、ZYMO RESEARCH试剂盒和DNA柱式胶回收试剂盒购于康宁生命科学有限公司;T-easy载体购自Promega 公司(USA);iQTMSYBR®Green Supermix 购自 Bio-Rad公司(USA);2×TaqPCR Master Mix 购自天根生化科技有限公司(中国北京);大肠杆菌(Escherichiacoli)DH5α感受态细胞(Trans-5α)为本实验室保存。
1.3方法
1.3.1山羊STAT3基因的分子克隆
1.3.1.1总RNA的提取和cDNA第一链的合成:采用Trizol 法提取肝组织的总RNA[12-13];利用紫外分光光度计和琼脂糖凝胶电泳法检测总RNA质量;按照反转录试剂盒说明书获得cDNA:5×PrimeScript Buffer 2(for Real Time)2.0 μL,PrimeScript RT Enzyme Mix I 0.5 μL,RT Primer Mix 0.5 μL,除基因组DNA的反应液 1.0 μL,RNase Free dH2O 10.0 μL。反应条件:37 ℃反转录15 min→85 ℃反转录酶失活5 s →反转录获得cDNA,-20 ℃备用;根据反转录cDNA的质量和浓度构建cDNA池,并以此cDNA池为模板克隆STAT3基因。1.3.1.2克隆引物的设计与PCR扩增:参考NCBI的基因序列(NM_001012671),利用Primer Premier软件(5.0)设计克隆山羊STAT3基因CDS区的PCR引物1对(上游:5′-AGCAGCAGTTGTGACCCCT-GATTC-3′;下游:5′-TGTAAGGGCTGGTGGGACATGGGT-3′),其预期扩增片段长度为2 410 bp。在 PCR过程中,总反应体系20 μL:上、下游引物各0.4 μL,RNase-Free ddH2O 7.4 μL,2×PowerTaqPCR MasterMix 11 μL,cDNA模板0.8 μL;PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸150 s,36个循环;72 ℃终延伸10 min,10 ℃保存。
1.3.1.3PCR产物的回收与单克隆的测序:利用0.8%琼脂糖凝胶电泳检测PCR产物,再根据凝胶回收试剂盒回收目的片段;质检合格纯化后PCR产物与 T-easy载体4 ℃过夜连接;连接产物转化至25 μL Trans-5α感受态细胞,经复苏、平板培养后,通过蓝、白斑筛选挑取白色单克隆菌落,用LB(Amp+)培养液37 ℃扩大培养,之后利用菌液PCR 鉴定阳性克隆,并送南京金斯瑞公司测序。
1.3.2生物信息学分析利用DNAMAN 软件(6.0)对测序所获得的山羊STAT3序列进行开放阅读框(ORF)和氨基酸(aa)序列预测;采用 MEGA软件(5.0)构建系统进化树;利用 EXPASY(http://www.expasy.org)对山羊STAT3蛋白进行理化性质研究;跨膜结构预测采用 TMHMM(http://www.cbs.dtu.dk/services/TMHMM)进行;利用NetPhos 2.0(http://cbs.dtu.dk/services/NetPhos/)对STAT3 进行磷酸化位点预测,利用NetNGlyc(http://www.cbs.dtu.dk/services/NetNGlyc/)分析蛋白质糖基化位点;利用在 线 程序Hopfield(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopm.html) 对蛋白质二级结构进行预测;亚细胞定位采用 PsortⅡ(http://psort.hgc.jp/)进行[14-21]。
1.3.3山羊STAT3基因甲基化修饰研究
1.3.3.1基因组DNA的提取与重亚硫酸盐处理:采用标准的苯酚-氯仿方法提取来源于高体重组和低体重组个体的耳组织基因组DNA[11-12,18-19];严格按照EZ DNA Methylation-GoldTM Kit试剂盒说明书对基因组DNA进行重亚硫酸盐处理。
1.3.3.2山羊STAT3基因甲基化引物的设计与扩增:利用在线软件Methprimer(http://www.urogene.org/methprimer/)筛选山羊STAT3基因CpG岛,并针对CpG岛设计了1对位于启动子区的甲基化引物(上游Methprimer-STAT3-M1-F:5′-GTATTGTTTTTTTATTTTTTTGAAT-3′;下游STAT3-M1-R:5′-CCTACTTTAAACTTCAATT-TCTAC-3′),扩增片段为191 bp(-807~-617 bp),包括10个CpG位点。25 μL PCR反应体系:50 ng·μL-1的重亚硫酸盐处理后的基因组DNA 1.0 μL,10 μmol·L-1的上、下游引物各0.5 μL,2×Reaction Mix(含Buffer、TaqDNA聚合酶、Mg2+、dNTPs等) 12.5 μL,灭菌超纯水10.5 μL。Touch-Down PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,68~54 ℃(每两循环降2 ℃)30 s,72 ℃延伸30 s,14个循环;94 ℃变性30 s,51 ℃复性30 s 72 ℃延伸30 s,40个循环;72 ℃延伸10 min;4 ℃保存。
1.3.3.3重亚硫酸盐处理后测序(BSP)和DNA甲基化模式分析:参考1.3.1.3中描述的方法进行TA克隆;随机挑选10~15个阳性克隆送南京金斯瑞公司测序,并利用T7正向或M13反向测序;根据DNA甲基化测序结果,分析阳性克隆中甲基化的CpG二核苷酸位点的百分数[11-13,15,17-19];分析高体重组与低体重组STAT3基因启动子区CpG岛的整体甲基化率[17-19,22-24];分析高体重组与低体重组STAT3基因启动子区甲基化差异与体重的关系:根据甲基化位点的甲基化差异数据特征,利用SPSS(18.0)软件中Fisher精确概率检验法分析高体重组与低体重组的DNA甲基化差异[11-12,16]。
2结果
2.1山羊STAT3基因CDS的分子克隆及氨基酸序列分析
利用RT-PCR方法获得一条长度为2 410 bp左右的条带(图1),与预期结果一致。经TA克隆、测序,成功地获得了山羊STAT3基因CDS序列;ORF finder分析表明,山羊STAT3基因CDS全长2 313 bp,编码770个氨基酸(图2)。
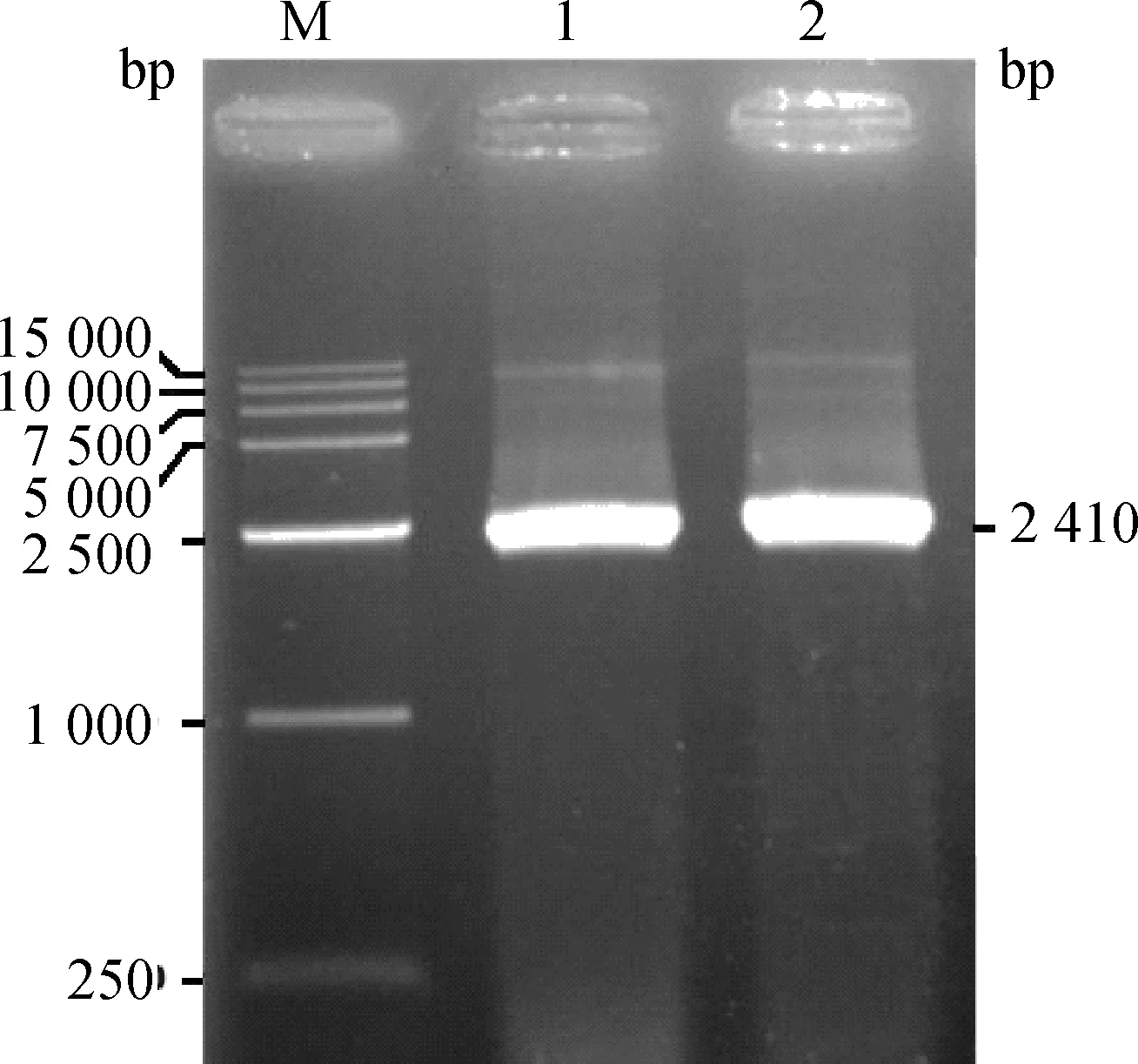
图1 山羊STAT3基因的RT-PCR电泳结果Fig.1 The RT-PCR electrophoresis results of the goat STAT3 gene
2.2山羊STAT3氨基酸序列的系统进化树构建
将山羊STAT3氨基酸序列与牛(NP_001012689)、人(AAS66986)、小鼠(AAA19452)、大鼠(AAH87025)、野猪(ABF21150)、绵羊(XP_004012974)氨基酸序列进行同源性比对,发现它们高度同源;在氨基酸同源性分析中(图3),山羊STAT3基因氨基酸序列与牛、绵羊、小鼠、大鼠、野猪和人氨基酸序列的相似性分别为99.6%、99.7%、99.2%、99.4%、99.4%和99.5%。系统发育树显示(图4),山羊与牛的亲缘关系最为接近,与人类、大鼠、小鼠和绵羊亲缘关系较远。

图2 山羊STAT3基因CDS与氨基酸序列Fig.2 The CDS and amino acid sequence of the goat STAT3 gene
2.3山羊STAT3蛋白结构与功能预测
2.3.1山羊STAT3蛋白理化性质分析山羊STAT3蛋白由770个氨基酸残基组成,其分子式为:C3909H6161N1063O1171S41,其分子量为88 099.8D,其理论等电点(pI)为5.94;该蛋白的氨基酸组成及其比例分别为:Ala(5.8%)、Arg(4.7%)、Asn(4.9%)、Asp(4.2%)、Cys(1.8%)、Gln(7.8%)、Glu(7.7%)、Gly(4.9%)、His(1.7%)、Ile(5.3%)、Leu(10.6%)、Lys(6.0%)、Met(3.5%)、Phe(3.9%)、Pro(4.3%)、Ser(6.8%)、Thr(6.1%)、Trp(1.9%)、Tyr(2.7%) 和Val(5.3%)。其不稳定系数为49.58,且预计在哺乳动物网织红细胞内半衰期为30h;脂溶指数为83.58,总平均疏水指数-0.400,属亲水蛋白。
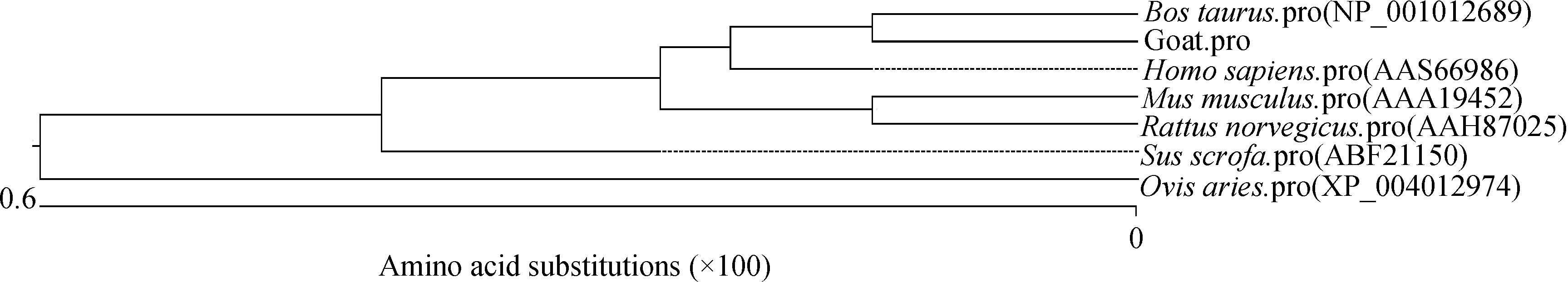
图4 不同物种STAT3基因的系统发育树Fig.4 Phylogenetic tree of STAT3 gene among various species
2.3.2山羊STAT3蛋白结构预测山羊STAT3蛋白主要由α-螺旋(46.62%)、β折叠(18.18%)、β转角(7.40%)及无规则卷曲(27.79%)构成。采用SWISS-MODEL和PyMol软件对山羊STAT3建模获得二级结构模型及结构域的预测(图5,图6)。
图5 山羊STAT3蛋白质二级结构分析Fig.5 The secondary structure analysis of goat STAT3 protein

图6 山羊STAT3蛋白质结构域Fig.6 Protein domains of goat STAT3
2.3.3山羊STAT3亚细胞定位、蛋白磷酸化和糖基化位点预测山羊STAT3蛋白在细胞质、细胞核、线粒体基质、内质网、膜泡分泌系统及质膜中的分布比例分别为34.8%、30.4%、17.4%、8.7%、4.3%和4.3%,在细胞质中分布最多。磷酸化分析显示(图7a),山羊STAT3蛋白存在较多的丝氨酸(Ser)磷酸化位点,而酪氨酸(Tyr)和苏氨酸(Thr)磷酸化位点较少。糖基化位点分析表明,山羊STAT3蛋白存在3个糖基化修饰位点,分别位于氨基酸序列的第192、401和538位(图7b)。
2.4山羊STAT3基因甲基化修饰分析
山羊STAT3基因启动子区CpG岛的PCR片段长度为191bp(图8),共包括了10个CpG二核苷酸位点(图9,图10)。经研究发现,高体重组(H)和低体重组(L)的整体甲基化率分别为42.86%和0。利用独立卡方χ2进行检验,发现H组和L组之间DNA甲基化修饰程度存在显著差异(P=0.020)(图11)。
3讨论
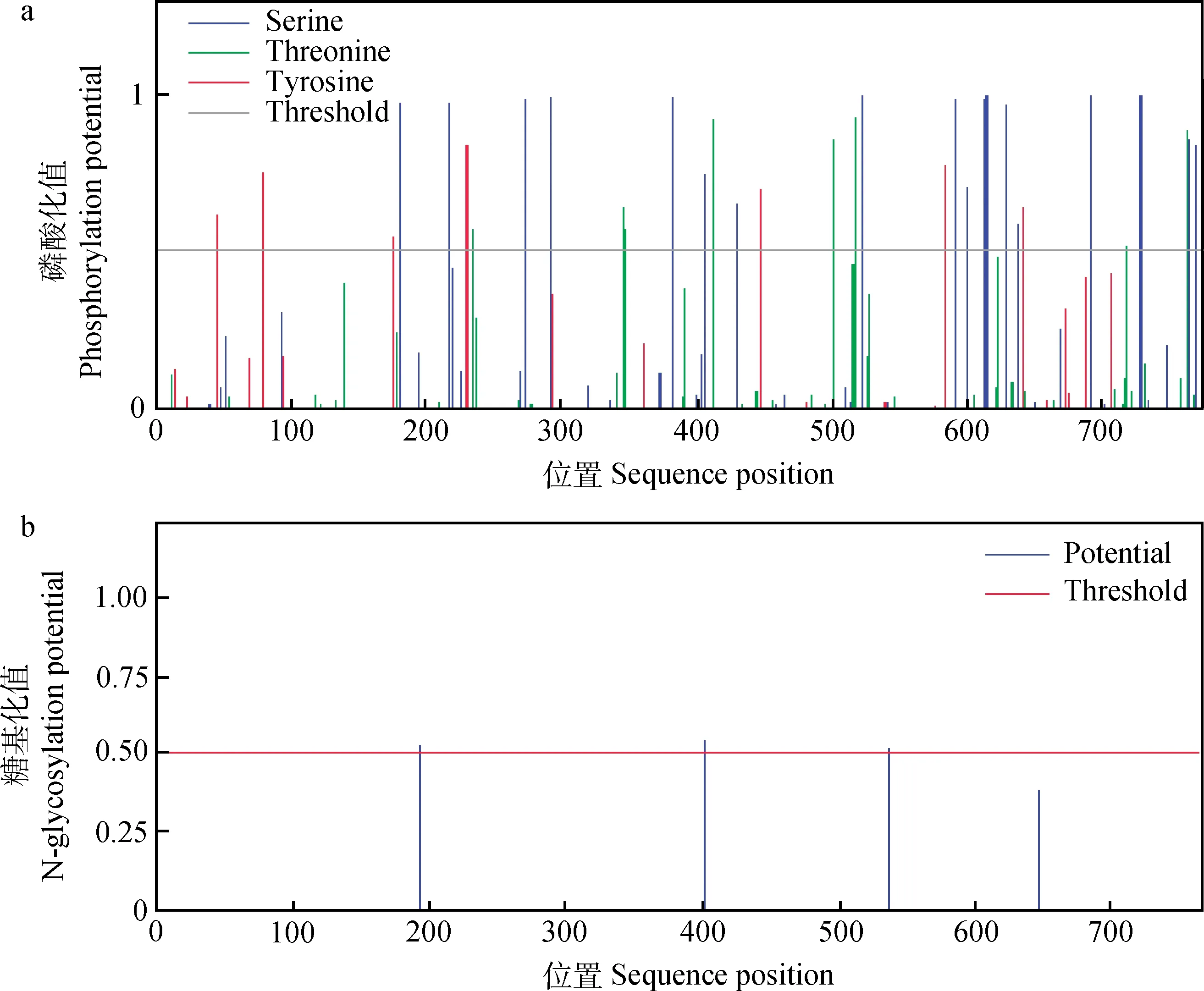
图7 山羊STAT3蛋白的磷酸化位点(a)和糖基化位点(b)Fig.7 Phosphorylation site(a) and glycosylation site(b) analyses of goat STAT3 protein
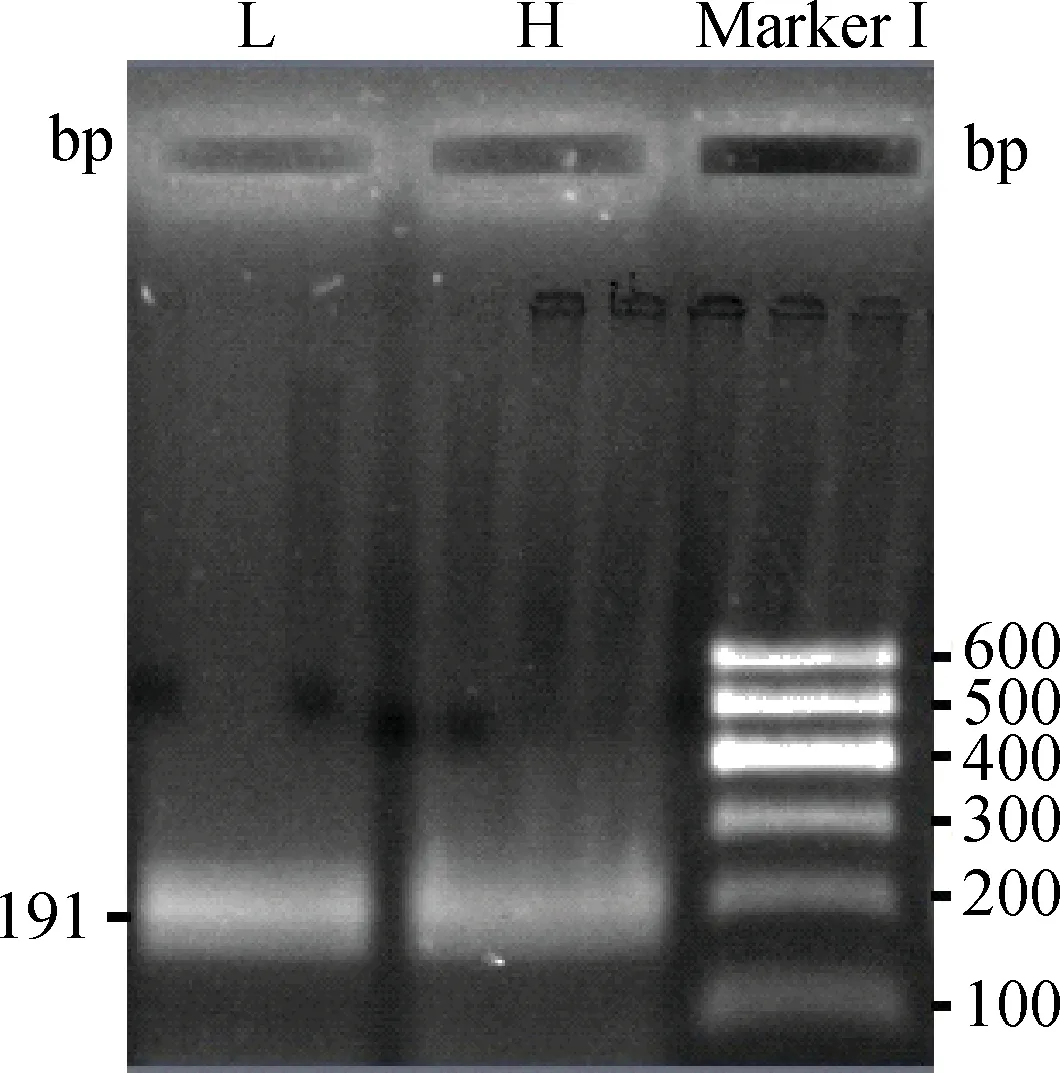
图8 山羊STAT3-M1 PCR电泳结果Fig.8 PCR electrophoresis results of the goat STAT3-M1
STAT3作为一种重要转录因子,是胞浆中信息的传递者,是胞核中转录因子的激活者,还是乳腺癌细胞中多种细胞因子信号传导途径的汇聚点,参与肿瘤发生发展的多个环节[20]。研究表明,STATs家族基因对体重具有显著遗传效应,其中STAT5a、STAT3和STAT1等蛋白参与GH与PRL的信号转导,从而对山羊体重均有重要影响;H.W.Davey等[21]发现,STAT5a与脂肪细胞增生密切相关;过表达动物IL-6将导致脂肪分解基因的mRNA水平升高,从而触发作为IL-6传递中的STAT3磷酸化水平,从而导致体重下降。本课题组最新研究表明,山羊STAT5a和STAT3基因遗传变异对生长性状有显著影响[22-23];STAT5a和STAT3为同一基因家族成员,且同源性较高、功能相似。因此,研究STAT3基因的功能对理解山羊体重和产肉性能具有重要意义。
本研究成功克隆了山羊STAT3基因CDS全长(2 313bp,编码770个氨基酸),为该基因的功能研究奠定了基础。不同各物种STAT3氨基酸序列比对结果提示该基因较为保守。生物信息学预测表明,第600~700位氨基酸具有SH2结构域,而且该区域中还存在较多的丝氨酸、苏氨酸(Thr)和酪氨酸(Tyr)的磷酸化位点,这些为该基因深入的功能验证提供了科学参考。
研究表明,基因启动子区DNA甲基化修饰会抑制基因的表达[24],当基因启动子区被甲基化后,甲基化结合蛋白会抑制SP1转录因子介导的转录激活[25]。STAT3基因在JAK-STAT信号途径中发挥着重要功能[26]。E.Kim等[27]指出,组蛋白甲基化转移酶(EZH2)与STAT3的结合会使STAT3甲基化,进而增强STAT3的活性。为此,本研究还分析了STAT3基因启动子区甲基化状态及其与山羊体重的关系。结果发现,低体重组STAT3基因启动子区是非甲基化的,而高体重组STAT3基因启动子区为中度甲基化水平;统计分析揭示,低体重组与高体重组的STAT3基因甲基化修饰程度之间存在显著差异,提示该基因甲基化修饰对体重有显著影响,同时,还提示该基因的DNA甲基化修饰可以作为体重性状筛选的有效表观遗传标记。为此,建议将STAT3基因作为影响山羊产肉性能的重要候选基因,并有必要进行深入研究。

上方数字代表源序列,下方数字代表重亚硫酸盐处理后序列比对所用的模式序列。CG或YG代表各CpG二核苷酸位点,横线指示引物位置The upward side sequence indicated origin sequence,while the downward side sequence indicated the bisulfite treatment sequence;CG or YG represented the location of CpG dinucleotide;the line indicated the location of primers图9 STAT3-M1的 CpG位点的甲基化模式图Fig.9 Methylated CpG sites mode of STAT3-M1 region
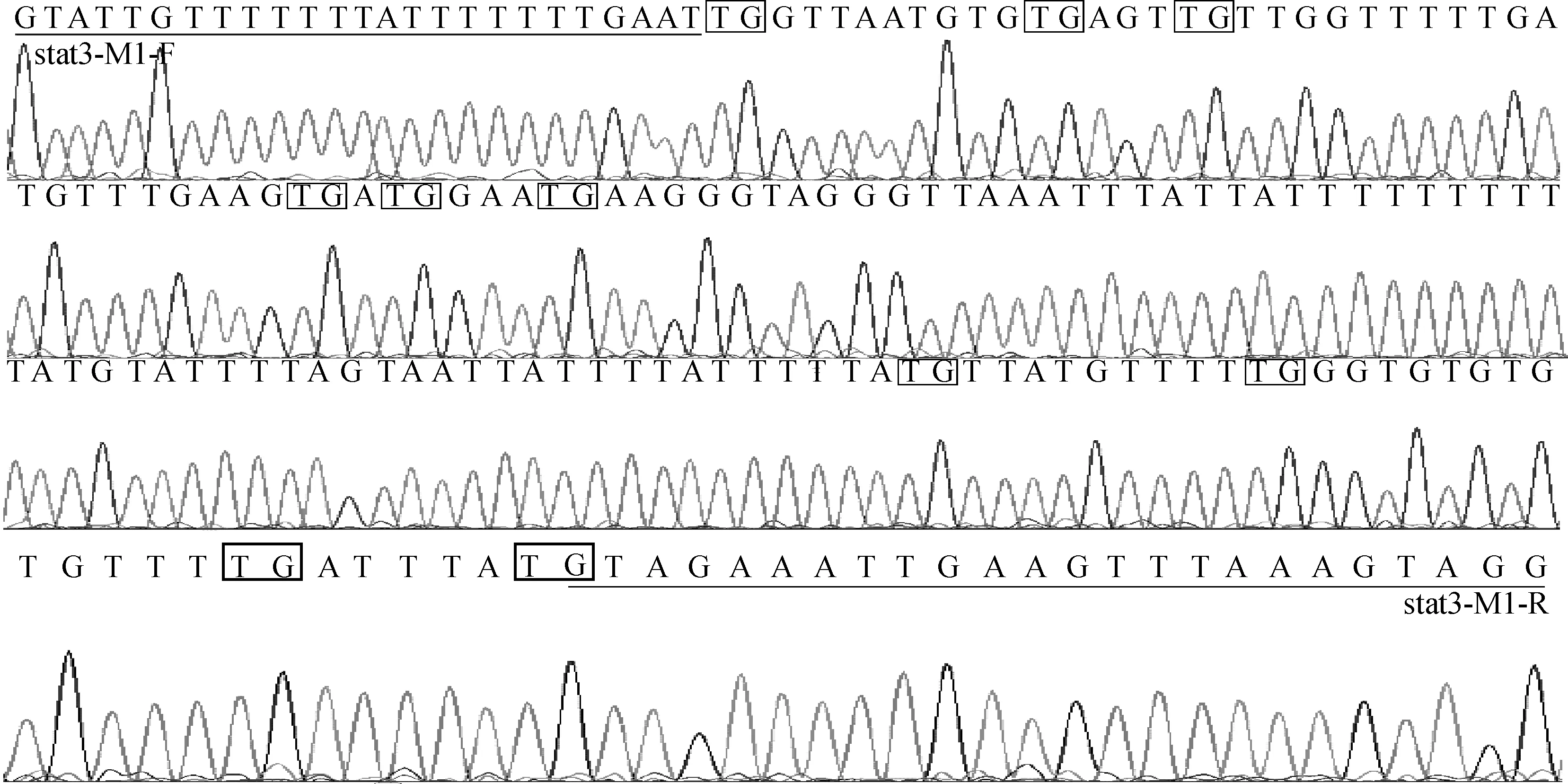
测序图中带框的字母CG或TG表示各CpG二核苷酸位点的位置;横线指示引物位置CG or TG represented the location of CpG dinucleotide in sequence map;the line indicated the location of primers图10 山羊STAT3基因的重亚硫酸盐处理后测序图Fig.10 The bisulfite sequencing results of goat STAT3 gene
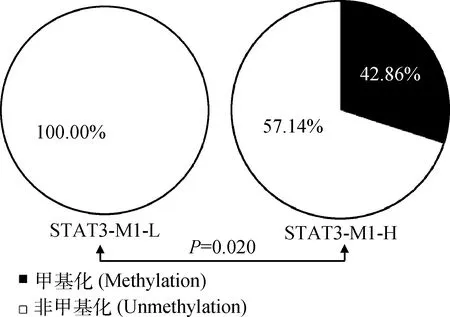
图11 不同体重组的山羊STAT3基因启动子区CpG岛整体甲基化率比较Fig.11 Overall methylation percentage in the CpG island of the STAT3 gene promoter region between the high body weight group and the low body weight group
总之,本研究成功克隆了山羊STAT3基因CDS序列,并发现该基因启动子区甲基化修饰显著影响山羊体重性状,可作为体重性状选择的有效表观遗传标记,这将有助于进一步解析山羊产肉调控的遗传与表观遗传机制,为未来山羊产业的发展提供科学资料。
参考文献(References):
[1]赵海谕,蓝贤勇,雷初朝,等.表观遗传学:家畜遗传育种的新挑战[J].家畜生态学报,2014,35(8):1-5.
ZHAOHY,LANXY,LEICZ,etal.Epigenetics:Newchallengesofbreedingandgeneticsinlivestock[J].Acta Ecologiae Animalis Domastici,2014,35(8):1-5.(inChinese)
[2]QINH,YEHWI,DESARNOP,etal.Signaltransducerandactivatoroftranscription-3/suppressorofcytokinesignaling-3(STAT3/SOCS3)axisinmyeloidcellsregulatesneuroinflammation[J].Proc Natl Acad Sci U S A,2012,109(13):5004-5009.
[3]ZHUANGS.RegulationofSTATsignalingbyacetylation[J].Cell Signal,2013,25(9):1924-1931.
[4]DEMARIAM,CAMPOREALEA,POLIV.STAT3andmetabolism:Howmanywaystouseasinglemolecule?[J].Int J Cancer,2014,135(9):1997-2003.
[5]SUBRAMANIAMA,SHANMUGAMMK,PERUMALE,etal.Potentialroleofsignaltransducerandactivatoroftranscription(STAT) 3signalingpathwayininflammation,survival,proliferationandinvasionofhepatocellularcarcinoma[J].Biochim Biophys Acta,2013,1835(1):46-60.[6]KAMRANMZ,PATILP,GUDERP.RoleofSTAT3incancermetastasisandtranslationaladvances[J].Biomed Res Int,2013,2013:421821.
[7]OHKUBON,SUZUKIY,AOTOM,etal.AccelerateddestructionoferythrocytesinTie2promoter-drivenSTAT3conditionalknockoutmice[J]. Life Sci,2013,93(9-11):380-387.
[8]RESEMANNHK,WATSONCJ,LLOYD-LEWISB.TheStat3paradox:Akillerandanoncogene[J].Mol Cell Endocrinol,2014,382(1):603-611.
[9]RICHARDAJ,STEPHENSJM.TheroleofJAK-STATsignalinginadiposetissuefunction[J].Biochim Biophys Acta,2013,1842(3):431-439.
[10]SCHÜBELERD.FunctionandinformationcontentofDNAmethylation[J].Nature,2015,517(7534):321-326.
[11]PANCY,JIAWC,WUXF,etal.DNAmethylationprofileofDNAmethyltransferase3b(Dnmt3b)anditsinfluenceongrowthtraitsingoat[J].JAPS,2013,23(2):380-387.
[12]赵海谕. 奶山羊PITX1、PITX2基因的遗传变异、mRNA表达及DNA甲基化修饰对泌乳性能的影响[D].杨凌:西北农林科技大学,2014.
ZHAOHY.Geneticvariation,mRNAexpressionandDNAmethylationmodificationofPITX1andPITX2genesandtheirinfluenceonmilkproductiontraitsindairygoats[D].Yangling:NorthwestA&FUniversity,2014.(inChinese)
[13]LANXY,CRETNEYEC,KROPPJ,etal.MaternaldietduringpregnancyinducesgeneexpressionandDNAmethylationchangesinfetaltissuesinsheep[J].Front Genet,2013,4:49.
[14]李盛杰,杜晓华,罗玉柱,等.天祝白牦牛NGB基因的克隆及生物信息学分析[J].畜牧兽医学报,2013,44(3):395-398.
LISJ,DUXH,LUOYZ,etal.CloningandbioinformaticsanalysisofNGBgeneofTianzhuwhiteyak[J].Acta Veterinaria et Zootechnica Sinica,2013,44(3):395-398.(inChinese)
[15]王萍,巨向红,雍艳红,等.猪SOCS3基因的克隆、生物信息分析及热应激条件下的表达[J].畜牧兽医学报,2014,45(7):1044-1052.
WANGP,JUXH,YONGYH,etal.CloningandbioinformaticsanalysisofporcineSOCS3cDNAanditsexpressionpatternduringheatstress[J].Acta Veterinaria et Zootechnica Sinica,2014,45(7):1044-1052.(inChinese)
[16]张春香,郭云雁,白元生,等.绵羊GPx5基因克隆、生物信息学分析及表达特性的研究[J].畜牧兽医学报,2014,45(7):1075-1083.
ZHANGCX,GUOYY,BAIYS,etal.Clone,bioinformaticsanalysisandexpressioncharacteristicsofovineGPx5[J].Acta Veterinaria et Zootechnica Sinica,2014,45(7):1075-1083.(inChinese)
[17]陈静,翟飞,夏明秀,等.鸡不同生精细胞中Piwil1基因启动子区DNA甲基化差异研究[J].畜牧兽医学报,2014,45(9):1404-1409.
CHENJ,ZHAIF,XIAMX,etal.DifferencesinDNAmethylationofthepromoterregionofPiwil1geneinchickenspermatogeniccells[J].Acta Veterinaria et Zootechnica Sinica,2014,45(9):1404-1409.(inChinese)
[18]李芳芳,戴建军,吴彩凤,等.WT1和FGF9基因在克隆猪隐睾中mRNA表达和DNA甲基化状态分析[J].畜牧兽医学报,2014,45(6):918-925.
LIFF,DAIJJ,WUCF,etal.mRNAexpressionandDNAmethylationstatusofWT1andFGF9geneincryptorchidismofclonedpig[J]. Acta Veterinaria et Zootechnica Sinica,2014,45(6):918-925.(inChinese)
[19]王梦楠,崔亚丽,吴国江,等.牛Ascl2基因印记及DNA甲基化状态分析[J].畜牧兽医学报,2014,45(12):1949-1956.
WANGMN,CUIYL,WUGJ,etal.GenomicimprintingandDNAmethylationstatusofAscl2geneincattle[J]. Acta Veterinaria et Zootechnica Sinica,2014,45(12):1949-1956.(inChinese)
[20]张文,王雅杰,薛春燕,等.STAT3基因在乳腺癌组织中的表达及意义[J].中国癌症杂志,2007,17(7):546-551.
ZHANGW,WNAGYJ,XUECY,etal.ExpressionofSTAT3geneinbreastcarcinomaanditsclinicalsignificance[J].China Oncology,2007,17(7):546-551.(inChinese)
[21]DAVEYHW,WILKINSRJ,WAXMANDJ.STAT5signalinginsexuallydimorphicgeneexpressionandgrowthpatterns[J].Am J Hum Genet,1999,65(4):959-965.
[22]WUX,JIAW,ZHANGJ,etal.DeterminationofthenovelgeneticvariantsofgoatSTAT5AgeneandtheireffectsonbodymeasurementtraitsintwoChinesenativebreeds[J].Small Rumin Res,2014,121(2-3):232-243.
[23]JIAW,WUX,LIX,etal.NovelgeneticvariantsassociatedwithmRNAexpressionofsignaltransducerandactivatoroftranscription3(STAT3)genesignificantlyaffectedgoatgrowthtraits[J].Small Rumin Res,2015,129:25-36.
[24]JONESPA.FunctionsofDNAmethylation:islands,startsites,genebodiesandbeyond[J].Nat Rev Genet,2012,13(7):484-492.
[25]KUDOS.Methyl-CpG-bindingproteinMeCP2repressesSp1-activatedtranscriptionofthehumanleukosialingenewhenthepromoterismethylated[J].Mol Cell Biol,1998,18(9):5492-5499.
[26]YANGJ,BAIWL,NIUPY,etal.AberranthypomethylatedSTAT3wasidentifiedasabiomarkerofchronicbenzenepoisoningthroughintegratingDNAmethylationandmRNAexpressiondata[J].Exp Mol Pathol,2014,96(3):346-353.
[27]KIME,KIMM,WOODH,etal.PhosphorylationofEZH2activatesSTAT3signalingviaSTAT3methylationandpromotestumorigenicityofglioblastomastem-likecells[J].Cancer Cell,2013,23(6):839-852.
(编辑郭云雁)
Molecular Cloning,Bioinformatics Analysis and Methylation Modification of GoatSTAT3 Gene
JIA Wen-chao1#,LIU Liang-liang2#,WU Xian-feng1,ZHAO Zhao-yan1,WANG Ke1,WANG Mao1,GAO Jing1,WANG Li-qiang1,CHEN Hong1,PAN Chuan-ying1,LAN Xian-yong1*
(1.ShaanxiKeyLaboratoryofMolecularBiologyforAgriculture,CollegeofAnimalScienceandTechnology/CollegeofLifeSciences,NorthwestA&FUniversity,Yangling712100,China;2.ComputerScienceandEngineeringSchoolofJust,JiangsuUniversityofScienceandTechnology,Zhenjiang212003,China)
Abstract:The aim of this study was to clone and analyze the entire coding sequence of goatSTAT3 gene as well as to detect theSTAT3 gene methylation modification and analyze its association with goat body weight using reverse transcription-polymerase chain reaction(RT-PCR),TA cloning,bioinformatics and bisulfite sequencing(BSP) methods.The results showed that the entire coding sequence of goatSTAT3 gene was 2 313 bp in length,and encoded 770 amino acids.The shared amino acid sequence consistency between goat(caprahircus) and sheep(Ovisaries),bovine(BosTaurus),boar(Susscrofa),mouse(Musmusculus),rat(Rattusnorvegicus),human(Homosapiens) were 99.7%,99.6%,99.4%,99.2%,99.4%,99.5%,respectively.The analysis of the methylation difference in the promoter region of goatSTAT3 gene between high body weight group and low body weight group demonstrated that the goats with high body weight had higher methylation level than those goats with low body weight(P=0.020).This finding indicated that the methylation modification ofSTAT3 gene had significant effect on body weight in goat,which could become the epigenetic marker in marker-assisted selection(MAS).These results would provide scientific data for studying genetic and epigenetic mechanism for meat production in goat.
Key words:goat;STAT3 gene;molecular cloning;sequence analysis;DNA methylation
doi:10.11843/j.issn.0366-6964.2016.03.006
收稿日期:2015-03-30
基金项目:国家自然科学基金(31172184);陕西省留学人员科技活动择优资助项目(2014-14);西北农林科技大学大学生创新性实验计划(2013)
作者简介:贾文超(1990-),男,土族,青海门源人,硕士生,主要从事动物遗传学研究,E-mail:jiawenchaozyq@163.com;刘亮亮(1979-),男,江西萍乡人,博士,讲师,主要从事计算机软件与信息分析,E-mail:lingyun79626@126.com。贾文超和刘亮亮为并列第一作者 *通信作者:蓝贤勇,博士,副教授,硕士生导师,主要从事动物遗传育种与表观遗传修饰研究,E-mail:lanxianyong79@nwsuaf.edu.cn
中图分类号:S827;S813.3
文献标志码:A
文章编号:0366-6964(2016)03-0457-10

