鸡传染性支气管炎病毒S1蛋白MHCⅠ分子限制性T细胞表位的鉴定
朱凤珠,鲁 梅,黄庆华,杨少华,黄艳艳,吴家强,谭刘刚,张秀美,崔言顺,许传田*
(1.山东省农业科学院畜牧兽医研究所,山东省畜禽疫病防治与繁育重点实验室,济南 250100;2.山东农业大学动物科技学院,泰安 271018;3.山东潍坊工程职业学院,青州 262500)
鸡传染性支气管炎病毒S1蛋白MHCⅠ分子限制性T细胞表位的鉴定
朱凤珠1,2,鲁梅3,黄庆华1,杨少华1,黄艳艳1,吴家强1,谭刘刚2,张秀美1,崔言顺2,许传田1*
(1.山东省农业科学院畜牧兽医研究所,山东省畜禽疫病防治与繁育重点实验室,济南 250100;2.山东农业大学动物科技学院,泰安 271018;3.山东潍坊工程职业学院,青州 262500)
摘要:利用生物结构技术预测传染性支气管炎S1蛋白的1条细胞毒性T淋巴细胞(CTL)表位,并合成相应的候选多肽(Sp6)。为了确定S1蛋白中确实存在该T细胞表位,并鉴定这条T细胞表位的正确性,构建了含有S1基因的重组质粒pCAGGS-S1,通过间接免疫荧光和Western blot确定该重组质粒可以在真核细胞表达后,将该重组质粒免疫SPF鸡,间接ELISA检测血清中的抗体。采集免疫鸡的脾淋巴细胞并用合成的候选多肽刺激,通过实时荧光定量PCR检测脾淋巴细胞中IFN-γ的分泌量以及流式细胞术检测CD8+T淋巴细胞的增殖情况,初步确定该候选肽的正确性。间接免疫荧光、Western blot和间接ELISA试验结果表明,S1蛋白能够在293T细胞中获得表达并能够引起机体的体液免疫,说明S1蛋白具有反应原性,为进一步验证T细胞表位打下了基础;荧光定量PCR结果显示Sp6刺激后的鸡的脾淋巴细胞中IFN-γ的分泌量明显增加;流式细胞检测发现经Sp6和不相关多肽NP89-97刺激后及空白对照,CD8+T淋巴细胞增殖分别为34.8%、2.6%、0。以上结果表明,多肽Sp6能在体外诱导活化的鸡淋巴细胞产生细胞毒性T淋巴细胞反应,是IBV S1的CTL表位。该研究结果对传染性支气管炎病毒免疫机制和通用疫苗研究具有借鉴意义。此次研究结果表明多肽Sp6能在体外诱导活化的鸡淋巴细胞产生CTL,是IBV S1的CTL表位。该研究结果对传染性支气管炎病毒免疫机制和通用疫苗研究具有借鉴意义。
关键词:禽传染性支气管炎病毒;S1蛋白;CTL表位
传染性支气管炎病毒(IBV)是威胁养禽行业的主要病原之一,各日龄的鸡均易感[1]。虽然用活疫苗或灭活疫苗能在一定程度上预防传染性支气管炎的发生,但由于变异株的不断出现,传染性支气管炎仍然呈经常流行性暴发,给养殖行业造成了巨大的经济损失。多重疫苗的频繁使用等因素使IBV在复制过程中容易出现缺失、插入、突变或重组,进而导致IBV不断产生变异,新的血清型和基因型不断出现[2]。而IB疫苗在不同血清型之间仅提供很小或不能提供有效的交叉保护作用[3]。IBV表现出的广泛的组织嗜性和高度的遗传变异性大大增加了对该病的预防难度[4]。因此,研制更加高效、安全、完善的IB疫苗已成为禽病科研的重点和难点。
通用疫苗的研发基于重组蛋白质、病毒样颗粒、病毒载体、DNA疫苗等技术[5]。表位疫苗是近年来发展起来的新型疫苗,其免疫效力在动物试验中得到验证,表位疫苗主要选取保护性抗原基因中决定抗原特异性的簇团。S1基因是IBV的免疫原基因,可诱导产生血凝抑制和中和抗体,还能诱导鸡的特异性细胞毒性T淋巴细胞反应。周继勇等研究表明,用转基因植物表达的IBV S1蛋白免疫后,雏鸡可以对致病性IBV产生血清中和抗体,其脾可在体外分泌IL-2并发生T淋巴细胞增殖反应[6]。通过迟发型超敏反应(delayed typehyper sensitivity,DTH)研究进一步发现,S1蛋白的亚单位免疫可诱导产生强烈的DTH反应,这充分证实了细胞介导免疫在IBV感染后的免疫保护中起着重要作用[7-8]。作为细胞介导免疫的重要一步,细胞毒性T淋巴细胞通过识别主要组织相容性抗原(MHC)Ⅰ类分子结合抗原来识别并杀伤靶细胞[9]。
作者前期研究表明,免疫过活疫苗的SPF鸡,在免疫后2周用IBV强毒攻毒,没有鸡死亡,但是攻毒前没有检测IBV中和抗体,到了免疫后第三周才检测到IBV中和抗体。因此推测,在免疫的前期,主要是细胞免疫在发挥作用。为了证明这一点,需要确认在IBV 的S1蛋白中,确实有CTL 能识别的 MHC-Ⅰ结合表位肽存在。因此,作者通过生物结构学技术预测了IBV S1蛋白的1个潜在的 T 细胞表位多肽Sp6,用表达S1基因的重组质粒免疫SPF鸡,之后采集免疫鸡的脾淋巴细胞并用合成的候选肽刺激,利用流式细胞术和SYBR Green Ⅰ Real-Time PCR方法检测脾CD8+T淋巴细胞增殖以及分泌IFN-γ的含量等指标来验证候选肽的正确性,为研制具有免疫保护的通用疫苗奠定基础。
1材料与方法
1.1病毒株及鸡胚
分离株327毒株,是本实验室在2008年从山东肉鸡上分离的一株可以引起肾病变的IBV毒株。SPF鸡胚和SPF鸡购自山东省农业科学院家禽研究所SPF鸡研究中心。
1.2引物、菌种、质粒、细胞、多肽和主要试剂
引物参考GenBank中IB全基因组序列,设计了用于扩增S1基因的特异性引物(上游引物:5′-GGAATTCGCCACCATGTTGGGGAAGTCACT-G-3′;下游引物:5′-CCGCTCGAGTCAACGCCTGCGACGATGTGA-3′),由生工生物工程(上海)股份有限公司合成;DH5α、限制性内切酶EcoRⅠ和XhoⅠ均购自宝生物工程(大连)有限公司;真核表达质粒pCAGGS购自优宝生物;293T细胞由本实验室保存;Trizol Reagent RNA 抽提试剂、One-Step RT-PCR试剂盒和DNA Marker DL 2000均购自山东赛恩斯科技有限公司。IB阳性血清(鸡源)由本实验室制备;FITC标记的兔抗鸡抗体(FITC-IgG)、HRP标记的兔抗鸡抗体(IgG-HRP)、封闭抗体mouse-IgG、羧甲基荧光素乙酰乙酸(CFSE)均购自Sigma公司;LipofectamineTM3000购自Invitrogen公司;Sp6多肽(NQFYIKLT)及不相关多肽NP89-97(PKKTGGPIY)由上海生工合成。鸡脏器淋巴细胞分离液KIT购自TBD(LTS1090CP);Mouse Anti-Chicken CD8-PE 购自SouthernBiotech。荧光定量仪器Light Cycler 480Ⅱ(Roche)、雷杜酶标分析仪Rayto RT-6100(深圳雷杜生命科学有限公司);流式细胞仪BD FACSDiva 7.0(购自BD公司)。
1.3pCAGGS-S1的构建
将IB分离株327接种9~11日龄SPF鸡胚,37 ℃温箱培养72 h(弃去24 h内死亡的鸡胚),无菌收集尿囊液,离心,按Trizol试剂说明书提取病毒基因组RNA。反转录获得cDNA,PCR程序为:95 ℃4 min;94 ℃30 s;52 ℃30 s;72 ℃1 min 30 s;72 ℃10 min;30个循环。回收PCR扩增的S1基因,回收产物经限制性内切酶EcoRⅠ和XhoⅠ双酶切处理后与pCAGGS载体连接,转化大肠杆菌DH5α感受态细胞,经菌液PCR初步鉴定后,由生工生物工程(上海)股份有限公司测序,并将测序正确的重组质粒命名为pCAGGS-S1。
1.4间接免疫荧光检测pCAGGS-S1蛋白瞬时表达
待293T细胞长至70%~90%时转染pCAGGS-S1,转染前准备好爬片,转染前12 h进行铺板。转染48 h后,吸掉细胞上清,加入等体积的PBST洗3次,每次5 min。加入500 μL 4%多聚甲醛固定15 min,PBST洗3次,每次5 min。加入通透剂0.2%TritonX-100,10~15 min,PBST洗3次,每次5 min。加入稀释后的一抗(传支阳性血清),室温作用1 h,PBST洗3次,每次5 min。加入稀释后的二抗(FITC标记的兔抗鸡抗体),室温避光作用1 h,PBST洗3次,每次5 min。加入3~5 μL指甲油进行封片,静止5 min,用倒置荧光显微镜,在495 nm 下,观察荧光。
1.5Western blot 检测pCAGGS-S1蛋白瞬时表达
收集转染48 h后的293T细胞,加入细胞裂解液后,进行SDS-PAGE,并电转至NC膜。将NC膜置于5%脱脂奶粉封闭液,4 ℃过夜,TBST洗3次,每次10 min。加入5%脱脂奶粉300倍稀释的传支阳性血清作为一抗,室温孵育2 h,TBST洗3次,每次10 min。加入5%脱脂奶粉8 000倍稀释的羊抗鸡IgG-HRP二抗,室温孵育2 h,TBST洗3次,每次10 min。DAB显色,观察条带。
1.6 重组质粒免疫后血清中S1抗体的检测
24只3周龄SPF鸡平均分成两组:A组,免疫重组质粒pCAGGS-S1;B组作为对照,免疫空载体。免疫剂量为100 μg·只-1[10];免疫途径为腿部多点肌肉注射;免疫后21 d以相同的剂量和方式加强免疫一次。所有试验鸡于免疫后7、14、21 d采血,分离血清,-20 ℃保存备用。
将原核表达的S1蛋白以不同浓度包被ELISA板,对IBV阳性血清及阴性血清也以不同的稀释倍数进行ELISA试验。最终确定S1蛋白的最佳包被浓度为4.2 μg·mL-1,血清的最佳稀释倍数为1∶120。结果判定标准:OD450 nm值< 0.43为阴性血清,P/N≥2.1为阳性血清。采用SD方差对所得数据进行分析。
1.7候选肽的鉴定
1.7.1CD8+T淋巴细胞的增殖试验加强免疫两周后的SPF鸡,无菌取出脾,置于平皿中,用Hanks洗涤三次,加入2 mL RPMI-1640培养液。粗剪成小块,用无菌的注射器芯管轻轻碾碎,200目筛网过滤到25 mL试管内。1 000 r·min-1,3 min,弃上清,再用Hanks清洗3次,每次800 r·min-1离心3 min。将细胞悬于含10%胎牛血清的1640培养液中。取细胞悬液,小心加入到等体积的细胞分离液面上。收集淋巴细胞层放入含细胞洗涤液的试管中,充分混匀后,1 200 r·min-1,20 min,弃上清留沉淀。将细胞重新悬,重复洗涤2次即得淋巴细胞。取9 μL重悬细胞液,加入1 μL的0.4%台盼蓝染色液,染色3~5 min,计数活细胞后,用RPMI-1640完全培养液调整细胞浓度为1×106·mL-1。将接种于24孔板,每孔1 mL,分别加入Sp6合成肽刺激物及不相关多肽NP89-97,终质量浓度为100 μg·mL-1。同时设置正常的脾淋巴细胞为空白对照组。37 ℃,5% CO2,培养3 d。取出培养3 d后的脾淋巴细胞,将1×106的细胞放入1.5 mL的EP管中,3 000 r·min-1,5 min,弃上清,加入100 μL PBS悬浮细胞。加入封闭抗体mouse-IgG(1×106·μL-1),室温15 min。加入荧光抗体Mouse Anti-Chicken CD8-PE(0.2 μg·106cell-1),4 ℃,避光,30 min。加入350 μL PBS轻轻混匀,3 000 r·min-1,5 min,弃上清。重复洗涤两次,最后将细胞重悬于500 μL PBS中,用流式细胞仪进行检测。1.7.2不同多肽体外刺激后,荧光定量PCR检测IFN-γ基因转录量将淋巴单细胞悬液加入合成多肽刺激物和不相关多肽,终质量浓度为100 μg·mL-1。37 ℃,5% CO2培养48 h。收集培养48 h后的细胞,按照Trizol试剂说明书提取细胞的总RNA。
模板cDNA的合成和PCR扩增:以提取的总RNA为模板,用One-Step RT-PCR试剂盒反转录获得cDNA。实验室已建立好的IFN-γ的标准曲线为:y=-3.223x+35.97(图1),以cDNA为模板对样品进行实时荧光定量PCR检测。总反应体系20 μL:cDNA模板1 μL、SYBR Premix Ex TaqTM10 μL、上下游引物(10 μmol·L-1)各0.5 μL、去离子水8 μL,混匀后在荧光PCR仪上进行扩增。反应条件:95 ℃预变性2 min;95 ℃10 s;55 ℃15 s; 72 ℃15 s;扩增45个循环;72 ℃延伸时采集荧光信号。以鸡β-actin基因作为内参基因校正试验误差。每种细胞中IFN-γ基因 mRNA的精确拷贝数由荧光曲线的Ct值和标准曲线计算获得。IFN-γ基因mRNA表达水平为IFN-γ基因总拷贝/β-actin基因总拷贝。根据公式计算出每个样本的归一化值,归一化值=目的基因浓度/内参基因浓度。利用公式:
计算待测组目的基因相对于对照组的表达差异倍数。然后分别统计待测组和对照组所有样本归一化值的算术平均数及标准偏差(s)。
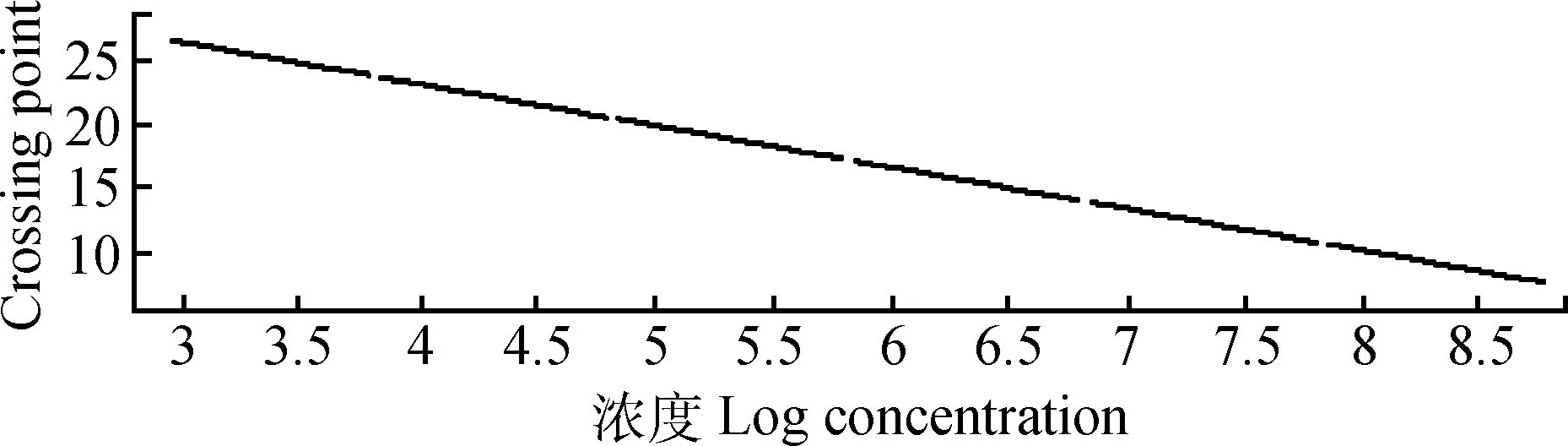
图1 IFN-γ基因标准曲线Fig.1 The standard curve of IFN-γ gene
2结果
2.1重组质粒pCAGGS-S1的构建及鉴定
重组质粒pCAGGS-S1经菌液PCR鉴定,扩增条带与预期大小一致(图2-A),测序鉴定,S1基因已插入载体pCAGGS中。用限制性内切酶XhoⅠ和EcoRⅠ双酶切pCAGGS-S1后得到约1 700和4 800 bp的两个片段,与预期结果相符(图2-B)。两者均表明重组质粒构建成功。
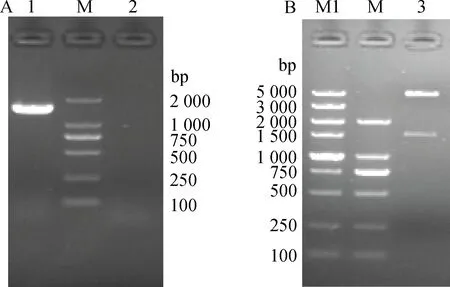
1.pCAGGS-S1 PCR产物电泳;2.阴性对照;3.pCAGGS-S1双酶切电泳;M.DL2000 DNA相对分子质量标准;M1.DL5000 DNA相对分子质量标准1.The amplification products of pCAGGS-S1;2.The negative control;3.The double digestion identification of the pCAGGS-S1; M.DL2000 DNA marker;M1.DL5000 DNA marker图2 重组质粒pCAGGS-S1的PCR和酶切鉴定Fig.2 PCR and double digestion identification of the recombinant plasmid pCAGGS-S1
2.2间接免疫荧光和Western blot检测S1蛋白的瞬时表达
2.2.1间接免疫荧光鉴定S1蛋白的瞬时表达重组质粒pCAGGS-S1转染293T细胞48 h,在荧光显微镜下出现较强的绿色荧光(图3A),而转染空质粒的细胞未出现荧光信号(图3B)。该试验结果表明:重组质粒pCAGGS-S1在真核细胞中能够得到正确的表达。
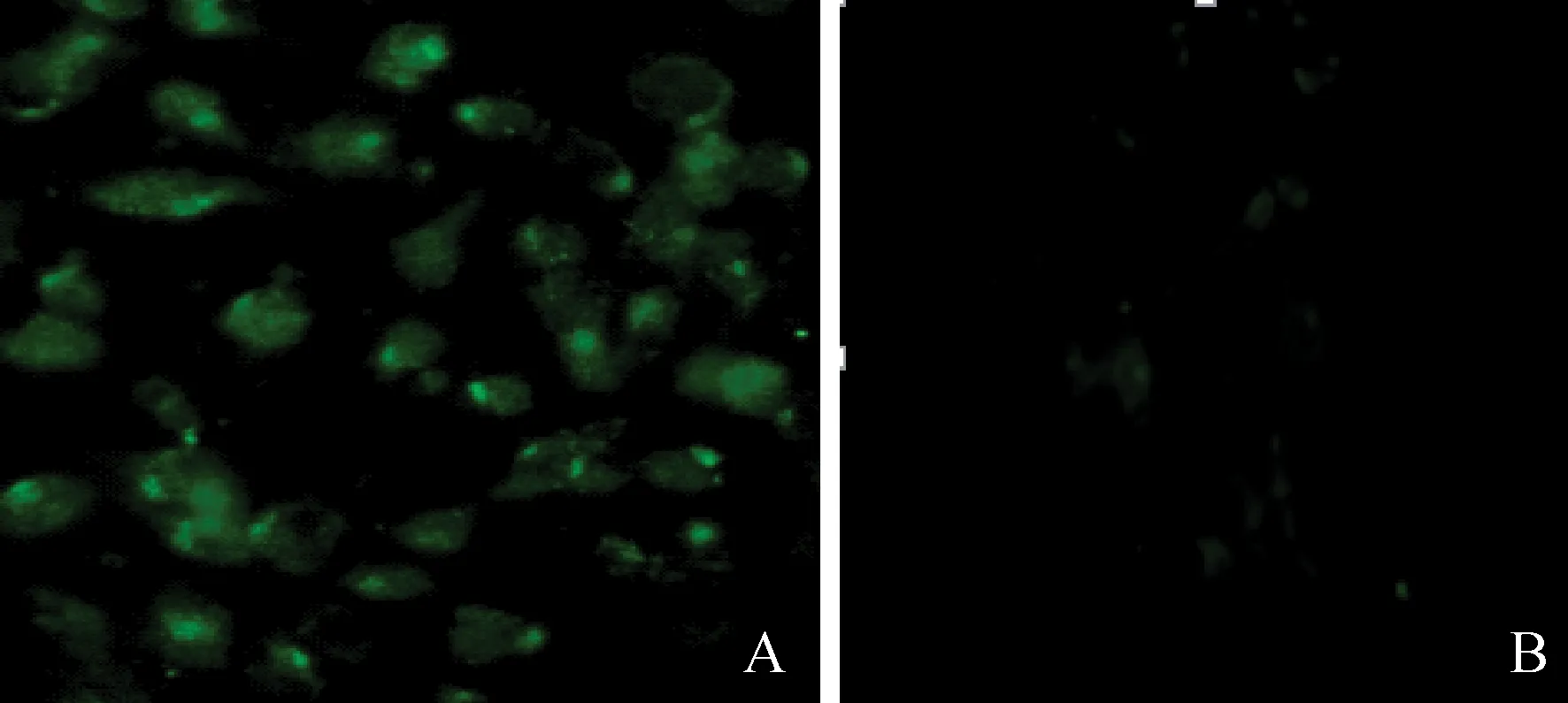
A.重组质粒转染293T细胞;B.空质粒转染293T细胞A.Recombinant plasmid pCAGGS-S1 transfect in 293T cells;B.pCAGGS transfect in 293T cells图3 间接免疫荧光检测pCAGGS-S1的瞬时表达(400×)Fig.3 Transient expression of recombinant plasmid pCAGGS-S1(400×)
2.2.2Western blot鉴定S1蛋白的瞬时表达转染pCAGGS-S1的293T细胞样品在90 ku出现明显一条带,与预期大小一致,而空载体和没有转染的293T细胞样品没有出现任何条带,这表明pCAGGS-S1在真核细胞中获得表达,并且具有良好免疫原性(图4)。
2.3免疫鸡血清中S1抗体的检测
试验结果表明,首次免疫pCAGGS-S1后,第一周鸡血清S1抗体几乎检测不到,第二周和第三周抗体滴度变化不明显,第三周加强免疫后1周,S1抗体OD值上升趋势尤为明显,在二免3周后S1抗体OD值达到最大(图5)。这说明,重组质粒pCAGGS-S1在鸡体内获得了表达,并且成功诱导鸡体产生体液免疫反应。2.3.1CD8+T淋巴细胞的增殖试验用Mouse Anti-Chicken CD8-PE对淋巴细胞标记,经流式细胞仪分群计数:发现经多肽Sp6刺激后 CD8+T细胞有34.8%的增殖,不相关多肽NP89-97刺激的CD8+T细胞略有增殖(2.6%),空白对照CD8+T细胞增殖为0(图6)。这表明肽Sp6能有效刺激活化CD8+T淋巴细胞增殖。
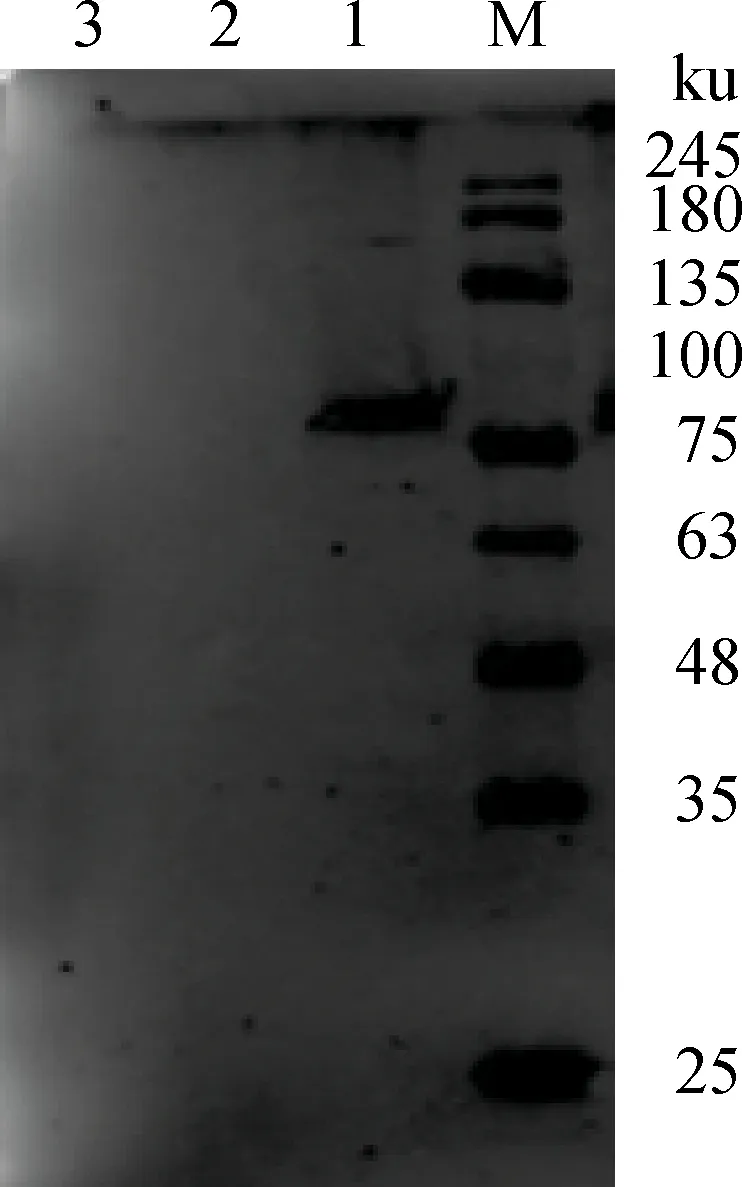
M.蛋白质相对分子质量标准;1.pCAGGS-S1转染293T细胞;2.pCAGGS转染293T细胞;3.正常293T细胞M.Protein marker;1.pCAGGS-S1 transfect in 293T cells;2.pCAGGS transfect in 293T;3.The normal 293T cells图4 Western blot鉴定S1蛋白的瞬时表达Fig.4 The detection of the expressed S1 protein by Western blot
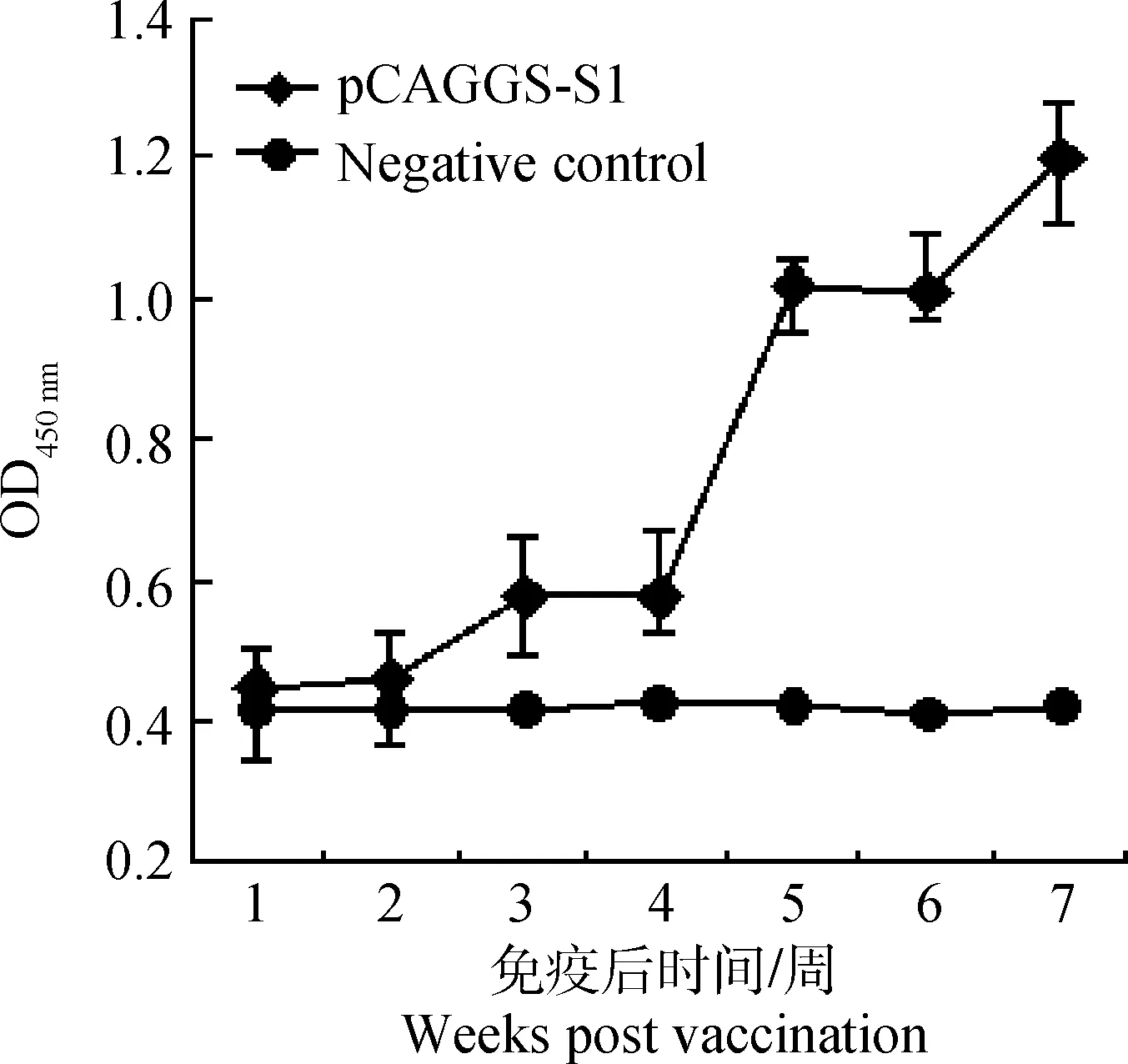
误差线采用sError bars was made by s图5 血清中S1抗体的变化水平Fig.5 The change of the S1 antibody level in immunized chickens
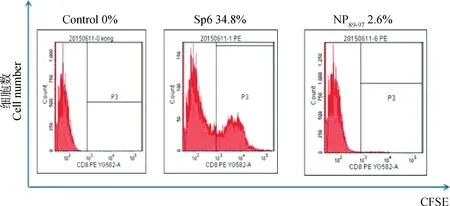
图6 不同肽刺激后CD8+T细胞增殖流式检测结果Fig.6 CD8+T cell proliferation after stimulation
2.3.2不同肽刺激后,脾淋巴细胞IFN-γ基因表达量的检测经多肽刺激后,Sp6刺激脾淋巴细胞的IFN-γ基因mRNA拷贝数明显高于对照组脾淋巴细胞(P≤0.05)(图7A)。除去试验本身误差,将拷贝数做归一化处理后,Sp6刺激的脾淋巴细胞产生的IFN-γ归一化值最高为0.035,其IFN-γ基因归一化值明显高于空白对照组脾淋巴细胞0.002 8,NP89-97组淋巴细胞IFN-γ基因归一化值为0.005(P≤0.05),Sp6刺激的脾淋巴细胞产生的IFN-γ基因归一化值差异不显著(P≥0.05)(图7B)。结果表明,Sp6能够刺激鸡脾淋巴细胞IFN-γ分泌,引起机体细胞毒性T淋巴细胞反应,为潜在的T细胞表位候选多肽。
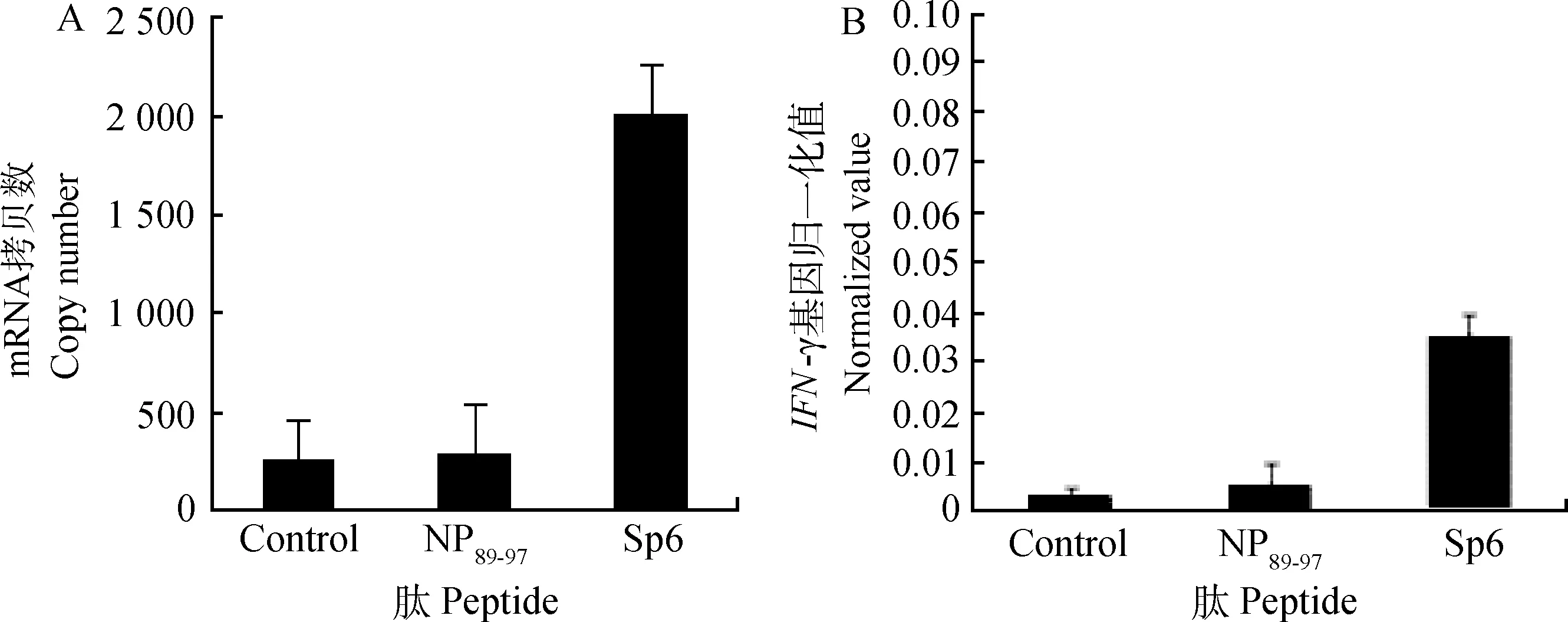
误差线采用sError bars was made by s图7 IFN-γ基因拷贝数和归一化值Fig.7 The copy number and the normalized value of IFN-γ gene
3讨论
S蛋白是构成冠状病毒最表层纤突的主要成分,由等摩尔分子的S1和S2构成,IBV的主要T细胞表位位于S1上。IBV血清型众多,S1是IBV变异程度最大的基因,不同毒株S1基因核苷酸变化幅度可高达50%以上,在同一血清毒株的S1基因中有25%~50%的氨基酸差异[11]。这些差异导致各毒株之间交叉保护性弱,本试验筛选S1蛋白的功能表位,为研制具有免疫保护的通用疫苗奠定基础。
S1基因经骨骼肌内源性表达后主要通过MHCⅠ类分子提呈抗原,特别有利于CD8+细胞毒性T淋巴细胞的激活,对IBV免疫保护具有重要意义[12]。细胞免疫的重要组成部分为CTL表位,而T细胞表位具有MHC限制性[13]。MHCⅠ类分子可以识别具有特定motif的8肽或者9肽,在识别的过程中,沟槽底部的某些氨基酸与表位肽中的某些氨基酸相互作用,从而达到特异性识别的效果。
作者人工合成1条多肽片段,利用IBV毒株的S1真核质粒免疫SPF鸡,确定了针对该毒株的通用S1蛋白T细胞优势表位,该多肽能够刺激IFN-γ高水平的分泌,且重复性好,可作为优势候选表位。
禽类细胞因子的检测技术发展滞慢,源于相应试剂的匮乏,现有检测T细胞表位的方法包括:淋巴细胞增殖试验,该方法只能反应整体细胞的增殖状态,不能从单细胞水平进行鉴定;体外抗原提呈试验:这种方法通过表位肽刺激未成熟DC细胞系,根据其能否提呈抗原表位给T细胞杂交瘤来鉴定T细胞抗原表位,由于特定细胞系的要求,使其具有一定的局限性;MTT还原法:这种检测方法操作简便,但存在微生物污染,假阳性结果居高;流式细胞分选法以及ELI spot检测方法。
作者选用了流式细胞术检测方法,它是一种在功能水平上对单细胞进行定量分析和分选的检测手段,具有速度快、精度高、准确性好等优点,成为当代最先进的细胞定量分析技术。流式细胞术能够快速测定单个细胞的生物学性质,并把特定的细胞或细胞器从群体中加以分类收集。该方法可以准确地把CD8+T细胞从淋巴细胞群中分离出来,并且可以检测其增殖情况,为试验的顺利进行提供保障。本试验采用实时荧光定量 PCR 技术检测IFN-γ的分泌情况,该方法是指在 PCR 反应体系中加入荧光基团,利用荧光信号积累实施实时监测整个PCR进程并对模板进行定量分析的方法,是目前检测基因表达的最准确、灵敏、有力的方法之一,已被应用于各种样品中基因mRNA水平的检测[14-16]。
淋巴细胞增殖试验和鸡IFN-γ检测结果显示:多肽Sp6刺激活化T细胞后,CD8+T细胞增殖34.8%,并且鸡IFN-γ的分泌量也明显增加,表明多肽Sp6能够诱导CTL反应,是IBV S1中的T细胞表位。
本研究使用的SPF鸡是来航鸡,而该鸡种是B15单倍型,即它只含有一种MHCⅠ类分子,因此可以以表位肽与B15 MHCⅠ类分子的相互作用结果来解释实验现象。这为利用分子建模和分子力学技术在S1蛋白中筛选潜在表位肽提供了基础。
本试验用含有全长IBVS1基因的重组质粒pCAGGS-S1免疫SPF鸡,在血清中检测到了S1的特异性抗体,表明pCAGGS-S1可以诱导机体体液免疫反应。经多肽Sp6刺激的脾淋巴细胞分泌的IFN-γ最多,而且实时荧光定量PCR证明Sp6刺激脾淋巴细胞生成的表达IFN-γ的mRNA拷贝数最高。流式细胞检测发现经Sp6、不相关多肽NP89-97刺激后及空白对照,CD8+T淋巴细胞增殖分别为34.8%、2.6%、0。以上结果表明Sp6能够诱导CTL反应,可能是 IBV S1蛋白的CTL表位。该研究结果初步确定了该多肽为IBV S1蛋白功能性T细胞抗原表位,为后续研制IBV通用表位疫苗奠定基础。
参考文献(References):
[1]BIJLENGA G,COOK J K,GELB J JR,et al.Development and use of the H strain of avian infectious bronchitis virus from the Netherlands as a vaccine:a review[J].AvianPathol,2004,33(6):550-557.
[2]LIU S W,KONG X G.A new genotype of nephropathogenic infectious bronchitis virus circulating in vaccinated and non-vaccinated flocks in China[J].AvianPathol,2004,33(3): 321-327.
[3]BONNEFOY L,BOUQUET J F,PICAULT J P,et al.Characterization of IBV variant strain PL 84084 isolated in France[J].AdvExpMedBiol,1993,342:395-397.
[4]CASAIS R,DOVE B,CAVANAGH D,et al.Recombinant avian infectious bronchitis virus expressing a heterologous spike gene demonstrates that the spike protein is a determinant of cell tropism[J].JVirol,2003,77(16):9084-9089.
[5]LAMBERT L C,FAUCI A S.Influenza vaccines for the future[J].NEnglJMed,2010,363(21):2036-2044.
[6]ZHOU J Y,CHENG L Q,ZHENG X J,et al.Generation of the transgenic potato expressing full-length spike protein of infectious bronchitis virus[J].JBiotechnol,2004,111(2):121-130.
[7]CHEN B Y,ITAKURA C.Cytopathology of chick renal epithelial cells experimentally infected with avian infectious bronchitis virus[J].AvianPathol,1996,25(4):675-690.
[8]田占成,孙永科,王云峰,等.表达鸡传染性支气管炎病毒S1基因重组鸡痘病毒对SPF鸡的免疫保护作用[J].畜牧兽医学报,2006,37(6):580-586.
TIAN Z C,SUN Y K,WANG Y F,et al.The immunological efficacies of recombinant fowlpox virus expressing the S1 gene of LX4 strain of infections bronchitis virus in specific pathogen free(SPF) chickens[J].ActaVeterinariaetZootechnicaSinica,2006,37(6):580-586.(in Chinese)
[9]CORR M,SLANETZ A E,BOYD L F,et al.T cell receptor-MHC class I peptide interactions:affinity,kinetics,and specificity[J].Sciences,1994,265(5174):946-949.
[10]侯艳霞,郭莹莹,沈楠,等.一株H5亚型禽流感病毒NP蛋白两个鸡MHC分子限制性T细胞表位的鉴定[J].中国预防兽医学报,2011,33(6):457-460.
HOU Y X,GUO Y Y,SHEN N,et al.Identification of two T cell epitopes of nucleoprotein from an H5 avian influenza virus in chickens[J].ChineseJournalofPreventiveVeterinaryMedicine,2011,33(6):457-460.(in Chinese)
[11]KUO S M,KAO H W,HOU M H,et al.Evolution of infectious bronchitis virus in Taiwan:Positively selected sites in the nucleocapsid protein and their effects on RNA-binding activity[J].VetMicrobiol,2013,162(2-4):408-418.
[12]IGNJATOVIC J,SAPATS S.Identification of previously unknown antigenic epitopes on the S and N proteins of avian infectious bronchitis virus[J].ArchVirol,2005,150(9):1813-1831.
[13]CORR M,SLANETZ A E,BOYD L F,et al.T cell receptor-MHC class I peptide interactions:affinity,kinetics,and specificity[J].Science,1994,265(5174):946-949.
[14]BUDHIA S,HARING L F,McCONNELL I,et al.Quantitation of ovine cytokine mRNA by real-time RT-PCR[J].JImmunolMethods,2006,309(1-2):160-172.
[15]SINGH R,RECINOS R F,AGRESTI M,et al.Real-time reverse transcriptase polymerase chain reaction:an improvement in detecting mRNA levels in mouse cranial tissue[J].PlastReconstrSurg,2006,117(7):2227-2234.
[16]SMITH R A,LEA R A,WEINSTEIN S R,et al.Detection of mRNA levels for the estrogen alpha,estrogen beta and androgen nuclear receptor genes in archival breast cancer tissue[J].CancerLett,2006,237(2):248-255.
(编辑白永平)
Identification of the MHC Class Ⅰ-restricted Cytotoxic T Cell Epitope in Avian Infectious Bronchitis Virus S1 Protein
ZHU Feng-zhu1,2,LU Mei3,HUANG Qing-hua1,YANG Shao-hua1,HUANG Yan-yan1,WU Jia-qiang1,TAN Liu-gang2,ZHANG Xiu-mei1,CUI Yan-shun2,XU Chuan-tian1*
(1.InstituteofAnimalScienceandVeterinaryMedicine,ShandongAcademyofAgriculturalSciences,ShandongKeyLabofAnimalDiseaseControlandBreeding,Jinan250100,China;2.CollegeofAnimalScience,ShandongAgriculturalUniversity,Tai’an271018,China;3.WeifangEngineeringVocationalCollege,Qingzhou262500,China)
Abstract:A T cell epitope candidate peptide Sp6 of the avian infectious bronchitis virus S1 was predicted with biological structures technology.To identify this peptide exist in S1 protein and verify validity of Sp6,the recombinant plasmid pCAGGS-S1 was constructed.While it can be expressed in eukaryotic cells after determined by indirect immunofluorescence and Western blot,using the recombinant plasmid immune SPF chickens,and the antibodies against S1 were detected by ELISA.Splenic cells were collected from inoculated chickens and stimulated with the peptides Sp6,NP89-97(PKKTGGPIY) and negative control.By SBRY Green qPCR detecting IFN-γ production of spleen lymphocytes and flow cytometry detecting the multiplication of CD8+T lymphocytes,preliminarily make sure that the candidate peptide is correct.The IFA /Western blot and ELISA results showed that the expression of S1 was confirmed in 293T and can induced the humoral immune,indicate that S1 protein is reaction to the original and lied a foundation for further validation of T cell epitope;the results of SBRY Green qPCR showed that spleen lymphocytes of chickens stimulated with the peptide Sp6 secreted significantly-increased IFN-γ.Flow cytometry assay results showed that the CD8+T lymphocytes were proliferated by 34.8%,2.6%,and 0,respectively,which indicated that the peptide Sp6 was a T cell epitope of IBV S1 and it can induce activation of chicken lymphocytes to produce cytotoxic T lymphocyte (CTL) reactioninvivo.All above results indicate that the peptide Sp6 was a T cell epitope of IBV S1 and it can induce activation of chicken lymphocytes to produce CTL reactioninvivo.The results possesses significance to mechanism of protective immunity against avian infectious bronchitis virus and the research towards universal IBV vaccine.
Key words:avian infectious bronchitis virus;S1 glycoprotein;CTL epitope
doi:10.11843/j.issn.0366-6964.2016.03.019
收稿日期:2015-08-06
基金项目:现代农业产业技术体系(CARS-42-Z12);公益性行业(农业)科研专项(201303033);十二五国家科技支撑计划(2015BAD12B03)
作者简介:朱凤珠(1988-),女,山东菏泽人,硕士生,主要从事动物传染病免疫机制研究,E-mail:zfz0530@163.com *通信作者:许传田,E-mail:xcttaian2002@163.com
中图分类号:S852.659.6
文献标志码:A
文章编号:0366-6964(2016)03-0559-07

