柚皮苷对人脐带间充质干细胞成骨分化的影响
张帆 司文腾 白玉 邹士平

【摘 要】目的:研究柚皮苷对人脐带间充质干细胞的生物学作用,以及对干细胞成骨分化的影响。方法:体外分离、培养及扩增HUCMSC,流式细胞技术检测HUCMSC表面特异标志物。取第3代细胞,设立2组,对照组加入地塞米松、抗坏血酸、β-甘油磷酸,柚皮苷组加入地塞米松、抗坏血酸、β-甘油磷酸、柚皮苷。观察细胞形态,进行碱性磷酸酶活性测定、钙沉积半定量分析。结果:流式细胞术检测实验中增殖培育的细胞表面白表达CD29、CD44,不表达CD34、CD45,证实了实验中培育增殖的细胞为人脐带间充质干细胞。柚皮苷组比对照组细胞液中碱性磷酸酶活性高。柚皮苷组细胞内碱性磷酸酶含量与对照组比较,差异有统计学意义(P < 0.05);茜素红染色半定量分析见柚皮苷组与对照组比较,差异有统计学意义(P < 0.05)。结论:HUCMSC可以在体外采用组织块贴壁培养法培养成功,柚皮苷对HUCMSC成骨分化有促进作用。
【关键词】 人脐带间充质干细胞;柚皮苷;成骨分化;促进作用
【ABSTRACT】 Objective:To study the biological effect of naringin on human umbilical cord mesenchymal stem cell(HUCMSC)and its differentiation into osteoblasts.Methods:HUCMSC was isolated,cultured and amplified in vitro,and the surface specific markers of it were detected by flow cytometry technique.Cells of the third generation were taken to establish two groups:a naringin group and a control group,adding dexamethasone,ascorbic acid,β-glycerophosphate to the control group,adding dexamethasone,ascorbic acid,β-glycerol phosphate and naringin to the naringin group,observing the cell morphology,determining the alkaline phosphatase activity and quantitatively analyzing of calcium deposition.Results:The expression of CD29,CD44 and non-expression of CD34 and CD45 showed that the proliferation of HUCMSC was confirmed in the experiment.The activity of alkaline phosphatase was higher in the naringin group than that of the control group.The difference of the content of alkaline phosphatase between the two groups was statistically significant(P < 0.05).Alizarin red staining and semi quantitative analysis showed that there was a statistical significance between the two groups (P < 0.05).Conclusion:HUCMSC can be successfully cultured in vitro by tissue adherent culture and naringin can promote the differentiation of HUCMSC into osteoblasts.
【Keywords】 human umbilical cord mesenchymal stem cells;naringin;osteogenic differentiation;
promoting effect
关节置换手术中,处理骨缺损一直是个难题,阻挡了关节外科的发展。对于髋膝关节置换中出现的骨缺损的处理,由同种异体骨、自体骨移植发展到3D打印骨缺损来修补[1]。但是由于只有支撑骨架缺少成骨干细胞这个种子,所以植骨效果差,易发生骨移植失败。本研究出发点是从各种中药提取物中寻找一种能够刺激细胞成骨分化的成分,从而找到能够诱导细胞分化的物质,解决骨缺损问题。本实验从2014年6月至2015年12月分别用柚皮苷和传统骨诱导培养基培养人脐带间充质干细胞(HUCMSC),对比研究柚皮苷是否具有促进HUCMSC成骨分化的作用。
1 材料与方法
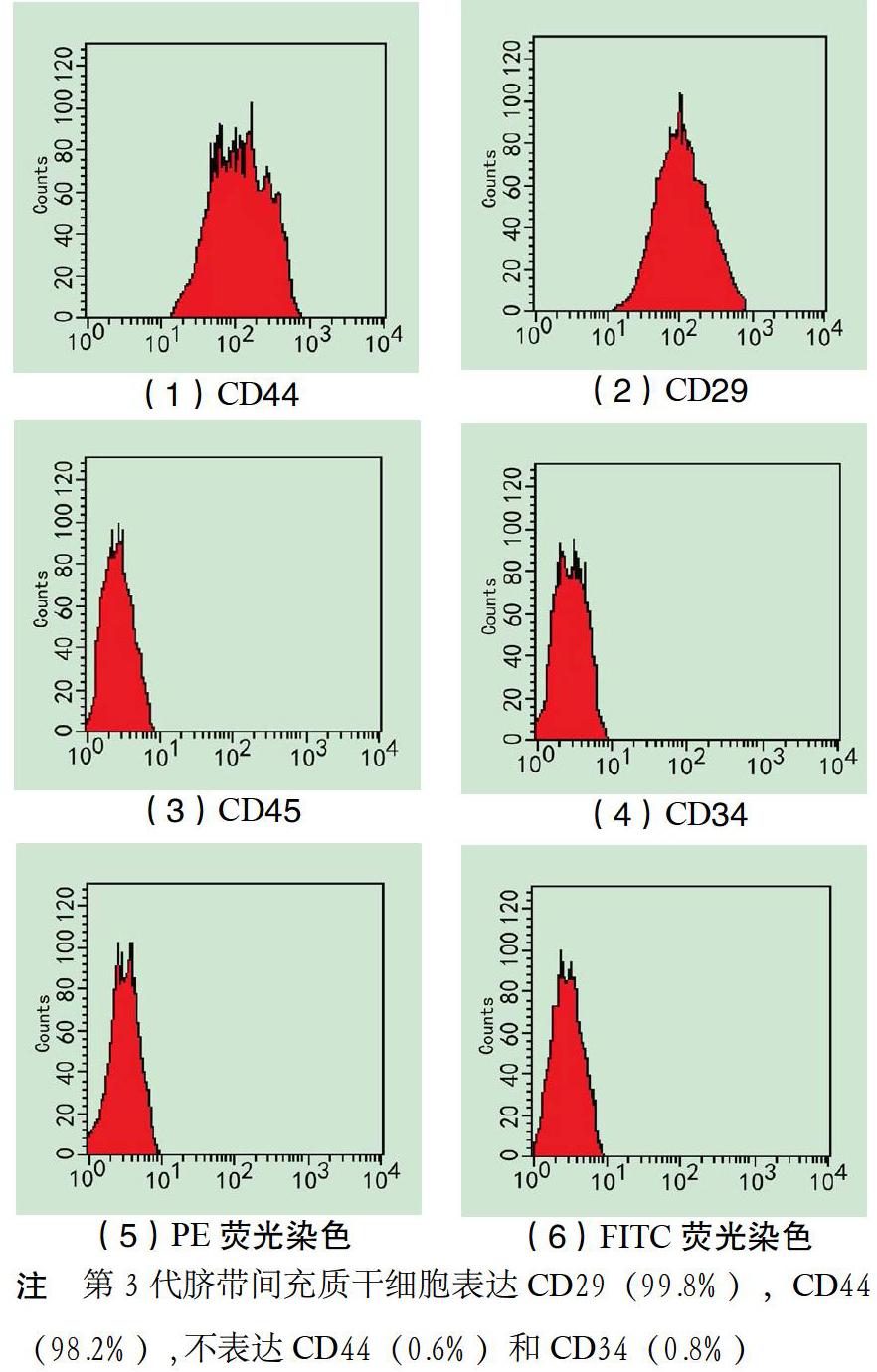
1.1 材 料 38~41周健康产妇剖腹产后切除2 h内的脐带,低糖复合氨基酸葡萄糖培养基(DMEM,Gibco公司),胎牛血清(FBS,Gibco公司),胰蛋白酶(Sigma公司),抗坏血酸(Sigma公司),β-甘油磷酸(Sigma公司),地塞米松(Sigma公司),柚皮苷(天津天一生物制药公司),BCM-100型超净工作台、茜素红(ARS,上海源叶生物公司),ALP检测试剂盒(BD公司),CD29、CD44、CD34、CD45单克隆抗体(BD公司),细胞培养瓶(Gibco公司),培养板(Gibco公司),硫化铵(天津化工),倒置相差显微镜等(理光),流式细胞仪(BD公司)。
1.2 脐带间充质干细胞的制备 剖腹产后从手术台上取下脐带并浸入制备的无菌磷酸盐缓冲液(PBS)之中,用外科剪去除脐带的外膜和脐带中的动静脉,将剩余的华尔通胶[2]用PBS溶液冲洗2次后,使用组织剪分成1~2 mm3大小的组织块[3],
准备细胞培养瓶,放入含有质量分数为10%的FBS的低糖DMEM培养液,培养液的量以超过组织块厚度2 mm为准,放入无菌培养箱中,恒温37 ℃、CO2饱和度为5%。每3天更换培养液,更换培养液的同时在显微镜下观察细胞融合情况,当达到70%以上后去除组织块。继续每3天换培养液,显微镜下观察到细胞达到90%融合时,准备质量分数为0.20%的胰蛋白酶使细胞悬浮。在显微镜下观察细胞90%悬浮后,按照1∶2分瓶培养并传代。扩增细胞以备后期细胞分组培养。
1.3 形态学及特异抗原检测 细胞光镜下检查:可见细胞呈旋涡状,螺旋状增殖排列。细胞表型采用流式细胞技术检测[4],对第3代细胞表面特异抗原检测,将2.5 g·L-1胰蛋白酶消化待检细胞PBS洗涤3次,制成细胞悬浊液,待检验细胞每管
0.1 mL加入第一抗体;4 ℃冰育30 min后,PBS清洗,加入荧光标记第二抗体;4 ℃冰育30 min,流式细胞检测仪检测CD29、CD44、CD34、CD45。
1.4 脐带间充质干细胞分组培养 HUCMSC增殖并繁育3代以后,盖玻片放入培养瓶中让细胞爬片,待盖玻片上爬满细胞后,采用随机余数分组法将其分为2组。对照组加入地塞米松(10-8 mol·L-1)、抗坏血酸(50 μg·mL-1)、β-甘油磷酸(10 mmol·L-1);柚皮苷组加入地塞米松(10-8 mol·L-1)、抗坏血酸(50μg·mL-1)、β-甘油磷酸(10 mmol·L-1)、柚皮苷(20 ng·mL-1)诱导。
1.5 成骨细胞诱导后鉴定
1.5.1 光镜下观察 对照组:可见大量脐带间充质干细胞向心旋涡状排列。柚皮苷组:干细胞由漩涡状向多边形、立方形细胞发展。
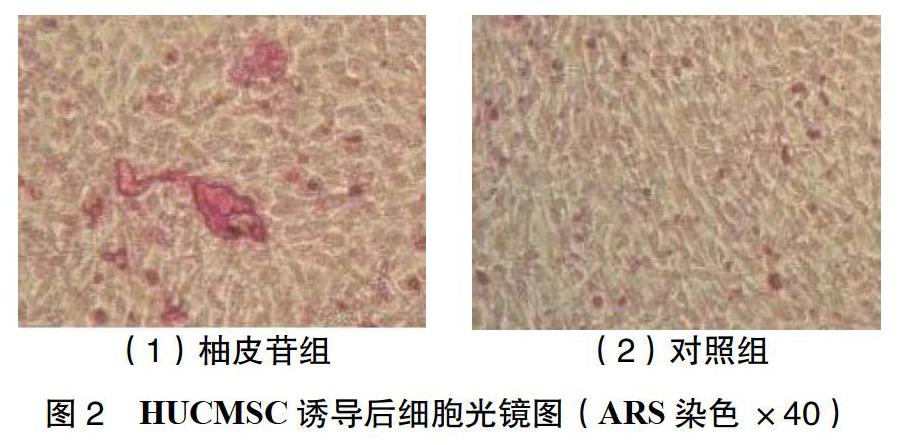
1.5.2 钙沉积的鉴定 柚皮苷组诱导培养28 d后,进行ARS染色。染色方法为2组细胞PBS冲洗2遍后,使用质量分数为4%的多聚甲醛固定10 min,蒸馏水冲洗2次,然后加质量分数为0.1%的ARS(pH = 8.8)保持恒温37 ℃染色5 min,胞浆内钙化颗粒可以被ARS染色成为棕红色或橘黄色[5]。
1.5.3 细胞内碱性磷酸酶(ALP)检测 2组细胞培养7 d后,开始测定ALP值,每次间隔24 h,共4次,每次裂解培养板内8个孔内增殖的细胞。步骤:吸走培养基,用PBS洗3次,每孔加200 μL质量分数为0.1%的细胞裂解液(覆盖孔底即可),反复冻溶3次,12 h以上。中间可震动培养板。2000 r·min-1离心10 min,进行裂解使胞浆内的ALP释放出来,ALP试剂盒测定裂解液。颜色的深浅和ALP呈正相关。用酶标仪在450 nm波长下测定吸光度(OD),通过标准曲线计算样品ALP浓度,通过OD值可以换算出ALP含量[6]。
1.6 统计学方法 采用SAS 9.3软件进行统计分析。计量资料以表示,采用独立样本t检验。以P < 0.05为差异有统计学意义。
2 结 果
2.1 HUCMSC的形态特点及鉴定 通过华尔通胶放入培养瓶后,恒温箱静置培养3 d,就可见少量细胞游出。随着时间延长,可见细胞由单一散在分布,逐步汇集成为放射状生长,形态统一,贴壁生长。培养15 d后传代,免疫组化结果显示,间充质干细胞(MSC)特异性标志CD29、CD44,不表达CD34、CD45。见图1。
2.2 HUCMSC诱导后光镜检测 HUCMSC在柚皮苷诱导剂的作用下,在倒置的显微镜下可见胞质内结晶反光点,对照组无此现象。柚皮苷组细胞融合率高于对照组。
2.3 HUCMSC诱导后ARS染色 细胞在ARS染色后,光镜下可见胞浆内出现棕红色的结节,周边有星芒装凸起。柚皮苷组胞浆内出现矿化结节并且有聚集趋势,成片状,数量多;而对照组少量矿化结节形成。见图2。
2.4 ARS染色及钙化颗粒的半定量分析 成骨诱导14,28 d后,在倒置显微镜下能观察到矿化颗粒的形成,并且柚皮苷组所形成的颗粒数量多,而对照组矿化颗粒少。矿化颗粒经氯化十六烷基吡啶溶解后,2组OD值:柚皮苷组1.1506±0.0571,2.3569±0.0825(P < 0.05);对照组0.6826±0.0125,1.3528±0.0584(P < 0.05)。2组比较,差异有统计学意义(P < 0.05,n = 4)。
2.5 诱导后的ALP定量检测分析 ALP染色后可见柚皮苷组细胞表达ALP强阳性,对照组弱阳性,2组对比可以推测出柚皮苷组在诱导剂对成骨分化有明显促进作用。见图3。细胞内ALP含量测定,按照ALP试剂盒操作流程,酶标仪560 nm处测定OD值计算含量,细胞内ALP含量测量结果见表1,柚皮苷组胞浆内ALP含量较对照组明显增高,差异有统计学意义(P < 0.05)。
3 讨 论
干细胞的研究能够帮助处理临床中出现的各种问题,其中种子细胞的选择至关重要[7],目前研究较多的是骨髓中提取[8],量太少,还要提前制备。Erices等[9]发现,脐带血中可以提取干细胞,但脐血干细胞同样提取困难并且量少。脐带MSC比脐带血干细胞有着先天优势:①来源问题好解
决;②华尔通胶内干细胞储备量很大;③没有伦理上的问题。因此,脐带MSC有广阔的前景[10]。本实验的目的是采用诱导培养液与基础培养液对照的方法,比较不同培养剂条件对脐带MSC向成骨细胞分化的影响。
中药骨碎补,别名崖姜、岩连姜、爬岩姜、肉碎补,骨碎补科蕨类植物,中医古籍中记载:“入肾,兼入心,疗骨中邪毒。”骨碎补中可以提纯出柚皮苷,以往的研究表明骨碎补能够促进大鼠骨折愈合[11],但是骨碎补中提纯的物质在体外是否能促进MSC向成骨细胞分化还是一个未知数。本研究结果显示,柚皮苷可以促进脐带MSC向成骨细胞分化,成骨诱导28 d后,通过对比细胞ALP染色以及ARS染色,表明柚皮苷对干细胞的成骨分化具有促进作用。本实验结果与文献报道的研究结果相似。实验证实了3个问题:①人脐带间中能够分离增殖出MSC。②骨碎补的提取物柚皮苷能够体外诱导MSC向成骨细胞发展。胞浆内ALP的含量,比对照组高出很多,证明了诱导因子的有效性。③实验过程中只用了一种诱导剂,尽量减少了干扰因素,找到了体外促进干细胞分化的方案。
本实验从骨碎补中提纯出的柚皮苷属于植物类雌激素,而雌激素在体内可以抑制骨吸收,促进成骨作用,这与本文的结论是相同的。ALP是一种与钙离子结合的蛋白,主要分布于细胞膜上,负责转运钙离子向胞内,促进细胞的矿化,同时也是促进细胞的成熟,ALP活性越高,则细胞的成骨性越强,越成熟。因此,ALP的检测作为本次实验的重点观察方向,结果也与目前实验相互吻合,柚皮苷组ALP活性明显高于对照组。柚皮苷是β-羟-β-β-甲基戊二酸单酰辅酶A还原酶抑制剂,最近的体外和动物实验均显示,该类药物能作用影响骨形态发生蛋白-2(BMP-2)因子,从而促进骨生长、增强骨骼强度。这可能与柚皮苷对干细胞成骨诱导有促进作用有关。柚皮苷促进干细胞成熟并成骨分化,考虑是有多种因子作用在其中,推测其分子过程为:①转录因子的逆表达,柚皮苷作用于干细胞后,上调转录因子Runx2和OSX的表达。miR-17-5p家族,尤其是miR-20a,能决定人间充质干细胞成骨分化的命运和调控成骨分化的过程。②改变胞内信号通路,柚皮苷可通过细胞外信号调节激酶信号通路的活性,结合IL-6调控,ERK5信号通路参与了成骨细胞的增殖分化,促进了干细胞成骨分化后,成骨干细胞的增殖。③胞质蛋白调控,柚皮苷具有促进IL-17F因子的分泌,IL-17F对成骨细胞的增殖能力、BMP-2的促进作用,同时
IL-17F还对抗BMP-2抑制因子Noggin mRNA对成骨细胞内的负反馈调节作用,促进成骨细胞的增殖;但是具体的机制有待于进一步实验验证[12]。
从中药提取的单一物质作为刺激因子能够使干细胞具有成骨细胞的活性,在后期人造骨架中能否增殖是关键,还有移植到人体后,能否继续发育成活,有待今后进一步研究和证实。
4 参考文献
[1] 郭晓山.骨盆与髋臼骨折的治疗展望[J].中医正骨,2013,25(6):3-5.
[2] Anzalone R,Lo Iacono M,Corrao S,et al.New emerging potentials for human Wharton's jelly mesenchymal stem cells:immunological features and hepatocyte-like differentiative capacity[J].Stem Cells Dev,2010,19(4):423-438.
[3] 高彦琳,张宁坤,陈厚良,等.改良原代培养体系提高人脐带间充质干细胞的产量[J].中国组织工程研究,2015,19(10):1477-1481.
[4] 陈宇,张宁坤,杨明,等.脐带华通胶间充质干细胞的分离培养及鉴定[J].中国现代医学杂志,2010,20(16):2412-2415.
[5] 王剑,王钢,陈天宇,等.异补骨脂素对小鼠骨髓基质干细胞成骨和成脂分化影响及其机制的相关研究[J].中华创伤骨科杂志,2015,17(12):1078-1085.
[6] 丁永利,陈星,赵明明,等.miR-133a对骨形态发生蛋白2诱导的鼠前成骨细胞分化的影响及其作用机制[J].中医正骨,2014,26(7):3-7.
[7] 王萧枫,童培建,金红婷,等.兔骨髓间充质干细胞的体外培养及相关检测的实验研究[J].中医正骨,2011,23(11):3-6.
[8] 姜红江,孙文学,鞠成朝,等.成人骨髓基质细胞培养[J].中医正骨,2000,12(5):5-6.
[9] Erices A,Conget P,Minguell JJ.Mesenchymal progenitor cells in human umbilical cord blood[J].British Journal of Haematology,2000,109(1):235-242.
[10] Pittenger MF,Mackay AM,Beck SC.Multilineage Potential of Adult Human Mesenchymal Stem Cells[J].Science,1999,284(5411):143-147.
[11] 伍海昭,朱敏,詹红生,等.骨碎补总黄酮对去卵巢大鼠骨组织Ⅰ型胶原表达及骨代谢的影响[J].中医正骨,2014,26(4):11-14.
[12] 贺旭峰,祝涛.骨碎补促进骨折愈合的机理[J].中医正骨,2013,25(11):67-69.
收稿日期:2016-01-26;修回日期:2016-03-21

