RuO2/Ti阳极电化学氧化吸收氨废气
徐晓华,许青枝,黄桂凤,王莉莉,黄立维(浙江工业大学环境学院,浙江 杭州 310014)
RuO2/Ti阳极电化学氧化吸收氨废气
徐晓华,许青枝,黄桂凤,王莉莉,黄立维
(浙江工业大学环境学院,浙江 杭州 310014)
摘要:采用溶液吸收结合电化学氧化法处理氨废气。电化学反应器采用尺寸为φ35 mm×350 mm的管式玻璃反应器,内壁贴附不锈钢网作为阴极,反应器中心轴向设置有φ10 mm×350 mm的钌钛电极(RuO2/Ti)棒作为阳极。电极浸没在吸收液中,含氨气体从反应器底部经气体分布器导入反应器。实验结果表明,与溶液吸收相比,溶液吸收结合电化学氧化可以更长时间保持较高的氨气去除率。由于RuO2/Ti电极产生的有效氯的间接氧化作用,氨气在NaCl溶液比在Na2SO4溶液中的去除率更高。以NaCl为电解液时,酸性条件下更有利于氨气的吸收和降解,并且氨气的去除率随着电流密度的增加而增加。产物分析发现氨气在NaCl和Na2SO4溶液中被电化学氧化后,主要产物为氮气,也有少量氨转化为硝酸根离子。
关键词:RuO2/Ti阳极;电化学;溶液;吸收;氨;废气
2015-11-03收到初稿,2016-02-22收到修改稿。
联系人:黄立维。第一作者:徐晓华(1989—),男,硕士研究生。
Received date: 2015-11-03.
引 言
氨气是我国限制性的恶臭污染物之一。养殖场、化工厂、垃圾填埋等排放出的大量含氨废气,不仅给大气环境带来危害,而且严重影响人体健康[1-3]。并且,氨废气溶解在雨水中形成的氨氮废水,进一步影响水质,也是造成湖泊富营养化以及饮用水污染的原因之一[4-6]。
目前,常用氨废气处理方法为溶液吸收法,通常采用清水或稀酸溶液作为吸收剂[7-9]。但是由于氨的平衡蒸气压较高,单纯的溶液吸收不易使氨得到完全去除。另外溶液吸收只是将气态氨转移到吸收液中,吸收液中的氨氮需要进一步处理。
电化学法作为一种废水高级氧化技术(AOP),由于其具有去除效果好、化学药剂使用量少、只需要消耗电能等特点[10-11],在处理废水方面已经有了广泛的研究和应用[12-13]。本研究提出了电化学氧化吸收处理氨废气,把吸收与电化学氧化相结合,通过溶液吸收氨废气并经过具有高催化性能的RuO2/Ti电极氧化,将吸收液中氨氮转化为氮气,从而持续保持较高的氨废气去除率。
1 实验材料和方法
1.1实验装置
实验装置如图1所示。实验采用的模拟废气是由氮气和氨气共同组成,钢瓶1中的氮气分成两路,一路经过玻璃转子流量计2以一定流量通入装有浓氨水(质量分数为28%)的气体发生瓶4,鼓吹出易挥发的氨气与另一路氮气在缓冲瓶5混合配成模拟氨废气。模拟氨废气由反应器底部进气口经过圆柱形曝气器通入电化学反应器8,经过电解反应器后,由上端出气口排出。其中在电化学反应器的进口和出口处分别设有气体采样点6、10,以便定时用稀硫酸采样吸收分别测定进出口氨气浓度。电极浸没在吸收液中,同时电化学反应器下端还设有液体采样点7,以便采样测定吸收液中的氨氮浓度。

图1 实验装置流程Fig.1 Schematic diagram of experimental apparatus1—N2cylinder; 2,3—gas flow meter; 4—ammonia generating bottle; 5—buffer bottle; 6,10—gas sampling mouth; 7—liquid sampling mouth; 8—electrochemical reactor; 9—DC power source
电化学反应器为线筒式反应器,尺寸为φ 35 mm×350 mm。主要由玻璃管、曝气装置、直流电源、阴极和阳极组成。将尺寸为300 mm×160 mm不锈钢网卷成圆柱形,贴附着玻璃反应器的内壁作为阴极。中间通过橡胶塞固定尺寸φ 10 mm×350 mm的RuO2/Ti电极作为阳极。曝气装置采用圆柱形微孔曝气头曝气。
1.2分析方法
分析仪器包括:UV759紫外可见分光光度计(上海精密科学仪器有限公司);PH/ORP计:PHS-25(上海雷磁仪器厂);离子色谱:ICS1000(戴安中国有限公司)。
气相中的氨采用纳氏试剂分光光度法(HJ 533—2009)测定,溶液中的氨氮采用纳氏试剂分光光度法(HJ 535—2009)测定,溶液中硝酸根和亚硝酸根采用离子色谱测定。氨废气的去除率按式(1)计算

2 实验结果与讨论
2.1不同溶液对氨废气去除率的影响
调节鼓吹氮气流量为200 ml·min−1,缓冲氮气流量为600 ml·min−1,使反应器进口氨气浓度约为8000 mg·m−3,分别采用200 ml浓度为0.05 mol·L−1NaCl溶液和0.05 mol·L−1Na2SO4溶液作为吸收液,在初始pH为7,直流电源设置为2 A,采取恒流电解,电流密度为10 mA·cm−1。每隔20 min定时取样分析测定反应器进出口氨气浓度,实验结果如图2所示。同时图中也给出了采用单独水溶液吸收氨气的效果作为对照。
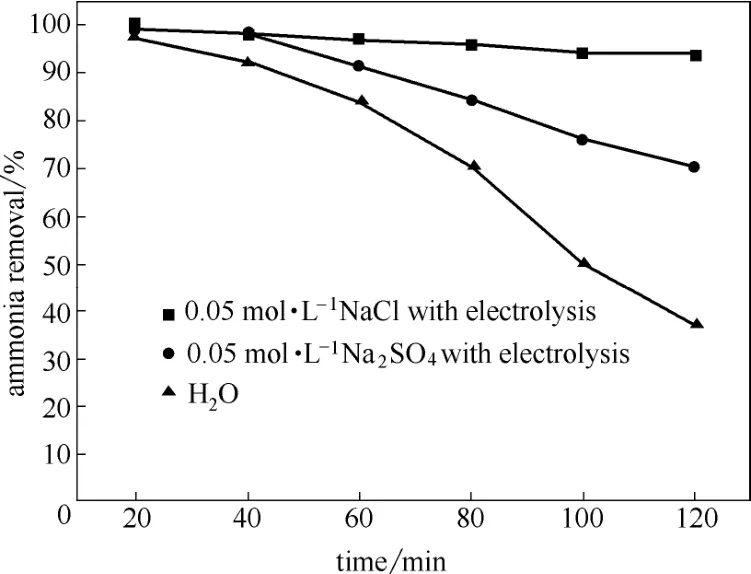
图2 不同溶液对氨废气去除率的影响Fig.2 Influence of different solution on removal of ammonia
由图2可以看出:在反应初始阶段,氨气在NaCl溶液和Na2SO4溶液的去除率相差不大,随着反应的继续进行,氨气在NaCl溶液的去除率保持在较高水平,而在Na2SO4溶液中去除率不断下降。这是因为开始阶段氨气的去除主要以物理吸收为主。随着吸收的进行,溶液中的氨氮浓度不断增加,吸收作用不断减弱,电解氧化起主要作用,氨气的去除主要以化学吸收为主。根据吸收速率方程式(2),电解减少了液相中的氨氮浓度,使得氨氮的平衡分压降低,传质推动力增大,从而加大了吸收速率。

实验采用目前普遍使用的RuO2/Ti电极,RuO2/Ti是形稳性阳极(DSA)类阳极,具有稳定性、高催化性和亲水性等特点[14-15]。以氯化钠溶液为吸收液,其电解时电极和溶液中发生的主要反应为[16-19]

以硫酸钠溶液为吸收液时,其电解发生的主要反应为[20-23]

在以氯化钠溶液为吸收液的电解过程中,氯离子首先在阳极上被氧化成了游离氯,然后溶解在水中形成有效氯(包括HClO、ClO−等)。氨气的去除主要以有效氯间接氧化成氮气为主,而电极的直接氧化和电极产生的羟基自由基(HO·)间接氧化可以忽略[17]。还有少量的HClO和ClO−会与氨氮发生氧化反应生成硝酸盐氮[16]。以硫酸钠溶液为吸收液时,在碱性条件下氨气的去除主要以反应式(7)电极逐步脱氢直接氧化成氮气为主,在酸性条件下氨气的去除以反应式(8)电极产生HO·间接氧化成氮气为主[21-22,24]。另外还有少量的氨氮被电极直接氧化成了硝酸盐[20-21]。实验还发现氨气在氯化钠溶液中的去除率始终高于在硫酸钠溶液中的去除率,这是由于实验中采用的RuO2/Ti阳极为DSA,氧气在RuO2/Ti阳极上的析出电位为 1.3 V高于氯气的析出电位1.13 V,因此在一定的电流密度范围内,Cl−优先在阳极上发生了吸附和氧化反应[21,25]。
为了进一步证明当阳极材料为RuO2/Ti,相同浓度的NaCl溶液在电解之后的氧化能力大于Na2SO4溶液,分别取等量等浓度的两种溶液,在相同的电流下电解120 min,测定溶液的氧化还原电位(ORP)值随电解时间的变化,结果如图3所示。
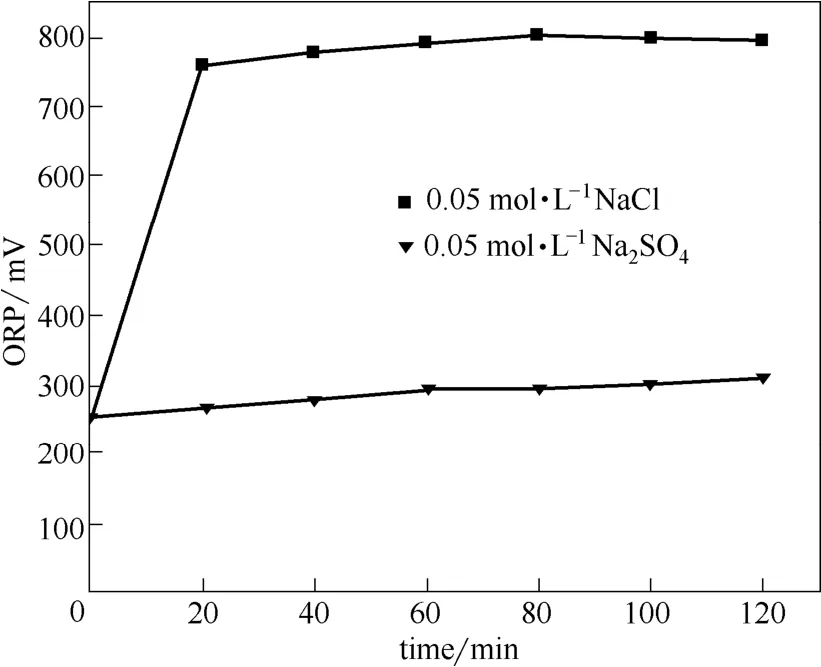
图3 不同溶液的ORP随电解时间的变化Fig.3 Changes of ORP in different solution with time
由图3可以看出,两种溶液的ORP值随着电解时间的增大而增大,但是0.05 mol·L−1的 NaCl溶液在电解20 min后ORP值远远高于0.05 mol·L−1Na2SO4溶液。所以氨气在氯化钠溶液中比在硫酸钠溶液中具有更高的去除率。
2.2初始pH对氨废气去除率的影响
取0.05 mol·L−1NaCl溶液200 ml作为吸收液,调节鼓吹氮气流量为200 ml·min−1,缓冲氮气流量为600 ml·min−1,使进口氨气浓度仍约为8000 mg·m−3,通过滴加NaOH或H2SO4改变吸收液的pH,直流电源设置为2 A,电压为7 V,恒流电解20 min后测定出口氨气浓度,研究初始pH对氨气去除率的影响,结果如图4所示。

图4 初始pH对氨废气去除率的影响Fig.4 Influence of initial pH on removal of ammonia
由图4可看出:当用NaCl溶液作吸收液时,随着pH的增大,氨气的去除率缓慢降低。这是因为以NaCl溶液作为吸收液时,氨气的去除主要以电极产生的有效氯的间接氧化为主。电解NaCl溶液时,有多个氧化还原反应同时进行,如HClO/Cl2、ClO−/Cl−等。HClO与ClO−在溶液中所占的比例与溶液的pH有关,在酸性环境中以HClO为主,在碱性环境中以ClO−为主。HClO的标准氧化还原电位为1.63 V,而ClO−仅为0.90 V[26],所以酸性条件下更有利于有效氯的间接氧化。碱性条件下,会使得ClO−与HClO发生式(10)的反应生成ClO3−,而ClO3−是在低温时稳定物质,不会对溶液中的氨氮起到氧化效果,也会导致氨气去除率降低[27-28]。
2.3电流密度对氨废气去除率的影响
取0.05 mol·L−1NaCl溶液200 ml作为吸收液,在pH= 7的条件下考察电流对氨废气处理效果的影响。调节鼓吹氮气流量为200 ml·min−1,缓冲氮气流量为600 ml·min−1,使进口氨气浓度约为8000 mg·m−3。待进口浓度稳定后,打开直流电源,调节电流分别为1.0、2.0、3.0、4.0、5.0 A,对应的电流密度分别为5、10、15、20、25 mA·cm−2。恒流电解120 min后取样分析,实验结果如图5所示。同时增加了单纯NaCl溶液吸收氨气120 min后的去除效果作为空白对照。

图5 电流密度对氨废气去除率的影响Fig.5 Influence of current density on removal of ammonia成,如HClO、HO·,进而显著提高了氨气的去除
从图5可以看出,在120 min后,在没有电流的情况下,溶液吸收氨废气的去除率下降到约39%,而溶液结合电化学氧化吸收依然维持在87%的去除效果。并且随着电解电流的增大,氨气的去除率逐渐增大。这是因为电流密度加快了电子的迁移转化速率,促进了更多的具有强氧化性的活性物质的生效率。但是当电流增加到15 mA·cm−2时,氨气去除率增加得不是很明显。可能是由于氨氮的浓度一定时,所需的氧化物也是一定的,过量的电子和氧化物反而起不到有效的氧化作用,还会降低氨气的去除效率。同时过大的电流密度还会导致析氧副反应的发生[29-30]。
2.4电化学氧化吸收氨氮后溶液中氨氮浓度变化
分别在吸收和电解吸收条件下,测量吸收液中氨氮浓度随时间的变化。调节鼓吹氮气流量为200 ml·min−1,缓冲氮气流量为600 ml·min−1,使进口氨气浓度约为8000 mg·m−3,采用200 ml浓度为0.05 mol·L−1NaCl溶液作为吸收液,在初始pH 为7,直流电源设置为2 A,电压为7 V,采取恒流电解,每隔20 min取样测定吸收液中NH3-N浓度,结果如图6所示。
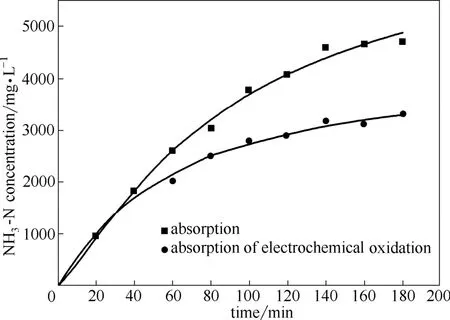
图6 吸收液中氨氮浓度随时间变化Fig.6 Influence of time on concentration of ammonia in absorption solution
由图6可以看出,吸收液中NH3-N浓度最初阶段增加较快,后面增加较缓慢,最后趋于稳定平衡。这是因为氨气是易溶于水的气体,开始阶段溶液中氨氮的浓度较低,吸收速率较快,随着溶液中氨氮浓度的增加,溶液中氨氮浓度的增加速率变缓。根据亨利定律,最终达到汽液平衡时,溶液就不再吸收氨气。从图中可以看出电化学氧化吸收溶液中仍具有较高的氨氮浓度,这是因为进口的氨氮浓度较大,而电化学的氧化能力不够,导致氨气的降解速率小于吸收速率。虽然可以看出电化学氧化吸收溶液中仍具有较高的氨氮浓度,但是采用溶液吸收结合电化学氧化时,氨氮浓度增加速率比单纯吸收条件下较慢,且浓度低于单纯吸收时吸收液中氨氮浓度,这表明电化学可以在很大程度上降低溶液中氨氮浓度,从而保证了较高的氨废气的去除率。
2.5RuO2/Ti阳极的电化学氧化氨气的产物分析
将电化学反应器的进气口密封,而出气口采用稀硫酸溶液吸收挥发出来的氨气,反应后测量其氨氮含量。分别配制氨氮质量浓度(以N计)为1000 mg·L−1的NH4Cl溶液和(NH4)2SO4溶液。然后在相应的0.01 mol·L−1NaCl溶液和0.01 mol·L−1Na2SO4溶液中分别采用2 A电流恒流电解2 h,每隔20 min取样一次。分别测定溶液中的氨氮、硝酸根和亚硝酸根离子的浓度。实验结果分别如图7和图8所示。
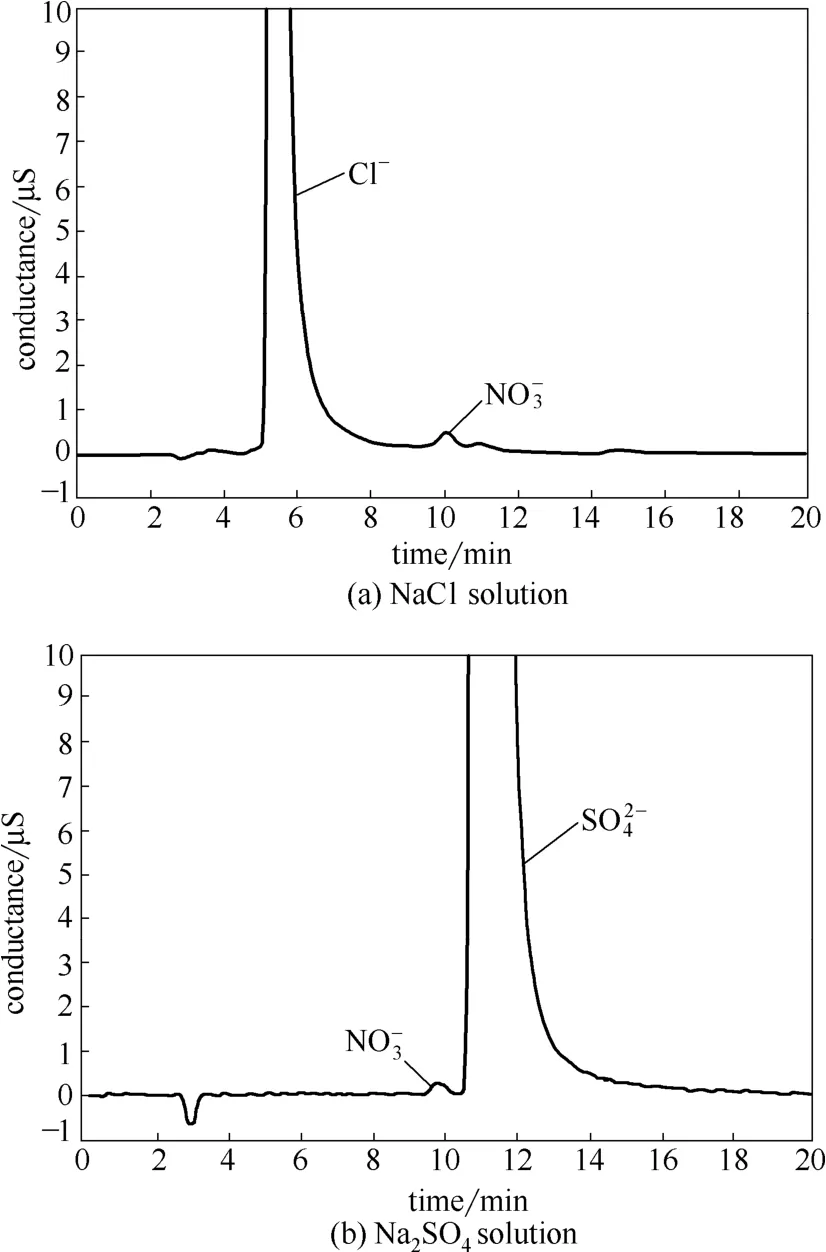
图7 不同溶液中电化学氧化氨氮后的离子谱图Fig.7 Ion chromatograms of NH3-N after electrochemical oxidation in different solution

图8 不同溶液中氮浓度的变化Fig.8 Variation of nitrogen concentration in different solution
从图7(a)和图8(a)中可以看出,在NaCl溶液中,只检测到了硝酸根离子,没有检测到亚硝酸根离子。氨氮的减少量远远大于硝酸盐氮的生成量,而挥发出去的氨气只占总量的1%。根据物料平衡,溶液中的氨氮主要转化成了氮气。同时用淀粉KI试剂检测单独电解后的NaCl溶液,发现淀粉KI试纸先变蓝后褪色,表明溶液中有次氯酸根离子的存在。说明在有氯离子存在的条件下,氨氮的去除主要以RuO2/Ti阳极产生的次氯酸的间接氧化成氮气为主,还有极少量被氧化成了硝酸盐。
而从图7(b)和图8(b)中可以看出,在Na2SO4溶液中没有检测到亚硝酸根离子的存在,这可能是由于浓度太低没有检测出来。虽然检测到了硝酸根离子的存在,但浓度较低,而挥发出去的氨气不足氨氮减少量的1%。因此推测氨氮在RuO2/Ti阳极上的电化学产物主要为氮气。而硝酸根离子的存在说明部分氨氮被氧化成了硝酸盐。但硝酸盐含量较少,这可能是将氨氮氧化成较高价态的硝酸盐氮更难,所以绝大部分氨氮被氧化成了较低价态的氮气。
3 结 论
(1)由于电化学能够降解吸收液中的氨氮,使得与溶液吸收相比,溶液吸收结合电化学氧化能够更长时间保持较高的氨气去除率。
(2)在以RuO2/Ti为阳极的电化学氧化吸收氨气中,NaCl溶液比Na2SO4溶液的去除效果更好。这主要是由于电解NaCl溶液产生的有效氯的间接氧化作用。
(3)采用NaCl溶液时,酸性条件更有利于氨气的吸收和降解,同时氨气的去除率随着电流密度的增加而逐渐增大。
(4)在NaCl溶液和Na2SO4溶液中,吸收液中的氨氮主要被RuO2/Ti阳极氧化成了氮气,同时少量的氨氮被氧化成了硝酸根离子。
符号说明
Cα,Cβ——分别为电化学反应器的进口和出口处氨废气的浓度,mg·m−3
ky——以(y− yi)为气相传质推动力的气相分吸收系数,kmol·m−2·s−1
NA——吸收速率,kmol·m−2·s−1
y,yi——分别为被吸收组分在气相主体和相界面上的摩尔分数
η——去除率,%
下角标
α——进口处
β——出口处
References
[1]OGAWA H, DAHL P J, SUZUKI T, et al. A microbiological-based air cleaning system using a two-step process for removal of ammonia in discharge air from a pig rearing building [J]. Biosystems Engineering, 2011, 109 (2): 108-119. DOI: 10.1016/j.biosystemseng.2011.02.007.
[2]HE P J, YANG N, GU H L, et al. N2O and NH3emissions from a bioreactor landfill operated under limited aerobic degradation conditions [J]. Journal of Environmental Sciences, 2011, 23 (6): 1011-1019. DOI: 10.1016/S1001-0742(10)60574-8.
[3]ZHOU Y, CHENG S Y, LANG J L, et al. A comprehensive ammonia emission inventory with high-resolution and its evaluation in the Beijing-Tianjin-Hebei(BTH) region, China [J]. Atmospheric Environment, 2015, 106: 305-317. DOI: 10.1016/j.atmosenv.2015.01.069.
[4]刘春爽, 李甲国, 闫来洪, 等. 废水中硫化物、硝酸盐和氨氮生物同步去除及其机理 [J]. 化工学报, 2015, 66 (2): 779-784. DOI: 10.11949/j.issn.0438-1157.20141091. LIU C S, LI J G, YAN L H, et al. Simultaneous biological removal of nitrate, sulfide and ammonia from wastewater and its mechanism [J]. CIESC Journal, 2015, 66 (2): 779-784. DOI: 10.11949/j.issn.0438-1157.20141091.
[5]FERNANDEZ NAVA Y, MARANON E, SOONS J, et al. Denitrification of high nitrate concentration wastewater using alternative carbon sources [J]. Journal of Hazardous Materials, 2010, 173 (1/2/3): 682-688. DOI: 10.1016/j.jhazmat.2009.08.140.
[6]李红艳, 李亚新, 孙东刚. 处理高浓度氨氮废水的阳离子交换树脂筛选 [J].化工学报, 2008, 59 (9): 2339-2345. LI H Y, LI Y X, SUN D G. Screening of cation exchange resins for treating wastewater containing high concentration ammonia [J]. Journal of Chemical Industry and Engineering (China), 2008, 59 (9): 2339-2345.
[7]MANUZON R B, ZHAO L Y, KEENER H M,et al. A prototype acid spray scrubber for absorbing ammonia emissions from exhaust fans of animal buildings [J]. Transactions of the ASABE, 2007, 50 (4): 1395-1407. DOI: 10.13031/2013.23628.
[8]DWYER O E, DODGE B F. Rate of absorption of ammonia by water in a packed tower [J]. Industrial and Engineering Chemistry, 1941, 33 (4): 485-492. DOI: 10.1021/ie50376a012.
[9]HADLOCON L J S, ZHAO L Y, WYSLOUZIL B E, et al. Semi-mechanistic modelling of ammonia absorption in an acid spray wet scrubber based on mass balance [J]. Biosystems Engineering, 2015, 136: 14-24. DOI: 10.1016/j.biosystemseng.2015.05.002.
[10]KAPALKA A, FIERRO S, FRONTISTIS Z, et al. Electrochemical oxidation of ammoniaon thermally and electrochemically prepared IrO2electrodes [J]. Electrochimica Acta, 2011, 56 (3): 1361-1365. DOI: 10.1016/j.electacta.2010.10.071.
[11]LI M, FENG C F, ZHANG Z Y, et al. Application of an electrochemical-ion exchange reactor for ammonia removal [J]. Electrochimica Acta, 2009, 55 (1): 159-164. DOI: 10.1016/j.electacta.2009.08.027.
[12]MAHVI A H, EBRAHIMI S J A, MESDAGHINIA A, et al. Performance evaluation of a continuous bipolar electrocoagulation/ electrooxidation-electroflotation (ECEO-EF) reactor designed for simultaneous removal of ammonia and phosphate from wastewater effluent [J]. Journal of Hazardous Materials, 2011, 192 (3): 1267-1274. DOI: 10.1016/j.jhazmat.2011.06.041.
[13]李德生, 范太兴, 申彦冰, 等. 污水处理厂尾水的电化学脱氮技术[J]. 化工学报, 2013, 64 (3): 1084-1090. LI D S, FAN T X, SHEN Y B, et al. Electrochemical technology for denitrification of tail water from wastewater treatment plant [J]. CIESC Journal, 2013, 64 (3): 1084-1090.
[14]张晓, 崔凯军, 黄立维, 等. 电化学反应器去除硫化氢废气实验研究 [J]. 浙江工业大学学报, 2008, 36 (5): 539-542. DOI: 10.3969/j.issn.1006-4303.2008.05.016. ZHANG X, CUI K J, HUANG L W, et al. Experimental study on the removal of H2S by an electrochemical reactor [J]. Journal of Zhejiang University of Technology, 2008, 36 (5): 539-542. DOI: 10.3969/j.issn.1006-4303.2008.05.016.
[15]CANDIDO L, PONCIANO GOMES J A C. Evaluation of anode materials for the electro-oxidation of ammonia and ammonium ions [J]. Materials Chemistry and Physics, 2011, 129 (3): 1146-1151. DOI: 10.1016/j.matchemphys.2011.05.080.
[16]KIM K W, KIM Y J, KIM I T, et al. Electrochemical conversion characteristics of ammonia to nitrogen [J]. Water Research, 2006, 40 (7): 1431-1441. DOI: 10.1016/j.watres.2006.01.042.
[17]LI L, LIU Y. Ammonia removal in electrochemical oxidation: mechanism and pseudo-kinetics [J]. Journal of Hazardous Materials, 2009, 2 (161): 1010-1016. DOI: 10.1016/j.jhazmat.2008.04.047.
[18]LI M, FENG C P, ZHANG Z Y, et al. Efficient electrochemical reduction of nitrate to nitrogen using Ti/IrO2-Pt anode and different cathodes [J]. Electrochimica Acta, 2009, 54 (20): 4600-4606. DOI: 10.1016/j.electacta.2009.03.064.
[19]SZPYRKOWICZ L, NAUMCZYK J, ZILIO GRANDI F. Electrochemical treatment of tannery wastewater using Ti/Pt and Ti/Pt/Ir electrodes [J]. Water Research, 1995, 29 (2): 517-524. DOI:10.1016/0043-1354(94)00176-8.
[20]DE VOOYS A C A, KOPER M T M, VAN SANTEN R A, et al. The role of adsorbates in the electrochemical oxidation of ammonia on noble and transition metal electrodes [J]. Journal of Electroanalytical Chemistry, 2001, 506 (2): 127-137. DOI: 10.1016/S0022-0728(01)00491-0.
[21]KIM K W, KIM Y J, KIM I T, et al. The electrolytic decomposition mechanism of ammonia to nitrogen at an IrO2anode [J]. Electrochimica Acta, 2005, 50 (22): 4356-4364. DOI: 10.1016/j.electacta.2005.01.046.
[22]BUNCE N J, BEJAN D. Mechanism of electrochemical oxidation of ammonia [J]. Electrochimica Acta, 2011, 56 (24): 8085-8093. DOI: 10.1016/j.electacta.2011.07.078.
[23]FAN N W, LI Z K, ZHAO L, et al. Electrochemical denitrification and kinetics study using Ti/IrO2-TiO2-RuO2as the anode and Cu/Zn as the cathode [J]. Chemical Engineering Journal, 2013, 24 (1): 83-90. DOI: 10.1016/j.cej.2012.10.026.
[24]FENG C P, SUGIURA N, SHIMADA S, et al. Development of a high performance electrochemical wastewater treatment system [J]. Journal of Hazardous Materials, 2003, 103 (1/2): 65-78. DOI: 10.1016/S0304-3894(03)00222-X.
[25]CHEN S Y, ZHENG Y H, WANG S W, et al. Ti/RuO2-Sb2O5-SnO2electrodes for chlorine evolution from seawater [J]. Chemical Engineering Journal, 2011, 172 (1): 47-51. DOI: 10.1016/j.cej.2011.05.059.
[26]许青枝, 黄立维, 蒋廉颖. 吸收液对电化学氧化吸收甲苯废气的影响 [J].高校化学工程学报, 2014, 28 (2): 438-422. DOI: 10.3969/j.issn.1003-9015.2014.02.040. XU Q Z, HUANG L W, JIANG L Y. Effect of absorbent on the removal of toluene by absorption combined with electrochemical oxidation [J]. Journal of Chemical Engineering of Chinese Universities, 2014, 28 (2): 438-422. DOI: 10.3969/j.issn.1003-9015.2014.02.040.
[27]VLYSSIDES A G, ISRAILIDES C J. Detoxification of tannery waste liquors with an electrolysis system [J]. Environment Pollution, 1997, 97 (1/2): 147-152. DOI: 10.1016/S0269-7491(97)00062-6.
[28]VANLANGENDONCK Y, CORBISIER D, LIERDE A V. Influence of operating conditions on the ammonia electro-oxidation rate in wastewaters from power plants (ELONITATMtechnique) [J]. Water Research, 2005, 39 (13): 3028-3034. DOI: 10.1016/j.watres.2005.05.013.
[29]CZARNETZKI L R, JANSSEN D L J. Formation of hypochlorite, chlorate and oxygen during NaCl electrolysis from alkaline solutions at an RuO2/TiO2anode [J]. Journal of Applied Electrochemistry, 1992, 22 (4): 315-324. DOI: 10.1007/BF01092683.
[30]LEI X H, LI M, ZHANG Z Y, et al. Electrochemical regeneration of zeolites and the removal of ammonia [J]. Journal of Hazardous Materials, 2009, 169 (1/2/3): 746-750. DOI: 10.1016/j.jhazmat.2009.04.012.
Removal of ammonia by absorption combined with electrochemical oxidation on RuO2/Ti anode
XU Xiaohua, XU Qingzhi, HUANG Guifeng, WANG Lili, HUANG Liwei
(College of Environment, Zhejiang University of Technology, Hangzhou 310014, Zhejiang, China)
Abstract:Ammonia in the exhaust gas was treated by solution absorption combined with electrochemical oxidation. The electrochemical reactor was a tubular glass reactor (φ35 mm×350 mm) with a stainless steel mesh attached to the inner wall as the cathode, and a titanium rod (φ10 mm×350 mm) coated with RuO2(RuO2/Ti) fixed on the axis of the reactor as the anode. Electrodes were immersed in absorption solutions. The sample gas containing ammonia was introduced to the reactor by a gas distributor installed at the bottom of the reactor. Experimental results indicated that the removal of ammonia was higher by absorption combined with electrochemical oxidation compared with solution absorption only. The removal of ammonia is higher in NaCl solution than that in Na2SO4one, which was attributed to the indirect oxidation of active chlorine generated by electrochemical reaction on RuO2/Ti anode. It was confirmed that oxidation of ammonia increased with low pH of NaCl solutions. With the increase of current density applied to the reactor, the decomposition of ammonia also increased. The major of absorbed ammonia in NaCl and Na2SO4solution converted to nitrogen after electrochemical reaction. Only a small amount of nitrate was found in solutions after reaction.
Key words:RuO2/Ti anode; electrochemistry; solution; absorption; ammonia; exhaust
中图分类号:X 512
文献标志码:A
文章编号:0438—1157(2016)06—2568—07
DOI:10.11949/j.issn.0438-1157.20151659
Corresponding author:Prof. HUANG Liwei, hlw@zjut.edu.cn

