犬骨髓单个核细胞构建组织工程骨的体外实验研究
尹宏宇 丁榆德 刘广鹏 曹谊林
犬骨髓单个核细胞构建组织工程骨的体外实验研究
尹宏宇丁榆德刘广鹏曹谊林
【摘要】目的探索组织工程骨(Tissue Engineered Bone,TEB)的即刻构建方案,以符合临床骨缺损即刻修复的要求。方法分离获取Beagle犬骨髓单个核细胞(Canine bone marrow mononuclear cells,cBMNCs)。将密度为30×106cells/mL 的cBMNCs复合部分脱钙骨(Partially demineralized bone matrix,pDBM)即刻构建TEB。对即刻构建的TEB进行体外培养和成骨检测。结果在成骨诱导的体外培养环境下,即刻构建的TEB具有一定的细胞活性和成骨能力。结论即刻构建的TEB可直接回植,以满足体内即刻骨缺损修复的要求。
【关键词】组织工程骨骨髓单个核细胞骨髓基质干细胞
作者单位:100144北京市中国医学科学院整形外科医院颌面整形外科中心(尹宏宇,丁榆德);200072上海市上海市第十人民医院整形外科(刘广鹏);100144北京市中国医学科学院整形外科医院(曹谊林)。
种子细胞是骨组织工程研究领域中的关键点。骨髓基质干细胞(Bone marrow mesenchymal stem cells,BMSCs)与其他骨源细胞相比,获取方法简便可靠,创伤较小,且体外培养可获得大量扩增的细胞。将BMSCs诱导为成骨细胞进行组织工程骨(Tissue Engineered Bone,TEB)的构建,已成为骨组织工程的研究热点[1]。但BMSCs复合材料构建TEB的常规体外构建方案一般需要3周时间,难以满足临床上即刻骨缺损修复的需要。因此,本实验通过骨髓单个核细胞(Bone marrow mononuclear cells,BMNCs)复合材料即刻构建TEB,并在成骨诱导环境下进行体外检测,以观察该方案应用于临床骨缺损即刻修复的可行性。
1 材料和方法
1.1材料
2岁龄Beagle犬6条(上海农学院),雌雄不限,体质量约20 Kg。
试剂(Sigma公司,美国):Percoll原液(77237 Percoll);DNA试剂盒;碱性磷酸酶(Alkaline phosphatase,ALP)染色剂;骨钙蛋白(Osteocalcin,OCN)染色剂。
1.2方法
1.2.1犬骨髓单个核细胞(Canine bone marrow mononuclear cells,cBMNCs)的分离提纯
抽取实验犬骨髓2.5 mL,参照文献[2]的方法,进行Percoll液配制和cBMNCs分离提纯。
1.2.2支架材料的准备
部分脱钙骨(Partially demineralized bone matrix,pDBM)取材于猪的股骨头松质骨,制备过程参照文献[3]。pDBM支架材料的孔径为(330.5±33.6)μm;孔隙率为(80.05%±3.92%);余留钙量为(19.0%±1.6%)。将pDBM加工成直径5 mm,厚1 mm的圆盘状。
1.2.3cBMNCs在pDBM上的黏附率
参照文献[4]的方法,分离获取的cBMNCs直接以10×106cells/mL、20×106cells/mL、30×106cells/mL、40×106cells/mL、50×106cells/mL、60×106cells/mL和70×106cells/mL的密度,分别接种于pDBM上,每个细胞密度各接种5块材料。将细胞材料复合物在培养箱中放置4 h后,换另一培养皿。将原培养皿中的细胞进行消化收集,血球计数板计算出未黏附的细胞数。
细胞黏附率=(接种的细胞数-未黏附的细胞)/接种的细胞数
1.2.4TEB的制备
分离获取10 mL的Beagle犬骨髓cBMNCs,根据黏附率的测定结果,选取最佳的细胞密度重悬成细胞悬液,并直接接种于pDBM支架材料来即刻构建TEB。
1.2.5TEB细胞活性的体外检测
将cBMNCs复合pDBM即刻构建的TEB体外成骨诱导培养32 d,以各自培养8 d的成骨诱导和未诱导的第2代cBMSCs复合pDBM常规构建TEB,再分别进行体外成骨诱导培养24 d[3]。从接种pDBM的次日起的第1、4、8、16、24和32天,用DNA定量检测法检测3种细胞在材料上各自的增殖情况(以单纯pDBM作为空白对照)。
1.2.6TEB ALP活性和OCN活性的体外检测[5]
检测时间点同1.2.5,测定3种细胞在材料上各自的ALP表达和OCN沉积。
1.2.7统计学分析
数据以Excel软件处理,行t检验。每个检测样本重复3次,数据以(x±s)表示,P<0.05为差异显著。
2 结果
2.1cBMNCs在pDBM支架材料上的黏附率
cBMNCs的细胞接种密度从10×106cells/mL到 30×106cells/mL时,随着密度的增加,pDBM上的黏附率逐渐增大。之后细胞密度从40×106cells/mL增加至70×106cells/mL,但黏附率却持续走低,提示细胞在pDBM上已过于饱和。原因可能是cBMNCs中除可贴壁细胞外还有较多其他的杂细胞,随着细胞密度的增加,贴壁细胞中混杂的不贴壁细胞数量更多,从而影响和干扰了cBMNCs在材料上的黏附,导致黏附率下降。因此,我们认为30×106cells/mL是cBMNCs复合pDBM的最佳接种密度(图1)。
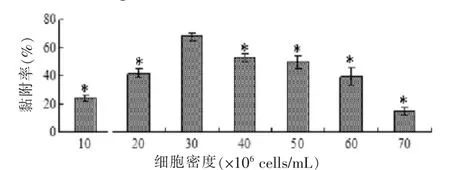
图1 cBMNCs在pDBM上的黏附率Fig. 1 The adhesion rate of cBMNCs on pDBM
2.2TEB细胞活性的体外检测
同样的培养时间内,第2代成骨诱导cBMSCs数量是第2代未成骨诱导cBMSCs的1.6倍。因此,成骨诱导和未诱导cBMSCs接种pDBM的密度是不同的,导致接种第1天成骨诱导cBMSCs-pDBM复合物的细胞量是(0.64±0.08)×106cells/mL,而未成骨诱导cBMSCs-pDBM复合物是(0.40±0.07)×106cells/mL。两者经过3 d的潜伏适应期后,从第4天开始进入了为期5 d的对数增殖期。尽管第8天后都开始成骨诱导,但由于细胞开始进入平台期,增速显著变缓。在成骨诱导和未诱导cBMSCs-pDBM复合物体外培养的第32天(即cBMNCs-pDBM复合物成骨诱导的第24天)检测的细胞量比较显示,成骨诱导cBMSCs-pDBM复合物>未成骨诱导cBMSCs-pDBM复合物>cBMNCs-pDBM复合物(P<0.05)(图2)。
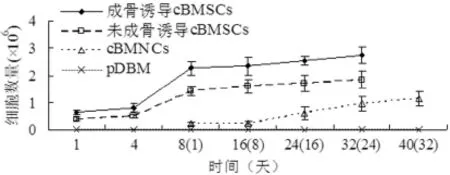
图2 cBMNCs-pDBM复合物、第2代成骨诱导和未诱导cBMSCs-pDBM模拟体内成骨环境下体外培养的细胞活性检测Fig. 2 The growth curves of cBMNCs,osteo-induced and noninduced cBMSCs of passage 2 on pDBM scaffolds under the environment of simulating osteogenesis
2.3TEB ALP活性的体外检测
第2代成骨诱导cBMSCs-pDBM复合物的ALP表达在32 d的体外培养时间内保持持续增加,尤其从接种第4天起增速明显加快,与2.2的检测结果相似。而第2代未成骨诱导cBMSCs-pDBM复合物在8 d的无诱导培养环境下几乎没有ALP表达,cBMNCs-pDBM复合物的ALP表达在体外培养的32 d内也保持持续增加,但第1周的增速很慢,之后增速才加快。尽管在成骨诱导和未诱导cBMSCspDBM复合物体外培养的第32天,检测成骨诱导cBMSCs-pDBM复合物的ALP表达(15.65±1.58 μmol PNP/min·106cells)是cBMNCs-pDBM复合物(6.18±1.49 μmol PNP/min·106cells)的2.5倍,但随着体外培养时间的延长,cBMNCs-pDBM复合物的ALP表达仍继续保持8 d的快速增加,在第32天时达到了(8.87±1.35 μmol PNP/min·106cells),并接近未成骨诱导cBMSCs-pDBM复合物第32天时的(9.19±2.64 μmol PNP/min·106cells),可见其具有很大的成骨潜能(图3)。
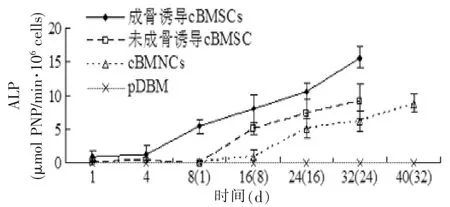
图3 cBMNCs-pDBM复合物、第2代成骨诱导和未诱导cBMSCs-pDBM复合物在模拟体内成骨环境下进行体外培养的ALP检测Fig. 3 The ALP activity of cBMNCs,osteo-induced and noninduced cBMSCs of passage 2 on pDBM scaffolds under the environment of simulating osteogenesis
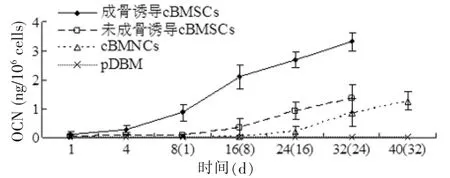
图4 cBMNCs-pDBM复合物、第2代成骨诱导和未诱导cBMSCs-pDBM复合物在模拟体内成骨环境下进行体外培养的OCN检测Fig. 4 The OCN activity of cBMNCs,osteo-induced and noninduced cBMSCs of passage 2 on pDBM scaffolds under the environment of simulating osteogenesis
2.4TEB OCN活性的体外检测
第2代成骨诱导cBMSCs-pDBM复合物和第2代未成骨诱导cBMSCs-pDBM复合物的OCN沉积在体外培养的32 d内的变化趋势类似于ALP定量检测结果。而cBMNCs-pDBM复合物的OCN沉积却出现2周的慢速增加,之后增速才加快。第32天检测OCN沉积,成骨诱导cBMSCs-pDBM复合物(3.32±0.32 ng/106cells)是cBMNCs-pDBM复合物(0.86±0.49 ng/106cells)的近4倍,但随着体外培养时间的延长,cBMNCs-pDBM复合物的OCN沉积仍保持8 d的快速增加,达到(1.26±0.32 ng/106cells),并接近未成骨诱导cBMSCs-pDBM复合物32 d时的(1.37±0.47 ng/106cells),同样证明其巨大的成骨潜能(图4)。
3 讨论
骨组织感染、骨不连、严重创伤、肿瘤切除,以及先天性畸形所造成的大块骨组织缺损,移植是临床修复的难点。TEB克服了自体和异体骨移植所存在的问题,是目前最有发展前景的骨修复方法[6]。种子细胞是构建TEB的重点之一。BMSCs来源稳定可靠,具有非常强的扩增、再生能力[7],而且获取骨髓的创伤相对较小,可反复抽取,多次取材,因此BMSCs是目前用于构建TEB的主要的种子细胞[8-9]。
BMSCs来源于BMNCs,而BMNCs是由单核前体细胞分化形成,单核前体细胞又是通过骨髓中大量未成熟的成单核细胞分化产生。新形成的BMNCs在骨髓中只短暂停留,24 h内即离开骨髓进入循环系统,在外周血停留约8 h后迁移至各组织中,并直接转化成巨噬细胞。单核前体细胞大小为12~18 μm,通常为圆形,细胞核不规则,可形成贴壁,约占骨髓细胞的3%。而BMNCs大小为12~15 μm,呈凹陷形,可缓慢移动,具有很强的贴壁能力[10-11]。
为解决临床即刻骨缺损修复的难题,有研究认为可将BMNCs作为种子细胞复合材料即刻构建TEB来直接回植。尽管已有体内实验证明此方案具有可行性,但无相关体外实验支持。因此,本实验通过在成骨诱导环境下对其进行细胞活性和成骨能力的体外检测来进一步加以验证。
前期研究显示,cBMSCs经体外成骨诱导后能大量扩增,第2代cBMSCs具有良好的成骨活性,并已找出复合pDBM适宜的体外培养天数为8 d[5]。本实验通过黏附率的检测获得了cBMNCs接种pDBM的最佳密度为30×106cells/mL。因此,将此浓度的cBMNCs复合pDBM即刻构建的TEB作为实验组。为了实现体外检测的可靠性,我们采用成骨诱导培养液作为体外培养环境。将第2代成骨诱导和未诱导cBMSCs-pDBM复合物先各自体外培养8 d,再与cBMNCs-pDBM复合物分别用成骨诱导培养液一起进行体外成骨诱导培养,并将cBMNCs-pDBM复合物再继续延长8 d的成骨培养,以验证其细胞生长与成骨分化的潜能。实验结果显示,在24 d的模拟体内成骨环境中,无论是细胞活性还是成骨能力,成骨诱导cBMSCs-pDBM复合物>未成骨诱导cBMSCs-pDBM复合物>cBMNCs-pDBM复合物,但随着体外培养时间的延长,cBMNCs-pDBM复合物的细胞增殖能力和成骨活性仍继续保持8 d的快速增加,接近未成骨诱导cBMSCs-pDBM复合物32 d时的检测结果,与成骨诱导cBMSCs-pDBM复合物之间的差距也进一步缩小,可见若继续培养,cBMNCs-pDBM复合物仍有明显的提升空间。
总之,本实验通过成骨诱导环境下的体外检测,进一步证明了从犬骨髓中分离获取的cBMNCs不经过培养而直接复合pDBM支架材料即刻构建TEB,在同样无体外培养的情况下立即用于体内骨缺损修复的方案具有可行性。
参考文献
[1]Oreffo RO,Triffitt JT. Future potentials for using osteogenic stem cells and biomaterials in orthopedics[J]. Bone,1999,25(2 Suppl):S5-S9.
[2]尹宏宇,刘广鹏,崔磊,等.Percoll法分离犬骨髓单个核细胞与体外成骨诱导培养的实验研究[J].组织工程与重建外科,2007,3 (5):277-279.
[3]Yin H,Cui L,Lui G,et al. Vitreous cryopreservation of tissue engineered bone composed of bone marrow mesenchymal stem cells and partially demineralized bone matrix[J]. Cryobiology,2009,59(2):180-187.
[4]Kasten P,Luginbuhl R,van Griensven M,et al. Comparison of human bone marrow stromal cells seeded on calcium-deficient hydroxyapatite,beta -tricalcium phosphate and demineralized bone matrix[J]. Biomaterials,2003,24(15):2593-2603.
[5]Cui L,Liu B,Liu G,et al. Repair of cranial bone defects with adipose derived stem cells and coral scaffold in a canine model [J]. Biomaterials,2007,28(36):5477-5486.
[6]Reichert JC,Klein TJ,Kuaha K,et al. Bone tissue engineering [J]. Tissue Eng,2010,1:431-456.
[7]Friedenstein AJ,Gorskaja JF,Kulagina NN. Fibroblast precursors in normal and irradiated mouse hematopoietic organs[J]. Exp Hematol,1976,4(5):267-274.
[8]Van Damme A,Vanden Driessche T,Collen D,et al. Bone marrow stromal cells as targets for gene therapy[J]. Curr Gene Ther,2002,2(2):195-209.
[9]Pirraco RP,Obokata H,Iwata T,et al. Development of osteogenic cell sheets for bone tissue engineering applications[J]. Tissue Eng Part A,2011,17(11-12):1507-1515.
[10]Lasser A. The mononuclear phagocytic system:a review[J]. Hum Pathol,1983,14(2):108-126.
[11]Che X,Guo J,Li X,et al. Intramuscular injection of bone marrow mononuclear cells contributes to bone repair following midpalatal expansion in rats[J]. Mol Med Rep,2016,13(1):681-688.
[12]Reichert JC,Cipitria A,Epari DR,et al. A tissue engineering solution for segmental defect regeneration in load-bearing long bones[J]. Sci Transl Med,2012,4(141):135-143.
[13]Wu J,Wang Q,Fu X,et al. Influence of immunogenicity of allogeneic bone marrow mesenchymal stem cells on bone tissue engineering[J]. Cell Transplant,2016,25(2):229-242.
Experimental Study of Constructing Tissue Engineered Bone with Canine Bone Marrow Mononuclear Cells in Vitro
YIN Hongyu1,DING Yude1,LIU Guangpeng2,CAO Yilin3. 1 Department of Maxillofacial Surgery,Plastic Surgery Hospital of Chinese Academy of Medical Sciences & Peking Union Medical College,Beijing 100144,China;2 Department of Plastic Surgery,Shanghai Tenth People's Hospital,Shanghai 200072,China;3 Plastic Surgery Hospital of Chinese Academy of Medical Sciences & Peking Union Medical College,Beijing 100144,China. Corresponding author: CAO Yilin(E-mail: yilincao@yahoo.com).
【Abstract】Objective To explore a method for instantly constructed TEB to meet the instantly clinical requirements of repairing bone defects. Methods BMNCs of Beagle were separated by 1.063 g/mL Percoll gradient solution. The ideal seeding density of 30×106cells/mL was obtained for canine bone marrow mononuclear cells(cBMNCs)on partially demineralized bone matrix(pDBM). The cell activity and osteogenic capacity of immediately constructed TEB composed of cBMNCs and pDBM were analyzed in vitro. ResultsCertain cell activity and osteogenic capacity were confirmed in immediately constructed TEB under the osteogenically inducted environment in vitro. Conclusion The directly replantation of instantly constructed TEB might satisfy the immediately clinical requirements of repairing bone defects.
【Key words】Tissue engineered bone;Bone marrow mononuclear cells;Bone marrow mesenchymal stem cells
【中图分类号】Q813.1+2
【文献标识码】A
【文章编号】1673-0364(2016)02-0094-04
通讯作者:曹谊林(E-mail:yilincao@yahoo.com)。
doi:10.3969/j.issn.1673-0364.2016.02.002
收稿日期:(2015年12月21日;修回日期:2015年2月25日)

