大鼠面神经挤压缺血损伤对巨噬细胞募集的影响
郭煜 欧阳火牛 程志华 罗聪 郭智霖
大鼠面神经挤压缺血损伤对巨噬细胞募集的影响
郭煜欧阳火牛程志华罗聪郭智霖
【摘要】目的研究挤压缺血损伤对面神经修复过程中巨噬细胞募集的影响,为治疗外伤性面瘫提供理论依据。方法60只雄性SD大鼠,随机分为缺血组20只,单纯挤压组20只,对照组20只。缺血组给予左侧面神经挤压并切断面神经表面营养血管,同时在手术显微镜下剥离神经外膜(造成完全缺血);单纯挤压组仅给予左侧面神经挤压,保留表面营养血管;对照组为假手术组。于术后3 d、7 d、14 d检测大鼠行为学及电生理变化;每组5只大鼠取材,切片行组织学观察;使用巨噬细胞特异性抗体CD68进行免疫组化染色,进一步分析巨噬细胞募集情况。结果术后3 d缺血组及单纯挤压组均出现面瘫表现;术后7 d时缺血组及单纯挤压组部分大鼠面瘫情况较术后3 d加重,部分大鼠已出现面瘫恢复迹象;术后14 d缺血组及单纯加压组大鼠面瘫表现较7 d时均有恢复,但缺血组大鼠恢复速度明显缓慢。电生理检测显示,随时间延长,缺血组及单纯挤压组大鼠口轮匝肌复合动作电位最大波幅和潜伏期逐渐恢复,但均未达正常水平。缺血组恢复幅度较单纯挤压组小。组织学观察显示,缺血组大鼠术后免疫组化结果表明巨噬细胞逐渐增多,7 d时达到高峰;单纯挤压组同缺血组类似,但巨噬细胞的数量明显多于缺血组;对照组无明显阳性表达。结论面神经局部营养血管的挤压缺血损伤,可阻碍神经修复过程中巨噬细胞的募集,最终阻碍神经修复过程。
【关键词】面神经挤压缺血损伤巨噬细胞募集
作者单位:200011上海市上海交通大学医学院附属第九人民医院神经外科。
面神经损伤是临床的常见病,致伤原因包括物理和化学两种因素。近年来,针对面神经损伤后的再生机制和相关信号通路进行了广泛深入的研究,但其真正的再生机制仍无定论[1-4,7,14-15]。目前可以肯定的是,在外周神经系统再生过程中,施旺细胞和巨噬细胞具有非常重要的作用[2],前者是构成髓鞘的主要细胞(在中枢神经系统为少突胶质细胞),并在神经损伤后吸引巨噬细胞聚集于损伤局部;后者的主要作用就是吞噬损坏的神经组织,为新生的神经组织创造一个良好的生长环境。本实验拟在已建立的缺血损伤模型基础上,进一步对巨噬细胞的增殖进行研究,观察缺血损伤对于巨噬细胞的募集的影响,并探讨其与神经再生进程之间的关系。
1 材料和方法
1.1实验动物、器材及试剂
60只8周龄SD雄性大鼠(本院实验动物中心提供),体质量200~238 g。随机分为挤压伤伴缺血的缺血组(20只);仅有挤压伤的单纯挤压组(20只);仅暴露面神经不行任何处理的对照组(20只)。同时,行自身双侧对照。
Medelec Synergy T2生理记录仪(Oxford Instruments,UK);大鼠抗小鼠CD68单克隆抗体(Serotec,USA)。
1.2建立挤压缺血模型
大鼠腹腔麻醉,无菌条件下沿左耳下1 cm处横向切开皮肤及皮下筋膜,切口长2 cm。在外耳道软骨前缘后,沿外耳道软骨前缘附近解剖出面神经主干,并向尾侧钝性分离至外耳道软骨后缘,完全暴露面神经。缺血组于面神经出茎乳孔1 mm处用静脉夹持续夹持3 min,然后手术显微镜下剥除神经表面血管。单纯挤压组仅在面神经出茎乳孔l mm处用动脉瘤夹持续夹持3 min。对照组暴露面神经后不作任何处理。3组均在彻底止血后逐层关闭术区。术后给予青霉素局部外用2 d,预防感染。
1.3术后大鼠的行为学评分
正常大鼠面部对称,鼻端向前居中,双侧胡须运动对称,角膜反射灵敏,无闭目不全等症状。术后分别于3 d、7 d、14 d观察大鼠上述表现的变化。
角膜反射:用2 mL注射器18号针头距离鼠眼3 cm处瞬间吹风2 mL,比较双侧眨眼反射的频度、速度和幅度。0分为双侧正常且对称;1分为减弱或延缓;2分为消失。触须运动的观察:通过比较双侧触须细微颤搐、节律性运动的程度进行评分。0分为双侧运动正常且对称;1分为触须运动减弱;2分为消失。鼻尖位置居中为0分;偏斜为1分。最后,总分≥3分,即可判断大鼠存在面神经瘫痪。
1.4神经电生理检测
术后3 d、7 d、14 d分别对大鼠进行面神经颅外段电生理检测,测定口轮匝肌复合电位的最大波幅及最大潜伏期。
1.5组织学检测
于术后3 d、7 d、14 d时切取各组面神经,多聚甲醛固定,脱水透明,浸蜡包埋,切片,HE染色,镜下观察。
1.6免疫组织化学染色
常规石蜡包埋,5 μm厚度连续切片,60℃烤片1 h后脱蜡,PBS冲洗3 min,3次;体积分数3%的H2O2阻断内源性过氧化物酶,室温下15 min,PBS冲洗3 min,3次;滴加山羊血清30 μL阻断非特异性抗原,室温15 min,倾去勿洗,滴加30 μL一抗(大鼠抗小鼠CD68),抗体1∶100稀释,4℃湿盒过夜;PBS冲洗3 min,3次,滴加30 μL生物素化二抗,37℃孵育30 min;PBS冲洗3 min,3次,DAB室温下避光显色;镜下控制,PBS冲洗,苏木精复染,梯度乙醇脱水,二甲苯透明,中性树脂封固。以PBS代替一抗作为空白对照,镜下观察并拍照。
1.7统计学分析
所有计数资料以(x±s)表示,使用SPSS 22.0统计软件进行配对t检验分析组间差异,P<0.05为差异有统计学意义。
2 结果
2.1行为学评分
缺血组及单纯挤压组大鼠术后3 d开始出现面瘫表现,胡须活动减弱,角膜反射消失,鼻尖明显侧偏;对照组无任何变化。术后1周时,缺血组有5只大鼠出现轻微角膜反射,6只大鼠胡须运动有所恢复,其余大鼠均无明显恢复;单纯挤压组9只大鼠出现角膜反射恢复,12只胡须轻微运动;对照组大鼠无任何阳性改变。术后2周,缺血组有7只角膜反射明显恢复,9只出现胡须运动,而所有大鼠鼻尖偏斜未有明显改变;单纯挤压组有9只角膜反射明显恢复,所有大鼠均不同程度出现胡须运动;对照组无任何变化。缺血组的恢复较单纯挤压组缓慢(表1)。

表1 各组术后3 d、7 d和14 d面神经功能评分Table 1 The degree of facial nerve function at 3,7,14 days after operation
2.2电生理检测
电生理检测显示,随时间延长,缺血组及单纯挤压组大鼠口轮匝肌复合动作电位最大波幅和潜伏期逐渐趋向对照组水平,但未完全恢复到对照组水平。缺血组恢复幅度较单纯挤压组小(表2、图1)。

表2 口轮匝肌复合动作电位最大波幅和潜伏期Table 2 The maximum amplitude and latency of Orbicularis oris muscle compound action potential
2.3组织学观察
2.3.1HE染色
术后3 d,缺血组及单纯挤压组轴突均出现肿胀变形,缺血组肿胀更为明显,呈条索状,基底膜腔肿胀,呈串珠状[7-11]。对照组面神经结构规整,神经纤维规则,轴突无明显肿胀及崩解,髓鞘无退变及崩坏。术后7 d,缺血组轴突肿胀加剧,部分崩解消失,髓鞘不连续或已消失成空泡状[8-9];单纯挤压组神经纤维情况与缺血组相似,但变性程度明显较轻。术后14 d,缺血组大量神经纤维崩解坏死,神经结构紊乱,部分神经内膜连续性好,遗留神经纤维坏死轮廓;单纯挤压组肿胀逐渐消退,慢慢恢复正常(图2)。
2.3.2免疫组化染色
对照组在术后3d、7d、14d时,CD68阳性表达无统计学差异;缺血组及单纯挤压组从术后3 d开始CD68阳性表达逐渐增高,在术后1周时达到峰值[10-18],而后逐渐减少。缺血组及单纯挤压组对比,缺血组巨噬细胞的募集数量少于单纯挤压组,这可能与离断了神经营养血管后,外源性巨噬细胞无法到达损伤部位有关。
术后3d时,CD68阳性细胞缺血组(0.20±0.006 个/视野),单纯挤压组(0.40±0.005个/视野),对照组(0.01±0.005个/视野)。
术后7d时,缺血组(0.29±0.007个/视野),单纯挤压组(0.66±0.008个/视野),对照组(0.01±0.005 个/视野)。缺血组及单纯挤压组的阳性细胞数量均高于对照组,缺血组的阳性细胞数量明显少于单纯挤压组(P<0.05)。对照组较术后3 d无明显变化。
术后14d时,缺血组(0.20±0.001个/视野),单纯挤压组(0.46±0.003个/视野),对照组(0.01±0.005 个/视野)。缺血组和单纯挤压组阳性细胞数量与术后7 d时比较均呈明显减少趋势,缺血组减少数量明显多于单纯挤压组(P<0.05),对照组则无明显变化。
综上所述,对照组术后3d、7d、14d阳性细胞表达无统计学意义;缺血组和单纯挤压组阳性细胞于术后3d起均开始增多,术后7d达到高峰,术后14d数量减少,但缺血组阳性表达数的高峰较单纯挤压组低,数量减少幅度较单纯挤压组大,差异有统计学意义(P<0.05)(图3-4)。

图1 口轮匝肌复合电位最大波幅及潜伏期变化趋势Fig. 1 Change trends of the maximum amplitude and latency of orbicularis oris muscle
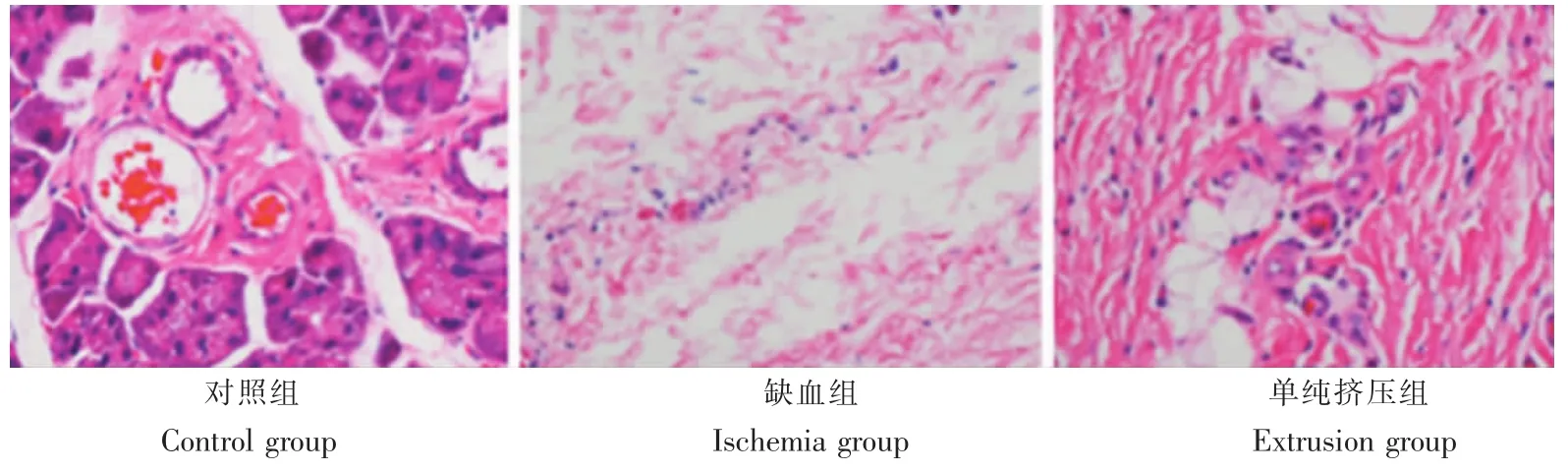
图2 术后7d各组HE染色结果(400×)Fig. 2 Histological observation by HE staining in each group 7 days after operation(400×)
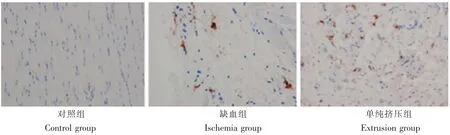
图3 术后7 d各组CD68表达情况(400×)Fig. 3 CD68 expression in each group 7 days after operation(400×)

图4 各组CD68表达的变化趋势Fig. 4 Change trend of CD68 expression in each group
3 讨论
面神经由于解剖位置的特殊性,容易受到损伤而造成面瘫,影响患者的生活和社交。面神经损伤后的修复和再生涉及一系列复杂的细胞和分子生物学改变[8-11]。
周围神经系统(PNS)与中枢神经系统(CNS)不同[14-15],损伤后具有较强的再生能力[7-14],再生过程涉及神经元的再生以及非神经细胞(包括雪旺细胞和一些免疫细胞)的募集。巨噬细胞是神经损伤修复过程中具有关键作用的一类免疫细胞。神经损伤后,大量的巨噬细胞聚集在损伤部位,这不仅是华勒氏变性(Wallerian degeneration)所必须的,更是清除崩坏的髓鞘和吞噬神经残端,为神经再生提供良好的环境所必要的。大量的坐骨神经单纯挤压损伤模型阐明了巨噬细胞的吞噬功能可为神经再生提供一个适宜的微环境。面神经损伤后,受损部位远心端发生华勒氏变性,轴索和髓鞘变性坏死,形成碎片,局部雪旺细胞活化增生,在吞噬碎片的同时,释放巨噬细胞趋化因子和神经生长因子、细胞外基质和表面黏着分子等。巨噬细胞趋化因子诱导大量巨噬细胞聚集,并吞噬清除轴突和髓鞘破损碎片,创造一个适宜面神经再生的局部环境[1-2]。而巨噬细胞到达损伤部位的主要途径就是血流[12-13],因此在各种原因引起的神经营养血管的损伤(切割,局部水肿压迫等)均会延缓甚至阻断面神经的再生过程。
本实验基于大鼠面神经缺血模型[2],进一步探讨单纯损伤和神经血供缺失后巨噬细胞的表达情况。通过大体行为学评估以及电生理检测等手段,我们观测到面神经缺血损伤的恢复过程要较单纯损伤更漫长,恢复的效果也较差。我们发现,缺血损伤后的巨噬细胞虽然在变化趋势上与单纯损伤组一致,但表达数量较单纯损伤组要少。因此我们认为,面神经局部营养血管的缺失直接导致了神经修复过程中巨噬细胞募集的障碍,损伤神经周围崩坏的髓鞘碎片以及神经残端无法及时有效清除,使神经再生过程无法在一个适宜的环境中进行,最终阻碍了神经修复过程。
参考文献
[1]Hoke A,Brushart T. Introduction to special issue:challenges and opportunities for regeneration in the peripheral nervous system [J]. Exp Neurol,2010,223(1):1-4.
[2]王志兴,郭智霖,程志华,等.局部缺血对面神经损伤后雪旺细胞增殖的影响[J].组织工程与重建外科,2013,5(3):150-152.
[3]Brown BN,Ratner BD,Goodman SB,et al. Macrophage polarization:an opportunity for improved outcomes in biomaterials and regenerative medicine[J]. Biomaterials,2012,33(15):3792-3802.
[4]Webber C,Zochodne D. The nerve regenerative microenvironment:early behavior and partnership of axons and Schwann cells[J]. Exp Neurol,2010,223(1):51-59.
[5]Cattin AL,Burden JJ,Van Emmenis L,et al. Macrophage-induced blood vessels guide schwann cell -mediated regeneration of peripheral nerves[J]. Cell,2015,162(5):1127-1139.
[6]Chen P,Bonaldo P. Role of macrophage polarization in tumor angiogenesis and vessel normalization:implications for new anticancer therapies[J]. Int Rev Cell Mol Biol,2013,301:1-35.
[7]Chen P,Cescon M,Zuccolotto G,et al. Collagen VI regulates peripheral nerve regeneration by modulating macrophage recruitment and polarization[J]. Acta Neuropathol,2015,129(1):97-113.
[8]Chernov AV,Dolkas J,Hoang K,et al. The Calcium-binding proteins S100A8 and S100A9 initiate the early inflammatory program in injured peripheral nerves[J]. J Biol Chem,2015,290 (18):11771-11784.
[9]Dessing MC,Tammaro A,Pulskens WP,et al. The calcium-binding protein complex S100A8/A9 has a crucial role in controlling macrophage-mediated renal repair following ischemia/reperfusion [J]. Kidney Int,2015,87(1):85-94.
[10]Diaz-Munoz MD,Osma-Garcia IC,Iniguez MA,et al. Cyclooxygenase -2 deficiency in macrophages leads to defective p110 gamma PI3K signaling and impairs cell adhesion and migration[J]. J Immunol,2013,191(1):395-406.
[11]Doulatov S,Notta F,Eppert K,et al. Revised map of the human progenitor hierarchy shows the origin of macrophages and dendritic cells in early lymphoid development[J]. Nat Immunol,2010,11(7):585-593.
[12]Ferrante CJ,Leibovich SJ. Regulation of macrophage polarization and wound healing[J]. Adv Wound Care(New Rochelle),2012,1 (1):10-16.
[13]Ferrante CJ,Pinhal-Enfield G,Elson G,et al. The adenosinedependent angiogenic switch of macrophages to an M2 -like phenotype is independent of interleukin-4 receptor alpha(IL-4 Ralpha)signaling[J]. Inflammation,2013,36(4):921-931.
[14]Franco R,Fernández-Suárez D. Alternatively activated microglia and macrophages in the central nervous system[J]. Prog Neurobiol,2015,131:65-86.
[15]Gomez PE,Klapproth K,Schulz C,et al. Tissue -resident macrophages originate from yolk -sac -derived erythro -myeloid progenitors[J]. Nature,2015,518(7540):547-551.
·论著·
The Effect of Facial Nerve Crush Injury and Ischemia on the Recruitment of Macrophages in Rats
GUO Yu,OUYANG Huoniu,CHENG Zhihua,LUO Cong,GUO Zhilin. Department of Neurosurgery,Shanghai Ninth People's Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China. Corresponding author: GUO Zhilin(E-mail: gzlysr@126.com).
【Abstract】ObjectiveTo study the influence of the facial nerve crimping ischemia injury on the recruitment of macrophage in rats,and to provide theoretical basis for clinical application of traumatic facial paralysis. Methods Sixty SD rats were randomly divided into 3 groups:20 in ischemia(extrusion+ischemia)group;20 in extrusion(extrusion only)group;20 in control group. Rats in ischemia group received an operation that extruding the left facial nerve,cutting off the surface nutrition blood vessels of the facial nerve and stripping epineurium under operating microscope(ischemia completely);The rats in extrusion group just received the extrusion on the left facial nerve but the nutrition blood vessels were preserved;The control group rats served as sham group. At 3 days,7 days,14 days after operation,behavioral observation and electrophysiological detection were given to each group. After assessment,5 rats were sacrificed in every group for immunohistochemistry(using macrophage specific antibody CD68),in order to study macrophages further. Results 1. Behavioral observation:At 3 days after operation,all rats in ischemia group and extrusion group showed facial paralysis. Then,at 7 days after operation,part of the rats' facial paralysis were aggravated,the other rats had recovery performance;At 14 days after operation,facial paralysis recovery was observed in experimental groups. However,the recovery rate of the ischemia group is significantly slower. 2. Electrophysiological detection:With the extension of time,orbicularisoris muscles compound action potential maximum amplitude and latency period in ischemia group and extrusion group were gradually approached to the control group. But didn’t achieve the normal level. The recovery rate in ischemia group was relatively lower than in extrusion group. 3. Histological observation:Immunohistochemical results showed that the macrophages gradually increased in ischemia group,until reached a peak at 7 days after operation;The result in extrusion group wassimilar but the number of macrophages was more than in ischemic group;No significant positive expression was observed in control group. ConclusionFacial nerve crush injury and ischemia can hinder the recruitment of macrophages,eventually hinder the process of nerve repair.
【Key words】Facial nerve;Crush Injury and Ischemia;Macrophages;Recruitment
【中图分类号】R651.3
【文献标识码】A
【文章编号】1673-0364(2016)02-0102-05
通讯作者:郭智霖(E-mail:gzlysr@126.com)。
doi:10.3969/j.issn.1673-0364.2016.02.004
收稿日期:(2016年1月20日;修回日期:2016年3月2日)

