血管瘤和脉管畸形诊断和治疗指南(2016版)
中华医学会整形外科分会血管瘤和脉管畸形学组
血管瘤和脉管畸形诊断和治疗指南(2016版)
中华医学会整形外科分会血管瘤和脉管畸形学组
第一部分 血管瘤和脉管畸形的分类(ISSVA2014版)
1982年,John B.Mulliken首次提出基于血管内皮细胞生物学特性的分类方法,将此前传统意义的“血管瘤”(Vascular anomalies)重新分为血管瘤和脉管畸形,并阐释了两者最本质的差别,即血管肿瘤存在血管内皮细胞的异常增殖,而血管畸形则无此现象。该观点被广泛认同,从而成为现代分类的基础。
1992年,国际血管瘤和脉管畸形研究学会(The International Society for the Study of Vascular Anomalies,ISSVA)在匈牙利布达佩斯成立,并在1996年制订了一套较为完善的分类系统(表1-1),成为国际上各学科交流的共同分类基础。
2014年4月,在澳大利亚墨尔本召开的第20 届ISSVA大会上,提出对ISSVA分类的全面修订草案,并于2015年发表(表1-2~1-9)。主要变化体现在:①把血管性肿瘤更加细分为良性、局部侵袭性(交界性)及恶性三类;②婴幼儿血管瘤依据形态和侵袭深度进行了分类;③血管畸形的分类更为细化;④将原分类中的一些疾病划归为确切分类待定,如疣状血管瘤、角化性血管瘤等;⑤增列了多种疾病的致病基因;⑥增加了血管病变相关综合征;⑦增列了合并血小板计数及凝血异常的血管性病变;⑧增加先天性部分消退型血管瘤。此分类系统体现了对血管瘤和脉管畸形的认识进展,更为完善,建议采用。
本指南所包含的常用字母缩写分别为:C:毛细血管;A:动脉;V:静脉;L:淋巴管;M:畸形。
虽然多个学科都有类似的分类方案,尤其在脉管畸形领域;但鉴于ISSVA分类具有前瞻性和实用性,已经在脉管畸形领域长期、广泛使用,故本学组推荐ISSVA分类(2014)方案为指南指定的方案。

表1 ISSVA血管瘤和脉管畸形分类(1996年)
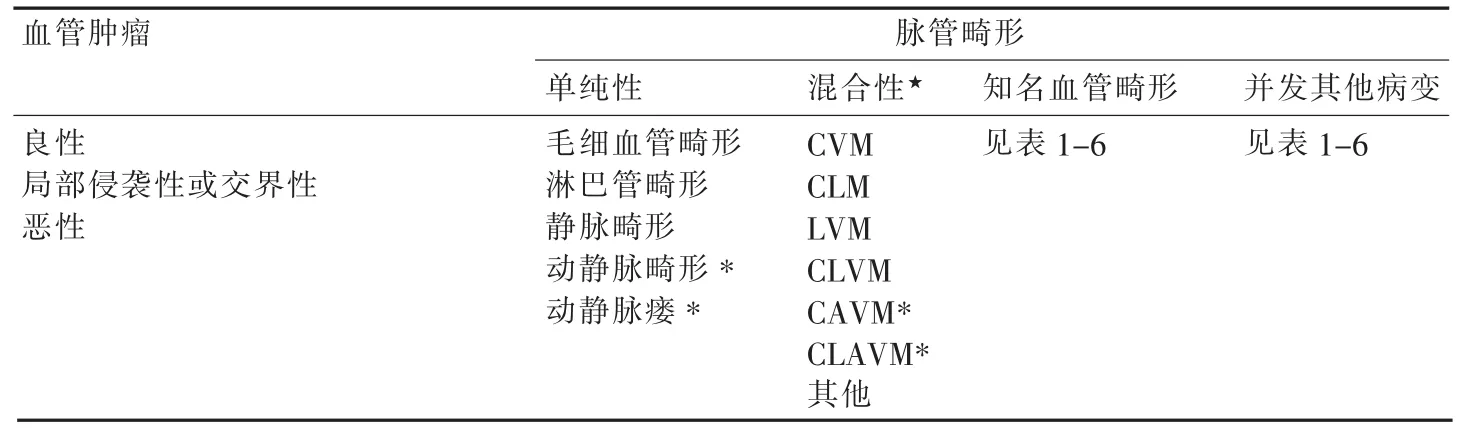
表1-2 ISSVA血管瘤与脉管畸形分类(2014年)

表1-3 血管肿瘤的ISSVA分类(2014年)

表1-4 血管畸形(单纯性血管畸形)的ISSVA分类(2014年)

表1-5 血管畸形(混合性血管畸形★)的ISSVA分类(2014年)

表1-6 血管畸形(其他类型)的ISSVA分类(2014年)

表1-7 已发现相关致病基因的血管性病变

表1-7(续)已发现相关致病基因的血管性病变

表1-8 婴幼儿血管瘤

表1-9 可能合并血小板数量或凝血异常的血管性病变
第二部分 血管瘤和脉管畸形的发病机制
婴幼儿血管瘤(Infantile hemangioma),是来源于血管内皮细胞的先天性良性肿瘤。婴幼儿血管瘤一般出生后1周左右出现,男女发病比例约为1∶3。在患儿1岁以内血管瘤处于增殖期,1岁左右逐渐进入消退期,大多数血管瘤可完全消退。据文献报道,1岁时血管瘤的消退率约为10%,5岁时约为50%,7岁时可达70%。而脉管畸形则是血管或淋巴管的先天性发育畸形,出生时即有,但有时并不明显,出生后逐渐明显。脉管畸形的男女发病率相等,不会自行消退,随患者的生长发育等比例生长。
血管瘤的病因与发病机制目前尚未明确,目前主要认为与“血管新生”(Angiogenesis)和“血管生成”(Vasculogenesis)密切相关,且近年认为后者起主要作用。血管瘤的组织病理学研究显示,增殖期血管瘤组织中,多种内皮细胞因子、成血管因子、生长因子、血管内皮细胞受体家族(VEGF-R)、骨髓标志物等均高表达;而在消退期血管瘤组织中,内皮细胞凋亡加速、肥大细胞(Mast cell)以及金属蛋白酶组织抑制因子(Tissue inhibitor of metalloproteinase 1,TIMP)等水平上调。因此认为,血管瘤的形成可能是由于局部微环境的变化以及内皮细胞自身转化的异常,从而导致血管内皮细胞的异常增殖。与血管内皮细胞异常增殖相关的因素主要有:①血管形成因子与血管形成抑制因子之间平衡失调;②细胞组成及其功能的变化,如肥大细胞、周细胞、免疫细胞异常;③雌激素水平升高;④细胞外基质和蛋白酶表达变化;⑤局部神经支配的影响;⑥凋亡学说等。
脉管畸形则是血管或淋巴管的先天发育畸形,其发生是由于胚胎发育时期“血管生成”(Vasculogenesis)过程的异常,从而导致血管结构的异常。毛细血管畸形也称为葡萄酒色斑或鲜红斑痣。葡萄酒色斑的发病机制包括两个部分:先天性(基因突变)及后天性(血流动力学及血管新生)。毛细血管畸形也可合并不同的血管畸形,例如:Sturge-Weber综合征、Klippel-Trenaunay综合征和Parkers Weber综合征等。2003年,从偶发的葡萄酒色斑家族性病例中发现RASA基因的失活性突变,而这些患者的临床表现具有一定的特征性,从而命名RASA基因突变所对应的疾病为毛细血管畸形-动静脉畸形综合征(Capillary malformation-arteriovenous malformation,CM-AVM),对68个家系病例的进一步验证也证实了RASA基因突变可特异性地造成CM-AVM。近年来,利用全基因组测序的方法比较了3例Sturge-Weber综合征患者的病灶组织和全血基因组,从而发现GNAQ基因上c.548G→A,p.Arg183Gln突变,进一步在88%Sturge-Weber综合征和92%无综合征表现的葡萄酒色斑患者体细胞中验证了GNAQ基因的单个碱基突变,从而证实了长久以来对于Sturge-Weber综合征与葡萄酒色斑先天性因素的假说。而对于静脉畸形(Venous malformation,VM),仅家族遗传性VM的发病机制研究已较为透彻,皮肤黏膜静脉畸形是由定位于染色体9p21的TEK突变引起,该突变为细胞内激酶区域的精氨酸被色氨酸替代(R849W);在散发型VM患者中,仅有近50%患者(28/57)能检测到TEK基因突变,但其中80%突变表现为激酶区域的亮氨酸被苯丙氨酸替代(L914F)。球细胞静脉畸形为另一种特殊类型的静脉畸形,其突变位点位于1p21-22区域内,该突变将造成肾小球蛋白(Glomulin)缺乏,血管平滑肌分化异常,形成特征性的球细胞。
第三部分 血管源性肿瘤的诊断和治疗
1婴幼儿血管瘤
1.1临床表现
婴幼儿血管瘤是指由胚胎期间的血管组织增生而形成的,以血管内皮细胞异常增生为特点,发生在皮肤和软组织的良性肿瘤。最早期的皮损表现为充血性、擦伤样或毛细血管扩张性斑片。生后6个月为早期增殖期,瘤体迅速增殖,明显隆起皮肤表面,形成草莓样斑块或肿瘤,大小可达最终面积的80%。之后增殖变缓,6~9个月为晚期增殖期,少数患儿增殖期会持续至1岁之后,瘤体最终在数年后逐渐消退。未经治疗的瘤体消退完成后有25%~69%的患儿残存皮肤及皮下组织退行性改变,包括瘢痕、萎缩、色素减退、毛细血管扩张和皮肤松弛。
根据相关文献,建议将血管瘤分为3个风险等级(见表3-1)。
1.2诊断及鉴别诊断
婴儿血管瘤根据病史、临床表现、影像学检查可诊断。浅表型婴儿血管瘤早期应与微静脉畸形区别;深在型婴儿血管瘤应与脉管畸形(静脉畸形、动静脉畸形等)区别(见表3-2)。
1.3辅助检查
90%以上的患儿局部B超检查即可了解瘤体的范围及血供情况,少数位于头皮、骶尾部、重要器官周围的瘤体,需要行MRI检查了解是否累及周围组织器官以及侵及的程度。
1.4治疗
1.4.1治疗方法及适应证
婴儿血管瘤主要以局部外用和系统用药为主,辅以激光或局部注射等,目的是抑制血管内皮细胞增生,促进瘤体消退,减少瘤体残留物。①高风险血管瘤:尽早治疗。一线治疗为口服普萘洛尔,若有禁忌症,则可系统使用糖皮质激素。②中度风险血管瘤:尽早治疗。早期而菲薄的病灶可给予外用β受体阻滞剂,也可加用脉冲染料激光;治疗过程中,若不能控制瘤体生长,则遵循高风险血管瘤方案。③低度风险血管瘤:如果很稳定,可以随诊观察,或尝试使用外用药物,如果瘤体生长迅速,则遵循中度风险血管瘤方案。④消退期和消退完成期血管瘤的进一步治疗,比如以唇部血管瘤的整形治疗为例,最佳年龄是3~4岁,因为之后血管瘤自发消退的改善不再明显,如果推迟治疗,则可能对患儿心理或其他功能造成影响。
1.4.2治疗方法的选择
1.4.1.1局部外用药物适用于浅表型婴幼儿血管瘤,常用的药物如下。
①β受体阻滞剂类,如普萘洛尔软膏、噻吗洛尔乳膏、噻吗洛尔滴眼液、卡替洛尔滴眼液等。用法及疗程:外涂于瘤体表面,每天2~4次,持续用药3~6个月或至瘤体颜色完全消退,通常用药第2~3个月疗效最为明显。除个别报道有变态反应性接触性皮炎外,还可能有发红、蜕皮等局部不良反应。
②5%咪喹莫特:隔日夜间睡前薄层外涂于瘤体表面,次日洗去,疗程16周。常见皮肤反应:红斑、表皮剥落、结痂等,发生不良反应时需及时停药,等待皮肤恢复后方可继续用药。由于该药物容易引起皮肤强烈的免疫反应,导致后期皮肤质地改变甚至瘢痕形成,故建议慎用,包括有外用β受体阻滞剂禁忌症的患儿。
1.4.1.2局部注射
①糖皮质激素:主要适用于早期、局限性、深在或明显增厚凸起的血管瘤,治疗终点为病灶体积缩小,甚至接近平坦。在眼周甚至更远区域,偶有报道可能因注射物逆流而导致眼动脉及其他动脉栓塞缺血而导致并发症。
②博莱霉素、平阳霉素及其他抗肿瘤药物:用于口服或局部注射糖皮质激素效果不佳时,为防止偶发的过敏,建议在注射过程中保持静脉补液通畅。另过度治疗可诱发晚期注射区域发育迟缓或障碍。
③局部脉冲染料激光:通常为585/595 nm脉冲染料激光,常用于浅表型婴儿血管瘤增殖期抑制瘤体增殖,血管瘤溃疡、消退期后减轻血管瘤的颜色或毛细血管扩张性红斑。该治疗并无病灶选择性,对深部病灶无法抑制其生长,以不形成新的皮肤损伤为前提。
1.4.1.3系统治疗
①普萘洛尔:目前建议剂量为1.5~2 mg/kg·d,分2次服用。使用本药物治疗时要注意适应证。用药前应对患儿进行全面的体格检查,包括心肌酶、血糖、肝肾功能、心电图、心脏彩超、甲状腺功能、胸片等。治疗可在门诊由有经验医师指导下进行,由患儿家长对患儿服药后情况进行监测。治疗起始剂量为每天1.0 mg/Kg,分2次口服。首次服药后观察患儿有无肢端湿冷、精神萎靡、呼吸困难和明显烦躁等现象。如患儿能够耐受,首次服药12 h后继续给药,剂量仍为0.5 mg/Kg。如患儿仍然无明显异常,第2天增量至每天1.5 mg/Kg,分2次口服,并密切观察。如无异常反应,第3天增量至每天2.0 mg/Kg,分2次口服,后续治疗以此剂量维持。服药期间定期复诊,服药后的前3个月4周复诊一次,3个月后可6~8周复诊一次,每次复诊应复查生化、心脏彩超及局部B超,以评估不良反应及疗效,若出现心肌损害、心功能受损、喘息、低血糖等情况,应对症治疗或由相应科室会诊,在此期间,普萘洛尔剂量应减半,不良反应严重时需停用。口服普萘洛尔瘤治疗婴儿血管瘤无确切停药年龄限制,4岁以内均可用药,瘤体基本消退(临床及B超结果),可考虑在1个月内逐渐减量至停药。因为可能会出现停药后复发现象,服药疗程通常会超过1年,停药年龄经常会延续到15月龄以上。
②糖皮质激素:口服泼尼松3~5 mg/Kg(总量不超过50 mg),隔日早晨1次顿服,共服8周;第9周减量1/2;第10周,每次服药10 mg;第11周,每次服药5 mg;第12周停服,完成1个疗程。如需继续,可间隔4~6周重复同样疗程。该治疗现可用于具有全身用药适应证而不适合于普萘洛尔治疗的病例。用药期间可能有身高、体重和血压等的暂时性影响,应密切监测。服药期间应停止疫苗接种,直至停药后6周以上。
1.4.1.4外科手术
部分IH患儿即使经过及时的非手术治疗,包括普萘洛尔治疗,仍会遗留明显外观或功能问题,如瘤体消退后仍残留明显畸形、增生期出现溃疡而遗留永久性瘢痕、非手术治疗不足以及时解决功能障碍等。手术在改善外观、快速去除病灶、美容性重建及改善功能障碍等方面有其独特优势。
婴儿期(IH增生期)在非手术治疗无法达到有效控制病情的情况下,不排除选择手术治疗,比如如下情况:①影响视力发育;②呼吸道阻塞;③外观畸形,比如可手术切除的头皮IH、窄蒂的IH等;④出血;⑤对非手术治疗无效的溃疡。因婴儿期手术后瘢痕较儿童期更不明显,故不排除在婴儿期进行手术。
儿童早期(IH消退期)即1岁左右至学龄前期,手术切除IH的指征包括:①非手术难以改善的皮肤松弛、溃疡后疤痕、难以消退的纤维脂肪组织残留等,如推迟手术无助于获得更好外观者;②预计手术后功能及外观效果均较理想者,如手术瘢痕不明显或符合亚单位分区原则等。
儿童后期(IH消退后期)即入学后的小学期间,手术切除指征为所有非手术难以改善但预计通过手术可得到较理想改善的皮肤松弛、皮肤损害、溃疡后疤痕、难以消退的纤维脂肪组织残留等。
在拟定IH手术方案前,需要对IH的特殊性有清晰的认识。IH是良性肿瘤,如何获得尽可能完美的术后外观和功能改善是IH手术重点关注的问题。手术要注意以下几点:①首先矫正畸形最明显的部位;②手术切口尽可能隐蔽或不明显;③尽可能将切除的组织充分利用;④设计方案和操作严格按美容性重建原则。总之,外科医生应以患儿为中心,从患儿外观、功能、心理发育以及手术风险等多方面综合考虑,并结合医生本人手术经验,谨慎权衡利弊,最终通常可获得最大限度的外观和功能改善。
2血管内皮瘤
2.1临床表现
血管内皮瘤指血管内皮来源的增殖性的良性、交界性或恶性肿瘤,包括卡波西形血管内皮瘤(Kaposiform hemangioendothelioma,KHE)、丛状血管瘤(Tufted angioma,TA)、梭形细胞血管内皮瘤(Spindle cell hemangioendothelioma,SCH)和其他少见血管内皮瘤(上皮样血管内皮瘤,混合性血管内皮瘤,网状血管内皮瘤,多形性血管内皮瘤,血管内乳头状血管内皮瘤,良性淋巴管内皮瘤)。血管内皮瘤发病率低,无明显年龄和性别差异,外观表现为皮肤黏膜缓慢生长的单发或多发结节或斑块,大多数无特征性的临床表现。梭形细胞血管内皮瘤表现为好发于肢体的结节,伴有静脉石产生,具有一定的诊断意义。而KHE和TA可引起Kasabach -Merritt现象(Kasabach-Merritt phenomenon,KMP),这是在脉管性疾病基础上伴发血小板减少、微血管溶血性贫血和消耗性凝血功能障碍的一类临床表现,其病程凶险,患者往往因凝血功能紊乱、败血症以及重要器官的损害而预后不佳。
2.2诊断
血管内皮瘤临床表现及影像学均无特征性表现,均需通过病理学明确诊断。其中,KHE病理上同时结合了婴幼儿血管瘤及结节期卡波西肉瘤的特点,最特征性的表现为病灶由许多实性的边界不清的结节构成,结节之间由结缔组织分隔开。每一个结节由小的毛细血管和内皮细胞团组成,呈肾小球样结构。丛状血管瘤特征是毛细血管和内皮细胞像“加农炮弹”一样分布,有裂隙样腔隙的小而紧密排列的血管以圆型、椭圆型的方式成簇随机分布于真皮层。增大的内皮细胞紧密排列,使毛细血管腔难以辨认。出血和含铁血黄素沉积很明显,梭形细胞血管内皮瘤病理上最典型的表现为薄壁的扩张静脉,管腔中通常可见血栓或静脉石,在这些静脉之间可见成簇梭形细胞。其他少见血管内皮瘤亦各有特征性的病理表现。
2.3辅助检查
影像学检查可辅助诊断及鉴别诊断。彩色多普勒可检测病灶内血流量,与其他低流量或高流量脉管畸形相鉴别。MRI检查可明确病灶范围。对大多数的病例,活检通常是必不可少,病理学诊断是血管内皮瘤的诊断金标准。此外,需要定期复查血常规,以明确血小板水平及凝血功能,判断Kasabach-Merritt现象是否发生及严重程度。
2.4治疗
2.4.1KHE和TA
针对KHE和TA的治疗可分为3种情况:①病灶稳定无临床症状,不伴有KMP。可观察随访,少数局限、表浅的病灶可选择手术切除。②病灶增大或有临床症状,但不伴有KMP。可选择口服泼尼松龙2~3 mg/Kg·d,服用3~4周后评估临床疗效并确定是否停药。口服阿司匹林2~5 mg/kg/d可作为其辅助治疗。③伴有KMP。一线治疗口服泼尼松龙2~3 mg/Kg·d (5 mg/Kg qod)或静脉用甲强龙1.6 mg/Kg·d,长春新碱0.05 mg/Kg每周一次静脉滴注,监测血小板变化情况,输注血小板只适用于手术前或有急性出血时,不作为常规治疗。一线治疗效果不佳时,可联合使用环磷酰胺10 mg/Kg·10 d。雷帕霉素0.1 mg/Kg·d可作为二线治疗,其作为一种新疗法有很好的前景,未来有望成为缓解KMP及控制KHE或TA的一线治疗方法。普萘洛尔在较多研究中证实对于KMP现象效果不佳,不建议单独使用。
2.4.2梭形细胞血管内皮瘤
单纯切除病灶可达到一定治疗效果,但60%的病例出现邻近皮肤及软组织的复发。伴有Maffucci综合征的患者需密切随访,其内生软骨瘤有很高风险转变为内生软骨肉瘤。
2.4.3其它少见血管内皮瘤
其他血管内皮瘤治疗相对较棘手。其发生率较低,目前尚无治疗共识,手术治疗被认为是唯一的根治方法。病灶较小者可通过手术完整切除,但手术复发率较高。如无明显增长或并发症,可选择观察随访。
3Kasabach-Merritt现象
自1940年Kasabach和Merritt报道了“毛细血管瘤”伴发血小板减少性紫癜的首个病例后,文献中引发上述症状的病灶诊断涵盖了多类“血管瘤”和“脉管畸形”,这类在脉管性病变基础上伴发一系列凝血功能异常的疾病,被概括为Kasabach-Merritt综合征(Kasabach-Merritt syndrome,KMS)。
Enjohras等和Sarkar等在1997年先后报道了典型KMS患儿的病理学研究结果,提出KMS的实质病灶为卡波西形血管内皮瘤(Kaposiform hemangioendothelioma,KHE)或丛状血管瘤(Tufted angioma,TA),而不是婴幼儿血管瘤(Infantile hemangioma,IH)。分属交界性和良性肿瘤的KHE和TA之间存在互相转变,部分病灶介于两者之间的现象也有大量报道。
Kasabach-Merritt现象(Kasabach-Merritt phenomenon,KMP)是在脉管性疾病基础上伴发血小板减少、微血管溶血性贫血和消耗性凝血功能障碍的一类临床表现,其病程凶险,患者往往因凝血功能紊乱、败血症,以及重要器官的损害而预后不佳,死亡率高达20%~30%。KMP多发生于新生儿或婴幼儿,在小儿血管性疾病中,KMP的发生率约为1/300,男女发病率相似。
3.1组织病理学特征及发病机制
目前普遍认可KHE/TA基础上发生KMP的病理机制包括:①异常增殖的血管内皮细胞对血小板的“捕获”作用,促使血小板黏附、聚集和活化,进而在局部激活凝血级联反应,纤维蛋白大量沉积形成微血栓,使得包括血小板在内的血液成分大量潴留,加剧了血小板和凝血因子的消耗。纤溶系统的相应亢进造成瘤内出血,肿瘤快速增大,并引起新一轮的凝血物质消耗,最终诱发弥散性血管内凝血。②KHE/TA的超微结构显示其内皮细胞基底膜薄弱,缺乏连续性,为凝血因子和胶原蛋白的相互作用创造了条件,可以一定程度上解释血小板减少和水肿、血栓形成等现象。③KHE/TA的特殊组织结构决定了其异常的血流动力效应(高流量和切应力),即细小而迂曲的毛细血管直接从大血管分出,容易形成湍流,导致血小板滞留和活化。血小板减少与凝血因子减少最终导致肿瘤内出血,表现为血管瘤快速增大伴紫癜,血小板计数迅速降低,凝血功能低下,严重者可导致颅内或消化道出血等严重并发症,最终引起患者死亡。
3.2临床表现、诊断及鉴别诊断
KMP主要表现为迅速增长的血管肿瘤KHE/ TA,常伴有不同程度的出血及炎症样表现。血管肿瘤多在出生时即存在,可位于皮肤、肌肉,也可位于腹膜后、纵隔、肝脾等实质脏器,以及骨骼、眼眶和颅内等。血管肿瘤可在短期内突然迅速增大并向周围扩散,表面紫红、温热,质硬有触痛,局部有瘀斑。实验室检查血小板明显减低,常低至20×109/L。发生DIC时,纤维蛋白原明显降低、纤维蛋白降解产物(FDP)或D-二聚体增高,同时有一定程度的微血管病性溶血性贫血。
根据血管肿瘤的典型病史,显著的出血倾向和血小板减少及相应的实验室检查,病变活检常提示卡波西形血管内皮瘤/丛状血管瘤(KHE/TA),对本症的诊断一般无困难。辅助诊断中B超是明确和监测大部分血管病变的主要手段。增强CT及MRI对诊断亦有价值,CT平扫表现为均匀或不均匀的低密度灶,增强呈明显强化;MRI T1W1呈等、低信号,T2W1呈等、高信号,增强呈不均匀显著强化。
KHE/TA应与其他类型血管性肿瘤相鉴别,如普通婴幼儿血管瘤(特别是病灶位于皮下,缺乏表面鲜红色斑片的深部病灶)、先天性血管瘤(快速消退型和不消退型)及血管肉瘤(以内皮细胞和纤维母细胞性组织增生形成的恶性度极高的肿瘤,以青少年多见,好发于四肢皮下组织,病理检查可确诊)鉴别。特别是近年发现,快速消退型先天性血管瘤(RICH)也可能出现一过性血小板降低。
3.3治疗方法
术前完善常规检查,包括血尿常规、肝肾功能、凝血功能、心电图、胸片等,定期复查血常规、凝血功能等,应用彩超、MRI和CT检查了解病变情况。
3.3.1手术治疗
KHE和TA的高浸润性常造成界限不清,并累及重要的血管神经甚至内脏器官,手术风险大,除少数局限、表浅的病灶首选手术切除外,目前多主张在药物有效控制病灶体积后,再行手术根治。但当药物治疗无效或起效前即出现病危的患者,姑息性手术切除仍不失为一种有效手段,术中可先行缝合以减少肿瘤血供,术后则辅以化疗预防残灶扩大。
3.3.2介入栓塞
在病灶巨大无法手术切除或凝血功能急剧恶化的危重病例中,在血管造影辅助下对KHE/TA的主要滋养血管进行选择性的药物或材料栓塞,可暂时缩小病灶,缓解凝血障碍,为进一步的手术或药物治疗创造条件,但可并发肢体、器官缺血梗死及感染,婴幼儿期治疗更增加了这一风险。
3.3.3全身用药
全身用药是目前KMP的首选治疗方法。一个多中心、多学科的调查研究展示了目前的诊疗共识:KHE/TA合并KMP的一线药物排序中,第一位为糖皮质激素联合长春新碱方案,两者的单独用药则分列第二、三位,之后推荐糖皮质激素联合普洛萘尔、环磷酰胺、雷帕霉素等。①糖皮质激素:可抑制血管内皮细胞异常增殖,降低炎性反应,用于血管肿瘤的治疗。但治疗KMP效果变异较大,近1/3患者对单独用药不敏感,但目前仍是一线药物。其他类似联合方案,比如,泼尼松∶甲泼尼龙∶地塞米松(5∶4∶0.75)方案。每天口服泼尼松2~3 mg/Kg,2~4周,被认为较为安全,2周后无效则应联合其他手段,每天以地塞米松0.32 mg/Kg或甲泼尼龙1.6 mg/Kg静脉滴注。②长春新碱:有显著促血管内皮细胞及肿瘤细胞凋亡的作用,目前有望被推荐为KMP的一线治疗方案而取代糖皮质激素。针对激素不敏感的KMP患儿,每周静脉应用长春新碱1~2 mg/m2(体表面积),可在1~3周内产生显著疗效。应用长春新碱与糖皮质激素联合治疗,明显获得缓解而未发生不良反应。长春新碱与环磷酰胺联合应用,每10天用药1次,每次10 mg/Kg,也可获得良好效果。在危重病例治疗中,应用VAC联合方案(长春新碱+更生霉素+环磷酰胺)和VAC联合氨甲蝶呤方案。不良反应(腹痛、深腱反射缺失、易怒)发生率约为19%。③普萘洛尔:常需联合其他药物,KHE/TA与IH在组织学和临床表现上差异显著,因此普洛萘尔对KHE/TA的疗效有限。④雷帕霉素(Rapamycin):又名西罗莫司(Sirolimus),可通过阻断哺乳动物雷帕霉素靶蛋白(Mammalian target of rapamycin,mTOR)信号通路抑制包括VEGF在内的多种细胞因子,具有抗血管增殖及促细胞凋亡自噬等作用。近年来其治疗婴幼儿KHE/TA等复杂脉管肿瘤的效果引起广泛重视,相应的药物试验已进入临床二期阶段。对KHE合并KMP的危重患儿,在多种治疗手段无效的情况下,每天给患儿口服雷帕霉素0.1 mg/Kg,并维持血药浓度(8~15 ng/mL),病灶稳定并随用药时间延长而逐渐消退,故认为雷帕霉素较长春新碱更为安全有效。

表3-1 血管瘤的风险等级及分级依据

表3-2 婴儿血管瘤与脉管畸形的鉴别诊断
第四部分 脉管畸形的诊断和治疗
1葡萄酒色斑
1.1临床表现
葡萄酒色斑(Port-wine stains,PWS)为最常见的毛细血管畸形(Capillary malformation),又称鲜红斑痣,系先天性皮肤毛细血管扩张畸形,发病率为0.3%~0.5%,常在出生时出现,好发于头、面、颈部,也可累及四肢和躯干。表现为边缘清楚而不规则的红斑,压之褪色或不完全褪色。红斑颜色常随气温、情绪等因素而变化。随着年龄的增长,病灶颜色逐渐加深、增厚,并出现结节样增生。部分严重的病变可伴有软组织,甚至骨组织的增生,导致患部增大变形等。
临床可分3型。①粉红型:病变区平坦,呈浅粉红至红色,指压完全褪色。②紫红型:病变区平坦,呈浅紫红至深紫红,指压褪色至不完全褪色。③增厚型:病变增厚或有结节增生,指压不完全褪色至不褪色。
1.2诊断及鉴别诊断
单纯葡萄酒色斑根据病史、临床表现即可诊断。其组织病理学改变为真皮浅层毛细血管网扩张畸形,管壁仍为单层内皮细胞构成,表皮层及其周围组织正常。
6月龄内患儿需与婴儿血管瘤区别,早期两者都可表现为红斑,但婴儿血管瘤有明确的增生过程,表现为可逐渐隆起、呈鲜红颗粒状,而葡萄酒色斑在幼儿期均呈平坦的红斑,病灶成比例增大。
发生在面部沿三叉神经分布的红斑,需排除伴有Sturge-Weber综合征(Sturge-Weber syndrome)。此综合征因病变侵犯软脑膜,有8%的患儿在婴儿期即出现惊厥,因可导致智力障碍和神经功能损害,需神经内科干预。此外,70%患此综合征患儿出现脉络膜受累,其中30%出现青光眼,早期眼科干预可避免失明。
发生在肢体的葡萄酒色斑还需与Klippel-Trénaunay综合征(Klippel-Trénaunay syndrome)鉴别。Klippel-Trénaunay综合征有3个临床特点:①患肢大面积红斑;②先天性静脉(淋巴管)畸形;③骨和软组织增生肥大。
另外,葡萄酒色斑还需要与毛细血管畸形-动静脉畸形(CM-AVM)相鉴别,后者为家族遗传性,可伴有全身多发的红斑,同时伴有深在的动静脉畸形病灶。
1.3辅助检查
葡萄酒色斑根据临床表现即可诊断,必要时病理检查可以确诊。
辅助检查主要用于鉴别综合征。Sturge-Weber综合征需通过增强MRI显示软脑膜的异常,还需眼科的眼压、眼底检查筛查青光眼及脉络膜血管畸形。Klippel-Trénaunay综合征的影响主要是皮下组织的增生,血管造影或MRI有助于发现深部静脉畸形。CM-AVM需要行CTA三维血管成像、增强MRI或血管造影来确诊AVM病灶。
1.4治疗
1.4.1激光的选择性光热作用治疗
利用血红蛋白吸收波段(532~1 064nm)的脉冲激光治疗,为国际上本病的通用治疗方法。需根据患者个体和病情、局部反应等确定治疗参数,剂量过大将致热损伤瘢痕。重复治疗间隔1~2个月。
①脉冲染料激光(Pulsed dye laser,PDL):常用595 nm PDL,脉宽0.45~20 ms,需要根据光斑大小调节能量密度,能量密度8~15 J/cm2;或585 nm PDL,脉宽0.45 ms,能量密度5~7 J/cm2;有585~600 nm可调PDL,脉宽1.5 ms。治疗终点为皮肤即刻出现紫癜。通常使用动态冷却系统或冷风冷却系统,以缓解疼痛及避免热损伤等副作用。
②脉冲倍频Nd:YAG激光:波长532 nm,脉宽5~30 ms,能量密度7~16 J/cm2。需根据治疗反应由小剂量开始逐步增加,病灶颜色变暗、呈灰紫色即可。因532 nm激光穿透较浅,黑色素吸收较多,色沉较其他波长激光治疗更为常见。
③长脉冲Nd:YAG激光:波长1 064 nm,脉宽1~60 ms,能量密度30~100 J/cm2。因1 064 nm激光穿透深,可用于增厚病变。不易出现紫癜,但瘢痕发生率较其他激光治疗高。
④长脉冲翠绿宝石激光:波长755 nm,可用于增厚病灶,脉宽3~20 ms,其治疗后色素沉着和瘢痕发生率较PDL高。
1.4.2光动力疗法(photodynamic therapy,PDT)
又称血管靶向光动力疗法(Vascular-target photodynamic therapy,V-PDT),利用激光激发富集于畸形毛细血管内皮细胞中的光敏剂所产生的单线态氧,选择性破坏畸形毛细血管网。是继选择性光热作用治疗之后的另一靶向性强、疗效好、安全性佳,且无热损伤的治疗新技术。需根据患者个体和病情,制定个性化方案,主要参数包括光敏药物与剂量,激光参量与治疗量,以及治疗区规划等。
①光敏药物:如血啉甲醚、血卟啉注射液等。按说明书进行皮试和静注,药量一般为2~5 mg/Kg,给药后即予照光。
②治疗光源:首选连续激光,如532 nm半导体激光或全固态激光等,其激发光敏药物效率最高;其次可用高频脉冲激光(准连续激光),如511/578 nm铜蒸气激光等;再者可用630 nm半导体激光,其穿透深度更深,但请注意深层正常血管网破坏风险增加。用有扩束或光束整形装置的点状光纤,要求光斑大、边界清、光强分布均匀(光强差≤10%)。非激光光源有发光二极管(LED)和强光(IPL)等,但激发作用和光束质量远不及激光,无法经光纤传输,难以准确测量输出光量,使用时需检测照射区的光强及均匀性。
③照光剂量:功率密度即照射强度一般约为80~100 mW/cm2。照光时间一般为15~40 min,能量密度即照射光量一般为60~360 J/cm2。对特殊部位如鼻翼、上唇、颏部、肢体等应适当缩短照射时间。
④用血卟啉注射液后,需要避强光直射皮肤约1~3个月,用海姆泊芬需2~4周。
⑤重复治疗间隔期至少2~4个月。
1.4.3非相干光治疗
强脉冲光治疗(Intense pulsed light,IPL),一般选用560 nm或590 nm的滤光片。需要根据皮肤类型选择合适的能量密度和脉宽同样需要避免热损伤导致的瘢痕和疼痛等副作用。
1.4.4手术治疗
对于非手术治疗无效的病例,可采用手术治疗来清除病灶,或改善外观畸形。
①直接切除缝合:对于病灶较小的葡萄酒色斑,经多次非手术治疗无效,或者既往治疗已形成瘢痕,或者病灶已增厚,可考虑一期手术切除后直接缝合关闭创面。对于切除后拉拢缝合时张力较大时,可适当向创缘两侧皮下广泛分离,或延长切口线,动员邻近皮肤组织量,达到一期缝合。
②局部皮瓣:对于按解剖亚单位分布的病灶,可考虑采用局部皮瓣转位修复,经一期皮瓣转位修复成活后,再行皮瓣修整达到较好的外观。在皮瓣组织量供区充足的情况下,尽可能切除亚单位内正常皮肤,以确保亚单位的完整重建,达到较好的美学效果。
③皮片移植:大面积葡萄酒色斑病灶切除后,创面采用中厚皮片或全厚皮移植覆盖创面,是最传统的、简便易行的手术方法。该方法适用于面部大面积病灶无正常皮肤供区提供修复、年龄较大的患者、自身条件无法耐受其他修复方法的患者。但其最大的弊端就是术后皮片的颜色和质地无法与受区相匹配,尤其是在面部,存在明显的色差以及面具样外观。
④组织扩张:面部皮肤质地具有特殊性,其他部位的组织移植后无法重现面部组织的特性。采用组织扩张的方法获取病灶邻近的局部皮瓣或带蒂皮瓣,来修复病灶,能够获得皮肤的质地、色泽、弹性、厚度与原位组织最接近的外观。
⑤预构扩张皮瓣:通过单纯组织扩张所获得的扩张皮瓣并不含有轴形血管,皮瓣转移时将会受到随意皮瓣的血运规律的限制,转移和利用率都将会受到很大影响。预构扩张皮瓣的核心是预先在扩张皮瓣内植入知名的血管束,构建轴型皮瓣,改善皮瓣血液供应,减少皮瓣的坏死率。
⑥正畸正颌手术:对于面部葡萄酒色斑合并的上下颌骨轮廓畸形,比如,骨骼肥大、咬合畸形,可联合正畸与正颌手术予以矫正。
2静脉畸形
2.1临床表现
静脉畸形(Venous malformation),旧称海绵状血管瘤,是静脉异常发育产生的静脉血管结构畸形,病理上表现为从毛细血管到腔穴不等的扩张血管腔窦,腔内壁衬以正常扁平的内皮细胞,内皮细胞下为一单层基底膜。血窦的管腔壁平滑肌稀少,外膜纤维变性。静脉畸形通常以单一的静脉结构为组分,也可与其它血管结构混合形成毛细血管静脉畸形或淋巴静脉畸形等混合畸形。
静脉畸形临床表现不一,从独立的皮肤静脉扩张,或局部海绵状肿块,到累及多组织和器官的混合型。出生时即存在,大部分可以被发现,少部分在幼年或青少年时才被发现。头、颈、颌面为好发部位,四肢、躯干次之。其生长速度与身体生长基本同步,不会自行退化,发病无性别差异。覆盖在静脉畸形上皮肤可以正常,如累及皮肤真皮层则表现为蓝色或深蓝色;毛细血管静脉畸形的皮肤为深红色或紫色;淋巴静脉畸形混合型表现为皮肤淋巴小滤泡(常伴有过度角化)。局部为柔软、压缩性、无搏动的包块。包块体积大小可随体位改变或静脉回流快慢而发生变化。如静脉畸形在面颈部者,在低头、屏气或压迫颈浅静脉时充盈增大;小儿表现为哭闹或用力挣扎时膨大;在四肢者,肢体抬高缩小,低垂或上止血带则充盈增大。有时可触及瘤体内有颗粒状静脉石。静脉血栓形成,表现为反复的局部疼痛和触痛。也可因血液淤滞于扩张静脉腔内造成消耗性凝血病。瘤体逐渐生长增大后,可引起沉重感和隐痛。
位于眼睑、口唇、舌、口底、咽壁等部位的瘤体,常影响外观,并可引起相应的视力、吞咽、语音、呼吸等功能障碍;侵及关节腔可引起局部酸痛、屈伸异常。静脉畸形也可只发生于肌肉而不侵入皮肤,如常见的咬肌内静脉畸形。皮下静脉畸形可影响邻近的骨骼变化,在面部多数表现为骨骼变形及肥大,而在四肢者多表现为骨骼脱钙和萎缩。淋巴静脉畸形则多表现为组织肥大变形。
2.2辅助检查
由病史及详细的体格检查可以确诊大部分静脉畸形,但对于分布不明确的病灶,或为了下一步治疗提供依据,可以进行下列检查。
①瘤体穿刺:从瘤体中央处穿刺,很容易抽到回血;但是,也无法完全排除非血管而血供十分丰富的疾病包块。
②X线平片:可用于确定瘤体范围及骨质的变化;可以确认静脉畸形腔内钙化灶及静脉石。
③B超:病灶表现为明显的液性暗区。主要应用于硬化治疗中的穿刺引导,有助于更加准确地穿刺至血窦,特别是深部病灶,或多次治疗后残余的分散血窦。
④MRI:由于静脉畸形内有丰富的血液及流动性,用MRI在加权下能清楚显示静脉畸形的范围,以及与周围组织紧密的关系,应作为首选的检查项目;同时进行血管增强,可以区分是否存在其他非血流液体(如淋巴液等)。其典型影像学特征为:在T1加权像为等信号或低信号,增强时可见不均匀的强化;T2加权像表现为明显的高信号,在抑脂像中,更能清晰显示病灶。
⑤瘤体造影:有经手背或足背浅静脉穿刺的肢体顺行静脉造影和瘤体直接穿刺造影两种静脉造影方法。顺行静脉造影适合于四肢部位的静脉畸形,尤其针对于广泛多发性的病例。静脉畸形的静脉造影特征为造影剂进入并潴留在与静脉沟通的异常血窦组织内,后者分隔为多腔,单或多发,形态各异。瘤体与主干静脉之间常有数条引流静脉。但如瘤体过大或瘤体与静脉间的交通过细,顺行造影常不能充分显示整个瘤体,或造影剂不能进入瘤体使之无法显影,此时可选用瘤体直接穿刺的造影法。直接穿刺方法,可确定穿刺的瘤腔大小,特别可以确认瘤体回流静脉血管与正常主干静脉的关系。另外,若瘤腔间交通不畅,需多点穿刺造影,才能真实反映病灶情况。
⑥选择性动脉造影:可以显示瘤体的营养和回流血管,对是否存在动静脉瘘有帮助。由于是创伤性检查,可酌情考虑。
2.3治疗
2.3.1治疗方法及适应证
静脉畸形可累及任何部位,但以头颈部最好发,可导致明显的外观畸形和器官移位;巨大的病灶还可导致面部骨骼发育异常。在肢体和躯干静脉畸形,尤其是弥散型病变中,因血流缓慢淤滞会出现病灶内血栓形成,可出现不同程度的疼痛,甚至引起功能障碍。因此,对于头面部和伴有疼痛的肢体病灶,应尽早治疗,控制病情进一步发展。
治疗静脉畸形的主要方法是血管内硬化治疗,这是多年发展后的共识。当然,还有其他的非手术和手术方法,可根据畸形的范围、界限、部位单独或联合使用。非手术治疗包括血管内硬化治疗、激光治疗、铜针留置术、电化学及患肢压迫治疗等。手术切除治疗包括单纯手术切除,硬化后手术切除,热凝及其他治疗后手术,及相关的修复重建手术。
2.3.2治疗方法的选择
2.3.2.1血管内硬化治疗(Intravascularsclerotherapy)
目前国际主流的治疗方法为血管内硬化治疗,即指通过无水乙醇、博莱霉素(平阳霉素)、泡沫硬化剂(聚多卡醇、聚桂醇、十四烷基硫酸钠)等硬化剂破坏血管内皮细胞,造成病灶血管的纤维化闭塞和体积的萎缩,实现外观和功能的康复,复发概率较小。但是,对于广泛而弥散的病灶,则需多次治疗,而且效果相对较差。
从病灶穿刺,回抽见缓慢静脉血流出,治疗在全麻、病灶内局麻或神经阻滞下进行,要切实保证必要的止痛才可治疗。如非在DSA下操作,则穿刺点至少两点以上,明确互相流通,才能再进行硬化剂注射,否则有可能进入动脉或动脉穿支,导致严重并发症。单次治疗,无水乙醇剂量不超过0.2 mL/Kg,聚桂醇单次剂量不超过8 mL,博莱霉素总剂量不超过300~400 mg。当瘤体侵及眼眶球后、颈部等很多危险区域时,建议在DSA下评估治疗的安全性,再行血管内治疗。在多次治疗后因血窦腔缩小致穿刺难度明显增加时,需在B超引导下精准定位残留病灶,以提高疗效。治疗完毕,穿刺点压迫片刻,局部制动3 d,患部应高于心脏位置以便肿胀消退。
并发症方面:如果没有注入动脉内,治疗也可能导致水泡和皮肤坏死。如深部瘤体侵犯肌肉,治疗后可产生短暂性肌肉痛,并较僵硬,1个月后逐渐恢复正常;如有神经穿过瘤体,多为可逆性损伤;如采用平阳霉素治疗,可出现过敏性休克,并常在多次治疗后才出现;如误入动脉系统,可能导致灾难性的组织器官,甚至肢体坏死;另有血管内治疗后出现心肺危象而导致死亡的报道,机理不清,需随时警惕。减缓静脉回流是提高疗效、减少并发症的重要措施。
2.3.2.2手术治疗
静脉畸形有丰富的腔窦及周围血管,除了部分界限较清楚的局限性异常扩张病灶外,绝大多数是弥漫且与正常组织界限不清的病灶,难以手术切除,并对局部组织的功能和形态影响较大,创伤大、出血控制难、复发快、功能和外观影响大。因此,手术不是静脉畸形的首选治疗方法。
手术治疗在必要的情况下才使用,如弥散型的静脉畸形对硬化治疗反应差,需要手术修复达到外观改善,此类型的巨唇、眼睑臃肿、面部软组织萎缩等都是手术治疗的适应证;对血管内治疗后残留病灶的外观改善、功能重建(如继发跟腱短缩延长等)也需要手术辅助;头面部大范围静脉畸形经过多次过度硬化治疗后,可能导致局部凹陷畸形,或因并发症导致凹陷甚至瘢痕等,可应用吻合血管或游离的筋膜瓣或筋膜脂肪瓣充填;合并骨骼畸形的患者可以通过截骨和轮廓整形获得良好的美容效果。对于疑难静脉畸形病例,如涉及眼眶内、颅内外沟通或肢体骨骼畸形的VM,手术也有可能是很重要的配合手段之一,成为静脉畸形多学科、序列化、美容性治疗计划的一部分。手术原则应在保存基本功能的情况下,仔细分离,保护神经血管肌腱等重要组织结构,进行适当的切除。
3动静脉畸形
3.1临床表现
动静脉畸形(Arteriovenous malformation,AVM)是一种高流量的先天性血管畸形,由扩张的动脉和静脉组成,异常的动静脉之间缺乏正常毛细血管床。AVM发生率低,无性别差异。40%~60%的患者出生时即发现,易被误诊为毛细血管畸形或血管瘤。头颈部相对好发,其次为四肢、躯干和内脏。病灶表现为皮肤红斑、皮温高、可触及搏动或振颤。局部可出现疼痛、溃疡或反复出血,严重者因长期血流动力学异常可致心力衰竭。AVM还引起外观畸形、重要组织器官受压、功能损害等。1990年,ISSVA采纳了Schobinger分期,将动静脉畸形按照疾病进展的严重程度分为4期(表4-1)。

表4-1 AVM的Schobinger临床分期
3.2诊断
绝大多数AVM可通过临床表现明确诊断。与血管瘤不同,AVM病灶在婴儿期无明显增生变大的病程。AVM的高流量特征可与毛细血管畸形、静脉畸形或淋巴管畸形区别开来。
3.3辅助检查
通过临床表现如不能明确,可利用影像学检查辅助诊断。彩色多普勒可检测AVM的高流量特征。MRI有利于明确病灶范围。数字减影血管造影(Digital subtraction angiography,DSA)是AVM诊断的金标准,治疗前需进行DSA检查,为治疗方案的选择提供指导。如果病灶累及骨骼,则需行CTA检查。除了疑似恶性肿瘤不能明确诊断的病例,活检通常不必要,且活检创伤可能引起病灶出血和病情加重。
3.4治疗
AVM治疗困难,复发率高。病灶供血动脉结扎或供血动脉近端栓塞,因病灶未充分处理,通常加重病情,且不利于后期治疗,这种有害无益的治疗方式应予废弃。
AVM治疗方式包括常规介入栓塞、无水乙醇介入治疗、外科手术和联合治疗。目前尚无成熟的内科药物治疗方式。
3.4.1常规介入栓塞
常规的介入栓塞剂可以是液体,如NBCA(nbutyl cyanoacrylate)或Onyx等,也可以是固体,如明胶海绵粉、PVA(polyvinyl alcohol)及弹簧圈等。因常规栓塞剂不能破坏血管内皮细胞,无法去除AVM病灶,绝大多数患者最终都会复发。但该治疗可减少术中出血。目前,常规介入栓塞主要用于术前准备。
3.4.2无水乙醇介入栓塞治疗
无水乙醇可破坏血管内皮细胞,是一种效果彻底的治疗。但误栓可引起周围正常组织坏死、重要器官功能丧失(如失明),甚至因心肺衰竭而导致死亡。该治疗必须由经验丰富的专科医师实施,以尽可能减少严重并发症的发生。对于很多颅外AVM,如果能够有效控制很低的并发症率,无水乙醇介入是颅外AVM首选的,有治愈潜力,且实现高度选择性的主要治疗方法。
3.4.3外科手术
外科手术在无水乙醇介入栓塞治疗出现以前一直是AVM治疗的主要方法,彻底清除病灶是手术治疗的理想目标。病灶切除后的缺损,不建议直接植皮,可以局部皮瓣、扩张皮瓣或游离皮瓣等进行修复。彻底的手术切除可以实现病灶区域的长期稳定,不再复发,而不完全的切除通常可导致后期的复发。严重的、范围过大和已导致严重并发症(如出血、疼痛或肢体坏死)的动静脉畸形,最终需要截肢。
无水乙醇介入治疗的出现虽然改变了AVM的治疗模式,但仍无法完全取代手术治疗。对于无水乙醇介入治疗潜在风险较大的患者,或因为病灶难以通过介入途径实现有效治疗,以及畏惧严重并发症的病例,手术仍是必要的治疗方式。另外,无水乙醇介入栓塞治疗的并发症(如误栓所致的组织坏死),需依靠整形手术改善外观。
3.4.4联合治疗
无水乙醇介入栓塞技术和外科手术技术,包括器官重建技术、显微外科技术、颌面外科技术、美容外科技术等均熟练掌握的联合治疗团队,可有效实现针对同一患者联合应用多学科技术,实现患者在疗效和安全性方面的利益最大化。
4淋巴管畸形
淋巴管畸形(Lymphatic malformation,LM),以往称为“淋巴管瘤”,是常见的一种先天性脉管畸形疾病。根据淋巴管囊腔的大小将LM分为巨囊型、微囊型和混合型3型。巨囊型LM由1个或多个体积≥2 cm3的囊腔构成(即以往所称的囊肿型或囊性水瘤),而微囊型LM则由多个体积<2 cm3的囊腔构成(即以往的毛细管型和海绵型),二者兼而有之的则称为混合型LM。LM的发病率为1/4 000~1/2 000,尚未发现有性别和种族的差异。该病多在2岁前个体中发病,约50%患者出生时即发现罹患此病。LM可发生在身体具有淋巴管网的任何部位,约75%的病变发生在头、颈部,其次为腋窝、纵隔及四肢。
4.1淋巴管畸形组织病理和发病机制
LM的发病机制尚不清楚,一般认为其病变内皮细胞均可能来源于脉管系统发育的早期。在胚胎期,静脉丛中的中胚层首先形成原始淋巴囊,淋巴囊再逐渐形成有功能的毛细淋巴管,毛细淋巴管相互吻合成网,逐渐汇集成一系列由小到大的各级淋巴管。在此过程中,由于某种原因可使淋巴管系统紊乱,造成淋巴管非恶性的异常生长和扩张,即形成LM组织。其病理学特点:LM内皮细胞组成的壁薄、形态不规则及大小各异的淋巴管腔内充满淋巴液,周围则有大量的成纤维细胞、白细胞、脂肪细胞和肌细胞等。但是,在LM的整个病理过程中,无LM内皮细胞数量的增加,且其形态和功能也表现正常,仅淋巴管管腔直径发生变化。
4.2临床表现及诊断
淋巴管畸形的临床症状多比较典型,结合超声、诊断性穿刺及MRI检查,必要时辅以CT检查及活检,基本可以确诊。
淋巴管畸形可以发生在全身任何部位,以主要淋巴系统所在区域最为常见,颈部及腋下发病率最高,腹股沟、纵隔、腹膜后次之,躯干及四肢最低。巨囊型淋巴管畸形通常由不止一个囊腔组成,囊腔之间可以相通或不相通。囊腔中含有水样的透明液体,有波动感,有时不透光或呈琥珀色。而微囊型淋巴管畸形病灶相对较实心。淋巴管畸形的临床表现受病变的类型、范围和深度的影响差异很大,可表现为皮肤黏膜上充满液体的小泡,或表现为巨大的肿物。
结合病史和体征后怀疑为淋巴管畸形时,应常规先行超声检查,以明确瘤体的部位、性质、大小及其与周围组织的关系,为手术或药物注射治疗提供依据,并可用于监测预后情况。MRI(血管增强)检查可提供比较可靠的客观图像并鉴别淋巴管和血管。深入了解瘤体的位置及与周围组织的关系,对于颈腋部较复杂位置以及腹盆腔较深位置的瘤体,在超声不能明确诊断时可用于鉴别诊断;也可进行辅助诊断性穿刺,若穿刺抽出淡黄色清亮淋巴液即可诊断为淋巴管畸形,若抽出陈旧性血液结合细胞学检查,则可诊断为淋巴管瘤伴出血。
4.3治疗
LM被认为是淋巴系统的良性病变,生长缓慢、很少自然消退。但在遭受创伤、感染及发生囊内出血或不适当治疗后,常突然增大。若LM生长在特殊部位,则可能导致毁容、畸形、压迫重要器官引起功能障碍,造成长期后遗症,甚至危及生命。故对该病需采取积极恰当的医疗干预措施。
以往认为手术是LM最主要的治疗手段,但目前LM的治疗方法多种多样,包括手术切除、激光治疗、硬化剂注射(如注射博来霉素、强力霉素、无水乙醇及OK-432)治疗等。但是,目前尚无一种方法可以治疗所有类型的LM。
硬化治疗为淋巴管畸形患者提供了重要的治疗手段,适用于巨囊型和混合型淋巴管畸形。巨囊型淋巴管畸形硬化治疗通常可取得满意的效果,而微囊型淋巴管畸形疗效相对较差。与手术治疗相比,硬化治疗有以下优点:①创伤小,不易损伤重要神经、血管、腺体、肌肉等组织结构;②巨囊型效果良好、治愈率高、不易复发;③操作简便,比较安全;④外形恢复良好,无明显瘢痕。进行硬化剂注射治疗时,应根据病灶特点,进行分部位、多次囊腔内注射治疗,避免损伤重要神经、腺体等。一般应抽尽或尽可能地抽尽每个囊腔中的淋巴液,再注入合适剂量与浓度的硬化剂。对于侵犯口底、咽旁、气道周围的病例,为避免治疗后肿胀引起的气道阻塞,治疗前需争取行气管切开术。若气管切开区域有病灶,可给予先行治疗。
目前常用的硬化剂有博莱霉素(Bleomycin),国产称平阳霉素(Pingyangmycin)、溶血性链球菌制剂OK-432(国产称沙培林)、强力霉素(Deoxycycline)、无水乙醇(Absolute ethanol)和泡沫硬化剂等。
手术治疗是过去最主要的,甚至是唯一的治疗手段,迄今仍是许多外科医师首选的治疗方法。但随着硬化治疗的开展和经验的积累,目前不主张毫无选择地对任何类型的LM进行手术切除,认为只有极少数病例需要在婴幼儿期行手术切除。尽管LM呈缓慢增大倾向,但并不会侵犯周围组织。局限性大囊型病变可以手术完全切除,但弥漫性微囊型病变完全切除困难。目前普遍认可的手术指征为:①病灶较小,位置较好可完全切除;②有症状的微囊型淋巴管畸形;③硬化治疗后仍有症状的巨囊型及混合型淋巴管畸形;④有危及生命的并发症;⑤对外观影响较大。手术切除淋巴管畸形首先需考虑到其良性疾病的性质,保证重要结构的保留。尽管完全切除是完美的结果,但考虑到病灶区重要神经、血管的保护,大部分情况次全切除或部分切除更为恰当。残留的病灶可通过注射硬化剂进一步治疗。对于头面部淋巴管畸形,巨囊型的舌骨下和舌骨上LM完全或次全切除的可能性较大,对于双侧较大病灶并且有上呼吸道压迫的患者,手术应为首选治疗方法。手术必须将单侧或双侧颈部功能性结构解剖清楚,如病灶过大可分期手术。弥漫型的微囊型淋巴管畸形对手术亦是很大的挑战,其病灶浸润周围组织及器官,使解剖结构不清楚,难以分辨其边界。双侧舌骨上伴有上呼吸道压迫的LM只能行部分手术切除,术后应注意水肿引起的上呼吸道压迫症状。气管切开和放置胃管对于预防压迫发生很重要。联合激光、硬化等治疗,对于大面积的病灶也很关键。
第五部分 血管瘤与脉管畸形相关综合征
1血管瘤相关综合征——PHACE综合征
1.1临床表现
PHACE综合征是一组以后颅窝畸形(Posterior fossa defects)、血管瘤(Hemangiomas)、动脉异常(Arterial anomalies)、心脏畸形和主动脉缩窄(Cardiac defects and coarctation of the aorta)以及眼异常(Eye anomalies)为表现的神经皮肤综合征,因这一系列相关畸形的首字母而命名。临床上,面部节段型血管瘤是该综合征的特征性表现,根据一项对108位面部节段型大面积血管瘤患儿的前瞻性多中心研究,有31%患有PHACE综合征。脑血管异常是该综合征最常见的皮肤以外的表现,约91%的患儿存在,通常发生在面部血管瘤的同侧大脑,主要表现为一侧动脉发育不全或缺失。因脑血管异常引起的中枢神经系统后遗症也是常见的临床表现。其他的皮肤以外的表现还包括心血管畸形(37%)、眼异常(16%)、腹侧发育异常(14%)等。
1.2诊断与鉴别诊断
根据2008年11月举行的PHACE综合征研讨大会上所制定的诊断标准,目前诊断共分为2类,即PHACE综合征和疑似PHACE综合征。皮肤以外的表现可分为主要和次要诊断标准(表5-1),当满足节段型面部血管瘤或头面部大于5cm直径的血管瘤和1条主要诊断标准或2条次要诊断标准即可确诊PHACE综合征,疑似PHACE综合征的诊断需要满足头面部大于5 cm直径的血管瘤和1条次要诊断标准。
PHACE综合征患儿在疾病的初期容易与Surge-Weber综合征相混淆,后者是一种以面部葡萄酒色斑、软脑膜和眼脉络膜血管瘤为特征的先天性神经皮肤综合征,随着血管瘤独特的早期快速增生后期缓慢消退的病程,两者的鉴别并不是很难。
1.3辅助检查
当面部节段型血管瘤患儿就诊时,除了常规的全身体检外,还应包括全面而详细的心脏、眼科及神经系统评估。临床检查上应该涉及头颈部检查、气道检查、颅神经检查、颈部触诊排除甲状腺异常,胸骨检查排除胸骨裂和脐上裂。筛查试验包括超声心动图、头部MRI、头颈部MRA、心脏大血管MRA和全面的眼科检查。此外,内分泌相关的血液检查有助于排除甲状腺激素不足的情况。
1.4治疗
由于PHACE综合征是一个多脏器累及的疾病,治疗时应由整形外科、神经外科、眼科、心脏科等多学科分别对症诊治,但也需要专科医师注意,在治疗各自专科疾病时,对其他异常器官所可能产生的影响。如当心脏科医师施行心血管手术治疗时,切勿忽略可能合并的脑血管异常及声门下血管瘤,因前者在术中有可能并发脑血管意外,而后者因影响气道易发生气道梗阻、窒息;整形外科医师对面部血管瘤合并脑血管狭窄、发育不良或部分血管瘤缺失的患儿进行口服心得安治疗时,应注意用量,避免心得安所可能引起的低血压,进而影响大脑血流灌注,引起神经系统后遗症。目前,已有临床研究证实口服心得安联合口服激素治疗PHACE综合征患儿,较传统的口服激素治疗更有优势,既能减少心得安和激素的用量,又可以增强疗效。
2脉管畸形相关综合征
2.1临床表现及诊断
2.1.1Sturge-Weber综合征
Sturge-Weber综合征(SWS,脑面或脑三叉神经血管瘤病)是一种皮肤神经综合征,特征是葡萄酒色斑(鲜红斑痣)位于三叉神经第1支(眼支)支配区,伴有软脑膜血管瘤病(通常表现为癫痫)和青光眼。
2.1.2色素血管性斑痣性错构瘤病
通常指葡萄酒色斑(鲜红斑痣)伴黑素细胞痣或贫血痣,共分为五型(表5-2),第Ⅱ型最常见。
2.1.3Klippel-Trenaunay和Parkes-Weber综合征
Klippel-Trenaunay(KT)综合征是一种散发性疾病,以血管畸形、静脉曲张和软组织及骨肥大三联征为主要表现。血管畸形最常见的是葡萄酒色斑(鲜红斑痣)型的毛细血管畸形。下肢是最好发的部位。当存在动静脉畸形时,被称为Klippel-Trenaunay-Weber综合征或Parkes-Weber综合征。
2.1.4变形综合征
是一种罕见的散发性疾病,其特点是存在于皮肤、皮下组织、结缔组织、中枢神经系统和内脏等多种组织的发育过度,临床特点为斑片状(镶嵌式)和非对称生长。可以出现各种皮肤和皮下血管畸形,包括毛细血管、静脉和淋巴管畸形,斑片状皮肤发育不良,后者导致皮肤静脉结构突出。
2.1.5Bannayan-Riley-Ruvalcaba综合征
Bannayan-Riley-Ruvalcaba(BRR)综合征是一种常染色体显性遗传的多发性错构瘤综合征,由PTEN基因突变造成。BRR综合症的特点是巨头、脂肪瘤、阴茎雀斑样痣和血管畸形。
2.1.6Cobb综合征
Cobb综合征(皮肤-脊椎脊髓-血管瘤病)是指皮肤血管畸形合并同一节段脊髓血管畸形。表现为伴或不伴有深部血管成分的皮肤毛细血管畸形,有时表面角化过度提示血管角皮瘤。脊髓畸形的神经病学表现包括神经根疼痛、运动功能障碍、感觉异常和痉挛性麻痹。
2.1.7Beckwith-Wiedemann综合征
Beckwith-Wiedemann综合征(BWS)是一种遗传性过度发育综合征,主要特点为内脏肥大、巨舌、各种发育缺陷以及新生儿低血糖,是最常见的过度发育综合症。BWS患者面部最常发生毛细血管畸形的区域包括前额正中、眉间和上眼睑。部分患者病变可延伸到鼻和上唇。
2.1.8Maffucci综合征
是一种少见的先天性非遗传性疾病,其特点在于软骨发育不良合并血管畸形。皮肤损害表现多发,为与血管畸形一致的,可压缩的红蓝色丘疹和结节。静脉畸形有时伴有血栓形成,在X线平片中可见钙化的静脉石。
2.1.9蓝色橡皮疱样痣综合征(BRBNS)
是一种罕见的疾病,特点为皮肤和胃肠道静脉畸形,其他内脏器官有时也会受累。诊断的一个特点是可压缩结节,结节压之退缩,留下一个空的皱缩囊,松开后立即恢复原样。
2.1.10Gorham综合征
Gorham综合征(又称Gorham-Stout病,骨消失,消失骨病,大块骨溶解)是一种原因不明的以进行性骨质破坏,伴脉管系统增生为特征的罕见疾病。许多患者有皮肤血管病变。
2.2辅助检查
血管畸形相关综合征这一类疾病辅助检查主要有3个目的:①通过必要的辅助检查进一步明确病变累及的血管异常的种类;②通过辅助检查明确病变累及的范围、深度及与周围组织的关系,从而为选择合理的治疗方案提供依据;③通过辅助检查评估血管病变对周围或全身器官的影响。其中,局部B超是首选的检查手段,可大体上了解血管异常累及范围;其次增强MRI是判断血管病变种类、累及范围的金标准;对于已明确的血管病变,由于治疗原因需要进一步了解异常血管的走行,则局部再做增强CT检查;其他辅助检查,如心脏彩超、腹部B超、双下肢长骨片、眼科检查、听力检查、脑电图及智力筛查等,则根据病变部位、范围等综合决定。如Sturge-Weber综合征,辅助检查应包括:①眼科检查,包括眼压测量和眼底检查;②头颅增强MRI,可了解颅内是否存在异常血管;③脑电图,以了解是否存在异常脑电波;④智力筛查,了解智力是否受影响。如KT综合征,辅助检查有:①局部B超,了解血管异常累及的范围;②局部增强MRI,了解皮肤血管及皮下血管异常情况,并了解皮下脂肪、肌肉及骨骼受累程度;③双下肢长骨片,了解双下肢是否等长等。
2.3治疗
2.3.1治疗原则
①治疗前需对病情进行充分评估,包括病史、症状、体征及辅助检查,根据评估结果决定相对根治治疗、对症姑息治疗或维持现状暂不治疗;②需与患者及家属进行充分沟通,告知疾病的转归、预后及治疗方法本身对疾病的影响,并进行心理辅导,降低其对预后的期望值,从而减少因患者急于求治的心理而导致过度治疗造成的损害;③评估完成后,选择合适的治疗方法,目的是减少致死率及致残率,而不是根治疾病本身。
2.3.2治疗方法的选择
需根据评估情况决定治疗方法。①本病对大部分患者的容貌均有影响。如Sturge-Weber综合征主要位于头面部,对于这些浅表的血管畸形可以进行激光治疗或光动力治疗,以尽可能减少外观畸形对患者造成的心理影响,而且早期治疗对抑制将来血管增生形成的结节样损害有积极的意义;如K-T综合征患者,在患者年龄很小时就给予局部束缚治疗,可以减缓两侧肢体不对称的发展速度,一定程度上提高患者的生活质量。②部分患者存在功能影响,如Sturge-Weber综合征可能出现眼压升高,则需要进行眼小梁部分切除术,以降低眼压,预防青光眼甚至失明。同时,本病还可能出现癫痫症状,需口服抗癫痫药物进行对症治疗。③少数患者可能出现生命威胁,如Sturge-Weber综合征存在脑血管异常时,可能出现脑血管破裂,脑出血,危及生命。对这些患者要密切监控,交待预后,在进行局部介入、栓塞等治疗无效时,再考虑手术治疗,以解除危及生命的症状或缓解严重功能障碍。
2.3.3治疗方法
①脉冲染料激光或光动力治疗:适用于浅表型血管畸形患者。
②局部约束治疗:适用于肢体过度增长,或双侧肢体不对称的患者,需根据年龄调整束缚衣大小。
③局部注射治疗:适用于病变较局限的深在性损害,常用的药物有平阳霉素、聚桂醇、无水乙醇等。
④介入或栓塞治疗:适用于存在动静脉瘘的患者,常用的栓塞剂包括无水乙醇、聚桂醇等。
⑤手术治疗:手术治疗的目的不是为了根除病灶,主要适用于存在严重功能障碍或生命危险的患者,局部注射或栓塞治疗无效时,可试行手术姑息治疗,以缓解症状或挽救生命。
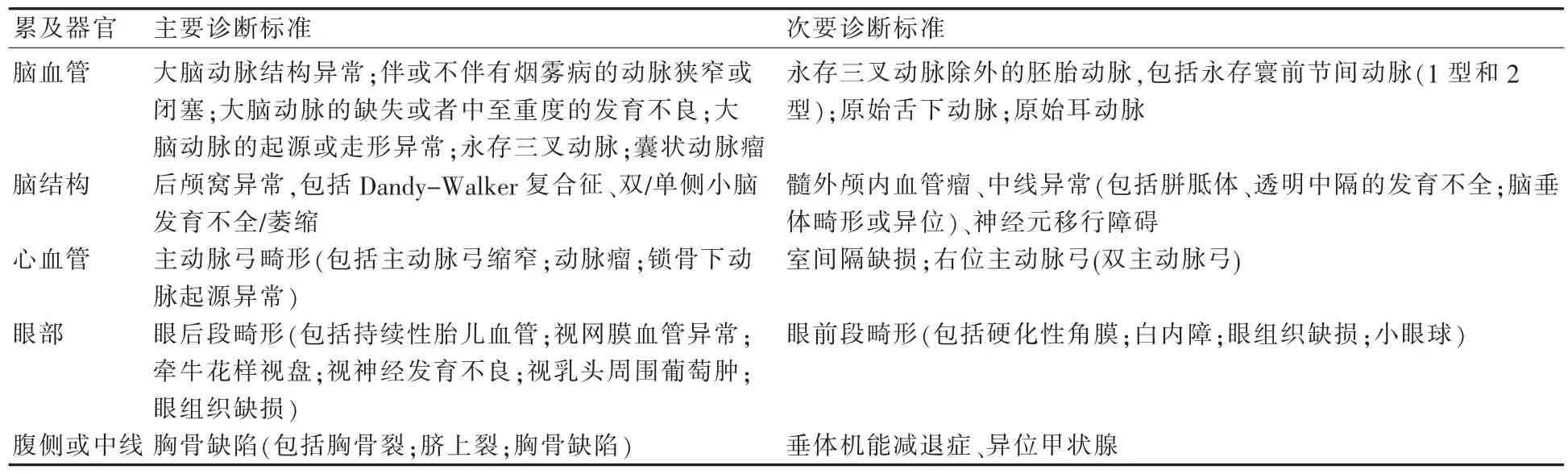
表5-1 主要诊断标准和次要诊断标准

表5-2 色素血管性斑痣性错构瘤病分类
第六部分 眶内血管瘤和脉管畸形的诊断和治疗
1眶内血管瘤的诊断和治疗
1.1眼眶血管瘤临床表现
血管瘤是婴幼儿最常见的眼眶良性肿瘤,绝大多数为后天病变,出生后数周至数月内发病;少数出生后即存在,为先天性病变。自然病程可分为增生期、消退期和消退完成期。增生期病变生长迅速,大于身体生长速度;约1岁以后肿瘤缓慢消退,进入消退期;5岁时约50%的眼部血管瘤可完全消退,9岁时90%完全消退。根据病变部位,眼眶血管瘤分为表浅、深部和混合型。表浅血管瘤仅限于皮肤层,主要表现为轻微隆起的鲜红色斑块(旧称草莓痣或毛细血管瘤);深部血管瘤位于眶隔后,表现为眶内的软组织肿块,眼球周围的深部病变可见局部皮下的青紫色隆起,球后深部病变肉眼不可见,但可推挤眼球,导致眼球突出或/和移位;混合型兼有表浅和深部病变特征。表浅血管瘤极少影响功能,深部血管瘤则可因上睑下垂造成视觉剥夺性弱视,或因眼球轴向改变导致散光、斜视,进而形成弱视。肌锥内的血管瘤可直接压迫视神经导致视力下降,但非常罕见。表浅血管瘤较深部病变生长更为迅速,有时可出现局部缺血、坏死、出血。彩色多普勒超声检查示病变血流丰富,为动静脉血混合频谱;磁共振检查显示T1加权像为低信号,T2加权像为高信号,对比增强后明显强化。
1.2眼眶血管瘤诊断和鉴别诊断
1.2.1诊断
根据出生后不久发病、生长迅速、鲜红色斑块或青紫色肿块、眼球突出/移位、彩色多普勒超声和MRI检查等进行诊断。
1.2.2鉴别诊断
表浅血管瘤需与下列疾病进行鉴别诊断。①葡萄酒色斑:先天性毛细血管畸形,病变无隆起,生长缓慢,部分患者合并先天性青光眼;②化脓性肉芽肿:外伤史,青少年多见,皮肤面局限性隆起,质脆、易反复破溃出血。
深部/混合血管瘤需与下列疾病进行鉴别诊断。①眼眶皮样囊肿或表皮样囊肿:婴幼儿多见,生长缓慢,多表现为眼眶外上方肿块、质地坚韧、边界清楚,皮肤面无颜色改变,CT显示病变内部低密度区,部分病例有局部骨质破坏,对比增强后无明显强化;②横纹肌肉瘤:发病年龄较血管瘤晚,好发于5~10岁儿童,部分患者有外伤史,生长迅速,可在数周时间内造成上睑下垂,结膜水肿,眼球严重突出、移位和视力下降。影像学检查可有骨破坏或病灶内出血;③脉管畸形:包括眼眶静脉畸形、淋巴管畸形以及静脉淋巴混合畸形。
1.3眼眶血管瘤治疗
1.3.1治疗适应证
上睑下垂遮挡视轴;眼球突出/移位导致散光、斜视;病变生长迅速出现坏死、出血、溃疡形成;病变体积大、明显影响外观。
1.3.2药物治疗
①β受体阻滞剂:排除哮喘等禁忌症后首选。普萘洛尔,治疗起始剂量为1.0 mg/Kg·d,分两次口服。第2天增量至1.5 mg/Kg·d,分2次口服,第3天增量至2.0 mg/Kg·d,分2次口服,后续治疗以此剂量维持。②糖皮质激素:β受体阻滞剂无效或不能耐受时给予激素治疗。口服泼尼松龙片,2~3 mg/Kg·d,用药6~8个月,为不适合普萘洛尔的病例使用。
1.3.3手术切除
适用病变范围包括:非手术治疗无效或不耐受,且影响视功能;不消退且明显影响外观。手术根据情况,在保证不损伤视神经、眼外肌等眶内重要结构的前提下,行部分或全部切除。
2眶内血管畸形的诊断和治疗
按照ISSVA分类,根据组织学来源和血液动力学特点,眼眶脉管畸形可以分为低流量和高流量两种类型。
低流量血管畸形包含:静脉畸形(Venous malformations,VMs)、淋巴管畸形(Lymphatic malformations,LMs)、淋巴管静脉混合畸形(Lymphaticovenous malformations,LVMs)。静脉畸形分为扩张型静脉畸形(Distensible VM)和非扩张型静脉畸形(Indisten-sible VM)。非扩张型静脉畸形最常见的是眼眶海绵状血管畸形(Cavernous VM,或称Cavernoushemangioma)。淋巴管畸形可分为巨囊型淋巴管畸形、微囊型管淋巴畸形和混合巨囊/微囊淋巴管畸形。根据血流动力学特点,淋巴管静脉混合畸形可以分为静脉畸形成分占优势淋巴管静脉混合畸形(静脉淋巴畸形,Venous dominant malformation LVM,VD-LVM)和淋巴管畸形成分占优势淋巴管静脉混合畸形(淋巴静脉畸形,Lymphatic -dominant malformation LVM,LD-LVM)。
高流量血管畸形包括:动静脉畸形(Arteriovenous malformation,AVM)和先天性动静脉瘘(Congenital arteriovenous fistulas,AVF)。
2.1临床表现
2.1.1静脉畸形
静脉畸形是最常见的眼眶脉管畸形,主要见于成人。根据病变所在部位,眼眶静脉畸形分为浅表型、深部型和结合型。浅表型表现为深紫蓝色、团状或弯曲状的结膜、眼睑或眶周病变;深部型外观上不可见,而是间接表现为眼球突出、移位,眼球运动受限等;结合型兼有上述二者特征。根据病变与眼眶正常静脉系统交通的密集程度,眼眶静脉畸形分为扩张型和非扩张型。扩张型静脉畸形与正常静脉系统广泛交通、血流丰富,在静脉压回流压力增加(如低头、弯腰、Valsalva运动)时,表浅病变扩张增大,深部病变表现为眼球突出度增加,且因眶压增高可伴有疼痛。MRI检查T1加权像低信号,T2加权像中高信号,对比增强后明显强化。出血可在MRI上观察到液平。CT检查可显示病变中的静脉石形成。颈静脉加压后,病变影像学显示范围扩大。值得注意的是,小的扩张型静脉畸形并无Valsalva试验阳性的临床改变,但影像学检查可以鉴定病变的扩张型特征。
眼眶非扩张型静脉畸形为海绵状血管畸形(Cavernous VM),以往称为海绵状血管瘤(Cavernoushemangioma)。海绵状静脉畸形与正常静脉联系较少,可有微小滋养血管,但血流较慢,静脉回流压力增加后病变无明显改变。海绵状静脉畸形形态学上以圆形或类圆形病变为主,边界清楚,包膜完整。海绵状静脉畸形主要表现为眼球突出、移位,进程缓慢。病变发展到压迫视神经阶段,可出现视力下降、视乳头水肿、视野缩小等改变。CT检查显示中等密度软组织病变,边界清楚,包膜完整,肌锥内病变可保留三角形透明区。MRI检查T1加权像低信号,T2加权像中高信号,对比增强后渐进性不均匀斑块状强化。
2.1.2混合畸形
组织学上,混合畸形包含静脉和淋巴管成分,根据以静脉成分或淋巴管成分为主,混合畸形分为静脉淋巴畸形或淋巴静脉畸形。静脉淋巴畸形临床上与非扩张静脉畸形临床表现非常接近,往往需要通过术后病理区分。淋巴静脉畸形(以往称为淋巴管瘤)主要发生于少年儿童,与正常静脉系统无交通或仅有少量交通,病变内部易反复出血,产生液性囊腔,称之为“巧克力囊肿”。患者发生上呼吸道病毒感染时,淋巴静脉畸形可随之加重,并随感染病情缓解而减轻。淋巴静脉畸形对糖皮质激素治疗有效,但作用仅为暂时性。静脉淋巴混合畸形影像学表现与静脉畸形类似。淋巴静脉混合畸形MRI检查T1加权像低信号,T2加权像高信号,对比增强后仅边缘增强,中央不增强。
2.1.3眼眶动静脉畸形
动静脉畸形在眼眶脉管畸形中所占比例很低,系眼眶动脉血管绕过毛细血管与静脉直接发生沟通,导致静脉血管压力增高,血管迂曲、增粗。根据影响静脉部位不同,患者可表现为眶周皮肤局部隆起、念珠状或索状弯曲迂回的粗大血管,并伴有搏动,表面温度高于正常皮肤,触之有震颤,听诊可闻及吹风样杂音;球结膜血管迂曲扩张;眼球突出、移位、视力下降等。CT或MRI血管成像可清晰显示病变滋养动脉和回流静脉。DSA是诊断金标准,并可用于引导介入治疗。
2.2诊断和鉴别诊断
2.2.1诊断
眼眶脉管畸形根据年龄、病史、临床表现、影像学检查可诊断。
2.2.2鉴别诊断
眼眶脉管畸形诊断包括:与眼眶血管瘤鉴别(见第六部分1.2.2),与眼眶脉管畸形之间的鉴别详见表6-1。
2.3治疗
2.3.1静脉畸形/混合畸形
根据病变类型、部位、血流情况进行个体化综合治疗,一般先给予血管内硬化或激光治疗,以降低病变区的血流、缩小病灶体积,再给予手术治疗。深部病变的硬化或激光治疗应在CT或MRI成像引导或导航引导下进行。
2.3.1.1扩张型
①表浅病变:翻瓣激光联合手术治疗。②深部肌锥外病变:病灶内激光联合手术治疗。③肌锥内病变:生物胶水硬化联合手术治疗。
2.3.1.2非扩张型/混合畸形
①穿刺有回流的表浅病变:硬化治疗。②穿刺无回流的表浅病变:病变弥散,翻瓣激光联合手术治疗;病变局限,手术治疗。③深部肌锥外病变:先博莱(平阳)霉素硬化治疗,无效再给予手术治疗。④肌锥内病变:博莱(平阳)霉素硬化治疗。
2.3.2动静脉畸形
乙醇介入治疗为首选方法,必要时可考虑手术治疗(配合或不配合术前DSA引导下的介入栓塞治疗)。
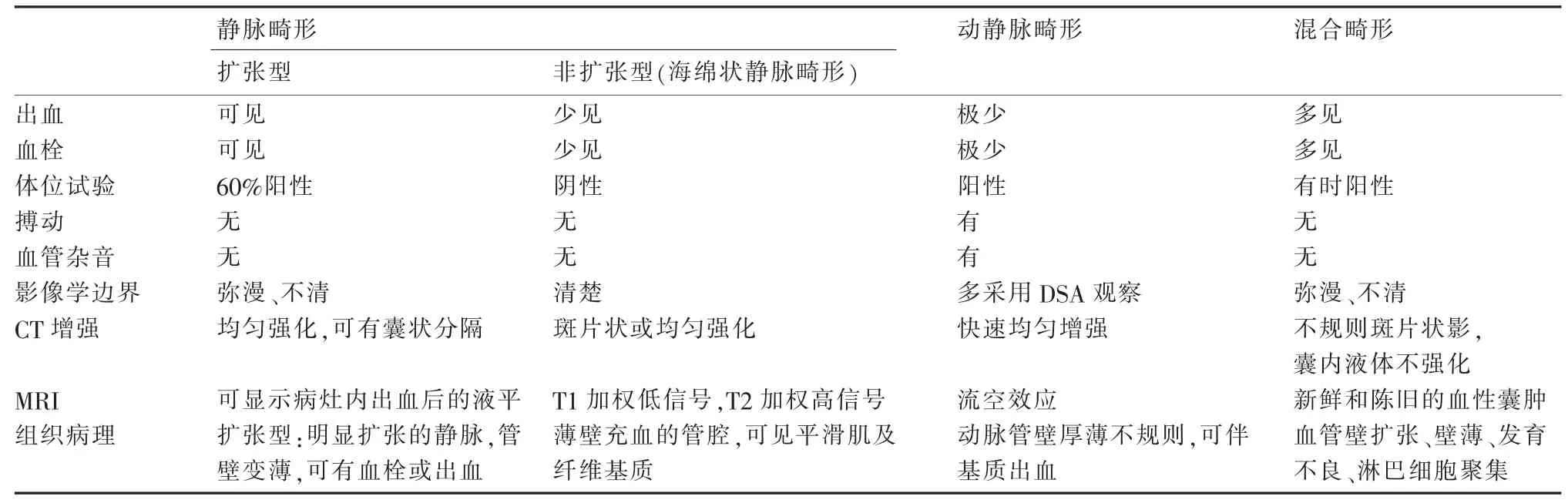
表6-1 不同类型眼眶脉管畸形的鉴别要点
参考文献
[1]Mulliken JB,Glowacki J. Hemangiomasand vascular malformations in infantsandchildren:aclassification based on endothelial characteristics[J]. Plast Reconstr Surg,1982,69(3):412-422.
[2]Enjolras O,Mulliken JB. Vascular tumors and vascular malformations (new issues)[J]. Adv Dermatol,1997,13:375-423.
[3]Michel W,Francine B,Denise A,et al. Vascular anomalies classification:recommendations from the international society for the study of vascular anomalies[J]. Pediatrics,2015,136(1):649-674.
[4]Greenberger S,Bischoff J. Pathogenesis of infantile haemangioma [J]. Br J Dermatol,2013,169(1):12-19.
[5]Ritter MR,Butschek RA,Friedlander M,et al. Pathogenesis of infantile haemangioma:new molecular and cellular insights[J]. Expert Rev Mol Med,2007,9(32):1-19.
[6]Boscolo E,Bischoff J. Vasculogenesis in infantile hemangioma [J]. Angiogenesis,2009,12(2):197-207.
[7]Greenberger S,Boscolo E,Adini I,et al. Corticosteroid suppression of VEGF -A in infantile hemangioma -derived stem cells[J]. N Engl J Med,2010,362(11):1005-1013.
[8]Eerola I,Boon LM,Mulliken JB,et al. Capillary malformationarteriovenous malformation,a new clinical and genetic disorder caused by RASA1 mutations[J]. Am J Hum Genet,2003,73(6):1240-1249.
[9]Revencu N,BoonL M,Mendola A,et al. RASA1 mutations and associated phenotypes in 68 families with capillary malformationarteriovenous malformation[J]. Hum Mutat,2013,34(12):1632-1641.
[10]Shirley MD,Tang H,Gallione CJ,et al. Sturge-Weber syndrome and port-wine stains caused by somatic mutation in GNAQ[J]. N Engl J Med,2013,368(21):1971-1979.
[11]Brouillard P,Vikkula M. Genetic causes of vascular malformations [J]. Hum Mol Genet,2007,16 Spec No.2:R140-R149.
[12]Limaye N,Wouters V,Vikkula M. Somatic mutations in angiopoietin receptor gene TEK cause solitary and multiple sporadic venous malformations[J]. Nat Genet,2009,41(1):118-124.
[13]Bauland CG,Luning TH,Smit JM,et al. Untreated hemangiomas: growth pattern and residual lesions[J]. Plastic Reconstr Surg,2011,127(4):1643-1648.
[14]Bowers RE,Graham EA,Tomlinson KM. The natural history of the strawberry nevus[J]. Arch Dermatol,1960,82(5):667-680.
[15]Luu M,Frieden IJ. Haemangioma:clinical course,complications and management[J].Br J Dermatol,2013,169(1):20-30.
[16]Xu G,Lv R,Zhao Z,et al. Topical propranolol for treatment of superficial infantile hemangioma[J]. J Am Acad Dermatol,2012,67(6):1210-1213.
[17]Kunzi-Rapp K. Topical propranolol therapy for infantile hemangiomas[J]. Pediatr Dermatol,2012,29(2):154-159.
[18]Mouhari -Toure A,Azoumah KD,Tchamdja K,et al. Rapid regression of infantile haemangioma with 2%propranolol ointment [J]. Ann Dermatol Venereol,2013,140(6-7):462-464.
[19]Weissenstein A,Straeter A,Villalon G,et al.Topical timolol for small infantile hemangioma:a new therapy option[J]. Turk J Pediatr,2012,54(2):156-158.
[20]Bonifazi E,Milano A,Foti C. Allergic contact dermatitis caused by topical propranolol in a 5 -month -old baby[J]. Contact Dermatitis,2014,71(4):250-251.
[21]Ho NT,Lansang P,Pope E. Topical imiquimod in the treatment of infantile hemangiomas:a retrospective study[J]. J Am Acad Dermatol,2007,56(1):63-68.
[22]马刚,林晓曦,江成鸿,等.咪喹莫特治疗婴幼儿血管瘤[J].中华整形外科杂志,2011,27(6):411-414.
[23]金云波,林晓曦,叶肖肖,等.普萘洛尔作为严重婴幼儿血管瘤一线治疗的前瞻性研究[J].中华整形外科杂志,2011,27(3):170-173.
[24]金云波,常雷,邹运,等.普萘洛尔治疗腮腺区巨大婴幼儿血管瘤远期疗效研究[J].组织工程与重建外科,2015,11(4):246-247.
[25]Hall GW. Kasabach-Merritt syndrome:pathogenesis and management [J]. Br J Haematol,2001,112(4):851-862.
[26]Requena L,Kutzner H. Hemangioendothelioma[J]. Sem Diagn Pathol,2013,30(1):29-44.
[27]Drolet BA,Trenor CR,Brandao LR,et al. Consensus-derived practice standards plan for complicated Kaposiform hemangioendothelioma[J]. J Pediatr,2013,163(1):285-291.
[28]Tlougan BE,Lee MT,Drolet BA,et al. Medical management of tumors associated with kasabach-merritt phenomenon:an expert survey[J]. J Pediatr Hematol Oncol,2013,35(8):618-622.
[29]Jena M,Suma MN,Jeyachandran P. Spindle-cell hemangioma (spindle-cell hemangioendothelioma):A diagnosis on fine-needle aspiration cytology[J]. DiagnCytopathol,2012,40Suppl 2:E153-E155.
[30]Kasabach HH,Merritt KK. Capillary hemangioma with extensive purpura:report of a case[J]. Am J Dis Child,1940,59(5):1063-1070.
[31]Enjolras O,Wassef M,Mazoyer E,et al. Infants with Kasabach-Merritt syndrome do not have "true" hemangiomas[J]. J Pediatr,1997,130(4):631-640.
[32]Sarkar M,Mulliken JB,Kozakewich HP,et al. Thrombocytopenic coagulopathy(Kasabach-Merritt phenomenon)is associated with Kaposiform hemangioendothelioma and not with common infantile hemangioma[J]. Plast Reconstr Surg,1997,100(6):1377 -1386.
[33]Haisley-Royster C,Enjolras O,Frieden IJ,et al. Kasabach -merritt phenomenon:a retrospective study of treatment with vincristine[J]. J Pediatr Hematol Oncol,2002,24(6):459-462.
[34]Enjolras O,Mulliken JB,Wassef M,et al. Residual lesions after Kasabach-Merritt phenomenon in 41 patients[J]. J Am Acad Dermatol,2000,42(2 Pt 1):225-235.
[35]Chu CY,Hsiao CH,Chiu HC. Transformation between Kaposiform hemangioendothelioma and tufted angioma[J].Dermatology,2003,206(4):334-337.
[36]Le Huu AR,Jokinen CH,Rubin BP,et al. Expression of prox1,lymphatic endothelial nuclear transcription factor,in Kaposiform hemangioendothelioma and tufted angioma[J]. Am J Surg Pathol,2010,34(11):1563-1573.
[37]Abass K,Saad H,Kherala M,et al. Successful treatment of Kasabach-Merritt syndrome with vincristine and surgery:a case report and review of literature[J]. Cases J,2008,1(1):9.
[38]Alvarez-Mendoza A,Lourdes TS,Ridmn-Sanz C,et al. Histopsthology of vascular lesions found in Kasabach-Merritt syndrome:review based on 13 case[J]. Pediatr Dev Pathol,2000,3(6):556-560.
[39]汤宏峰,周媛嫒,顾伟忠,等.卡波西形血管内皮瘤临床病理特征[J].中华外科杂志,2004,42(18):1132-1135.
[40]Lyons LL,North PE,Mac-Moune LF,et al. Kaposiform hemangioendothelioma:a study of 33 cases emphasizing its pathologic,immunophenotypic,and biologic uniqueness fromjuvenile hemangioma[J]. Am J Surg Pathol,2004,28(5):559-568.
[41]Rodriguez V,Lee A,Witman PM,et al. Kasabach -merritt phenomenon:case series and retrospective review of the mayo clinic experience[J]. J Pediatr Hematol Oncol,2009,31(7):522-526.
[42]Croteau SE,Liang MG,Kozakewich HP,et al. Kaposiform hemangioendothelioma:atypical features and risks of Kasabach-Merrittphenomenon in 107 referrals[J]. J Pediatr,2013,162(1):142-147.
[43]Zukerberg LR,Nickoloff BJ,Weiss SW. Kaposiform hemangioendotheliomaof infancy and childhood:an aggressive neoplasmassociatedwith Kasabach -Merritt syndrome and lymphangiomatosis [J].Am J SurgPathol,1993,17(4):321-328.
[44]Respondek-Libenska M,Janisk K,Jakubek A,et al. Prenatal diagnosis of fetal face in a case of Kesabach-Merfitt syndrome [J]. Ultrasound Obstet Gynecol,2002,19(6):627-629.
[45]Panow C,Berger C,Willi U,et al. MRI and CT of a haemangioma of the mandible in Kasabach-Merritt syndrome[J]. Neuroradiology,2000,42(3):215-217.
[46]邵虹,朱铭,李玉华,等.儿童Kasabach-Merritt综合征的临床和CT、MRI表现[J].中华放射学杂志,2007,41(6):637-640.
[47]Baselga E,Cordiseo MR,Garzon M,et al. Rapidly involuting eongenital haemangionla associated with transient thrombocytopenia and coagulopathy:8 case series[J]. Br J Dermatol,2008,158(6):1363-1370.
[48]George M,Singhal V,Sharma V,et al. Successful surgical excision of a complex vascular lesion in an infant with Kasabach-Merritt syndrome[J]. Pediatr Dermatol,2002,19(4):340-344.
[49]Drolet BA,Scott LA,Esterly NB,et al. Early surgical intervention in a patient with Kasabach-Merritt phenomenon[J]. J Pediatr,2001,138(5):756-758.
[50]Jiang RS,Hu R. Successful treatment of Kasabach -Merritt syndrome arising from kaposiform hemangioendothelioma by systemic corticosteroid therapy and surgery[J]. Int J Clin Oncol,2012,17(5):512-516.
[51]Kim MG,Choi YS,Park SJ,et al. Kaposiform hemangioendothelioma of the breast in an adult female[J]. Clin Breast Cancer,2011,11(2):135-137.
[52]Shen W,Cui J,Chen J,et al. Kasabach-Merritt syndrome:case reports of successful treatment with partial tumor resection and vincristine chemotherapy[J]. Ann Plast Surg,2010,65(3):361-363.
[53]Tan ST,Wallis RA,He Y,et al. Mast cells and hemangioma[J]. Plast Reconstr Surg,2004,113(3):999-1011.
[54]欧阳天祥,邢新,李军辉,等.栓塞硬化联合激素注射治疗K-M综合征[J].第二军医大学学报,2002,23(6):676-677.
[55]Blei F,Karp N,Rofsky N,et al. Successful multimodal therapy for kaposiform hemangioendothelioma complicated by Kasabach-Merritt phenomenon:case report and review of the literature[J]. Pediatr Hematol Oncol,1998,15(4):295-305.
[56]O'Regan GM,Irvine AD,Yao N,et al. Mediastinal and neck kaposiform hemangioendothelioma:report of three cases[J]. Pediatr Dermatol,2009,26(3):331-337.
[57]Ryan C,Price V,John P,et al. Kasabach-Merritt phenomenon:a single centre experience[J]. Eur J Haematol,2010,84(2):97-104.
[58]Garcia -Monaco R,Giachetti A,Peralta O,et al. Kaposiform hemangioendothelioma with Kasabach -Merritt phenomenon successful treatment with embolization and vincristine in two newborns[J]. J Vasc Interv Radiol,2012,23(3):417-422.
[59]Zhou SY,Li HB,Mao YM,et al. Successful treatment of Kasabach-Merritt syndrome with transarterial embolization and corticosteroids[J]. J Pediatr Surg,2013,48(3):673-676.
[60]Zarem HA,Edgerton MT. Induced resolution of cavernous hemangiomas following prednisolone therapy[J]. Plast Reconstr Surg,1967,39(1):76-83.
[61]Gidding CE,Kellie SJ,Kamps WA,et al. Vincristine revisited [J]. Crit Rev Oncol Hematol,1999,29(3):267-287.
[62]Lopez V,Marti N,Pereda C,et al. Successful management of Kaposiformhemangioendothelioma with Kasabach -Merritt phenomenon using vincristine and ticlopidine[J]. Pediatr Dermatol,2009,26(3):365-366.
[63]Freeman I,Ganesan K,Emmerson AJ. Kasabach-Merritt syndrome in a term neonate[J]. Arch Dis Child Fetal Neonatal Ed,2012,97 (2):F139-F140.
[64]Thomson K,Pinnock R,Teague L,et al. Vincristine for the treatment of Kasabach-Merritt syndrome:recent New Zealand case experience [J]. N Z Med J,2007,120(1249):U2418.
[65]Taki M,Ohi C,Yamashita A,et al. Successful treatment with vincristine of an infant with intractable Kasabach -Merritt syndrome[J]. Pediatr Int,2006,48(1):82-84.
[66]Hu B,Lachman R,Phillips J,et al. Kasabach-Merritt syndromeassociated kaposiform hemangioendothelioma successfully treated with cyclophosphamide,vincristine,and actinomycin D[J]. J Pediatr Hematol Oncol,1998,20(6):567-569.
[67]Hermans DJ,van Beynum IM,van der Vijver RJ,et al. Kaposiformhemangioendothelioma with Kasabach-Merritt syndrome:a new indication for propranolol treatment[J]. J Pediatr Hematol Oncol,2011,33(4):e171-e173.
[68]Arunachalam P,Kumar VR,Swathi D. Kasabach-Merritt syndrome with large cutaneous vascular tumors[J]. J Indian Assoc Pediatr Surg,2012,17(1):33-36.
[69]Iacobas I,Burrows PE,Adams DM,et al. Oral rapamycin in the treatment of patients with hamartoma syndromes and PTEN mutation[J]. Pediatr Blood Cancer,2011,57(2):321-323.
[70]Adams DM,Trenor CC 3rd,Hammill AM,et al. Safety and efficacy study of sirolimus in the treatment of complicated vascular anomalies[J]. Pediatrics,2016,137(2):1-10.
[71]Blatt J,Stavas J,Moats-Staats B,et al. Treatment of childhood kaposiform hemangioendothelioma with sirolimus[J]. Pediatr Blood Cancer,2010,55(7):1396-1398.
[72]Jahnel J,Lackner H,Reiterer F,et al.Kaposiform hemangioendothelioma with Kasabach-Merritt phenomenon:from vincristine to sirolimus[J]. Klin Padiatr,2012,224(6):395-397.
[73]Hammill AM,Wentzel M,Gupta A,et al. Sirolimus for the treatment of complicated vascular anomalies in children[J]. Pediatr Blood Cancer,2011,57(6):1018-1024.
[74]Nozaki T,Nosaka S,Miyazaki O,et al. Syndromes associated with vascular tumors and malformations:a pictorial review[J]. Radiographics,2013,33(1):175-195.
[75]Hochman M,Adams DM,Reeves TD. Current knowledge and management of vascular anomalies,II:malformations[J]. Arch Facial Plast Surg,2011,13(6):425-433.
[76]顾瑛.临床诊疗指南——激光医学分册[M].北京:人民卫生出版社,2010.
[77]顾瑛.临床技术操作规范——激光医学分册[M].北京:人民军医出版社,2011.
[78]顾瑛.光动力疗法[M].北京:人民卫生出版社,2012.
[79]Brightman LA,Geronemus RG,Reddy KK. Laser treatment of port-wine stains[J]. Clin Cosmet Investig Dermatol,2015,8:27-33.
[80]Klein A,Bäumler W,Landthaler M,et al. Laser and IPL treatment of port -wine stains:therapy options,limitations,and practical aspects[J]. Lasers Med Sci,2011,26(6):845-859.
[81]Eivazi B,Ardelean M,Bäumler W,et al. Update on hemangiomas and vascular malformations of the head and neck[J]. Eur Arch Otorhinolaryngol,2009,266(2):187-197.
[82]Marler JJ,Mulliken JB. Current management of hemangiomas and vascular malformations[J]. Clin Plast Surg,2005,32(1):99-116.
[83]Duyka LJ,Fan CY,Coviello-Malle JM,et al. Progesterone receptors identified in vascular malformations of the head and neck[J]. Otolaryngol Head Neck Surg,2009,141(4):491-495.
[84]Lewin JS,Merkle EM,Ouerk JL,et al. Low-flow vascular malformations in the head and neck:safety and feasibility of MR imagingguided percutaneous sclerotherapy--preliminary experience with 14 procedures in three patients[J]. Radiology,1999,211(2):566-570.
[85]Li ZP. Therapeutic coagulation induced in cavernous hemangioma by use of percutaneous copper needles[J]. Plast Reconstr Surg,1992,89(4):613-622.
[86]Uehara S,Osuga K,Yoneda A,et al. Intralesional sclerotherapy for subcutaneousvenous malformations in children[J]. Pediatr Surg Int,2009,25(8):709-713.
[87]欧阳天祥,郭恩覃,邢新,等.海绵状血管瘤内压监测指导栓塞及硬化剂注射[J].中华整形烧伤外科杂志,1997,13(3):171-174.
[88]Jin Y,Lin X,Li W,et al. Sclerotherapy after embolization of draining vein:a safe treatment method for venous malformations [J]. J Vasc Surg,2008,47(6):1292-1299.
[89]Jin Y,Lin X,Chen H,et al. Craniofacial venous malformations:magnetic resonance imaging features that predict treatmen outcome[J]. J Oral Maxillofac Surg,2009,67(11):2388-2396.
[90]Kohout MP,Hansen M,Pribaz JJ,et al. Arteriovenous malformations of the head and neck:natural history and management[J]. Plast Reconstr Surg,1998,102(3):643-654.
[91]Liu AS,Mulliken JB,Zurakowski D,et al. Extracranial arteriovenous malformations:natural progression and recurrence after treatment[J]. Plast Reconstr Surg,2010,125(4):1185-1194.
[92]Jin Y,Lin X,Chen H,et al. Auricular Arteriovenous malformations:potential success of superselective ethanol embolotherapy[J]. J Vasc Interv Radiol,2009,20(6):736-743.
[93]Greene AK,Orbach DB. Management of arteriovenous malformations[J]. Clin Plast Surg,2011,38(1):95-106.
[94]Lee BB,Do YS,Yakes W,et al. Management of arteriovenous malformations:a multidisciplinary approach[J]. J Vasc Surg,2004,39(3):590-600.
[95]金云波,林晓曦,胡晓洁,等.DSA下无水乙醇超选择性血管内治疗颅面部动静脉畸形[J].中华整形外科杂志,2009,25(6):406-411.
[96]Giguère CM,Bauman NM,Sato Y,et al. Treatmentof lymphangiomas with OK -432(picibanil)sclerotherapy;A prospective mufti -institutionaltrial[J]. Arch Otolaryngol Head Neck Surg,2002,128(10):1137-1144.
[97]Kennedy TI,Whitaker M,Pellitteri P,et al. Cystic hygroma/ lymphangioma:a rational approach to management[J]. Laryngoscope,2001,111(11 Pt 1):1929-1937.
[98]Ninh TN,Ninh TX. Cystic hygroma in children:a report of 126 cases[J]. J Pediatr Surg,1974,9(2):191-195.
[99]Dadras SS,North PE,Bertoncini J,et al. Infantile hemangiomas are arrested in an early developmental vascular differentiation state[J]. Mod Pathol,2004,17(9):1068-1079.
[100]Sabin FR. The lymphatic system in human embryos,with a consideration of the morphology of the system as a whole[J]. Am J Anat,1909,9:43-91.
[101]Perkins JA,Manning SC,Tempero RM,et al. Lymphatic malformations:current cellular and clinical investigations[J]. Otolaryngol Head Neck Surg,2010,142(6):789-794.
[102]Veikkola T,Jussila I,Makinen T,et al. Signalling via vascular endothelial growth factor receptor-3 is sufficient for lymphangiogenesis in transgenic mice[J]. EMBO J,2001,20(6):1223-1231.
[103]Adams RH,Diella F,Hennig S,et al.The cytoplasmic domain of the ligand ephrin B2 is required for vascular morphogenesis but not cranial neural crest migration[J]. Cell,2001,104(1):57-69.
[104]Partanen TA,Alitalo K,Miettinen M. Lack of lymphatic vascularspecificity of vascular endothelial growth factor receptor 3 in 185 vascular tumors[J]. Cancer,1999,86(11):2406-2412.
[105]Norgall S,Papoutsi M,Rossler J,et al. Elevated expression of VEUFR-3 in lymphatic endothelial cells from lymphangiomas[J]. BMC Cancer,2007,7:105.
[106]Huang HY,Ho CC,Huang PH,et al. Co-expression of VEGF-C and its receptors,VEGFR-2 and VEGFR-3,in endothelial cells of lymphangioma. Implication in autocrine or paracrine regulation of lymphangioma[J]. Lab Invest,2001,81(12):1729-1734.
[107]Al-Rawi MA,Jiang WU. Lymphangiogenesis and cancer metastasis [J]. Front Biosci,2011,16:723-739.
[108]Wigle JT,Oliver G. Prox1 function is required for the development of the murine lymphatic system[J]. Cell,1999,98(6):769 -778.
[109]Cursiefen C,Chen L,Dana MR,et al. Corneal lymphangiogenesis:evidence,mechanisms,and implications for corneal transplant immunology[J]. Cornea,2003,22(3):273-281.
[110]Liersch R,Detmar M. Lymphangiogenesis in development anddisease[J]. Thromb Haemost,2007,98(2):304-310.
[111]Oliver G. Lymphatic vasculature development[J]. Nat Rev Immunol,2004,4(1):35-45.
[112]Waner M,Suen JY. Hemangiomas and vascular malformations of the head and neck[M]. New York:Wiley-Liss,1999:69-74.
[113]Fuentes S,Delgado D,Marti E,et al. Treatment of lymphatic malformations with OK-432 sclerosis. Our experience[J]. Cir Pediatr,2010,23(2):88-91.
[114]Laranne J,Keski-Nisula L,Rautio R,et al. OK-432(Picibanil)therapy for lymphangiomas in children[J]. Eur Arch Otorhinolaryngol,2002,259(5):274-278.
[115]Mathur NN,Rana I,Bothra R,et al. Bleomycin sclerotherapy in congenital lymphatic and vascular malformations of head and neck[J]. Int J Pediatr Otorhinolaryngol,2005,69(1):75-80.
[116]Sung MW,Lee DW,Kim DY,et al. Sclerotherapy with picibanil (OK-432)for congenital lymphatic malformation in the head and neck[J]. Laryngoscope,2001,111(8):1430-1433.
[117]Nehra D,Jacobson L,Barnes P,et al. Doxycycline sclerotherapy as primary treatment of head and neck lymphatic malformations in children[J]. J Pediatr Surg,2008,43(3):451-460.
[118]Cordes BM,Seidel FU,Sulek M,et al. Doxycycline sclerotherapy as the primary treatment for head and neck lymphatic malformations [J]. Otolaryngol Head Neck Surg,2007,137(6):962-964.
[119]Perkins JA,Manning SC,Tempero RM,et al. Lymphatic malformations:review of current treatment[J]. Otolaryngol Head Neck Surg,2010,142(6):795-803.
[120]Poldervaart MT,Breugem CC,Speleman L,et al. Treatment of lymphatic malformations with OK-432(Picibanil):review of the literature[J]. J Craniolac Surg,2009,20(4):1159-1162.
[121]Renton JP,Smith RJH. Current treatment paradigms in the management of lymphatic malformations[J]. Laryngoscope,2011,121(1):56-59.
[122]Smith MC,Zimmerman MB,Burke DK,et al. Efficacy and safetyof OK-432 immunotherapy of lymphatic malformations[J]. Laryngoscope,2009,119(1):107-115.
[123]Ogita S,Tsuto T,Tokiwa K,et al. Intracystc injection of OK-432:a new sclerosing therapy for cystic hygroma in children[J]. Brit J Surg,1987,74(8):690-691.
[124]Giguere CM,Bauman NM,Smith RJ. New treatment options for lymphangioma in infants and children[J]. Ann Otol Rhinol Laryngol,2002,111(12 Pt 1):1066-1075.
[125]Emery PJ,Bailey CM,Evans JN. Cystic hygroma of the head and neck. A review of 37cases[J]. J Laryngol Otol,1984,98(6):613-619.
[126]Haggstrom AN,Garzon MC,Baselga E,et al. Risk for PHACE syndrome in infants with large facial hemangiomas[J]. Pediatrics,2010,126(2):e418-e426.
[127]Metry D,Heyer G,Hess C,et al. Consensus statement on diagnostic criteria for PHACE syndrome[J]. Pediatrics,2009,124(5):1447-1456. [128]Hartemink DA,Chiu YE,Drolet BA,et al. PHACES syndrome:a review[J]. Int J Pediatr Otorhinolaryngol,2009,73(2):181-187.
[129]Gnarra M,Solman L,Harper JI,et al. Propranolol and prednisolone combination for the treatment of segmental haemangioma in PHACES syndrome[J]. Br J Dermatol,2015,173(1):242-246.
[130]Rootman J. Diseases of the orbit,2nd[M]. Philadelphia:Lippincott Williams & Wilkins,2003.
[131]Rootman J. Vascular malformations of the orbit:hemodynamic concepts[J]. Orbit,2003,22(2):103-120.
[132]Black EH,Nesi FA,Calvano CJ,et al. Smith and Nesi's ophthalmic plastic and reconstructive surgery,3rd[M]. Berlin:Springer,2012.
[133]Hernandez JA,Chia A,Quah BL,et al. Periocular capillary hemangioma:management practices in recent years[J]. Clin Ophthalmol,2013,7:1227-1232.
[134]Léauté-Labrèze C,Dumas de la Roque E,Hubiche T,et al. Propranolol for severe hemangiomas of infancy[J]. N Engl J Med,2008,358(24):2649-2651.
[135]Xu S,Jia R,Ge S,et al. Treatment of periorbital infantile haemangiomas:a systematic literature review on propranolol or steroids[J]. J Paediatr Child Health,2014,50(4):271-279.
[136]Xu SQ,Jia RB,Zhang W,et al. Beta-blockers versus corticosteroids in the treatment of infantile hemangioma:an evidence -based systematic review[J]. World J Pediatr,2013,9(3):221-229.
[137]范先群.眼整形外科学[M].北京:北京科学技术出版社,2009.
[138]许诗琼,贾仁兵,范先群.婴幼儿眼部血管瘤治疗进展[J].中华眼视光学与视觉科学杂志,2013,15(10):637-640.
[139]Harris GJ. Orbital vascular malformations:a consensus statement on terminology and its clinical implications[J]. AM J Ophthalmol,1999,127(4):453-455.
[140]Jia R,Xu S,Huang X,et al. Pingyangmycin as first-line treatment for low -flow orbital or periorbital venous malformations:evaluation of 33 consecutive patients[J]. JAMA Ophthalmology,2014,123(8):942-948.
[141]Eivazi B,Wiegand S,Negm H,et al. Orbital and periorbital vascular anomalies--an approach to diagnosis and therapeutic concepts[J]. Acta Otolaryngol,2010,130(8):942-951.
附录一:国际通用的血管瘤和脉管畸形治疗技术
1血管瘤和脉管畸形相关的激光治疗技术
1.1激光在血管瘤治疗中的应用
1.1.1血管瘤的激光治疗
婴幼儿血管瘤常以综合治疗为主,常用的方法有药物治疗、激光治疗、手术治疗等。其中激光治疗的适应证为浅表局限或散在的病变,综合治疗或自然消退后残余皮肤的血管瘤病灶,遗留的松弛和不平整的皮肤。
尽管婴幼儿血管瘤中多数为实体的增生内皮细胞,但激光治疗血管瘤可能的机制仍然是通过选择性光热作用。常用的有脉冲染料激光(Pulsed Dye Laser,PDL)、KTP激光、Nd:YAG激光、点阵激光。各种激光均有不同的适应证。
1.1.1.1脉冲染料激光
波长为585~595 nm,脉宽为0.45~20 ms,光斑大小为3~12 mm,能量密度为6~15 J/cm2,主要适用于增生早期的小范围点片状病灶,可阻止瘤体进一步增殖扩大,对消退期残留的浅表病灶也能达到加速消退,并改善功能和外观的效果。由于脉冲染料激光治疗血管瘤的最大穿透深度为1.2 mm,对深部或较厚的血管瘤需配合药物注射或其他穿透较深的激光治疗。
治疗即刻病灶呈现紫癜反应,7~10 d结痂脱落,病灶将明显变薄,浅表病灶经数次治疗后可彻底消除,治疗次数因血管瘤厚度而异。
1.1.1.2Nd:YAG激光
波长为1 064 nm的红外激光,有连续和脉冲两种输出方式。治疗原理是通过非选择性光热作用,在病灶萎缩的同时,周围正常组织将不可避免地因热损伤而出现相应的皮肤损伤。
①连续Nd:YAG激光:连续Nd:YAG激光对黏膜血管瘤效果理想,一次性可消除瘤体且瘢痕不明显。由于连续Nd:YAG激光的穿透深度可达4~6 mm,对皮肤上较厚的瘤体可较快去除,但治疗极易出现瘢痕,因此不推荐用于治疗皮肤上血管瘤。治疗后至少2周以后痂皮开始脱落,治疗间隔8周以上。
②长脉冲Nd:YAG激光:长脉冲Nd:YAG激光较连续Nd:YAG激光,在疗效及安全性上有很大的改善,脉宽参数0.25~300 ms可调,并有单脉冲、双脉冲和三脉冲形式,激光能量为10~600 J/cm2,带有喷雾动态冷却系统(Dynamic cooling device,DCD),避免了连续激光的非特异性热损伤,同时比脉冲染料激光的作用更深。
1.1.1.3点阵激光(Fractional Laser)
对于血管瘤自然消退后永久性的纤维脂肪残留,以及皮肤萎缩、粗糙、无弹性等改变,可用CO2激光和Er:YAG等剥脱性点阵激光治疗,达到增加皮肤平整度和表面重建等效果,而且副作用小,恢复时间短且具有疗效。
1.1.2激光治疗并发症
①红肿:激光治疗后即刻会出现红肿反应,通常24 h内逐渐消退,如果红肿持续不退,且逐渐加重,并出现水泡,则有感染可能,可服用消炎、消肿药。痒感,小儿常去搔抓,造成瘢痕。
②水泡:水泡是热损伤出现的表现,通常治疗后24 h内出现,及时将浆液性渗出引流,表皮勿损伤,愈合后可不留痕迹。但如果浆液性渗出变成脓性,则为感染征兆,遗留瘢痕的可能性很大。
③感染:常发生在易于污染的部位,及不易暴露、潮湿的位置,如腹股沟、会阴处等,表现为治疗区分泌物多,难于结痂愈合,或结厚痂,痂下有分泌物,处理以局部清洁换药为主,可口服抗生素,愈合后常遗留瘢痕及色素异常。
④瘢痕:激光治疗血管瘤出现瘢痕通常为热损伤过重所至。脉冲染料激光相对KTP激光及YAG激光热损伤小,瘢痕发生率低。如治疗能量过大,术中、术后未使用冷却,则易发生水泡,而出现凹陷性瘢痕,少见由于感染导致的增生性瘢痕。连续YAG激光对皮肤血管瘤的治疗极易出现瘢痕,故除口腔、眼睑、阴道、宫颈等黏膜处血管瘤外请慎用。
⑤色素改变:多为暂时性色素沉着,数月内消退,色素减退少见,且出现时间较晚,处理也较困难。
⑥皮肤质地异常:过度治疗会出现表皮的纤维化,使皮肤质地发生改变。进入消退期的血管瘤可选择观察,或仅采用小剂量治疗促进消退。
1.2激光在脉管畸形治疗中的应用
1.2.1毛细血管畸形
目前,临床上常用于治疗葡萄酒色斑的激光有脉冲染料激光、KTP激光、长脉冲Nd:YAG激光和强脉冲光。
①脉冲染料激光:包括Vbeam Perfecta、Cynergy等,波长585或595 nm。治疗参数根据患者的皮肤类型、病变程度、部位、面积大小进行选择。通常深色皮肤、浅红色病灶、位于皮肤较薄或易出现瘢痕处(眼周、口周、鼻背、前胸、外阴)及婴幼儿的葡萄酒色斑,选用较低能量密度;而对于紫色或增生或扩张病灶,选用较高能量密度。双波长激光建议用于增厚的扩张病灶,而平坦病灶则主张单用染料激光治疗。
②肽氧磷酸钾激光(KTP):波长532 nm(绿光),脉宽可调。治疗剂量的选择仍遵循不同肤色、不同部位、不同程度的个体化原则。脉宽的选择原则:较粗血管选择长脉宽,细小血管选用短脉宽。对扩张畸形严重的病变,如紫型、增厚型葡萄酒色斑选用7 ms、10 ms脉宽,而儿童浅红型葡萄酒色斑则选择2 ms、5 ms,并用低能量密度,以免出现瘢痕。
③强脉冲光:可发出波长500~1 200 nm的复合光谱的脉冲强光。治疗葡萄酒色斑通常选用515 nm、560 nm、590 nm滤光片,治疗终点为组织开始呈现浅灰色或暗红色。
1.2.2静脉畸形的激光治疗
因为微创血管内治疗已取代手术治疗而成为首选方法,主要采取局部经皮瘤内注入血管硬化剂类药物,如无水乙醇、博来霉素、聚桂醇等。因此,激光治疗仅适用于皮肤黏膜上的浅表静脉畸形,可分别使用长脉宽或连续Nd:YAG激光。
1.2.3获得性血管病变
是一类由于后天某些因素导致的血管异常性病变,称为获得性血管病变。
1.2.3.1匍行性血管瘤
匍行性血管瘤是一种在扩张的毛细血管内伴有内皮细胞增生的血管性疾病,典型病损为直径1 mm左右的鲜红色至紫色的血管瘤样小点或小丘疹,稍隆起于皮肤表面,压之退色,群集发生,匐行发展。全身除掌、跖、黏膜外,身体任何部位均可发生,下肢最多见。治疗采用脉冲染料激光治疗,585 nm或者595 nm波长,通常治疗2~3次,病变可消退。
1.2.3.2血管角皮瘤
血管角皮瘤是一种以真皮浅层毛细血管扩张和表皮角化过度为特征的皮肤血管性疾病,为常染色体显性遗传病,临床上分为五型,即肢端型、阴囊型、丘疹型、限界型和弥漫型,以前两型最为常见。
治疗采用脉冲染料激光,585或者595 nm波长,脉宽0.5~2 ms,能量5.5~7.5 J/cm2;也可采用双波长激光,通常治疗2~3次后病变可部分消退。
1.2.3.3疣状血管瘤
疣状血管瘤为血管瘤伴有表皮疣状角化过度,该病出生后或婴幼儿期发现,初为蓝红色结节,边缘清楚,随年龄增长瘤体逐渐扩大,表面凹凸不平,后渐变为蓝黑色并角化过度,呈不规则疣状。好发于下肢和足部。病理表现为真皮内扩张的血管窦,表皮角化过度,继发棘层肥厚和乳头瘤样增生。治疗选择超脉冲CO2激光汽化,瘤体较大者可用连续Nd:YAG激光从根部切除,如采用双波长长脉冲激光亦需早期多次治疗。
1.2.3.4老年性血管瘤
老年性血管瘤(Senile angioma or senile hemangioma)又称De Morgan斑,主要发生于成人躯干部,为多发性鲜红色的小血管瘤。皮损为直径1~5 mm丘疹,鲜红或樱桃色,逐渐增大,呈半球状,稍高出于皮面,大小不一,质软,数目多少不定,压之可退色,有时可见瘤体周围有缺血晕。本病亦可发生于青少年,随年龄增长而逐渐增多,主要发生于躯干和四肢近端,偶发于头皮和面部以及四肢远端,但不累及手足。本病可用585 nm、595 nm、532 nm激光及长脉冲Nd:YAG治疗
1.2.3.5化脓性肉芽肿
毛细血管扩张性肉芽肿(Granuloma telangiectaticum),又称化脓性肉芽肿(Granuloma pyogenicum),是血管增生类疾病,多在皮肤穿通外伤后,新生成的血管形成息肉状病灶。可发生于任何年龄,常发生于身体易受伤部位,好发于头面部、手足等处,无明显症状,常因瘤体反复出血而就医。治疗可用注射联合激光治疗,通常采用CO2激光、连续Nd:YAG激光和脉冲染料激光。可单用一种激光也可三种联合使用,术中出血少,治疗彻底,瘢痕不明显。
1.2.3.6血管痣
为局限性毛细血管扩张,表现为点状或小圆球状红色新生物,突出于皮肤表面,有的周围有放射状扩张的毛细血管,形如蜘蛛,故名蜘蛛痣。血管痣常见于儿童,蜘蛛痣可于妊娠或患慢性肝病时增多,其发生原因与雌激素增多有关。用脉冲染料激光治疗为佳,对于较大的血管痣,中心血管部分可用Nd:YAG激光治疗。
1.2.3.7毛细血管扩张
毛细血管扩张(Telangiectasis)可作为一些疾病的主要症状,也可继发于一些皮肤病及全身性疾病,亦可由物理、地理因素造成,部分健康人也会无任何诱因地出现面部毛细血管扩张。可有如下的表现和诱因:①部分皮肤病可出现毛细血管扩张的症状,如酒渣鼻、慢性盘状红斑狼疮、着色性干皮病、放射性皮炎、硬皮病、皮肤异色症、毛细血管扩张性环状紫癜、雷诺氏病等,都可有明显的毛细血管扩张症;②毛细血管扩张的全身性疾病,如肝脏疾病、内分泌疾病(甲亢、卵巢和脑垂体疾患等)、结缔组织病(系统性红斑狼疮、皮肌炎、全身性硬皮病等),以及一些心脏病和铅中毒等,都可有毛细血管扩张表现;③物理因素,如长期日光照射、X线照射等,都能引起皮肤毛细血管扩张;④地理因素,如高原地区引起的高原红;⑤药物因素,如激素性皮炎等;⑥特发性毛细血管扩张(Idiopathic telangiectasis)。本病除治疗原发病外,可用585 nm、532 nm激光及强脉冲光治疗。
1.2.3.8静脉湖
静脉湖可发生于任何年龄,但好发于中老年人暴露部位的皮肤和黏膜,如头、颈、耳、口唇等,呈深蓝色至黑色丘疹。病理表现见扩张的静脉,真皮浅层可见高度扩张的血管腔隙,其中充满红细胞,管壁由单层内皮细胞和薄层纤维组织构成。可采用长脉宽Nd:YAG激光治疗去除静脉病灶。
2脉管畸形的介入栓塞治疗
介入栓塞治疗是一种血管内治疗方法,是指在医学影像设备的引导下,结合临床治疗学原理,通过导管等器材注入栓塞剂对病变进行治疗的一系列技术,包括血管或非血管二种途径将栓塞药物或装置送入到病灶血管腔内部,以达到治疗目的。目前,介入栓塞已成为脉管畸形必不可少的治疗方法。
2.1常用介入栓塞药物及选择
临床使用的栓塞剂种类繁多,分为固体及液体栓塞剂。固体栓塞剂有PVA颗粒、明胶海绵、弹簧圈等;液体栓塞剂有Onyx、二氰基丙烯酸正丁酯(N-butyl-2-cyanoacrylate,NBCA)、无水乙醇等。选择栓塞剂需考虑以下因素:①需要治疗的病灶部位及血管分布区域;②血管畸形的类型、流量特点;③超选择注射栓塞剂的可行性;④治疗目的以及预期栓塞的持久性。
2.2介入栓塞治疗在高流量脉管畸形——动静脉畸形中的应用
介入栓塞血管内治疗在颅外动静脉畸形治疗中的地位日益重要。处于静止期、无症状的动静脉畸形以观察为主;对于出现症状或增大明显的动静脉畸形,介入栓塞是重要的治疗手段。治疗前常规影像学检查有助于了解病灶局部解剖关系及范围,DSA造影是最重要的术前检查项目,不仅能直接显示病灶瘘口分布及引流情况,为制定治疗方案提供依据,更是疗效评价的通用指标。动静脉畸形的治疗目的包括:①完全治愈动静脉畸形;②栓塞缩小病灶,减少盗血现象,治疗及改善并发症,比如经久不愈的溃疡等;③配合手术治疗的术前介入栓塞减少病灶血流,以利于手术切除。④改善局部异常的血流动力学,阻止静脉动脉化进程。
单纯将病灶供血动脉栓塞,不仅无法消除病灶,反而会加速血流动力学紊乱,促进病灶发展。目前,除非是遇到难以控制的大出血等紧急情况,不再主张单纯栓塞供血动脉。现代动静脉畸形血管内治疗的核心是使栓塞剂直接作用于病灶瘘口或尽量接近瘘口。治疗方法上可通过经动脉途径、经静脉逆行途径及经皮穿刺直达瘘口。栓塞治疗成功的关键在于输送器的准确置位,以及栓塞材料的选择。输送器的准确置位是指将注入栓塞材料的输送器通过血管内或经皮穿刺的方式置于异常血管团的中央,经其造影仅有血管团和回流静脉显示,而供血动脉不显示。动静脉畸形常用的栓塞材料有PVA颗粒、Onyx、二氰基丙烯酸正丁酯(N -butyl -2 -cyanoacrylate,NBCA)、无水乙醇和弹簧圈等。宜根据病变的范围、栓塞目的、回流静脉出现的早晚,以及侧支循环情况,选择相应的栓塞材料。
PVA是颗粒栓塞材料中最常用的栓塞剂。使用前,首先把PVA和造影剂进行混合,然后把混悬液抽进注射器内立即进行栓塞治疗用。注射时,应在电视监视下进行,缓慢、不得返流。PVA栓塞后的病理改变有血管壁原发性炎性反应。PVA属于中期栓塞材料,但经病理证实,其颗粒周围可发生再通。
动静脉畸形的栓塞治疗以选用液体栓塞剂为主,液体栓塞剂主要包括组织胶NBCA、Onyx和无水乙醇。组织胶NBCA和Onyx的栓塞效果较PVA长久,曾被认为是动静脉畸形的永久栓塞剂,但是长期的临床随访显示,NBCA和Onyx栓塞后,还会发生新生血管的形成和血管再通,表现为栓塞治疗后病变复发。同时,NBCA和Onyx的栓塞不能解决动静脉畸形所致的占位效应,不能改善病变所致外观畸变。
无水乙醇作为液体栓塞剂治疗动静脉畸形,使治愈这一类最困难的脉管畸形成为可能,是动静脉畸形治疗史上的一个飞跃。无水乙醇不同于以往任何栓塞硬化剂,由于其脱水和剥蚀作用,使接触的血红蛋白变性并直接破坏作为动静脉畸形复发根源的血管内皮细胞,从而达到动静脉畸形的治愈效果。通过此项技术,即使是弥散复杂的病变,亦可以达到完全治愈的目的,或者至少可以减小病变体积,改善患者的临床症状,避免出现急性出血和心衰等严重后果。无水乙醇流动性好,可以浸润到毛细血管水平,是目前唯一能达到动静脉畸形根治效果的栓塞剂。乙醇栓塞治疗动静脉畸形的关键,是将乙醇通过导管或直接穿刺的方法,注入到病变异常血管团内,而非其供血动脉或引流静脉。治疗的目标是通过一次或分次治疗,全部或部分消除病灶,直至取得令人满意的临床效果。无水乙醇注射时常引起患者剧烈疼痛和肺动脉压升高等一系列病理生理变化,故手术常需在全麻状态下进行。无水乙醇的注射量以病变血管的体积及其血流动力学特征而定,无水乙醇注射前应注射造影剂直至造影剂充满整个异常血管团,以明确无水乙醇的注射量及注射的压力和速率。虽然乙醇用于动静脉畸形的栓塞治疗已初步取得了令人满意的临床效果,但作为最具挑战性的栓塞材料,其带来的并发症必须引起足够的重视。
对于伴有明显回流静脉扩张的动静脉畸形,可使用弹簧圈堵塞回流静脉端,以有效地降低病灶的血液流速,使乙醇与内皮细胞接触时间延长,更好地发挥无水乙醇治疗动静脉畸形的效率,同时亦可减少乙醇用量,提高治疗安全性。
无水乙醇介入栓塞治疗动静脉畸形,有发生心肺衰竭等严重并发症的可能,高效率的同时伴随着高风险,因此严格的术前造影评估、患者选择,以及严密的术中监测、术后管理缺一不可。同时,该类疾病需在专业的脉管性疾病诊疗中心治疗,任何不谨慎的操作及不合理的乙醇运用,都将造成灾难性的后果,因此该治疗的并发症限制了广泛的推广应用。
2.3介入硬化治疗在低流量脉管畸形——静脉畸形、淋巴管畸形中的应用
低流量脉管畸形包括静脉畸形及淋巴管畸形。静脉畸形,是人体最常见的先天性血管畸形。静脉畸形主要采用经皮穿刺静脉造影的方式,显示病变及其血流构筑。通过静脉造影观察病变的形态、静脉回流的速度、静脉回流的区域、不同区域的病变是否相通。静脉畸形按回流静脉的情况可分为4型:Ⅰ型为孤立型,无明显回流静脉;Ⅱ型为回流静脉系正常静脉;Ⅲ型回流静脉发育正常;Ⅳ型为静脉扩张型。淋巴管畸形分为微囊型及巨囊型,是少见的低流量脉管畸形。
以往对静脉畸形、淋巴管畸形的治疗大多提倡手术切除。但对于弥散型或范围巨大者,由于功能和解剖的限制,仅靠手术治疗难以奏效,并且会导致大出血、神经损伤、畸形加重,以及病变复发等并发症。
低流量脉管畸形介入治疗的硬化剂主要包括平阳霉素、鱼肝油酸钠、聚桂醇和无水乙醇等。大型静脉畸形介入硬化治疗前,应行病变的瘤腔造影,以了解畸形静脉的回流状态。低回流者一般可选用博莱霉素和聚桂醇,高回流者则需要选择无水乙醇。因为博莱霉素等弱效硬化剂进入管腔后立即流走,药物在血管腔内发挥作用的时间有限。而无水乙醇进入管腔后,对血管内皮细胞等结构发挥强烈的破坏作用,从而达到治疗目的。
博莱霉素、平阳霉素以及聚桂醇,均是较温和、组织反应轻微的硬化剂,适于回流较慢或分布很浅表的静脉畸形的治疗;对眼睑周围、鼻尖等特殊部位的静脉畸形,可用其进行硬化治疗。注射硬化剂前,须开放静脉通道,以防药物过敏等意外发生。
DSA血管造影监视下,无水乙醇介入硬化治疗静脉畸形和淋巴管,是目前较高效的治疗方法。造影下治疗可以明确显示病灶范围、形态、流量、引流情况,减少并发症风险。大面积、深在脉管畸形,以及不合作患儿的介入硬化过程,应全麻下进行;病变较小或合作的脉管畸形患者,可局麻下进行。由于治疗后肿胀严重,所以对累及舌根、咽、喉部位的病变,注射时建议行预防性气管切开,或带管观察到安全时拔管。脉管畸形介入硬化治疗的后期,病变囊腔变小,穿刺变得困难,此时可在超声引导下进行硬化剂的注射治疗。
MRI可作为随访手段进行疗效评估。无水乙醇介入硬化治疗脉管畸形疗效肯定,需结合具体病情多次、分阶段治疗,需结合动态的静脉造影、在DSA监视下进行,特殊解剖部位尚需结合博莱霉素硬化治疗。对于经硬化治疗病变得到完全控制后,外观仍遗留有明显畸形的患者,可行整形手术治疗,以提高患者的生活质量。无水乙醇不仅对脉管畸形产生治疗作用,而且在治疗脉管畸形的同时,能使病变缩小或消失,从而达到改善外观的目的。
总之,介入栓塞血管内治疗高流量及低流量脉管畸形的临床运用日趋广泛,相应的栓塞剂及治疗方法不断改进。介入栓塞治疗具有手术治疗无法达到的优点和疗效,特别是无水乙醇介入治疗的疗效及复发率已优于手术治疗。然而,由于介入治疗具有特有的高风险及有限适应证,不适于在经验不足、病例稀少的中心过快推广。对于疑难、复杂脉管畸形(特别是动静脉畸形)仍需采用综合治疗方案。根据病情、解剖、血流动力学特点在介入及手术之间合理组合及取舍,才能达到治疗效益合理化和最大化。
3无水乙醇在血管畸形治疗中的应用
无水乙醇侵蚀性强,可使血红蛋白变性、血管内皮细胞脱水、原生质沉淀、血管壁内皮细胞层剥脱、血管壁内弹性膜层节段性损坏,这些过程联合在一起,迅速引起病灶组织坏死和血栓形成。这种侵蚀作用是无水乙醇治疗血管畸形的机制。对于正常组织如神经、肌肉或结缔组织,要注意避免无水乙醇进入其供血动脉,而导致的正常组织坏死。因此,无水乙醇治疗血管畸形,必须要由经验丰富的专科医师操作,不恰当地应用无水乙醇,或使用经验不足,可能导致严重的并发症或高并发症率,甚至灾难性后果。
3.1安全应用无水乙醇的要点
安全应用无水乙醇的技术要点如下:①超选择抵达血管畸形病灶;②避免误栓正常血管;③无水乙醇用量每次最好不超过0.2 mL/Kg(成人);④良好的术中监测;⑤及时的术后护理,包括恰当用药以减少不良反应引起的后遗症;⑥密切随访疗效和制定后续治疗计划。
3.2无水乙醇在静脉畸形中的应用
静脉畸形(Venous malformations)为先天性血管畸形、头颈部静脉畸形患者,常因外观畸形而就诊,四肢静脉畸形常引起疼痛、肿胀或功能障碍,严重者可出现静脉性溃疡。静脉畸形病灶在MRI的T2像显影明确。经皮穿刺的静脉造影,能更好地显示病灶的血流动力学特征。
经皮穿刺直达病灶是最好的治疗方式。术中需仔细评估病灶的体积和回流静脉情况。反复评估充满病灶所需的造影剂体积和避免无水乙醇流入正常血管所需的压力。只要术中评估充分、操作得当,术后并发症通常很少。大多数静脉畸形经无水乙醇治疗可治愈或病灶明显缩小,甚至消失。判断注射点不在动脉内,是安全治疗的核心,如果不能经过DSA造影确认,或经穿刺方法,比如双针法或多针法等确认在静脉血窦内,则应慎重注射。当然,这个原则同样适用于泡沫硬化剂及其他硬化剂。
3.3无水乙醇在动静脉畸形中的应用
动静脉畸形(Arteriovenous malformations,AVM)缺乏正常的毛细血管床,病灶的特殊结构导致血流动力学异常,引起一系列效应。①供血动脉扩张、迂曲、增厚,血流量增加;②末梢动脉血流经血压较低的瘘口分流盗血;③末梢动脉压降低,引起末梢组织缺血;④外周静脉压升高,加重外周动脉缺血、疼痛、溃疡、肿胀和坏疽;⑤长期心排血量升高,发展为心力衰竭。大多数患者会因病情发展而必须进行治疗。
无水乙醇介入栓塞治疗AVM效果显著,不仅完全不同于其他固态或液态栓塞剂作为术前辅助治疗的作用,而且正在替代很多既往只有根治性手术才能达到的几乎痊愈的结果。因此,该方法正在改变动静脉畸形的治疗模式。只要可以超选择到达病灶瘘口,无论哪个临床分期,均可进行治疗。另一方面,无水乙醇治疗引发的并发症问题也引起了广泛关注。误栓或返流可能引起周围正常组织和器官坏死、神经损伤(如面瘫)、重要器官功能丧失(如失明),甚至心肺衰竭而导致死亡。无水乙醇治疗要求导管或注射针必须超选择抵达病灶,防止误栓或过度返流。对病灶血流动力学状态的充分评估和精准的操作,是保证治疗安全有效的前提,必须由经验丰富的专科医师实施或指导,尽可能避免严重并发症的发生。
4泡沫硬化治疗
泡沫硬化治疗是静脉畸形常用的血管内治疗方法之一,目前国内使用的有聚桂醇、安束喜等,现以聚桂醇为例,阐述该治疗的基本原则。
聚桂醇注射液是一种泡沫硬化剂,化学成分为聚氧乙烯月桂醇醚。治疗原理是:药物泡沫注入病变血管,造成血管栓塞,血栓形成并产生无菌性炎症,促使结缔组织增生纤维化,使血管闭塞、瘤体萎缩消退。泡沫制剂使药物在血管内流动变慢,与血管壁接触面增大,既减少了药量又增强了疗效,与传统硬化剂比较,具有疼痛及局部反应轻,瘢痕不明显,毒副作用小,安全、方便等优点。
4.1适应证
含有扩张静脉的血管畸形,其中皮下静脉曲张、静脉扩张畸形、肌间静脉畸形为首选。婴幼儿血管瘤主要为血管内皮细胞构成,治疗机制并无特异性,并有可能导致结痂、溃疡等形成,故不是推荐的主要适应证。
4.2泡沫配制方法药液
CO2或药液∶空气=1∶4,采用三通管配制。
4.3治疗间隔时间
2~4周治疗一次
4.4灌注治疗技术要点
对皮下静脉扩张、曲张及静脉畸形,注射针头穿刺入扩张静脉后,让泡沫硬化剂充满静脉畸形,通过压迫等方法可以增加潴留时间,并可明显提高疗效。深部病灶,如肌间静脉畸形,也可在DSA下,或在彩超引导下注射或灌注。血管瘤注射可在回抽到血液后,缓慢推药至病灶发白为止,药物体积一般勿超过肿瘤的1/2。
4.5副作用及并发症
①严重紫绀、呼吸障碍、心率下降,主要见于新生儿血管畸形。应严格选择病例,小剂量缓慢推注药液。②注射后的坏死及溃疡、结痂,主要见于血管瘤,预防要点为严格掌握治疗适应证及剂量。③过敏,皮肤瘙痒荨麻疹,少见。④疼痛,局部红肿。⑤严重呛咳、面唇轻度紫绀,与药物用量、泡沫浓度、推注速度及大量气体入血有关。
4.6其它注意事项
①麻醉问题:多数病例门诊即可完成治疗。新生儿及大型病变,用药剂量大时可住院治疗。一般不需麻醉,但婴幼儿灌注时疼痛、哭吵剧烈,对于极其不合作的小儿、注射时间长或口腔咽部特殊部位,可考虑基础或全麻下进行。②各类血管畸形的治疗选择应根据其类型灵活制定优选方案。
5抗肿瘤药物注射治疗
抗肿瘤药物治疗在血管瘤和脉管畸形的各种重要类型中都有可能涉及,其中以博莱霉素最为常见,下面以国产的博莱霉素A5(平阳霉素)为例,阐述其应用原则。
5.1平阳霉素治疗血管瘤和脉管畸形的机制
平阳霉素是博来霉素类抗肿瘤药物的新品种,由我国自主研制并投入临床应用。其作用机制是通过抑制癌细胞DNA的合成和切断DNA链,影响癌细胞代谢功能,从而促进癌细胞变性、坏死。平阳霉素是细胞周期非特异性药物,对机体的免疫功能影响较少,对造血功能无明显影响。
应用抗癌药物治疗血管瘤,60~80年代国外已有个案报告。平阳霉素为国产的广谱抗癌抗生素,对血管内皮细胞有抑制作用,可静注、肌注、瘤内注射和动脉内注射,不良反应小。平阳霉素导致血管腔闭锁的机制是,特异性损伤血管内皮细胞及管壁,诱导血管平滑肌细胞和内皮细胞增生,使管壁增厚、管腔狭窄,最终闭锁。
5.2平阳霉素治疗适应证
近年来,大量临床研究表明,平阳霉素注射治疗血管瘤和脉管畸形具有良好的效果,包括①各期婴幼儿血管瘤;②静脉畸形;③淋巴管畸形(微囊型和大囊型),甚至部分早期或残留的动静脉畸形。
5.3平阳霉素治疗方法
治疗婴幼儿血管瘤的浓度为1 mg/mL(平阳霉素8 mg+2%利多卡因1~2 mL+5~6 mL注射用水,也可加1 mL地塞米松),剂量为1 mg/cm2,每次用药量一般不超过4 mg,病变范围大时7~14 d(视肿胀消退程度)后可重复注射,注射次数应尽量少,注射总量一般不超过20 mg,当病变得到控制并逐渐消退即可,切勿追求血管瘤短期内完全消失。治疗血管瘤时,可从瘤体周边进针,向瘤内注射药液至瘤体表面肿胀、稍变白为度。位于眼睑、唇红及会阴等表浅的病变,每次注射药量应较其他部位相应减少,否则易出现溃疡坏死。面积较大或多发者,可采取分次注药治疗,一般先外周后中央,以防止治疗期间病变向周围进一步扩展。
对于静脉畸形及大囊型淋巴管畸形,注射浓度为3 mg/mL左右(平阳霉素8 mg+2 mL注射用水),亦可加用1 mL地塞米松,静脉畸形应穿刺抽出回血,并确认不在动脉内后再注射;治疗次数和病灶体积相关。对于巨囊型淋巴管畸形,抽净囊液后保持针头原位再行注射;微囊型淋巴管畸形的药物浓度为1.5~2 mg/mL。例如:平阳霉素8 mg+2%利多卡因1~2 mL+2~3 mL注射用水+1 mL地塞米松,每次用药量成人8 mg,小儿一般不超过4 mg,宜从病变最明显的部位进针,向瘤内注射药液至瘤体表面明显肿胀、表面泡点变苍白为止。间隔7~14 d(视病变大小)后重复注射,3~5次为一个疗程。
5.4平阳霉素不良反应及防治
平阳霉素注射治疗不良反应较小,常见的不良反应有发热、局部软组织肿胀、消化道反应、局部破溃坏死等,而过敏性休克、脱发、皮肤反应及白细胞降低等较为少见。长期使用平阳霉素的最令人担心是其肺毒性。肺毒性的发生与剂量大小密切相关,平阳霉素总剂量低于450 mg时,发生率为3%~5%;高于500 mg时,发生率达35.5%。
总量超过160 mg,可引起肺纤维化,但一般用于治疗血管瘤和脉管畸形的总剂量不超过100 mg。平阳霉素注射可导致注射组织发育不良和缺损,治疗早期并无表现。但后期可能严重影响外观,需引起重视。
使用平阳霉素,偶可引起过敏反应,多发生在多次注射后。过敏反应发病急,症状严重,如准备不足,抢救不及时,可导致患者死亡,必须引起高度重视。为预防过敏反应和急救需要,建议平阳霉素与地塞米松一起注射;注射药物前,开放静脉通路,以方便过敏性休克发生时进行抢救。一旦发生过敏性休克应①立即停药,协助患者平卧、吸氧;②立即皮下注射0.1%盐酸肾上腺素0.5~1.0 mL,小儿酌减。症状如不缓解,应立即静脉注射肾上腺素、地塞米松,直至脱离危险;③发生心跳骤停应立即进行复苏抢救。
附录二:国内少数单位开展的其他特殊治疗技术
指南前面所描述的是国际上较为广泛使用,并得到共识的推荐治疗方法或技术。但国内仍有一些既往使用过的治疗方法,或对其他领域治疗方法的扩大应用。这些方法目前仍在一些医疗机构开展,且形成一定的经验和治疗特色。但这些治疗方法大多存在效率或并发症控制方面的不足,在使用或掌握不当的情况下,可能造成严重的皮肤瘢痕、色素改变、远期复发、非特异性的深部组织损伤、注射后局部组织凹陷或发育障碍、重要血管结扎等。因此,这些方法目前应用已在逐渐减少,或者仍可能有待进一步改进,目前尚无法形成医学意义上的推广,很难形成共识或作为推荐治疗。以下选择其中3种治疗技术,仅供了解和参考。
1电化学治疗
电化学疗法是上世纪80年代兴起的一种治疗恶性肿瘤的微创疗法,上世纪90年代起应用于血管畸形的治疗,对大面积血管畸形提供了一种创伤小、恢复快和临床疗效确切的治疗选择。通常体积较小的低流量血管畸形可以选择硬化剂注射,而巨大的弥漫性病灶硬化剂治疗经常受限,而传统的外科手术创伤大,并发症多,风险高,而且很难将病灶清除,复发率极高。电化学治疗因此成为一种新的选择。
1.1电化学治疗的基本原理
通过电化学治疗仪和特制电极针将直流电导入病变组织内并产生强烈的化学反应,阳电极区pH值下降到1~2,呈强酸性;阴电极区pH值上升到12~13,呈强碱性;这种强酸强碱性可破坏病变组织,产生凝血块和无菌性坏死。最后凝血块和坏死组织的机化使血腔实性变,导致病变体积的缩小和临床症状的改善。
1.2电化学治疗的适应证
①手术切除难以施行的巨大弥漫性低流量血管畸形(静脉畸形或淋巴管畸形);②动脉栓塞治疗后的巨大高流量血管畸形(动静脉畸形),
1.3电化学治疗的方法
①手术前行凝血功能和肝肾功能等常规检查。根据病变部位选择麻醉方式,椎管或全身麻醉。②根据MRI或超声检查确定的病变部位和范围,通常沿肿瘤的纵轴方向,在病变旁约2 cm的健康皮肤处,应用18G套管针穿刺进入病变区域。拔除套管针的针芯,将特制的铂金电极针沿套管送进病变区域。电极针要贯穿整个病变区域。电极针之间的距离约1 cm左右。根据病变的大小可将电极针排列成单层或多层。调整套管针的位置令电极针和病变充分接触并保护正常组织。③将电极针分别连接于电化学治疗仪的阴阳极后通电治疗。治疗电压8~12 V,电流100~180 mA,电量约80~100 C/cm2。治疗中能触摸到瘤体组织由软变硬。④治疗完成停机后拔除电极针和套管针,纱布压迫针眼止血,局部加压包扎。⑤治疗结束后可根据情况辅助硬化剂注射治疗。
1.4电化学治疗的注意事项
①邻近重要血管神经的病变是电化学治疗的相对禁忌症,解剖不清楚或治疗电量过大可造成重要血管神经的损伤;②治疗参数因人而异,需要根据经验调整,不能一概而论;③电极针的位置、数量和绝缘套管的位置,均和疗效及可能的皮肤损伤有关。④高流量血管畸形的电化学治疗通常在行动脉栓塞后48 h内完成。
1.5电化学治疗的疗效评价
电化学治疗后局部坏死物质和凝固血块的吸收机化需要3~6个月,故通常治疗后3~6个月进行疗效评定。通过临床症状的改善、影像学检查所见病变大小的改变,及病变处外观的改善,来评价治疗效果。
2高频电凝治疗
高频电凝微创术就是通过高频电凝治疗机和微创电凝针,达到对病变组织局部微创治疗的一种治疗方法。主要是通过高频电凝破坏局部组织内的血管结构,并使蛋白发生凝固变性。破坏血管至血管闭合,血管壁中蛋白变性,血管失去功能,可使局部丰富的血管数量减少至正常范围;使血液中的血红蛋白凝固变性,形成栓子阻碍或阻塞血液流动。二者共同作用,能使局部组织内血流量减少或缺血,进而阻止瘤体的快速生长,甚至萎缩,达到治疗的目的。
主要设备包括:高频电凝治疗机(仪)、微创电凝针。治疗方法:首先在治疗前通过医学影像学确定病患部位、范围大小和距体表的深度,并在体表加以标注。根据瘤体的大小、性质、距体表的深度等不同,选择适当的能量输出。一般在4~10 W的范围,能量选择过高会使局部组织碳化或汽化,局部容易形成空洞、死腔,诱发感染或局部机化形成硬结,影响治疗效果。能量选择过低则达不到治疗的效果。放电时间一般1~2 sec即可。
手术及术后注意事项在手术过程中注意避开神经、腺体的导管以及较大的血管。在治疗结束前距表面3~5 mm停止放电,以免电(灼)伤皮肤黏膜,遗留瘢痕和色素沉着。治疗结束局部加压包扎,抬高患部,以减轻局部的组织水肿。两次治疗间隔2个月以上为宜。
适应证:①血管瘤;②静脉畸形、淋巴管畸形和部分混合脉管畸形。
禁忌症:①治疗区域急性炎症;②出血性疾病;③高流量血管畸形;④其他不适合采用高频电治疗的患者,如安装起搏器的患者等。
并发症:①感染;②局部出血,加压包扎或局部压迫即可止血;③局部水肿;④损伤临近正常组织。
3尿素治疗
3.1尿素治疗血管瘤与脉管畸形原理
尿素属于人体相容性物质,对人体无毒性及副作用,20%的尿素是一种临床应用的脱水剂,可静脉注射及局部注射。上世纪70年代开始尝试用于血管瘤治疗,至今已有40年历史。
尿素注射治疗血管瘤的机制:①尿素注射后,血管瘤组织立即出现无菌性急性炎症改变、变质、渗透和增生,1~2周后炎症消退,新生的结缔组织取代血管瘤组织;②尿素能破坏细胞基质。尿素是一种细胞毒剂,能抑制肿瘤细胞的生长增殖,并直接作用于肿瘤细胞器酶系统,如碱性磷酸酶、乳酸脱氢酶,或与多核苷肽合成有关的核酸酶等影响多核苷酸代谢;③高浓度尿素能打开蛋白链,使氨基酸侧链及蛋白多肽主链结构变化,导致蛋白质变性溶解;④尿素的高渗透压可对肿瘤细胞起杀伤作用。除对细胞本身的作用外,尿素还可能对机体免疫系统起作用。
对于脉管畸形,高浓度尿素在畸形组织内滞留时,使其蛋白代谢受阻,酶促反应紊乱,局部发生无菌性炎性变,细胞坏死。尿素可引起小动脉收缩及内皮细胞代谢异常,内膜增厚,即瘤体血管发生栓塞。高浓度尿素滞留于瘤体血管内时,使其内膜细胞发生脱水、坏死、血管内凝血。上述诸因素使瘤体内血管发生广泛栓塞,病变组织因缺血、缺氧、代谢障碍而发生退行性改变,进而被结缔组织取代,从而达到硬化缩小瘤体的目的,使手术更易进行,减少术中出血,降低手术复发率。
3.2尿素疗法的主要特点
尿素疗法属硬化剂疗法的一种,与其他治疗血管瘤的硬化剂不同,尿素是人体的一种正常代谢产物,为人体的相容性物质,对人体无明显的毒、副作用且在体内无蓄积,其安全性是该疗法最突出的优点之一。
因血液在血管瘤的血管内流速较正常组织的血管内明显减慢,故当注入尿素后,在病变内作用时间较长,对组织的影响亦大。而当尿素随血液流入正常组织内后,随血流速度的明显加快而迅速流逝,并很快被稀释,因此对正常组织影响甚微。
3.3尿素治疗血管瘤与脉管畸形的方法
将精制尿素配制成适当的溶液,通过三种具体方法应用。
3.3.1单纯局部尿素注射
用于体表婴幼儿血管瘤。操作方法:将40%尿素溶液直接一点或多点注射于瘤体中,注射剂量根据病变的面积大小、部位深浅、生长速度等情况酌情考虑,一般每次1~4 mL,每日1次,连续注射5~8 d为1个疗程。若瘤体仍有生长,间隔1~3个月可再注射1个疗程。
3.3.2选择性颈外动脉结扎置管、尿素介入治疗
适应证:适用于颌面部巨大重症血管瘤(包括并发KMP的重症病变)及静脉畸形。操作方法:①置管方法平卧头侧位(病变侧在上),于颈动脉三角区,下颌角下2 cm作横切口,长约2 cm,沿胸锁乳突肌前沿解剖颈动脉三角,显露颈总动脉及颈内、外动脉,确认颈外动脉后近心端结扎,远心端置入硅胶管,引出体外,肝素帽密封。②药物灌注术后每日通过置管注入40%尿素溶液3~8 mL,连续注射2~4周后拔除硅胶管。疗程主要根据病变的严重程度来决定,较轻者2周,重者可达4周。合并KMP的患儿同时通过置管每日注入甲基强的松龙3~5 mg/Kg,待血小板计数恢复正常后减半量继续注射1周,后改为口服强的松片5~10 mg/d,逐渐减量至停用。
该治疗方法对颌面部重症血管瘤效果好,不但能够达到治愈的目的,而且能够达到较为理想的美容效果,是一种独特的治疗选择。
3.3.3局部尿素注射+手术切除
适应证:适用于脉管畸形及并发KMP的重症血管性肿瘤。操作方法:通过局部尿素注射使病变组织硬化,再行手术切除,术前先行40%尿素溶液瘤体内多点分层注射治疗,每日1次,注射量为2~15 mL,连续注射治疗3~14 d,分一期或二期手术切除治疗。
血管瘤和脉管畸形诊断和治疗指南(2016版)编写说明
本版指南由中华医学会整形外科分会血管瘤和脉管畸形学组发起和组织撰写,包括学组委员(以下按姓氏笔画排名)马琳、王根会、王彪、付时章、江成鸿、苏振民、李龙、李伟、李克雷、李京宏、李锁兰、余文林、沈为民、张莉、陆信武、陈石海、陈达、陈敏亮、范先群、罗春芬、周启星、郑胜武、郑家伟、侯团结、夏有辰、顾瑛、晏丹、徐剑炜、郭亮、崔杰、逯岩、董长宪、雷少榕、霍然;学组组长林晓曦,副组长欧阳天祥、李勤、杨力,学组秘书袁斯明、胡晓洁还负责指南的发起、组织;此外,国内血管瘤和脉管畸形领域多学科学者,及其所带领的团队,对指南撰写的专业化和先进性做出了贡献。
第一部分血管瘤和脉管畸形的分类(陈辉、林晓曦);第二部分血管瘤和脉管畸形的发病机制(郑家伟、应涵汝、吕东泽、胡丽);第三部分血管源性肿瘤的诊断和治疗:1.婴幼儿血管瘤(马琳、霍然、常雷、仇雅璟、金云波);2.血管内皮瘤(杨希、林晓曦);3. Kasabach-Merritt现象(欧阳天祥);第四部分脉管畸形的诊断和治疗:1.葡萄酒色斑(李勤,苑凯华、顾瑛、马刚、于文心、林晓曦);2.静脉畸形(欧阳天祥、陈
辉、胡丽);3.动静脉畸形(金云波、华晨、邹运、林晓曦);4.淋巴管畸形(欧阳天祥、杨希);第五部分血管瘤与脉管畸形相关综合征(马琳、仇雅璟);第六部分眶内血管瘤和脉管畸形的诊断和治疗(范先群、贾仁兵、胡晓洁);附录一国际通用血管瘤和脉管畸形治疗技术:1.血管瘤和脉管畸形相关的激光治疗技术(李勤、苑凯华、马刚、于文心);2.脉管畸形的介入栓塞治疗(范新东、金云波、华晨);3.无水乙醇在血管畸形治疗中的应用(金云波、林晓曦);4.泡沫硬化治疗(周德凯、陈辉、胡丽);5.抗肿瘤药物治疗(李克雷、秦中平、金云波、邹运);附录二国内少数单位开展的其他特殊治疗技术:1.电化学治疗(李京宏);2.高频电凝治疗(李锁兰);3.尿素治疗(董长宪)。
本指南编撰的发起人为林晓曦,袁斯明、金云波负责了本指南稿件的汇编和校订,杨希、邹运亦对指南的编撰工作做出了积极贡献。
本指南通讯作者:林晓曦(上海交通大学医学院附属第九人民医院整复外科,E-mail:linxiaoxi@126.com)。
·论著·
·论著·
【中图分类号】R732.2
【文献标识码】A
【文章编号】1673-0364(2016)02-0063-32
doi:10.3969/j.issn.1673-0364.2016.02.001
收稿日期:(2016年3月10日;修回日期:2016年4月20日)

