高谷物日粮对山羊小肠发酵、肠道结构和微生物菌群数量的影响研究
薛春旭,叶慧敏,冯泮飞,刘军花,毛胜勇(南京农业大学动物科技学院,江苏 南京 210095)
高谷物日粮对山羊小肠发酵、肠道结构和微生物菌群数量的影响研究
薛春旭,叶慧敏,冯泮飞,刘军花,毛胜勇*
(南京农业大学动物科技学院,江苏 南京 210095)
本试验旨在研究高谷物日粮对山羊小肠微生物发酵、上皮组织形态及微生物菌群数量的影响。采用随机区组实验设计,将12头山羊随机分为两组,即全干草组(只饲喂粗饲料)和高谷物组(75%精料和25%粗饲料混合饲喂),每组6头,试验期为6周,试验结束后屠宰取小肠内容物及组织样品用于相关分析。结果表明,1)与干草组相比,饲喂高谷物日粮显著提高了空肠内容物中总挥发性脂肪酸(P=0.015)、丙酸(P=0.008)、丁酸(P=0.004)、异丁酸浓度(P=0.035),降低了乳酸浓度(P=0.008),但对p H值、乙酸、戊酸、异戊酸浓度及L PS含量无显著性影响(P>0.05)。与干草组相比,饲喂高谷物日粮显著提高了回肠内容物的总挥发性脂肪酸(P=0.007)、丙酸(P=0.013)、丁酸(P=0.008)、戊酸(P<0.001)、乳酸浓度(P=0.008)以及脂多糖含量(P<0.001),降低了p H值(P=0.005),但对乙酸、异丁酸和异戊酸浓度无显著影响(P>0.05);2)与干草组相比,高谷物日粮组山羊的十二指肠、空肠和回肠的绒毛高度和隐窝深度均显著升高(P<0.001);空肠绒毛高度与隐窝深度的比值显著降低(P=0.024);电镜结果表明,高谷物组空肠和回肠紧密连接受到破坏;3)与干草组相比,高谷物日粮组山羊回肠黏膜中碱性磷酸酶活性显著提高(P<0.05),但对空肠黏膜中碱性磷酸酶活性无显著影响(P>0.05);4)Real-tim e PC R定量分析表明,与干草对照组相比,高谷物日粮山羊回肠拟杆菌门16S rR N A基因拷贝数显著降低(P=0.037),厚壁菌门与拟杆菌门细菌数量比值显著升高(P<0.001),但对厚壁菌门细菌基因拷贝数无显著影响(P>0.05);空肠中拟杆菌门基因拷贝数、厚壁菌门基因拷贝数以及厚壁菌门与拟杆菌门细菌数量比值无显著变化(P>0.05)。结果说明,饲喂高谷物日粮对回肠上皮组织形态及回肠微生物发酵具有显著影响,对其健康可能有不利影响。
高谷物日粮;小肠;紧密连接;碱性磷酸酶;微生物
http://cyxb.lzu.edu.cn
薛春旭,叶慧敏,冯泮飞,刘军花,毛胜勇.高谷物日粮对山羊小肠发酵、肠道结构和微生物菌群数量的影响研究.草业学报,2016,25(5):175-183.X U E Chun-Xu,Y E H ui-Min,F E N G Pan-Fei,LIU Jun-H ua,M A O Sheng-Yong.T he effect of high-grain diets on sm all intestinal ferm entation,m orphological structure and microbial flora in goats.Acta Prataculturae Sinica,2016,25(5):175-183.
在现代规模化、集约化牛羊养殖过程中,生产者为追求最大程度经济效益,常在动物饲料中使用高比例谷物原料,但大量使用高谷物日粮在提高动物生产性能的同时,也引发了一些营养代谢疾病如瘤胃酸中毒。近年来,研究者已对瘤胃酸中毒的致病机制和潜在危害做了大量研究。相关报道显示,瘤胃酸中毒可改变瘤胃微生物菌群结构与组成[1],致瘤胃p H值下降、挥发性脂肪酸(volatile fatty acid,V F A)累积,瘤胃内脂多糖(lipopolysaccharide,L PS)和生物胺的浓度显著增加[2-3],致瘤胃上皮屏障损伤;同时大量可发酵碳水化合物进入后肠,还可引发后肠酸中毒[4]。因此,这些结果暗示,长期饲喂高谷物日粮可使反刍动物瘤胃与后肠健康受损。
小肠是动物消化道重要的生理器官,其功能包括两方面:一是接收来自胃初步消化的营养物质,起到容器作用;二是将初步消化的营养物质进一步消化分解成小分子物质,通过肠黏膜上皮细胞吸收进入血液和淋巴。因此,维持小肠的正常结构与功能对于动物健康至关重要。我们前期研究发现,饲喂高谷物日粮除影响山羊瘤胃功能外,瘤胃中未经消化的过量精料进入小肠后,也可能对小肠的生理结构与小肠微生物发酵造成不利影响。然而,当前该领域的研究工作主要集中于饲喂高谷物日粮对山羊前胃与后肠发酵及其上皮健康的影响,有关高谷物日粮对山羊小肠消化生理的影响尚不清楚。因此,本研究以山羊为研究对象,探究了高谷物日粮对山羊小肠上皮形态学变化、碱性磷酸酶活性及微生物菌群的影响,拟进一步丰富人们对高谷物日粮影响动物健康的理论认识。
1 材料与方法
实验于2014年12月到2015年3月在南京农业大学动物实验基地进行。
1.1 试验设计
试验选用12头体重相近、安装有永久性瘤胃瘘管的健康南京本地山羊[(28.4±3.0)kg],单栏饲养,自由饮水。采用随机区组试验设计,将12只山羊分为两组,即饲喂全干草组(100%粗饲料)以及高谷物组(75%高精料+ 25%的粗饲料),每组6头,试验期为6周。饲粮供给量按体重的3.5%计算,预设为1.05 kg,精料和粗饲料分开饲喂,每天饲喂两次(分别为8:00和17:00),每次等量饲喂。干草与高谷物组的饲料原料组成以及营养水平见表1。
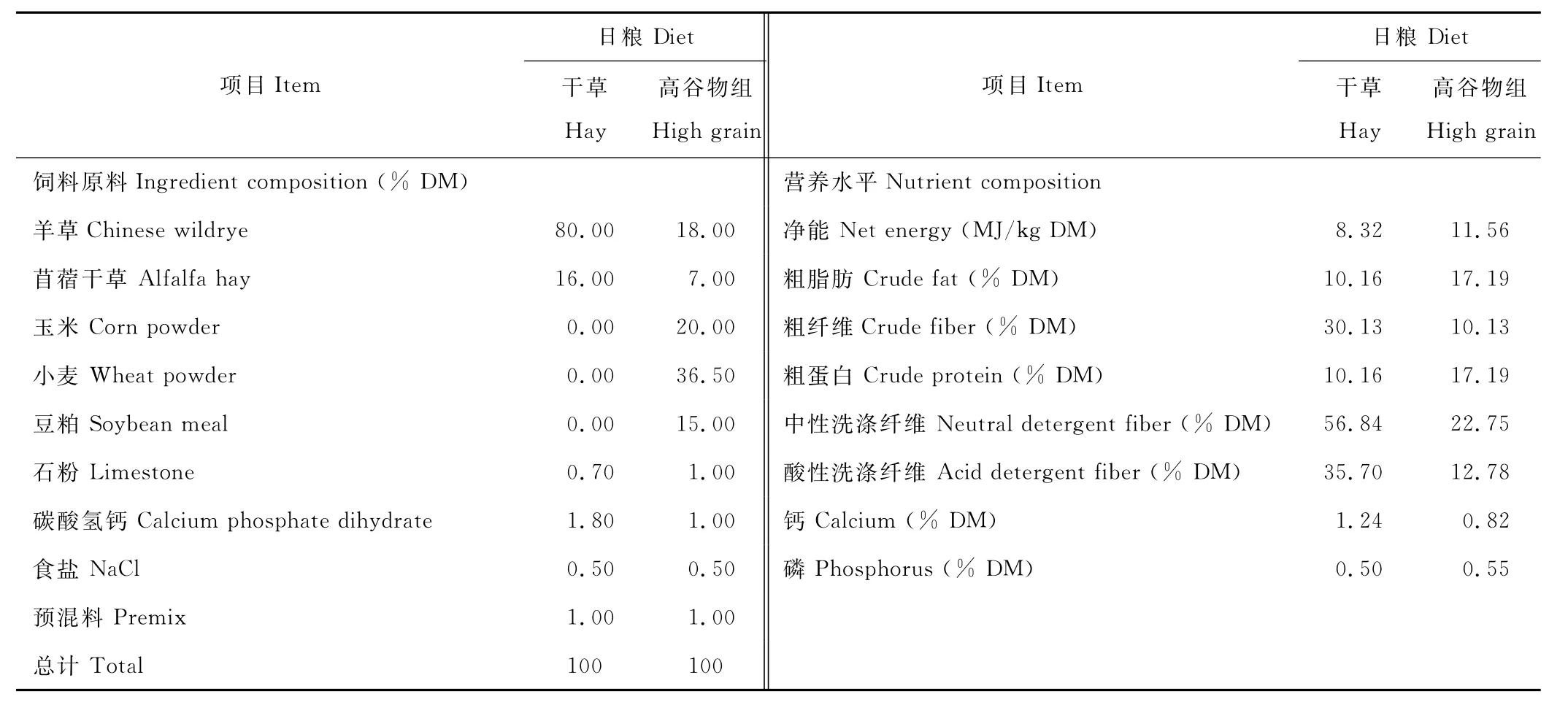
表1 日粮组成与营养水平(D M基础)Table 1 Ingredients and nutrient composition of the experimental diets(D M basis)
1.2 样品采集
在实验期第42天,晨饲前屠宰取十二指肠、空肠和回肠黏膜样,用冰磷酸缓冲液清洗干净后,分成3部分,其中一部分立即冻存于液氮中,用于碱性磷酸酶活性测定;另一部分用2.5%戊二醛固定,用于扫描和透射电镜观察;其他部分用4%多聚甲醛固定,用于石蜡切片。屠宰后立即取空肠和回肠内容物,各部分分别混合均匀后,分别测定内容物p H值,另取部分按1∶1的重量比与去离子水混合,5000 r/min下离心15 min后,取上清液冻存于-20℃冰箱中用于挥发性脂肪酸、乳酸和L PS浓度的测定,L PS在分析之前使用Li等[5]的方法处理,取10 g样品转移到无热源的管中,其中包含10 m L的生理盐水,并且混合均匀,4℃、13000 r/min下离心40 min后,收集大约2 m L样品,过滤到无热源的玻璃管中,然后100℃加热30 min。室温冷却10 min,存放在-20℃下待测;同时取部分内容物冻存于-20℃冰箱中用于细菌D N A提取。
1.3 指标测定及方法
1.3.1 空肠、回肠发酵参数的测定 采用比色法测定空肠、回肠内容物中乳酸浓度[6],采用气相色谱法(日本,G C-14B气相色谱仪,色谱柱型号为A gilent J & W G C Colu m ns:30 m×0.32 m m×0.25μm,柱温110℃,气化室温度180℃,检测室温度180℃)测定挥发性脂肪酸浓度[7]。p H值用p H计(HI 9024 C,H A N N A)测定。采用显色基质特异性鲎试剂盒测定游离L PS浓度(厦门鲎试剂厂有限公司),基本原理是内毒素可激活鲎试剂中的C因子,进而激活凝固酶原,凝固酶可水解人工合成显色基质鲎三肽释放出呈黄色的对硝基苯胺(para nitro aniline,P N A),再将P N A重氮化形成偶氮兰复合物(呈玫瑰红),该复合物可于545 n m波长处测定吸光度。试剂盒包括:鲎试剂(1.7 m L/支)、显色基质(1.7 m L/支)、细菌内毒素工作品(9 E U/支)、偶氮化试剂1(10 m L/支)、偶氮化试剂2(10 m L/支)、偶氮化试剂3(10 m L/支)、细菌内毒素检查用水(50 m L/瓶)、反应终止液(盐酸H Cl,50 m L/瓶)。
1.3.2 空肠和回肠黏膜碱性磷酸酶活性的测定
山羊空肠和回肠黏膜的碱性磷酸酶活性的测定采用试剂盒。试剂盒购于南京建成生物工程研究所。
1.3.3 组织切片的处理 用4%多聚甲醛固定,洗涤、酒精梯度脱水、浸蜡、包埋、切片、帖片、脱蜡复水、苏木精-伊红染色、封固,在光学显微镜下观察十二指肠、空肠和回肠上皮组织形态的变化。
1.3.4 电镜样品的处理 用冰磷酸缓冲液反复清洗各肠组织样品,2.5%的戊二醛固定后,磷酸缓冲液清洗;采用乙醇脱水后,冷冻干燥仪干燥样品,用离子溅射仪镀膜,扫描电子显微镜进行观察(S-3000 N,日本,HIT AC HI)。透射电镜实验中的样品前处理与扫描电镜预处理一致,缀以1%的锇酸固定,乙醇梯度脱水,用丙酮置换后,浸渍、包埋、聚合,修块使样品表面积小于0.2 m m×0.2 m m,超薄切片,经铀染色与铅染色清洗后,透射电子显微镜(H-7650,日本,HIT A C HI)进行观察。
1.3.5 总细菌D N A提取和16S rR N A基因片段扩增 称取约0.1 g解冻后的肠道内容物样至灭菌后的Eppendorf管中,加入1.5 m L的磷酸缓冲液(phosphate buffer solution,PBS)(p H=7.0),涡旋混合,13000 r/min离心5 min,弃上清,参照K hafipour等[1]的方法,用珠磨法机械破碎样品,后用酚和氯仿/异戊醇提取其总D N A。提取D N A于-20℃保存备用。
1.3.6 Real-tim e P C R定量分析 使用A BI 7500 Real-tim e P C R仪(A pplied Biosysterm)对肠道内容物样中拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)进行定量。分别以化脓拟杆菌(Bacteroides pyogenus)和厚壁菌的16S rR N A基因作为模板,模板拷贝数分别为3.29×109和7.48×109copies/μL。模板按照10倍梯度向下稀释,在标准曲线上使用5个点,每个点3次重复检测,制作相应细菌定量的标准曲线。Real-tim e P C R反应体系为20μL:10.4μL S Y B R Green Supermix(T O Y O B O),10μm ol/L的上下游引物各0.4μL,2μL样品D N A以及6.8μL无菌水。实验定量P C R分析所用引物见表2,引物Bact934F/Bact1060 R和Firm 934F/Firm 1060 R[8]分别用于定量山羊肠道内容物样中拟杆菌门和厚壁菌门的16S rR N A基因拷贝数,P C R反应程序为:95℃10 min,而后95℃30 s,60℃下退火及延伸1 min,40个循环。
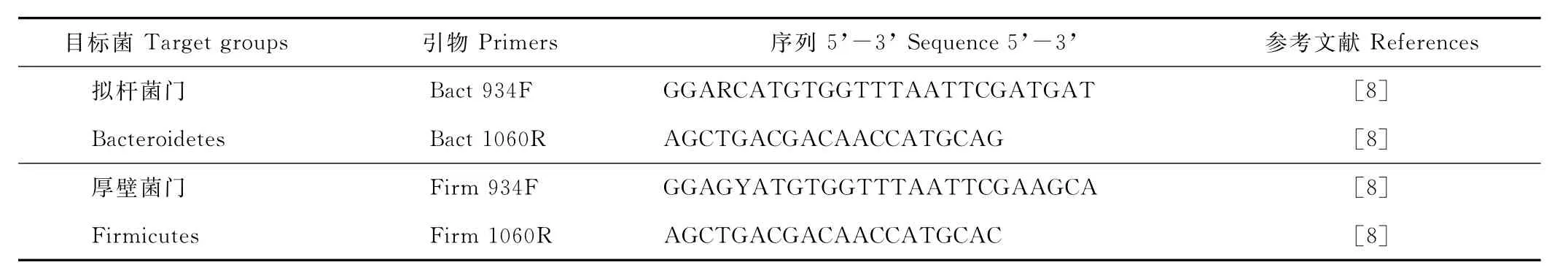
表2 本研究中所用引物序列Table 2 List of primers used in this study
1.4 数据处理
试验数据采用SPPS(SPSS version 18.0,Chicago,IL)统计软件中Independent T-test程序进行统计分析。试验结果均以平均值±标准误表示。显著性置于0.05水平。
2 结果与分析
2.1 山羊空肠和回肠发酵参数
由表3可见,与干草组相比,饲喂高谷物日粮显著提高了空肠总挥发性脂肪酸(P=0.015)、丙酸(P=0.008)、丁酸(P=0.004)、异丁酸浓度(P=0.035),降低了乳酸浓度(P=0.008),但对空肠内容物中p H、乙酸、戊酸、异戊酸浓度及L PS含量无显著性影响(P>0.05)。与干草组相比,饲喂高谷物日粮显著提高了回肠总挥发性脂肪酸(P=0.007)、丙酸(P=0.013)、丁酸(P=0.008)、戊酸(P<0.001)、乳酸浓度(P=0.008)以及L PS含量(P<0.001),降低了回肠内容物的p H值(P=0.005),但对乙酸、异丁酸和异戊酸浓度无显著影响(P>0.05)。
2.2 山羊小肠上皮形态结构
由图1可见,光学显微镜下观测结果表明,与干草组相比(十二指肠:图1 A;空肠:图1 C),高谷物日粮组十二指肠(图1B)和空肠(图1 D)的细胞间空隙明显增大。与干草组(图1 E和图1 G)相比,高谷物日粮组的回肠(图1F和图1 H)绒毛松散,出现脱落现象,排列不齐。透射电镜结果表明,与干草组(空肠:图1I;回肠:图1 K)相比,高谷物日粮组的空肠(图1J)紧密连接缝隙变大、回肠(图1 L)紧密连接结构模糊不清。
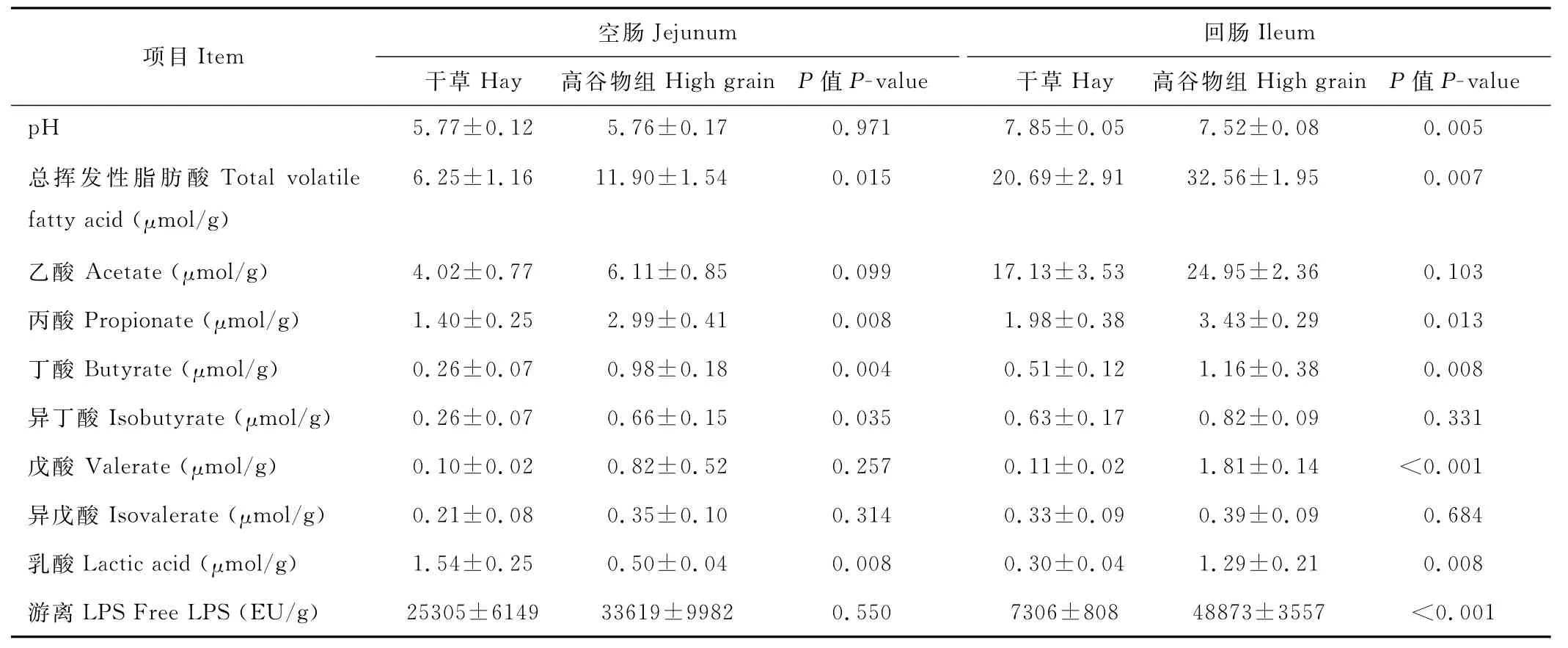
表3 高谷物日粮对山羊空肠和回肠发酵参数的影响Table 3 Effects of a high grain diet feeding on the jejunal and ileal fermentation parameters in goats
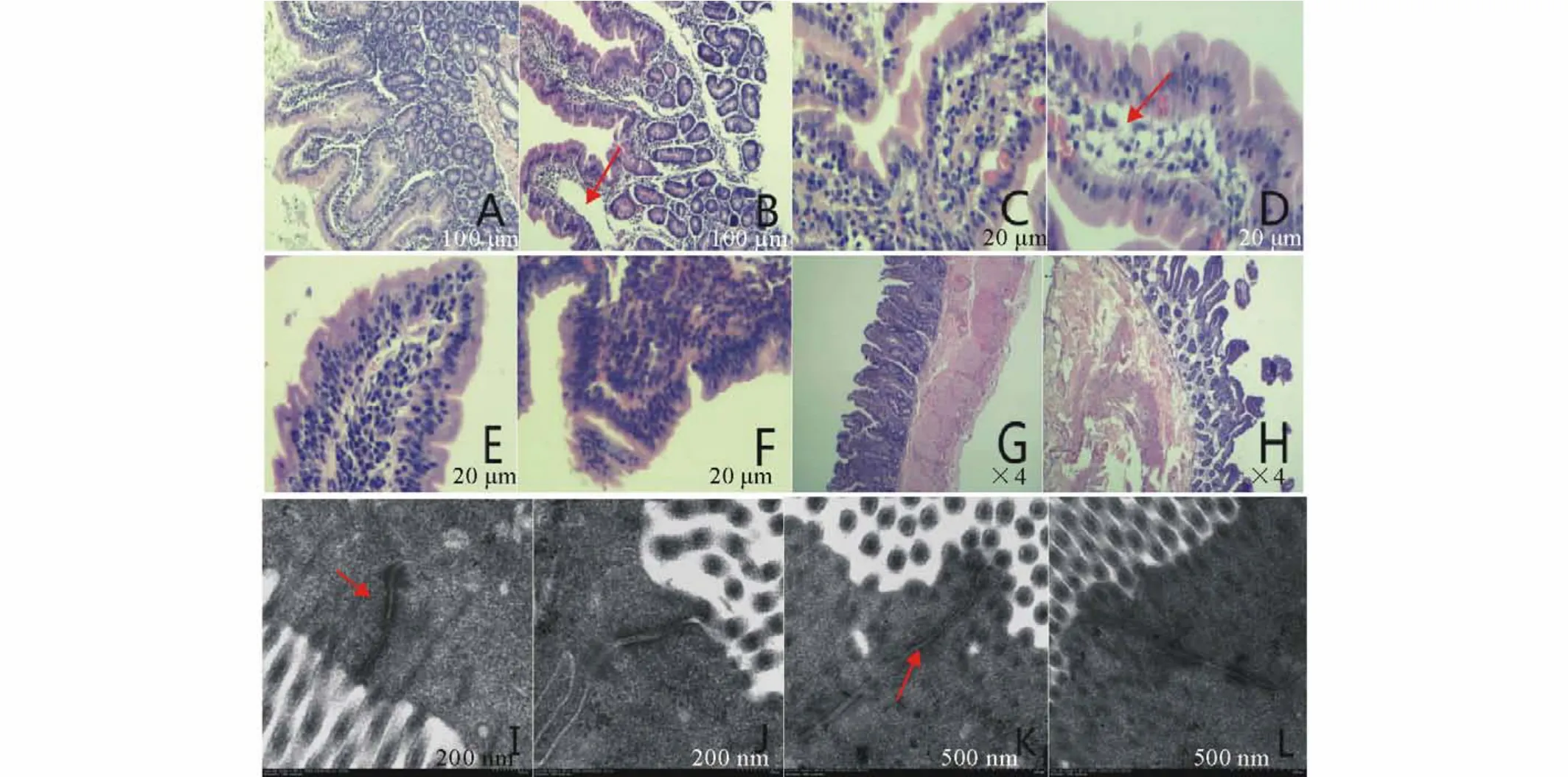
图1 饲喂高谷物日粮对山羊十二指肠、空肠与回肠上皮形态的影响Fig.1 The effect of a high grain diet feeding on changes in histomorphology of duodenu m,jejunu m and ileu m epitheliu m
2.3 山羊小肠绒毛高度和隐窝深度
从表4可知,高谷物组山羊十二指肠、空肠和回肠绒毛高度和隐窝深度极显著高于干草对照组(P<0.001)。与干草对照组相比,高谷物组山羊空肠绒毛高度与隐窝深度的比值显著下降(P=0.024)。而十二指肠、回肠的绒毛高度与隐窝深度的比值差异不显著(P>0.05)。
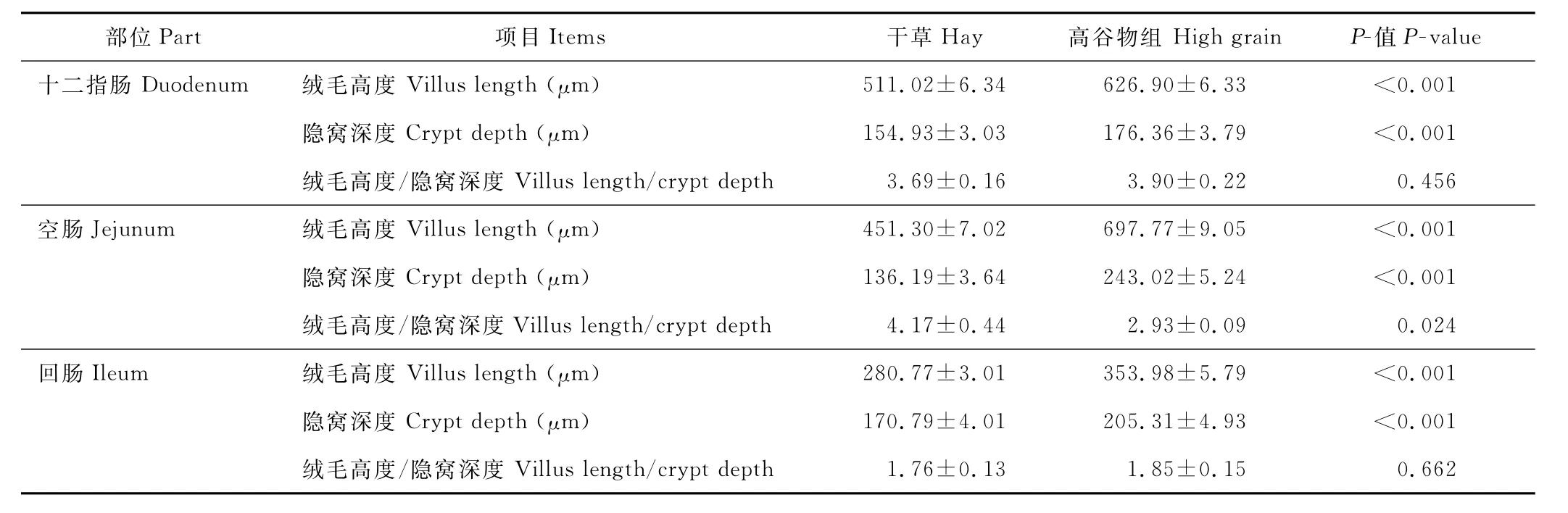
表4 高谷物日粮对山羊小肠绒毛高度和隐窝深度的影响Table 4 Effect of a high grain diet on the smallintestinal villi height and crypt depth in goats
2.4 空肠和回肠内容物中厚壁菌门与拟杆菌门数量
由表5可见,与干草组相比,高谷物日粮组山羊回肠拟杆菌门16S rR N A基因的拷贝数显著降低(P=0.037),同时厚壁菌门与拟杆菌门细菌数量比值显著升高(P<0.001),但两组间厚壁菌门细菌数量无显著差异(P>0.05);与对照组相比,饲喂高谷物日粮对空肠中拟杆菌门、厚壁菌门16S rR N A基因的拷贝数及二者间的比例无显著影响(P>0.05)。
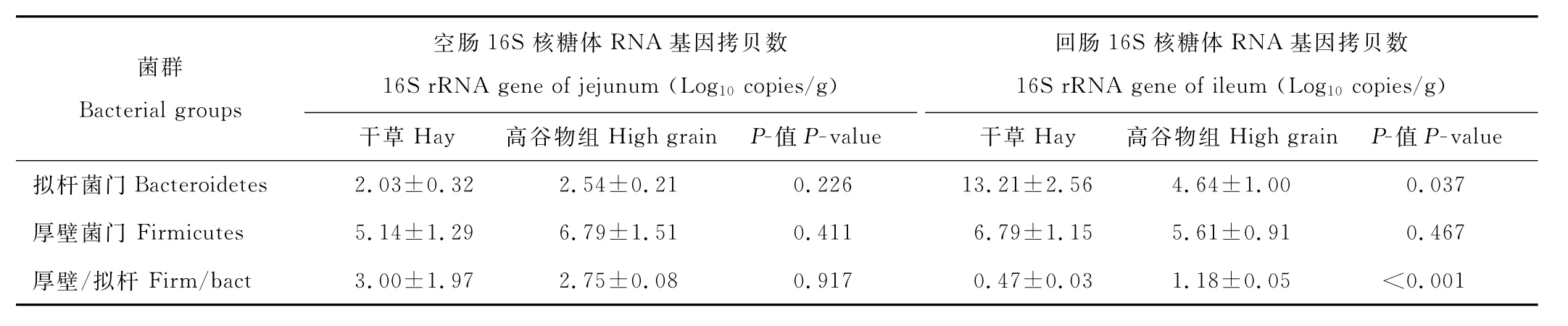
表5 高谷物日粮对空肠、回肠内容物中拟杆菌门和厚壁菌门16S rR N A基因拷贝数的影响Table 5 Effect of a high grain diet on the 16S rR N A gene copy nu m ber of Firmicutes and Bacteroidetes in jejunu m and ileu m digesta
2.5 山羊空肠和回肠碱性磷酸酶活性
由表6可见,与干草对照组相比,饲喂高谷物日粮可以提高回肠黏膜中碱性磷酸酶活性(P=0.046),但对山羊空肠中碱性磷酸酶活性无显著差异(P>0.05)。
3 讨论与结论

表6 高谷物日粮对山羊空肠和回肠中碱性磷酸酶的影响Table 6 Effect of a high grain diet on the activity of alkaline phosphatase in jejunu m and ileu m m ucosa
小肠作为消化道内营养物质吸收和转运的主要部位,其绒毛高度及隐窝深度是衡量肠道消化吸收功能的重要指标[9-10]。研究显示,小肠绒毛高度下降说明其吸收功能可能下降;而隐窝深度变浅则显示细胞成熟率上升,分泌功能增强[11]。本试验结果显示,饲喂高谷物日粮的山羊十二指肠、空肠和回肠绒毛高度和隐窝深度极显著高于对照组(P<0.001),结果说明饲喂高谷物日粮可促进小肠黏膜生长,增强消化吸收功能,其原因可能与空肠(P=0.004)和回肠(P=0.008)中丁酸含量显著升高有关。相关研究表明,肠道丁酸浓度升高可下调消化道上皮中胰岛素结合蛋白3(IG FBP-3)基因表达,由于IG FBP-3是胰岛素样生长因子1(IG F-1)的重要结合蛋白,其表达水平下降可导致IG F-1的释放量增加,而IG F-1增加可促进肠上皮细胞的生长[12]。此外,也有研究表明,丁酸可通过减少消化道上皮细胞的凋亡来诱导上皮乳头状突起的生长[13]。因此,丁酸可能通过多条途径影响肠上皮生长。
研究显示,饲喂高谷物日粮可提高奶牛与山羊后肠中总挥发性脂肪酸浓度[5],致p H值下降。本实验发现,饲喂高谷物日粮的山羊空肠和回肠内容物中总挥发性脂肪酸浓度升高,结果与上述报道相似,说明饲喂高谷物日粮同时也影响了山羊小肠微生物发酵。本实验同时发现,高谷物组山羊的回肠乳酸浓度显著升高,说明高谷物日粮可能有利于回肠中乳酸菌生长。研究表明,饲喂大量谷物可提高奶牛瘤胃液中游离脂多糖的浓度,而低p H与高浓度L PS可能损伤瘤胃上皮结构[14]。本实验中饲喂高谷物日粮山羊的回肠内容中L PS浓度显著升高,结果与上述报道相似。说明饲喂高谷物日粮不仅可影响瘤胃与后肠发酵,同时影响小肠尤其是回肠微生物发酵。
对反刍动物而言,较瘤胃复层上皮相比,由单层上皮细胞组成的小肠上皮屏障完整性更易被破坏[15]。在肠上皮屏障中,细胞间紧密连接在维护上皮屏障功能、上皮细胞极性及上皮屏障通透性中起到重要作用[16-17]。研究显示,饲喂高谷物日粮可破坏奶牛结肠黏膜屏障的完整性和通透性,导致肠上皮屏障损伤,在形态学上表现为肠上皮紧密连接间隙变宽,上皮细胞核破裂和线粒体结构性损伤[18],线粒体结构性损伤可进一步抑制A T P的生成[19-20],进而影响与上皮通透性相关的紧密连接蛋白Claudin-4和Occludin的基因转录与翻译,最终导致这些蛋白的表达下降,上皮通透性发生改变,引发细胞肿胀坏死和大分子物质(微生物和微生物产物,如L PS)易位,造成肠道损伤[14]。本实验中,光学显微镜观测结果表明,与对照组相比,饲喂高谷物日粮的山羊回肠绒毛松散,出现脱落现象,排列不齐。透射电镜结果表明,回肠紧密连接结构模糊不清。我们推测,出现上述结果的原因可能与高谷物日粮下山羊回肠中p H值显著降低所引发的系列生理效应有关。此外,本试验结果发现,饲喂高谷物日粮组的山羊的空肠空隙明显增大,紧密连接出现开口,空肠绒毛高度与隐窝深度的比值显著下降。前人研究表明,肠绒毛高度与隐窝深度的比值可反应小肠黏膜的受损程度,比值下降暗示小肠黏膜受损[21]。因此,上述结果说明,饲喂高谷物组山羊的空肠黏膜也受到损伤,但本实验结果未发现高谷物组与干草组山羊的空肠p H值及L PS浓度有显著差异,因此,空肠上皮出现明显损伤的原因尚不清楚,需进一步研究。
日粮是影响肠道微生物区系结构和功能的主要因素之一[22-24]。研究表明,日粮原料特性及其物理性质改变可导致奶牛瘤胃与后肠发酵模式变化,进而引发瘤胃与后肠微生物菌群结构发生改变。相关研究显示,当奶牛日粮从以粗饲料为主的日粮转变为高谷物日粮为主时,瘤胃中总挥发性脂肪酸浓度显著升高,同时瘤胃菌群中拟杆菌门比例会显著下降,而厚壁菌门比例显著升高[25]。本研究发现,饲喂高谷物日粮显著提高了空肠与回肠内容物中总挥发性脂肪酸含量,显著影响了回肠中拟杆菌门数量,但对山羊空肠中厚壁菌门与拟杆菌门细菌的数量无显著影响;我们推测,高谷物日粮对两段肠道内容物中微生物菌群数量影响不一致的原因可能与食糜流通速度不同有关。较空肠相比,回肠中食糜的流通速度较低;因此,回肠内容物中微生物可充分利用底物生长,因而数量较高;这也说明日粮可能更易影响微生物菌群结构与组成。本试验同时发现,饲喂高谷物日粮显著降低了拟杆菌门细菌数量,由于拟杆菌门细菌主要为革兰氏阴性菌,而革兰氏阴性菌对环境p H值尤其敏感,因此,其数量下降可能与回肠内容物p H值下降有关;同时,革兰氏阴性菌细胞壁中含有大量的脂多糖,因此,该类微生物可能因不适应低p H而导致细菌大量死亡、裂解,最终导致内容物中L PS浓度显著升高[26]。
碱性磷酸酶(alkaline phosphatase)是一种非特异性磷酸单脂酶,广泛存在于动物界和微生物界,可催化磷酸单脂水解反应和转磷酸作用。研究表明,碱性磷酸酶在肠道免疫中发挥作用,其主要存在于肠上皮表面,可作为肠道黏膜防护因子[27],是防止脂多糖进入机体的第一道防线。近年来研究发现,小牛肠碱性磷酸酶可作为一种新型药物制剂,治疗小鼠和仔猪因L PS诱发的肠源性疾病[28],其原理与碱性磷酸酶可通过对L PS的脱磷酸反应,进而减弱革兰阴性菌毒性有关[29-31]。本研究中,高谷物日粮显著提高了回肠黏膜中碱性磷酸酶活性(P<0.05),但对山羊空肠黏膜的碱性磷酸酶活性无显著影响。其原因可能与饲喂高谷物日粮组山羊空肠内容物中L PS浓度显著升高有关。实际上,在L PS浓度升高情况下,动物机体可能会对L PS产生一种生理性应答,以阻止L PS对上皮组织的损伤。该结果同时表明,碱性磷酸酶可能在调控L PS的生理毒性和维护动物肠上皮屏障功能中起着重要作用。
综上所述,饲喂高谷物日粮可提高山羊空肠与回肠中总挥发性脂肪酸浓度,致回肠内容物p H下降、乳酸及L PS浓度升高;同时回肠上皮紧密连接受损,回肠拟杆菌门数量与碱性磷酸酶活性受到影响。结果暗示,饲喂高谷物日粮改变了小肠微生物发酵,导致小肠上皮健康受损。
References:
[1]K hafipour E,Li S,Plaizier J C,etal.Ru m en microbio m e co m position determined using two nutritional m odels of subacute ru minal acidosis.A pplied and Environ m ental Microbiology,2009,22:7115-7124.
[2]K hafipour E,Krause D O,Plaizier J C.A grain-based subacute ru minal acidosis challenge causes translocation of lipopolysaccharide and triggers infla m m ation.Journal of Dairy Science,2009,92:1060-1070.
[3]W ang D S,Zhang R Y,Zhu W Y,etal.Effects of subacute ru minal acidosis challenges on ferm entation and biogenic a mines in the ru m en of dairy cows.Livestock Science,2013,155:262-272.
[4]Gressley T F,H all M B,Arm entano L E.Ru minant nutrition sy m posiu m:productivity,digestion,and health responses to hindgut acidosis in ru minants.Journal of A nim al Science,2011,89(4):1120-1130.
[5]Li S,K hafipour E,Krause D O,etal.Effects of subacute ru minal acidosis challenges on ferm entation and endotoxins in the ru m en and hindgut of dairy cows.Journal of Dairy Science,2012,95(1):294-303.
[6]Zhang L X,Zhang T F,Li L Y.Bioche mical Test M ethod and Technology(second edition)[M].Beijing:Higher Education Press,1997.
[7]Qin W L.Determination of volatile fatty acids by m eans of gas chro m atography.Journal of Nanjing A gricultural U niversity,1982,5:110-116.
[8]Guo X,Xia X,Tang R,etal.Develop m ent of a real-tim e PC R m ethod for Firmicutes and Bacteroidetesin faeces and its application to quantify intestinal population of obese and lean pigs.Letters in A pplied Microbiology,2008,47:367-373.
[9]Li D F.S wine N utrition(second edition)[M].Beijing:China’s A gricultural Science and Technology Press,2003:7-10.
[10]Li K Z,Li N,Li J S,etal.The effect of short-chain fatty acids(SFC A)on intestinal m orphology and kinetic energy after rat s m all bowel transplantation.W orld Chinese Journal of Digestology,2002,10(6):720-722.
[11]Eid Y Z,O htsuka A,H ayashi K.Tea polychenols reduce glucocorticoid-induced growth inhibition and oxidative stress in broiler chickens.British Poultry Science,2003,44:127-132.
[12]Van landeqhe m L,Santoro M A,M ah A T,etal.IG F1 stim ulates crypt expansion via differential activation of 2 intestinal ste m cell populations.The Journal of the Federation of A m erican Societies for Experim ental Biology,2015,29(7):2828-2842.
[13]M entschel J,Leiser R,M ulling C,etal.Butyric acid stim ulates ru m en m ucosa develop m entin the calf m ainly by a reduction of apoptosis.Archives of A nim al N utrition,2001,55:85-102.
[14]Liu J H,Xu T T,Zhu W Y,etal.A high-grain diet alters the o m asal epithelial structure and expression of tight junction proteins in goat m odel.The Veterinary Journal,2014,201(1):95-100.
[15]Oetzel G R.Subacute ru minal acidosis in dairy cattle.A dvances in Dairy Technology,2003,15:307-317.
[16]Graha m C,Sim m ons N L.Functional organization of the bovine ru m en epitheliu m.A m erican Journal of Physiology Regulatory Integrative and Co m parative Physiology,2005,288(1):173-181.
[17]Penner G B,Steele M A,Aschenbach J R,etal.Ru minant nutrition sy m posiu m:m olecular adaptation of ru minal epithelia to highly ferm entable diets.Journal of A nim al Science,2011,89(4):1108-1119.
[18]Tao S Y,Duan m u Y Q,Dong H B,etal.A high-concentrate diet induced colonic epithelial barrier disruption is associated with the activating of cell apoptosis in lactating goats.B M C Veterinary Research,2014,10:235.
[19]Gaebel G,Bell M,M artens H.The effect of low m ucosal p H on sodiu m and chloride m ove m ent across the isolated ru m en m ucosa of sheep.Q uarterly Journal of Experim ental Physiology and Cognate M edical Sciences,1989,74:35-44.
[20]Teixeira B M,Kowaltowski A J,Castilho R F,etal.Inhibition of mitochondrial perm eability transition by low p H is associated with less extensive m e m brane protein thiol oxidation.Bioscience Reports,1999,19:525-533.
[21]Xie D,Chen Y X,W ang Z X,etal.Effects of m onochro m atic light on structure of s m allintestinal m ucosa in broilers.Scien-tia A gricultura Sinica,2009,42(3):1084-1090.
[22]Kocherginskaya S A,A minov R I,W hite B A,etal.A nalysis of the ru m en bacterial diversity under two different diet conditions using denaturing gradient gel electrophoresis,rando m sequencing,and statistical ecology approaches.A naerobe,2001,7:119-134.
[23]Tajim a K,Arai S,O gata K,etal.Ru m en bacterial co m m unity transition during adaptation to high-grain diet.A naerobe,2000,6:273-284.
[24]Zhou M,H ernandez-Sanabria E,Guan L L.Characterization of variation in ru m en m ethanogenic co m m unities under different dietary and host feed efficiency conditions,as determined by PC R-denaturing gradient gel electrophoresis analysis.A pplied and Environ m ental Microbiology,2010,76:3776-3786.
[25]Fernando S C,Purvis H T,Najar F Z,etal.Ru m en microbial population dyna mics during adaptation to a high-grain diet.A pplied and Environ m ental Microbiology,2010,76(22):7482-8490.
[26]H uo W J,Zhu W Y,M ao S Y.Effects of feeding increasing proportions of corn grain on concentration of lipopolysaccharide in the ru m en fluid and the subsequent alterations in im m une responses in goats.Asian-A ustralasian Journal of A nim al Science,2013,26(10):1437-1445.
[27]Chen K T,M alo M S,Beasley-Topliffe L K,etal.A role for intestinal alkaline phosphatase in the m aintenance of local gut im m unity.Digestive Diseases and Sciences,2011,56(4):1020-1027.
[28]Tian X J,Song X H,Yan S J,etal.Study of refolding of calf intestinal alkaline phosphatase.Protein Che mistry,2003,22(5):417-422.
[29]Goldberg R F,A usten W G Jr,Zhang X,etal.Intestinal alkaline phosphatase is a gut m ucosal defense factor m aintained by enteral nutrition.Proceedings of the National Acade m y of Sciences of the U nited States of A m erica,2008,105(9):3551-3556.
[30]Bates J M,A kerlund J,Mittge E,etal.Intestinal alkaline phosphatase detoxifies lipopolysaccharide and prevents infla m m ation in zebrafish in response to the gut microbiota.Cell H ost Microbe,2007,2(6):371-382.
[31]Poelstra K,Bakker W W,Klok P A,etal.Dephosphorylation of endotoxin by alkaline phosphataseinvivo.A m erican Journal of Pathology,1997,151(4):1163-1169.
[6]张龙翔,张庭芳,李玲媛.生化试验方法和技术第二版[M].北京:高等教育出版社,1997.
[7]秦为琳.应用气相色谱测定挥发性脂肪酸方法的研究改进.南京农业大学学报,1982,5:110-116.
[9]李德发.猪的营养(第二版)[M].北京:中国农业科学技术出版社,2003:7-10.
[10]李可洲,李宁,黎介寿,等.短链脂肪酸对大鼠移植小肠形态及动能的作用研究.世界华人消化杂志,2002,10(6):720-722.
[21]谢电,陈耀星,王子旭,等.单色光对肉雏鸡小肠黏膜形态结构的影响.中国农业科学,2009,42(3):1084-1090.
The effect of high-grain diets on small intestinal fermentation,morphological structure and microbial flora in goats
X U E Chun-Xu,Y E H ui-Min,F E N G Pan-Fei,LIU Jun-H ua,M A O Sheng-Y ong*
Collegeof Animal Science and Technology,Nanjing Agricultural University,Nanjing 210095,China
T his study investigated the effect of high-grain(H G)diets on microbial ferm entation,epithelial tissue m orphology,alkaline phosphatase activity and the quantity of microbial flora in the s m all intestine of goats.T welve goats were rando mly allocated to tw o groups(6 in each group)and were fed a hay(0%grain)or H G diet(75%grain)for 6 weeks.After 6 weeks offeeding,the goats were slaughtered to collect s m allintestinal digesta and tissue for analysis.T he results showed that:1)Co m pared with the hay group,H G feeding sig-nificantly increased the concentrations of total volatile fatty acid(P=0.015),propionate(P=0.008),butyrate (P=0.004)and isobutyrate(P=0.035),w hile it significantly decreased the concentration of lactic acid(P=0.008).H owever,H G diet feeding did not influence p H or the concentrations of acetate,valerate,isovalerate and L PS in jejuna digesta(P>0.05);Co m pared with the hay group,H G diet increased the concentrations of total volatile fatty acid(P=0.007),propionate(P=0.013),butyrate(P=0.008),valerate(P<0.001),lactic acid(P=0.008)and lipopolysaccharide levels(P<0.001),w hile it decreased the p H value(P=0.005)in ileal digesta.T here were no significant differences in the concentrations of acetate,isobutyrate,isovalerate between the hay and H G groups(P>0.05).2)Co m pared with the control,H G feeding significantly increased villi height and crypt depth in the duodenu m,jejunu m and ileu m tissue(P<0.001).T he ratio of villus height to crypt depth(V/C)increased in the jejunu m(P=0.024).Trans mission electron micrographs ofjejunu m and ileu m tissue during the H G diet displayed a deterioration of the tight junction.3)Co m pared with the control,H G diets significantly increased the alkaline phosphatase activity of ileal m ucosa(P<0.05),but had no influence on the alkaline phosphatase activity of jejunu m m ucosa(P>0.05).4)Real-tim e P C R analysis showed that in ileu m digesta the 16S rR N A gene copies of Bacteroidetes fro m the H G group were significantly lower than for the hay group(P=0.037).T he H G group showed an increase in the ratio of Firmicutesto Bacteroidetes(P<0.001),w hile there was no significant difference in the 16S rR N A gene copies of Firmicutes(P>0.05).N o significant differences(P>0.05)between the hay and H G groups’jejunu m digesta were observed in the 16S rR N A gene copies of Bacteroidetes and Firmicutes,or in the ratio of Firmicutes to Bacteroidetes.In su m m ary,these resultsindicate that feeding goats high proportions of grain can significantly influence the m orphological characteristics ofileal epitheliu m and microbialferm entation in ileal digesta,and m ay have a negative effect on the health of goats.
high-grain diet;s m allintestine;tight junction;alkaline phosphatase;microbial flora
.E-m ail:m aoshengyong@163.com
10.11686/cyxb2015381
2015-08-31;改回日期:2015-11-03
国家自然科学基金项目(31372339)资助。
薛春旭(1991-),女,天津人,在读硕士。E-m ail:xuechunxu2014@163.com

