接种尖镰孢菌对枸杞苯丙烷代谢关键酶及产物的影响
李捷,冯丽丹,杨成德,王有科,何静,张宝琳,陈秀蓉*(.甘肃农业大学,甘肃 兰州 730070;.甘肃省林业科学研究院,甘肃 兰州 73000)
接种尖镰孢菌对枸杞苯丙烷代谢关键酶及产物的影响
李捷1,冯丽丹1,杨成德1,王有科1,何静1,张宝琳2,陈秀蓉1*
(1.甘肃农业大学,甘肃 兰州 730070;2.甘肃省林业科学研究院,甘肃 兰州 730020)
为了阐明抗感枸杞与根腐病病原菌互作过程中苯丙烷代谢途径中关键酶和代谢产物的变化差异与抗病性的关系,以枸杞栽培品种宁杞一号(NingqiⅠ)、宁杞二号(NingqiⅡ),国内野生种中国枸杞、宁夏枸杞,美洲引进野生种L.brevipes、L.exsertum等6种材料为参试材料,采用切根法接种强致病菌尖镰孢菌后统计死亡率,以此筛选出抗病和感病材料,并测定二者0~20 d内苯丙氨酸解氨酶(P A L)、肉桂酸羟化酶(C4 H)、4-香豆酰-辅酶A连接酶(4 C L)等苯丙烷代谢途径关键酶以及总酚和类黄酮等代谢产物的动态变化。结果表明,6种参试材料接种枸杞根腐病强致病菌尖镰孢菌后,野生材料较栽培材料抗病性强,宁杞一号为感病材料,L.exsertum抗根腐病能力最强;抗病材料L.exsertum苯丙烷代谢关键酶苯丙氨酸解氨酶、肉桂酸羟化酶、4-香豆酰-辅酶A连接酶活性显著高于宁杞一号,初步确定苯丙烷代谢中的苯丙氨酸解氨酶、肉桂酸羟化酶、4-香豆酰-辅酶A连接酶的活性和类黄酮的含量与枸杞材料抗根腐病呈正相关。因此,苯丙氨酸解氨酶、肉桂酸羟化酶、4-香豆酰-辅酶A连接酶活性和类黄酮含量,初步可以作为筛选抗枸杞尖镰孢菌根腐病的生化指标。
枸杞;根腐病;尖镰孢菌;苯丙烷代谢;抗病性
http://cyxb.lzu.edu.cn
李捷,冯丽丹,杨成德,王有科,何静,张宝琳,陈秀蓉.接种尖镰孢菌对枸杞苯丙烷代谢关键酶及产物的影响.草业学报,2016,25(5):87-94.
LI Jie,F E N G Li-Dan,Y A N G Cheng-De,W A N G You-Ke,H E Jing,Z H A N G Bao-Lin,C H E N Xiu-Rong.Effects of key enzy m es and products in phenylpropanoid path way of Lycium infected by Fusarium oxysporum.Acta Prataculturae Sinica,2016,25(5):87-94.
枸杞(Lycium barbarum)为茄科多年生落叶灌木,是重要的“药食同源”型植物资源之一,是干旱荒漠区的牧草资源[1],具有抗衰老[2]、抗氧化[3]、免疫调节[4]及生殖系统[5]等重要功能,是中国西北地区的特色经济林,业已成为农村重要的经济来源。但1980年枸杞根腐病在西宁市省军区园艺场成片发生,在柴达木盆地的香日德农场的发病率一度高达53.2%[6];1989年枸杞根腐病在宁夏普遍发生,最重的病株37.6%,枯死株26.5%,平均病株15%,枯死株5%[7];1998年新疆主要枸杞栽培区有些地块栽植当年就开始死亡,一般地块栽植2~3年后死亡率为20%~30%,重者全田被毁[8]。根据本研究小组2012-2013年对甘肃枸杞主产区根腐病调查显示:平均发病率为20.6%,最严重地块高达72.4%,已经严重影响到了该产业的可持续发展。因此寻找抗枸杞根腐病的种质资源并研究它们的抗病生理机制显得尤为重要。关于植物的抗病性与其苯丙烷代谢具有密切的相关性已有不少报道。高必达和陈捷[9]认为,植物的防御反应与苯丙烷代谢途径的中间代谢产物及终产物有密切的关系;包改红等[10]研究证明抗病品种“青薯168”接种硫色镰孢菌(Fusarium sulphureum)后,苯丙氨酸解氨酶、肉桂酸羟化酶和4-香豆酰-辅酶A连接酶活性以及总酚、类黄酮和木质素含量均显著高于感病的“陇薯3号”,苯丙烷代谢在马铃薯(Solanum tuberosum)块茎抗干腐病方面具有重要的作用;马静芳等[11]认为苜蓿(Medicagosativa)接种尖镰孢菌(Fusarium oxysporum)抗性品种的苯丙氨酸解氨酶活性显著高于感病品种,其活性与苜蓿抗病性有重要的关系;宋修鹏等[12]证实了甘蔗(Saccharum officinarum)苯丙氨酸解氨酶基因(ScP AL)参与了抗黑穗病过程。而枸杞接种尖镰孢菌(F.oxysporum)后对苯丙烷代谢中关键酶和产物的影响尚未见研究报道。本研究拟选用6个枸杞材料,接种强致病菌尖镰孢菌确定其抗感材料,再进一步选择具有代表性的抗、感枸杞材料各1个,研究苯丙烷代谢中关键酶活性的变化趋势和主要代谢产物的积累情况,以期为西北地区选育抗枸杞根腐病材料提供参考。
1 材料与方法
1.1 材料
枸杞:选育自野生种宁夏枸杞(L.barbarum)的主栽品种宁杞一号、宁杞二号,野生种中国枸杞(L.chinense)、野生种宁夏枸杞,引自美国的枸杞属野生种L.brevipes、L.exsertum共6种材料(表1)。6种材料于2014年在甘肃农业大学林学院森林培育实验室进行组织培养炼苗,移栽至13 c m×12 c m营养钵中,以泥炭∶蛭石(V∶V)=1∶1灭菌后为培养基质,每盆移栽3株,成活后仅保留1株生长最好的继续培养。每周浇灌一次灭菌M S营养液,期间补充无菌水以保持土壤湿润,苗木生长至20 cm 左右时,选生长健壮均一苗木若干进行试验。
病原菌:尖镰孢菌,采自甘肃省靖远县枸杞产区根腐病发病植株。在接种前7 d于马铃薯琼脂培养基(P D A)上活化备用。
主要仪器与试剂:Shim adzu U V2450紫外可见分光光度计、T herm o F R ESC O17低温高速离心机等。试验采用的所有试剂均为分析纯。
1.2 方法
1.2.1 6种材料抗病性比较 接种方法:本试验于2014年在甘肃农业大学森林培育实验中心进行。取长至满皿的尖镰孢菌加无菌水制成浓度为106个/m L菌悬液。采取伤根后灌根的方法接种。具体做法如下:先用锋利的刀具在距离苗木2 c m处垂直向下切断根系至盆底,苗木的4个方向各切一刀,确保切断一定数量的根系,若未切断根系可将断根位置稍往苗木方向平移。然后将配制好备用的菌悬液每盆浇灌20 m L,每处理接种10盆,以切根浇灌无菌水20 m L为对照;每处理均重复3次。接种后覆膜、插上编号标签,黑暗培养24 h后正常光照培养,7 d后去膜,浇灌无菌水保持土壤湿润。
观测及统计方法:接种后,观察6种枸杞的发病情况,20 d时调查发病情况。以茎基部上出现褐色病斑,根系及维管束变黑,植株地上部落叶90%以上作为根腐病典型特征[13],调查死亡率并比较各材料的抗病性。
死亡率(%)=(发病死亡株数-对照死亡数)/(接种总株数-对照死亡数)×100
1.2.2 苯丙烷代谢途径相关指标样品处理及采样 选感、抗枸杞各1种,按照1.2.1的方法接种尖镰孢菌。接种后立即采样一次,然后每4 d的14:00定时采样1次,采集植株中上部完全展开的叶片,每株采集2~3片,做成混合样6份,每份0.2 g,用锡箔纸包好,液氮冷冻后放入-80℃低温冰箱内保存备用;采0~20 d的样品,共6次。
1.2.3 苯丙氨酸解氨酶(P A L)活性测定 参照李合生等[14]和Liu等[15]的方法,提取液和测定体系随样品重量减量。
1.2.4 肉桂酸羟化酶(C4 H)活性测定 参照范存斐等[16]以及La m b和Rubery[17]的方法,提取液和测定体系随样品重量减量。
1.2.5 4-香豆酰-辅酶A连接酶(4 C L)活性测定 参照范存斐等[16]与朱明华等[18]的方法,提取液和测定体系随样品重量减量。
1.2.6 总酚、类黄酮含量测定 参照Pirie和M ullins[19]的方法,提取液和测定体系随样品重量减量。
1.3 数据统计
采用Microsoft Excel 2010和SPSS 19.0数据处理系统进行数据统计处理。应用SPSS 19.0对数据进行单因素方差分析(O ne-way A N O V A),并利用Duncan’s多重比较对差异进行显著性分析。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 6种材料对根腐病病原菌抗性比较
表1结果显示,6种材料接种尖镰孢菌后,第20天宁杞一号、宁杞二号、中国枸杞、宁夏枸杞、L.brevipes和L.exsertum死亡率分别为89.3%,78.6%,75.9%,71.4%,51.7%和13.8%。O ne-way A N O V A结果表明,宁杞一号死亡率显著高于其余枸杞(P<0.05),而L.exsertum接种后死亡率显著低于其余枸杞(P<0.05);野生种枸杞死亡率略低于栽培种枸杞;引进野生种枸杞死亡率均较低。结果显示宁杞一号为感病品种;而L.exsertum对尖镰孢菌引起的枸杞根腐病具有良好的抗性。因此选择宁杞一号和L.exsertum为感病、抗病材料进行苯丙烷代谢相关指标的研究。
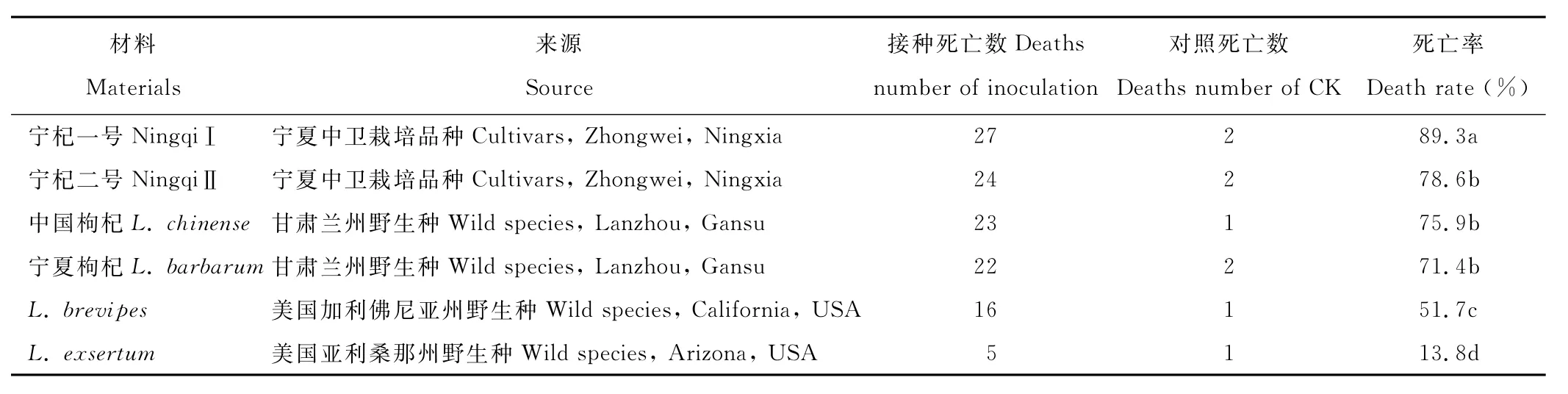
表1 6种枸杞接种尖镰孢菌死亡率Table 1 The death rate of 6 Lyciums by inoculation F.oxysporum
2.2 尖镰孢菌对抗感材料苯丙氨酸解氨酶(P A L)、肉桂酸羟化酶(C4 H)及4-香豆酰-辅酶A连接酶(4 C L)活性的影响
图1表明,宁杞一号对照、宁杞一号接种、L.exsertum对照和L.exsertum接种在0~20 d内P A L活性均呈现出降-升-降的变化趋势,L.exsertum起始活性更高。宁杞一号对照和L.exsertum对照在0~20 d内波动微小,组内差异不显著(P=0.059和0.361);而宁杞一号接种和L.exsertum接种组变化比较剧烈。宁杞一号接种组P A L活性先大幅下降后大幅上升并在第8天超过L.exsertum接种组,最后迅速下降至最低水平,表明在第8天时虽然P A L活性被激发了,但其酶活持续时间很短。L.exsertum接种组P A L活性小幅下降后迅速上升,在第20天达到所有组别最高值81.49 U/(g F W·min)。试验表明,L.exsertum在0~20 d内P A L活性显著高于宁杞一号(P<0.05),且接种尖镰孢菌后可显著提高其体内P A L的活性(P<0.05)。
在图2中4组试验材料在0~20 d内C4 H活性均呈现出先升后降的变化趋势。宁杞一号对照、宁杞一号接种和L.exsertum对照组在整个过程中组间差异不显著,但是L.exsertum接种组下降幅度显著小于其余3个组别,其达到了均值4.376 U/(g F W·min),显著高于起始值(1.415 U/g F W·min)。试验表明,L.exsertum在接种尖镰孢菌后0~20 d内可显著激发其体内C4 H的活性(P<0.05)。
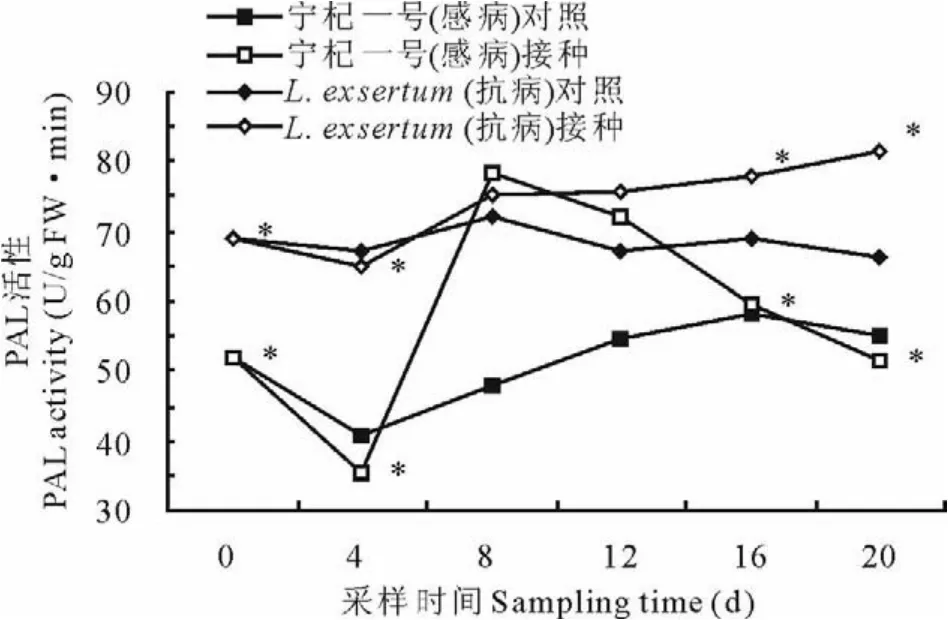
图1 接种尖镰孢菌枸杞P A L活性的变化Fig.1 The changes of phenylalanine am monialyase activity after inoculation F.oxysporum
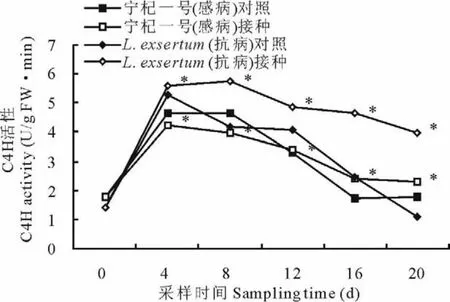
图2 接种尖镰孢菌枸杞C4 H活性的变化Fig.2 The changes of trans-cinnamic acid-4-hydroxylase activity after inoculation F.oxysporum
在图3中,4组试验材料均出现了4 C L活性先升后降的变化趋势。宁杞一号对照、宁杞一号接种和L.exsertum对照组在0~20 d中差异不显著,但是L.exsertum接种组的4 C L在第8天后保持了较高的活性。L.exsertum接种组第0天活性为0.354 U/(g F W·min),而20 d内均值为6.937 U/(g F W·min),上升了19.6倍。试验表明,L.exsertum在接种尖镰孢菌后0~20 d内可显著激发其体内4 C L的活性(P<0.05)。
2.3 尖镰孢菌对抗感材料总酚和类黄酮含量的影响
如图4所示,4组试验材料在0~20 d内总酚含量均出现了先升后降的变化趋势。宁杞一号对照、宁杞一号接种组间和L.exsertum对照与L.exsertum接种组间总酚含量差异不显著,宁杞一号接种与L.exsertum接种组间差异也不显著。宁杞一号总酚含量整体高于L.exsertum。试验结果表明,在接种尖镰孢菌后各参试材料中总酚含量0~20 d内没有显著地积累,各材料中总酚含量与其抗病性的相关性不大。
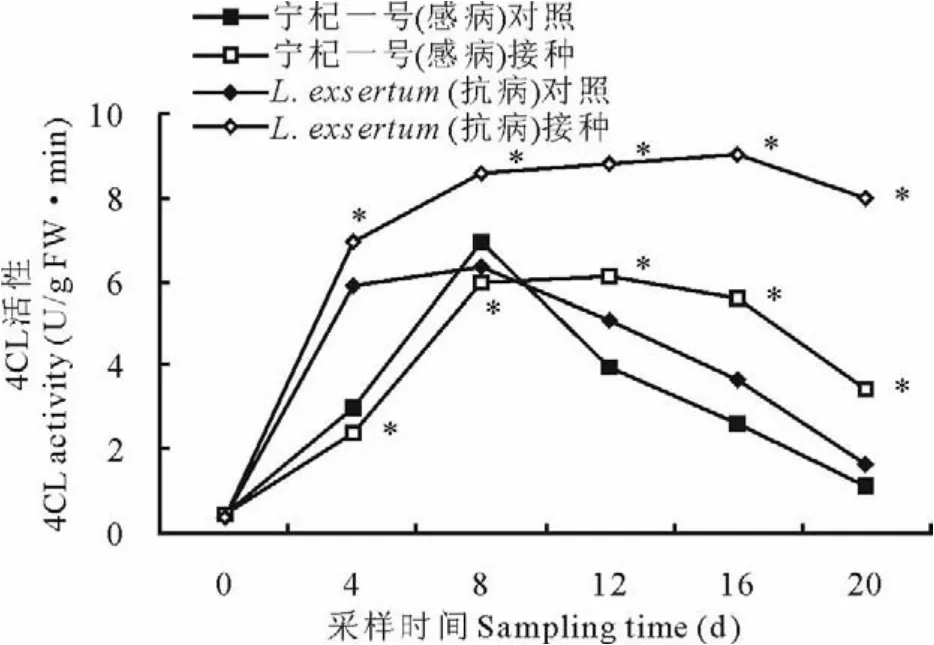
图3 接种尖镰孢菌枸杞4CL活性的变化Fig.3 The changes of 4-cou marate:coenzyme A ligase activity after inoculation F.oxysporum
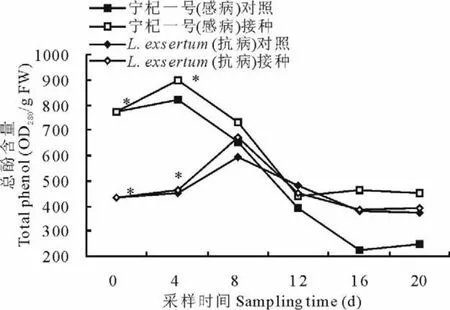
图4 接种尖镰孢菌枸杞总酚含量的变化Fig.4 The changes of total phenolics contents after inoculation F.oxysporum
如图5所示,宁杞一号对照、宁杞一号接种与L.exsertum对照在0~20 d内类黄酮含量均出现了先升后降的变化趋势,而L.exsertum接种组则是先上升而后稳定在较高水平。宁杞一号对照和宁杞一号接种组在0~20 d内出现了较大幅度的波动,峰值均在第4天,分别为825.44和666.17 O D325/g F W,但是到第20天时均未出现类黄酮的积累,反而略低于第0天。L.exsertum对照组一直在第0天含量水平波动,整个过程无显著差异(P>0.05)。L.exsertum接种组第8天之后显著高于其余组别(P<0.05)。试验表明,L.exsertum的抗病性可能与类黄酮的积累呈正相关。
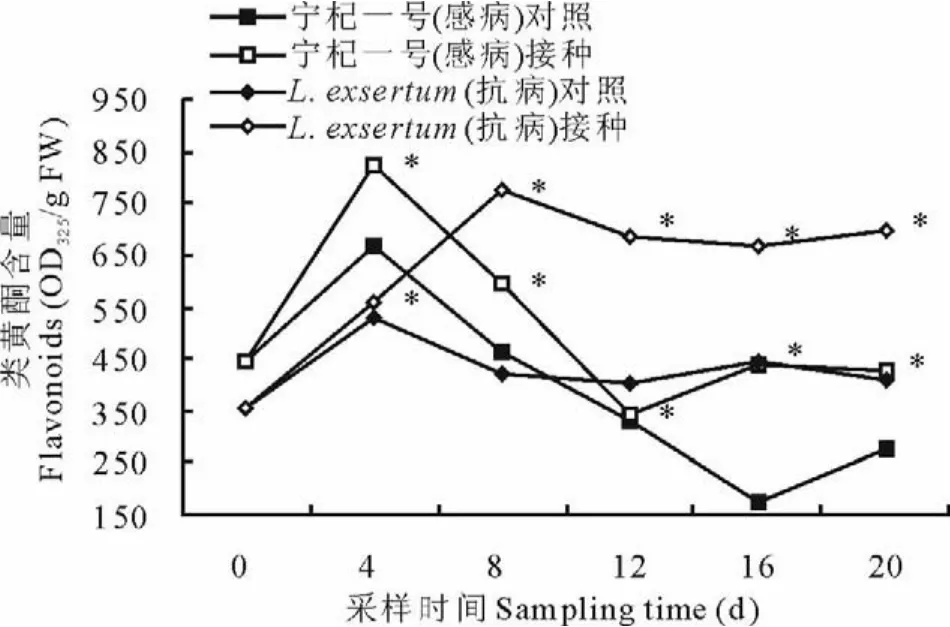
图5 接种尖镰孢菌枸杞类黄酮含量的变化Fig.5 The changes of flavonoids contents after inoculation F.oxysporum
3 讨论
3.1 6种材料对根腐病病原菌抗性表现
6种材料接种尖镰孢菌后对照株中有个别植株死亡,其原因可能是切根时对根系具有一定的损伤造成;当接种尖镰孢菌后L.exsertum死亡率仅为13.8%,为参试材料中死亡率最低,显著低于宁杞一号的89.3%(表1)。研究表明L.exsertum在6种参试材料中抗根腐病能力最强,且野生种材料的抗病性略高于栽培品种枸杞,在分子育种的过程中可以加以利用。
3.2 苯丙氨酸解氨酶(P A L)、肉桂酸羟化酶(C4 H)及4-香豆酰-辅酶A连接酶(4 C L)等苯丙烷代谢关键酶在抗枸杞根腐病中的作用
苯丙氨酸解氨酶(P A L)是苯丙烷代谢途径的关键酶,参与了多种激发子诱导的抗性[20],增强了植物对病原侵染的抵抗能力[21]。徐凌飞等[22]认为P A L的活性变化与梨品种抗病性呈正相关,李晓敏等[23]的研究显示大蒜(Allium sativum)抗病品种P A L活性的最大峰值高于感病品种,薛军等[24]通过苦荞(Fagopyrum tataricum)苯丙氨酸解氨酶基因(FtP AL)的研究认为P A L在苦荞抗病过程中有重要作用,刘瑞峰等[25]对早期差异表达基因分析发现苯丙烷代谢途径在月季(Rosa chinensis)抵抗黑斑病菌过程中发挥重要作用。在本研究中接种尖镰孢菌后抗病材料L.exsertum P A L活性显著高于感病的宁杞一号,且接种尖镰孢菌后可显著提高其体内P A L的活性,这与前人在黄瓜(Cucumissativus)[26]和甘薯(Dioscoreaesculenta)[27]上的研究结果类似。
C4 H作为苯丙烷代谢途径上P A L之后的又一关键酶[28],以肉桂酸为前体催化合成ρ-香豆酸,这是咖啡酸和阿魏酸等物质的前体。C4 H活性的增强可以增加苯丙烷代谢酚酸类物质的合成,从而抑制病原物的生长繁殖[29]。真菌感染、机械损伤及化学诱导子等刺激下均能引起C4 H基因的过表达[30]。在本研究中L.exsertum在接种尖镰孢菌后0~20 d内可显著激发其体内C4 H的活性,印证了前人的研究。
4 C L是木质素生物合成途径中的关键合成酶,可以以肉桂酸、ρ-香豆酸、咖啡酸和阿魏酸等物质作为前体,合成苯丙烷酸的Co A酯,在抵御植物病害袭击、抗击外来侵袭、维持植物正常生长等方面发挥着巨大的作用[31]。在本研究中L.exsertum在接种尖镰孢菌后0~20 d内可显著激发其体内4 C L的活性,也与前人的研究结果类似。
对苯丙烷途径关键酶以及相关产物积累的研究表明,接种尖镰孢菌后L.exsertum体内的P A L、C4 H、4 C L活性增加幅度均显著大于宁杞一号,并且L.exsertum的死亡率也最低。表明L.exsertum在其抗病过程中P A L、C4 H、4 C L等起到了重要作用,对尖镰孢菌的侵染具有较强的抵抗能力。因此通过本研究,初步可以确定苯丙烷代谢关键酶以及相关产物在枸杞抗根腐病过程中具有重要的作用,但在基因水平上是如何控制其酶活的表达还有待进一步研究。
3.3 总酚和类黄酮等苯丙烷代谢关键产物在抗枸杞根腐病中的作用
由4 C L催化和合成的苯丙烷酸的Co A酯进一步合成木质素、总酚以及类黄酮等对病原菌有杀灭作用的各种次生代谢物质[32]。酚类物质可氧化成有直接毒性的醌类物质,能有效抑制病原菌的扩展[33],以提高植物的抗病能力。刘美艳等[34]认为甘薯块根中类黄酮、总酚含量的提高,有利于提高抗黑斑病的能力;刘普等[35]认为梨树腐烂病发病程度与枝条韧皮部总酚含量呈显著正相关关系;但丁谦等[36]对甜瓜(Cucumis melo)的类黄酮和总酚的含量表明抗感病品种间难以找出规律性。在本研究中L.exsertum在接种尖镰孢菌后0~20 d内可显著提高类黄酮的含量,但是总酚含量无相关规律,其原因有待于进一步研究。
另外,在本研究中不论接种尖镰孢菌与否,第4天均出现了酶活及物质含量变化急剧,可能与切根接种有关,这种接种方式对植株造成的机械损伤可能引起了苯丙烷途径相关物质的变化。
4 结论
6种参试材料接种根腐病强致病菌尖镰孢菌后,野生种材料较栽培材料抗病性较强,宁杞一号为感病材料,L.exsertum抗根腐病能力最强。
抗病材料L.exsertum苯丙烷代谢关键酶P A L、C4 H、4 C L活性显著高于宁杞一号,初步确定苯丙烷代谢中的P A L、C4 H、4 C L的活性和类黄酮的含量与枸杞材料抗根腐病呈正相关。因此,P A L、C4 H、4 C L酶活性和类黄酮含量,初步可以作为筛选抗枸杞镰孢菌根腐病的生化指标。
References:
[1]Zhang J,Zhang Q,H e J M,etal.Estim ation and analysis of grass bio m ass in desert by re m ote sensing.Acta Ecologica Sinica,2007,27(6):2294-2301.
[2]Luo Q,Li Z,Yan J,et al.Lycium barbarum polysaccharides induce apoptosis in hu m an prostate cancer cells and inhibits prostate cancer growth in a xenograft m ouse m odel of hu m an prostate cancer.Journal of M edicinal Food,2009,12(4):695-703.
[3]Zhao R,Li Q W,Xiao B.Effect of Lycium barbarum polysaccharide on the im prove m ent ofinsulin resistance in NID D M rats.Yakugaku Zasshi,2005,125(12):981-988.
[4]Zhang H F,W ang Y F.The protective effects of Lycium bararum polysaccharides on alloxan-induced rat pancreatic islets da m age.Chinese Journal of Cell Biology,2005,27(2):173-177.
[5]Chen Z,Soo M Y,Srinivasan N,etal.Activation of m acrophages by polysaccharide-protein co m plex fro m Lycium barbarum.A pplied Physics Letters,2015,106(10):1116-1122.
[6]Liu Z R.Preliminary study on the withered disease of Chinese wolfberry.Science and Technology of Qinghai A griculture and Forestry,1980,3:43-45.
[7]Lu Z K,W ang G Z,Zhang L R,et al.Occurrence and control of wolfberry root rot.Acta Phytophylacica Sinica,1994,21(3):249-254.
[8]Li H,Li G Y,Fu J H.Identification of the causing agent of wolfberry root rotin Xinjiang.Journal of Plant Protection,1998,25(3):253-257.
[9]Gao B D,Chen J.Physiological Plant Path way[M].Beijing:Science Press,2006.
[10]Bao G H,Bi Y,Li Y C,etal.Co m parasion of phenylpropanoid path way m etabolis m in slices of susceptible and resistant potato cultivars inoculated with Fusarium sulphureum.Food Science,2015,36(6):151-156.
[11]M a J F,Li M Q,Zhang Z H,etal.Study on relationship between phenylalanine a m m onialyase(P A L)and resistance to crow n and root rot in alfalfa cultivars.Acta Prataculturae Sinica,2003,12(4):35-39.
[12]Song X P,H uang X,M o F L,etal.Cloning and expression analysis of sugarcane phenylalanin a m m onia-lyase(PAL)gene.Scientia A gricultura Sinica,2013,46(14):2856-2868.
[13]Gu B G,Zhang Y H,Liu N C,etal.G B/T 17980.88-2004,Fungicides A gainst Soybean Root Rot[S].Beijing:Standards Press of China,2004.
[14]Li H S,Sun Q,Zhao S J,etal.The Principle and Technology of Plant Physiology and Bioche mistry Experim ent[M].Beijing:Higher Education Press,2000:105-109.
[15]Liu H X,Jiang W B,Bi Y,etal.Postharvest B T H treatm ent induces resistance of peach(Prunus persica L.cv.Jiubao)fruit to infection by Penicillium expansum and enhances activity of fruit defense m echanis ms.Postharvest Biology and Technology,2005,35(3):263-269.
[16]Fan C F,Bi Y,W ang Y F,etal.Effect of salicylic acid dipping on postharvest diseases and phenylpropanoid path way in m usk m elon fruits.Scientia A gricultura Sinica,2012,45(3):584-589.
[17]La m b C J,Rubery P H.A spectrophoto m etric assay for trans-cinna mic acid 4-hydroxylase activity.A nalytical Bioche mistry,1975,68(2):554-561.
[18]Zhu M H,O uyang G C,Xue Y L.Changes of activities of four enzy m es(G6P D,P A L,4 C L,P O)and lignin contentin imm unization induced cucu m ber.Acta A griculture Shanghai,1990,6(2):21-26.
[19]Pirie A,M ullins M G.Changes in anthocyanin and phenolics content of grapevine leaf and fruit tissue treated with sucrose,nitrate,and abscisic acid.Plant Physiology,1976,58(4):468-472.
[20]M auch-M ani B,Slusarenko A J.Production of salicylic acid precursors is a m ajor function of phenylalanine a m m onialyase in the resistance of Arabidopsis to Peronospora parasitica.The Plant Cell,1996,8(2):203-212.
[21]W hetten R,Sederoff R.Lignin biosynthesis.The Plant Cell,1995,7(7):1001-1013.
[22]Xu L F,Zhao H B,M a F W,etal.Crude toxin isolated fro m Verturia noshicola on physiological charateristics of in vitro leaves of susceptible and resistant pear.Acta Botanica Boreali-Occidentalia Sinica,2007,27(6):1156-1160.
[23]Li X M,Cheng Z H,Dong Y X.Effects of Alternaria porri(Elliott)Cif.crude toxin on protective enzy m e activities and leaf anato mical structure of garlic seedlings.China Vegetables,2012,16(1):68-74.
[24]Xue J,M a S,Deng X,etal.Prokaryotic expression and reverse catalytic activity characterizations of phenylalanine a m m onialyase gene(FtPAL)fro m Fagopyrum tataricum.Journal of A gricultural Biotechnology,2014,22(1):64-70.
[25]Liu R F,Liu Q,Zhang F Y,etal.The analysis of differential expression genes for rose early responding to black-spot disease.Acta H orticulturae Sinica,2015,42(4):731-740.
[26]Tian X L,Liu M T,Yang J R.Seed germination and growth of various resistant cucu m ber seedlings under Fusarium oxysporum crude toxin stress.Chinese Journal of Eco-A griculture,2008,16(6):1495-1498.
[27]W ang W,Ruan M H,Qiu Y X,etal.Phenylaprapanoid m etabolis m of sweet potato against Pseudomonassolanacearum.Chinese Journal of Eco-A griculture,2009,17(5):944-948.
[28]Li L,Zhao Y,M a J L.Recent progress on key enzy m es:P A L,C4 H,4 C L of phenylalanine m etabolis m path way.China Journal of Bioinform atics,2007,5(4):187-189.
[29]Zhang W Y,Bi Y.Postharvests Diseases and Control of Fruits and Vegetables[M].Beijing:China A griculture Press,1996.
[30]Liang L,H an X M,Zhang Z,etal.Cloning and expression analysis of cinna m ate 4-hydroxylase(C4 H)reductase gene fro m Aquilariasinensis.China Journal of Chinese M ateria M edica,2014,6(10):705-707.
[31]Chiang V L.M onolignol biosynthesis and genetic engineering of lignin in trees,a review.Environ m ental Che mistry Letters,2006,4(3):143-146.
[32]Zhao S J,Liu D,H u Z B.4-cou m arate:Coenzy m e a ligase in plant.Plant Physiology Co m m unications,2006,42(3):529-538.
[33]Reim ers P J,Leach I E.Race-specific resistance to Xanthomonasoryzae pv.Oryzae conferred by bacterial blight resistance gene Xa-10 in rice(Oryzaesativa)involves accu m ulation of a lignin-like substance in host tissues.M olecular Plant Pathology,1999,38(1):39-55.
[34]Liu M Y,Sun H J,W ang J J,etal.The study on phenol m etabolis m in sweet potato infected by Ceratocystisfimbriata elliset halsted.Scientia A gricultura Sinica,2012,28(24):226-230.
[35]Liu P,Shi Y Y,Xue C,etal.Investigation of the resistance to pear valsa canker and the physiological and bioche mical characteristics in pyrus germ plas m.Acta Botanica Boreali-Occidentalia Sinica,2014,34(6):1164-1172.
[36]Ding Q,Jin S L,Q u Y L,etal.Determination and analysis of antifungal co m position content in m elon leaves.Journal of Gansu A gricultural U niversity,2012,47(4):57-60,63.
[1]张杰,张强,何金梅,等.荒漠草原牧草生物量的遥感估算及空间分布.生态学报,2007,27(6):2294-2301.
[6]刘振荣.枸杞枯萎病研究初报.青海农林科技,1980,3:43-45.
[7]鲁占魁,王国珍,张丽荣,等.枸杞根腐病的发生及防治研究.植物保护学报,1994,21(3):249-254.
[8]李晖,李国英,付建红.新疆枸杞烂根病病原的鉴定.植物保护学报,1998,25(3):253-257.
[9]高必达,陈捷.生理植物病理学[M].北京:科学出版社,2006.
[10]包改红,毕阳,李永才,等.硫色镰刀菌(Fusarium sulphureum)接种对抗病/易感品种马铃薯块茎苯丙烷代谢的影响比较.食品科学,2015,36(6):151-156.
[11]马静芳,李敏权,张自和,等.苯丙氨酸解氨酶与苜蓿种质根和根颈腐烂病抗病性研究.草业学报,2003,12(4):35-39.
[12]宋修鹏,黄杏,莫凤连,等.甘蔗苯丙氨酸解氨酶基因(PAL)的克隆和表达分析.中国农业科学,2013,46(14):2856-2868.
[13]顾宝根,张匀华,刘乃炽,等.G B/T 17980.88-2004,杀菌剂防治大豆根腐病[S].北京:中国标准出版社,2004.
[14]李合生,孙群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:105-109.
[16]范存斐,毕阳,王云飞,等.水杨酸对厚皮甜瓜采后病害及苯丙烷代谢的影响.中国农业科学,2012,45(3):584-589.
[18]朱明华,欧阳光察,薛应龙.黄瓜免疫诱导过程中G6P D、P A L、4 C L、P O活性和木质素含量的变化.上海农业学报,1990,6(2):21-26.
[22]徐凌飞,赵竑博,马锋旺,等.梨黑星菌粗毒素对抗病和感病梨离体叶片生理特性的影响.西北植物学报,2007,27(6):1156-1160.
[23]李晓敏,程智慧,董殷鑫.紫斑病菌粗毒素对大蒜幼苗防御酶活性和叶片解剖结构的影响.中国蔬菜,2012,16(1):68-74.
[24]薛军,马双,邓霞,等.苦荞苯丙氨酸解氨酶基因(FtPAL)的原核表达及其逆向催化酶学性质分析.农业生物技术学报,2014,22(1):64-70.
[25]刘瑞峰,刘强,张非亚,等.月季响应黑斑病的早期差异表达基因分析.园艺学报,2015,42(4):731-740.
[26]田雪亮,刘鸣韬,杨家荣.黄瓜枯萎菌粗毒素对不同抗性黄瓜种子萌发及幼苗胁迫作用研究.中国生态农业学报,2008,16(6):1495-1498.
[27]王伟,阮妙鸿,邱永祥,等.甘薯抗薯瘟病的苯丙烷类代谢研究.中国生态农业学报,2009,17(5):944-948.
[28]李莉,赵越,马君兰.苯丙氨酸代谢途径关键酶:P A L、C4 H、4 C L研究新进展.生物信息学,2007,5(4):187-189.
[29]张维一,毕阳.果蔬采后病害与控制[M].北京:中国农业出版社,1996.
[30]梁良,韩晓敏,张争,等.白木香肉桂酸-4-羟基化酶(C4 H)基因的克隆及表达分析.中国中药杂志,2014,6(10):705-707.
[32]赵淑娟,刘涤,胡之璧.植物4-香豆酸:辅酶A连接酶.植物生理学通讯,2006,42(3):529-538.
[34]刘美艳,孙厚俊,王景景,等.甘薯块根抗黑斑病酚类物质代谢的研究.中国农学通报,2012,28(24):226-230.
[35]刘普,施园园,薛程,等.梨树腐烂病抗性种质筛选及相关生理生化特性研究.西北植物学报,2014,34(6):1164-1172.
[36]丁谦,靳生林,曲亚玲,等.甜瓜不同品种叶片中抗病成分含量的测定与分析.甘肃农业大学学报,2012,47(4):57-60,63.
Effects of key enzymes and products in phenylpropanoid pathway of Lycium infected by Fusarium oxysporum
LI Jie1,FE N G Li-Dan1,Y A N G Cheng-De1,WA N G You-Ke1,H E Jing1,Z H A N G Bao-Lin2,C H E N Xiu-Rong1*
1.Gansu Agricultural University,Lanzhou 730070,China;2.Gansu Academy of Forestry Science,Lanzhou 730020,China
In this study,the phenylpropanoid path way of the interaction of w olfberry and root rot pathogens will be discussed.T he relationship between w olfberry phenylpropanoid path way and disease resistance will be clarified.In this study,the experim ental m aterials are cultivated varieties NingqiⅠ,NingqiⅡ;do m estic wild species Lycium chinense,L.barbarum;wild species of A m erica L.brevipes,L.exsertum.T he strong pathogenic Fusarium oxysporum isolated fro m the onset of w olfberry will be inoculation by root cutting m ethod.A nd the anti-sense w olfbeey will be choose.T his 2 kinds of w olfberry as m aterials to study the change of phenylalanine a m m onia lyase,cinna mic acid hydroxylase,4-hydroxylase p-cou m aric acyl-coenzy m e A ligase,phenolics and flavonoids in 20 days.T he results show that the disease resistance of wild m aterials are strong than the cultivated m aterialin 6 kinds of test m aterials w hich were inoculated with w olfberry root rot strong pathogen F.oxysporum.NingqiⅠis susceptible m aterials.T he resistance to root rot disease of L.exsertum are strongest.T he key enzy m es of phenylpropanoid path way like phenylalnine a m m onialyase,trans-cinna mic acid-4-hydroxylase,4-cou m arate:coenzy m e A ligase activity are significantly higher than NingqiⅠ.Initially identified the phenylalnine a m m onialyase,trans-cinna mic acid-4-hydroxylase,4-cou m arate:coenzy m e A ligase activity and flavonoid content of phenylpropanoid path way of test m aterial resistance to root rot disease was positively correlated.T herefore,the phenylalnine a m m onialyase,trans-cinna mic acid-4-hydroxylase,4-cou m arate:coenzy m e A ligase enzy m e activity and flavonoid content can be a screening of anti-Chinese w olfberry Fusarium root rot of bioche micalindexes preliminary.
Lycium spp.;root rot;Fusarium oxysporum;phenylpropanoid path way;disease resistance
.E-m ail:chenxiurong@gsau.edu.cn
10.11686/cyxb2016024
2016-01-19;改回日期:2016-03-08
国家林业局“948”项目(2011-4-39),甘肃中草药科技攻关项目(G Y C11-01),甘肃省科技支撑项目(1304 F K C A054)和甘肃农业大学盛彤笙科技创新基金(G S A U-S T S-1338)资助。
李捷(1981-),男,四川仁寿人,讲师,在读博士。E-m ail:lj81658@gsau.edu.cn

