微波止血分离器在降低肝门板的肝癌切除术中的应用
肖震宇 万春 杨藩 童兵 黄志勇
·论 著·(临床实践)
微波止血分离器在降低肝门板的肝癌切除术中的应用
肖震宇 万春 杨藩 童兵 黄志勇
目的 探讨微波止血分离器在降低肝门板的肝癌切除手术中的临床应用价值。方法 回顾分析2010年至2012年70例应用微波止血分离器进行的降低肝门板的肝癌切除手术资料,采用微波止血分离器(HeSetor)进行肝门板解剖及断肝,术中仅阻断切除侧肝门;与同期40例常规手术对照组资料进行比较,该组采用常规Pringle阻断肝门及钳夹断肝。结果 两组手术均顺利完成。HeSetor结合降低肝门板组手术时间平均(115.4±42.3) min;术中出血量平均(120.0±105.2) ml,术中均无输血;术后肝功能生化检查平均在(6.3±2.7) d恢复;术后并发症发生率为15.7%(11/70),其中胸腔积液5例(7.1%),腹水6例(8.6%);术后平均住院(6.4±3.5) d。常规手术对照组手术时间平均(169.1±86.5) min;术中出血量平均(360.5±153.1) ml,术中3例输血(7.5%);术后肝功能生化检查平均在(9.1±5.6) d恢复;术后并发症发生率为30.0%(12/40),其中胸腔积液5例(15.0%),腹水5例(15.0%),胆瘘2例(7.5%);术后平均住院(11.1±6.3) d。两组间以上指标比较,P值均小于0.05。结论 应用微波止血分离器进行的降低肝门板的肝癌切除手术是一种安全可靠的肝切除方法,术中出血少,容易掌握,术后恢复快,值得临床推广应用。
肝切除术; 肝肿瘤; 止血技术; 微波
手术切除仍然是当前肝癌治疗的主要方法,术中控制和减少出血以及尽量保护剩余肝脏的功能是手术成功的关键[1-2]。研究表明手术出血量与术后肝衰竭发生及术后生存率密切相关[3-4]。微波止血分离器(HeSetor)是一种新型的医疗器械,其优势在于剥凝合一,凝固方向性强,速度快,可以用于外科手术中5 mm以下血管凝固、止血,从而达到精细解剖的目的,特别适用于多血实质性脏器手术操作[5-6]。我院普外科自2010至2012年利用微波止血分离器(HeSetor)同时结合降低肝门板手术技术对70例肝癌病人进行了切除手术,通过与同期40例常规肝癌切除手术临床资料进行分析对比,我们认为该方法切实易行,能够有效控制术中出血,防止术后肝功能不良,同时该方法可以预防切缘肿瘤残留,具有一定的临床意义,现报告如下。
资料与方法
一、临床资料
使用HeSetor结合降低肝门板组病例70例,男性58例,女性12例,平均年龄53.5岁(28~79岁),常规手术对照组40例,术中使用常规Pringle手法间歇阻断肝门,其中男性32例,女性8例,平均年龄50.2岁(29~76岁)。HeSetor结合降低肝门板组中原发性肝癌63例,转移性7例,55例合并不同程度肝硬化。肝功能Child-Pugh分级: A级59例,B级11例。对照组原发性肝癌35例,转移性5例,29例合并不同程度肝硬化。肝功能Child-Pugh分级: A级31例,B级9例。术前详细检查病人的一般情况以及肝脏储备功能,根据影像学资料(CT或MRI) 判断病灶可切除性及与胆管、血管的毗邻关系(图1)。HeSetor结合降低肝门板组中应用新型微波止血分离器HeSetor®M120型进行肝实质的离断及断面止血,其中择期手术63例,急诊手术7例。左半肝切除21例,左外叶切除13例,右半肝切除25例,右后叶切除7列,第Ⅷ段切除4例,其中有33例同时施行了胆囊切除。对照组中择期手术38例,急诊手术2例。左半肝切除15例,左外叶切除6例,右半肝切除18例,右后叶切除1列,其中有19例同时施行了胆囊切除。
二、操作方法
HeSetor结合降低肝门板组采用新型微波止血分离器HeSetor®M120型,刀头型号为ZS8-8,主机工作频率915 MHz,最大输出功率120 W,功率连续可调。进腹探查,根据情况切除或不切除胆囊。显露肝十二指肠韧带前层腹膜与肝方连接处,紧贴后方肝门板深面利用微波止血分离器(HeSetor)分开肝实质,显露左右肝管汇合部上缘,以弯度适当血管钳绕过肝门板后方,从肝门横沟后缘穿出,钳夹阻断带引出,断肝时将其收紧即可阻断病侧入肝血流。此时切除侧处于无供血状态,即可在预切线上利用微波止血分离器(HeSetor)断肝(图2);HeSetor微波止血分离器在手术中主要作为钝性剥离及止血使用,助手可用电刀配合对小的出血进行凝固。在钝性离断肝实质的过程中,先凝固肝组织再左右横向剥离推进,可以清晰显露管道结构。肝断面直接利用HeSetor彻底凝固止血,个别粗大管道单独结扎或缝扎,肝创面以大网膜覆盖,局部置放腹腔引流管引出腹腔,关腹。常规手术对照组术中使用常规Pringle’s手法间歇阻断肝门,平均阻断时间15.5 min,使用传统钳夹断肝法离断肝实质,断面予以褥式缝合后置引流、关腹。

图1 典型病人CT影像 A.巨大肝右叶肿瘤,行右半肝切除;B.肿瘤位于肝左叶伴破裂出血,行左半肝切除;C.左外叶肿瘤,行肝左外叶切除;D.转移性肝癌,行局部肝段切除
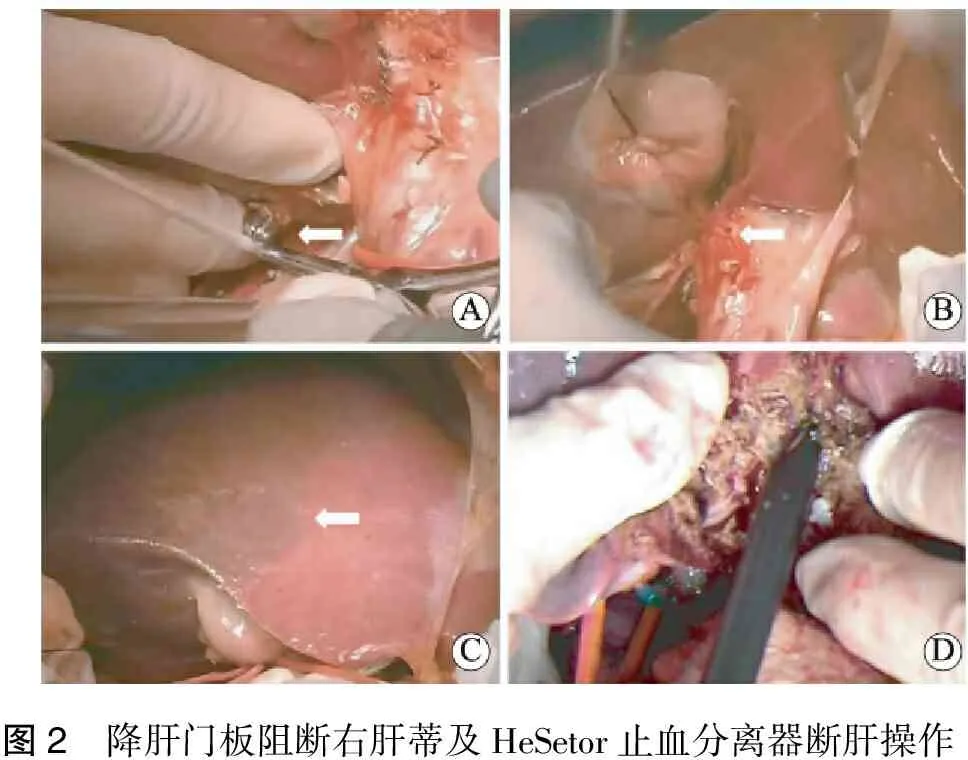
图2 降肝门板阻断右肝蒂及HeSetor止血分离器断肝操作
三、统计学分析
结 果
两组病例均顺利完成手术。HeSetor结合降低肝门板组手术时间80~220 min,平均(115.4±42.3) min;术中出血量10~320 ml,平均(120.0±105.2) ml,术中均无输血;术后第1天腹腔引流量30~180 ml,平均(90.4±75.0) ml;肝功能生化检查在4~14 d恢复,平均(6.3±2.7) d;术后并发症发生率为15.7%(11/70),其中胸腔积液5例(7.1%),腹水6例(8.6%);术后平均住院(6.4±3.5)d(6~14d)。常规手术对照组手术时间95~300 min,平均(169.1±86.5) min;术中出血量100~600 ml,平均(360.5±153.1) ml,术中3例输血(7.5%);术后第1天腹腔引流量150~360 ml,平均(189.7±106.9) ml;肝功能生化检查在6~25 d恢复,平均(9.1±5.6) d;术后并发症发生率为30.0%(12/40),其中胸腔积液5例(15.0%),腹水5例(15.0%),胆瘘2例(7.5%);术后平均住院(11.1±6.3) d(8~27 d)。两组术后随访6~24个月,随访率100%,中位随访时间11个月。HeSetor结合降低肝门板组5例(7.1%)肝细胞癌病人分别在术后6~14个月后出现肝内转移复发,均行局部消融治疗或介入治疗。常规手术对照组5例(12.5%)肝细胞癌病人分别在术后6~14个月后出现肝内转移复发,行局部消融治疗或介入治疗。两组以上主要手术指标比较,差异均有统计学意义(P<0.05),见表1。
讨 论
我国肝癌病人多合并肝硬化,肝脏储备功能不同程度地存在损害,在肝脏手术时更容易出血[7-10]。出血量是影响病人术后病死率和并发症发生率的重要因素之一[11-12]。为了控制出血,阻断入肝血流下行肝切除术,即Pringle 法,一直是肝脏外科的常规手术方式,该法的缺点是阻断了全部入肝血流,不需切除的健侧肝脏也会发生缺血再灌注损伤[13-16],加重了肝功能的损害,使病人术后肝衰竭发生概率升高,从而增加了术后病死率。如何既能有效控制肝实质离断时的大量出血,又能避免残余肝缺血损伤以及胃肠道淤血等并发症的发生,一直是困扰肝脏外科医生的难题。
Couinand在1957年首次提出肝门板这一概念, 此后该解剖概念逐步引起了外科界的关注[17]。肝门板由肝包膜在肝门处增厚形成,并随肝蒂的门管结构深入肝实质内即Glisson氏鞘,血管胆管均包裹在Glisson鞘内,较坚韧,有一定阻力。游离肝门板是在Glisson鞘外进行,关键在于紧贴包膜下解剖, 要避免深入肝实质损伤肝中静脉的左下属支的起始部,选择血管钳应弯度合适,紧贴肝门板绕过, 同时以左手食指在肝门下缘作引导 。本组术中游离肝门板过程均很顺利,利用微波止血分离器(HeSetor)分离肝门板时, 一般甚少出血, 所需时间最长不超过15 min。当肝门板解剖后,肝管汇合部便会下降,从而降低了胆管损伤的可能性。游离肝门板的术侧入肝血流阻法,在肝切除时阻断不受时间限制,手术可以从容不迫地进行, 同Pringle’s法相比,断肝时出血少,手术时间缩短,术后肝功能恢复快,并发症降低,适用于合并肝硬化原发性肝癌的手术切除。
微波止血分离器(HeSetor)是一种新型的手术器械,可集中能量于局部组织,产生90 ℃左右的高温,造成组织瞬间凝固,具有不碳化、损伤小、快速高效止血等特点,在实性器官手术中能够达到精细解剖的手术效果,具有一定使用优势。肝脏外科的发展和术中控制出血方法的进步密切相关,术中出血量、输血量也与手术成败、手术并发症和病死率关联密切。本研究中我们尝试将微波止血分离器作为主要分离止血设备应用降低肝门板的肝癌切除手术中,获得了较好的结果。相较于传统的“微波刀”,微波止血分离器(HeSetor)将微波天线改造成独特的钝性剥离手术刀,刀头内除包含发射极,还有接收极。其凝固范围和止血效果要优于传统电刀,极大的缩短了手术时间。分离过程中5 mm以下管道可直接封闭,手术过程中出血量明显减少。本组所以病例术中均无需输血。HeSetor刀头能量是集中于轴向发射的,故组织横向损伤深度仅为0.5~2.0 mm。所有这些工作特性使得HeSetor对需保留的肝组织损伤较小,在肝切除手术中具有一定的优势。此外,在手术中利用微波止血分离器快速凝固,剥凝同步的特点,可实现术中对肿瘤周围组织离断区进行止血及瘤周消融;而在肿瘤切除后对瘤床进行二次瘤床消融。有研究表明微波能够激发体内免疫应答,增加治疗区域杀伤肿瘤T细胞的聚集,提高对肿瘤细胞的免疫水平,从而达到抑制肿瘤的作用[18-20]。术中瘤周消融不仅减少了出血量,同时在一定程度上消融杀灭了切缘残留的肿瘤细胞,切缘的阴性率得到提高。

表1 两组病人手术指标结果比较
在使用微波止血分离器的过程中,我们总结以下几点经验:①术前应依据影像学检查制定合理的切除范围和切缘;②术中需结合B超再次确认切缘周边重要管道走向,避免误伤;③微波止血分离器在手术中主要作为钝性剥离及止血使用,助手可用电刀配合;④钝性剥离的过程中,应执行先凝固再左右横向剥离推进的操作方法,以清晰显露管道结构,切忌急躁冒进,造成意外出血;⑤当接近重要管腔结构时,应适当降低微波止血分离器的功率,并于剥离同时向刀头滴注少量生理盐水,以免损伤深部组织;⑥5 mm以下管道HeSetor可直接实现闭合,超过5 mm的管道需切实结扎;⑦对于创面较大的肝断面可以进行二次凝固,防止术后渗血并降低切缘残瘤率。
1 Waghray A,Murali AR,Menon KN.Hepatocellular carcinoma:From diagnosis to treatment.World J Hepatol,2015,7:1020-1029.DOI:10.4254/wjh.v7.i8.1020.
2 辛乐,张志伟,陈孝平.影响大肝癌切除术后肝功能代偿不良因素的分析.腹部外科,2013,26:100-103.DOI:3969/j.issn.1003-5591.2013.02.010.
3 She WH,Chok KSh.Strategies to increase the resectability of hepatocellular carcinoma.World J Hepatol,2015,7:2147-2154.DOI:10.4254/wjh.v7.i18.2147.
4 吕文平,周开伦,李杰,等.晚期小肝癌的临床预测因素及肝切除术预后研究.解放军医学杂志,2013,38:44-47.DOI:10.3877/cma.j.issn.1674-0785.2013.01.014.
5 肖震宇,陈孝平,黄志勇,等.腹腔镜下应用新型微波刀切除肝癌20例报告.中国微创外科杂志,2005,5:9-10.DOI:10.3969/j.issn.1009-6604.2005.11.002.
6 赵超尘,岑钧华,王晓明,等.微波止血分离器在腹腔镜肝切除术中的应用.中国普通外科杂志,2015,24:84-87.DOI:10.3978/j.issn.1005-6947.2015.01.016.
8 张一超,夏骏,李雄.肝硬化合并肝癌及单纯肝癌病人免疫功能检测结果分析.检验医学,2014,11:1128-1131.DOI:10.3969/j.issn.1673-8640.
9 吴力群,张顺,郭卫东,等.伴有肝硬化门静脉高压症的肝细胞癌病人肝切除术的并发症和预后分析.中华普通外科杂志,2013,28:492-496.DOI:10.3760/cma.j.issn.1007-631x.
10吴志勇,陈炜.肝硬化门静脉高压症及其伴随腹部疾病的外科治疗.中华消化外科杂志,2013,12:814-819.DOI:10.3760/cma.j.issn.1673-9752.
11施文武,游红勇,李兵.不同手术治疗原发性肝癌疗效及其预后影响因素分析.检验医学与临床,2014,11:1191-1194.DOI:10.3969/J.ISSN.1672-9455.2014.09.017.
12耿小平.中晚期肝癌的外科治疗.腹部外科,2000,13:15-17.
13Winbladh A,Björnsson B,Trulsson L,et al.Ischemic preconditioning prior to intermittent Pringle maneuver in liver resections.J Hepatobiliary Pancreat Sci,2012,19:159-170.DOI:10.1007/s00534-011-0402-9.
14Franchello A,Gilbo N,David E,et al.Ischemic preconditioning (IP) of the liver as a safe and protective technique against ischemia/reperfusion injury (IRI).Am J Transplant,2009,9:1629-1639.DOI:10.1111/j.1600-6143.2009.02680.x.
15Li M,Zhang C,Zhang T,et al.Outcome using selective hemihepatic vascular occlusion and Pringle maneuver for hepatic resection of liver cavernous hemangioma.World J Surg Oncol,2015,13:267.DOI:10.1186/s12957-015-0680-9
16Tong Y,Yang JM,Lai EC,et al.Complete hemihepatic vascular exclusion versus pringle maneuver for liver resection:a comparative study.Hepatogastroenterology,2011,58:1307-1311.DOI:10.5754/hge10639
17Batignani G.Hilar plate detachment and extraglissonian extrahepatic anterior approach to the right portal pedicle for right liver resections.J Am Coll Surg,2000,190:631-634.DOI:10.1016/S1072-7515(00)00254-4.
18Li X1, Liang P.Immunotherapy for hepatocellular carcinoma following thermal ablation.J Buon,2014,19:867-871.DOI:10.1007/s00261-004-0255-7.
19Chen Z,Shen S,Peng B,et al.Intratumoural GM-CSF microspheres and CTLA-4 blockade enhance the antitumour immunity induced by thermal ablation in a subcutaneous murine hepatoma model.Int J Hyperthermia,2009,25:374-382.DOI:10.1080/02656730902976807.
20Gravante G,Sconocchia G,Ong SL,et al.Immunoregulatory effects of liver ablation therapies for the treatment of primary and metastatic liver malignancies.Liver Int,2009,29:18-24.DOI:10.1111/j.1478-3231.2008.01915.x.
Application of microwave hemostatic device in hepatectomy of liver cancer with hilar plate dissection
XiaoZhenyu,WanChun,YangFan,TongBing,HuangZhiyong.
DepartmentofGeneralSurgery,TongjiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China
XiaoZhenyu,Email:xiaozhenyu58@163.com
Objective To evaluate the applied value of microwave hemostatic device in hepatectomy of liver cancer with hilar plate dissection.Methods The clinical data of 70 patients with liver cancer undergoing hepatectomy with microwave hemostatic device (HeSetor) from 2010 to 2012 were retrospectively analyzed and compared with 40 patients with liver cancer undergoing conventional hepatectomy. The technique of focal hepatic vascular clamping with hilar plate dissection was adopted during all the operations in the group of using HeSetor. In the control group of conventional hepatectomy, traditional Pringle maneuver and clamp crushing method was adopted.Results All the hepatectomies of both groups were successfully completed. In the HeSetor group, the average operative time was 115.4±42.3 min and average intraoperative blood loss was 120±105.2 mL. No patients were given blood transfusion during operations. The liver function returned to the normal level within 6.3±2.7 days. The incidence rate of post-operative complications was 15.7% (11/70), 5 cases suffered from hydrothorax, and 6 cases from ascites. The mean length of postoperative hospital stay was 6.4±3.5 days. In the control group, the average operative time was 169.1±86.5 min and average intraoperative blood loss was 360.5±153.1 mL. Three patients were given blood transfuion during operations. The liver function returned to the normal level within 9.1±5.6 days. The incidence rate of post-operative complications was 30.0% (12/40), 5 cases suffered from hydrothorax, 5 cases from ascites, and 2 cases from bile leakage. The mean length of postoperative hospital stay was 11.1±6.3 days (P<0.05).Conclusions Microwave hemostatic device was safe and feasible in hepatectomy of liver cancer with hilar plate dissection. This technique can provide the advantages of facility with convenience, easily handling and rapid recovery, which deserves further clinical applications.
Hepatectomy; liver cancer; Hemostatic techniques; Microwave
430030 武汉,华中科技大学同济医学院附属同济医院普外科(肖震宇、杨藩、童兵、黄志勇);河南省南阳市中心医院普外科(万春)
肖震宇,Email:xiaozhenyu58@163.com
R735.7
A [DOI] 10.3969/j.issn.1003-5591.2016.02.006
黄志强.肝脏外科技术的发展.消化外科,2002,1:1-6.
10.3760/cma.j.issn.1673-9752.
2015-08-13)

