口虾蛄高血糖激素基因全长cDNA的克隆及表达分析
刘海映,张秀芹,隋宥珍,李宏俊,邢坤*,姜玉声,杨贵福,陈雷,张娜
(1.大连海洋大学 辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁 大连116023; 2.国家海洋环境监测中心,辽宁 大连 116023; 3.大连海洋大学 农业部北方海水增养殖重点实验室,辽宁 大连 116023)
口虾蛄高血糖激素基因全长cDNA的克隆及表达分析
刘海映1,张秀芹1,隋宥珍1,李宏俊2,邢坤1*,姜玉声3,杨贵福1,陈雷1,张娜1
(1.大连海洋大学 辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁 大连116023; 2.国家海洋环境监测中心,辽宁 大连 116023; 3.大连海洋大学 农业部北方海水增养殖重点实验室,辽宁 大连 116023)
摘要:本文首次采用RACE技术获得口虾蛄(Oratosquilla oratoria)眼柄部高血糖激素(crustacean hyperglycemic hormone,CHH)基因cDNA全长序列,共2 421 bp,5′UTR长度为180 bp,3′UTR 为1 821 bp,开放阅读框(ORF)长420 bp,编码139个氨基酸。预测蛋白二级结构α-螺旋23.74%,延伸链占23.02%,无规则卷曲占53.24%,预测分子量为15.47 kD,等电点(pI)为7.049。CHH成熟肽包含6个CHH家族中位置保守的Cys残基,C端为GK,推断为ES型CHH基因。聚类分析表明:口虾蛄CHH和十足目CHH聚为同一个分支的两亚群,具有较近的亲缘关系。荧光定量PCR分析结果表明,CHH基因在肠中表达量最高,在眼柄、触角中有较高的表达量,在肌肉中表达量相对较低,在卵巢中表达最低,而在精巢中不表达。
关键词:口虾蛄;高血糖激素CHH;分子克隆;荧光定量PCR;表达分析
1引言
高血糖激素(crustacean hyperglycemic hormone,CHH)是甲壳动物眼柄中含量丰富且研究最多的激素,由眼柄X器官-窦腺复合体合成和分泌,在甲壳类动物的生长、繁殖和蜕皮等生理过程中具有重要作用[1—2]。与高血糖激素协同调控作用的CHH家族神经多肽激素还包括蜕皮抑制激素(molt-inhibiting hormone,MIH)、性腺抑制激素(gonad-inhibiting hormone,GIH)和大颚器抑制激素(mandibular organ-inhibiting hormone,MOIH)等,这些神经多肽激素氨基酸序列具有较高的相似性。CHH基因不仅对甲壳类动物蜕皮和生殖起重要作用,同时还参与了调控甲壳动物的能量代谢、血糖调节和渗透压调节等重要生理活动[3—7]。甲壳动物高血糖激素神经肽由信号肽,相关肽(precursor-related peptide,CPRP),二盐基切割位点(KR或RR),成熟肽72-74氨基酸和C端酰氨化封阻位点组成[6,8]。根据相关肽基因序列(CPRP)的有无可以将CHH家族神经肽分为CHH与MIH/GIH/MOIH两个亚族,即CHH Ⅰ族与CHH Ⅱ族。目前,CHH基因已相继在日本沼虾(Macrobrachiumnipponense)[9]、美洲螯龙虾(Homarusamericanus)[10]、中华绒螯蟹(Eriocheirsinensis)[11]、斑节对虾(Penaeusmonodon)[12]、刀额新对虾(Metapenaeusensis)[13]、红斑青蟹(Callinectessapidus)[14]等多种甲壳类动物中克隆,同时CHH基因的分子结构和组织表达等方面也被深入地研究[9,14]。然而,这些工作在虾蟹的研究多以十足目物种为研究对象,且CHH基因在甲壳动物中的进化关系至今尚不清楚。因此,有必要对包括口足目在内的甲壳动物CHH基因序列特性进行研究,为探甲壳动物生长、繁殖相关基因的功能演化提供重要依据。
口虾蛄(Oratosquillaoratoria)俗称虾爬子,隶属于节肢动物门(Arthropoda)、甲壳纲(Crustacea)、软甲亚纲(Eumalacostraca)、口足目(Stomatopoda)、虾蛄科(Squillidae)、口虾蛄属(Oratosquilla)。口虾蛄作为我国沿海地区重要的海产经济甲壳类渔业资源,其经济价值高。国内外关于口虾蛄分子生物学的研究主要集中在遗传多样性分析等方面[15—17],对口虾蛄功能基因的报道很少[18],而口虾蛄CHH基因的功能性研究目前尚未见报道。本文以口虾蛄为实验材料,采用cDNA末端快速扩增(RACE)方法克隆CHH基因全长cDNA序列,对CHH基因在口虾蛄不同组织中表达规律进行荧光定量分析,旨在为口虾蛄蜕皮等相关功能研究和作用机制奠定基础,同时为其他甲壳类动物CHH家族基因的功能研究提及进化机制提供参考。
2材料与方法
2.1材料
2.1.1实验虾蛄
口虾蛄来自大连近岸水域,取性腺发育成熟的雌雄个体,体长范围为10.5~16.0 cm,在实验室控温循环水槽中暂养1周,水温维持在25℃,pH 8.2,持续充气,每天投喂新鲜菲律宾蛤仔(Ruditapesphilippinarum)两次。
2.1.2试剂和仪器
3′-Full RACE Core Setwith PrimeScriptTMRTases试剂盒、5′-Full RACE Core Setwith PrimeScriptTMRTases试剂盒、PrimeScript RT reagent Kit with gDNA Eraser、SYBR Premix Ex Taq(Tli RNaseH Plus)均购自Takara;pEASY-T1载体、感受态细胞Trans5αChemically Competent Cell(TransGen Biotech);动物总RNA快速抽提试剂盒、全血总RNA快速抽提试剂盒、AXYGEN 柱式凝胶回收试剂盒、去RNA酶离心管等均来自Sangon Biotech;PCR引物由Sangon Biotech合成。实验所用仪器包括微型离心机(日本TOMY),紫外分光光度计(Eppendorf BioPhotometer),梯度PCR扩增仪(Eppendorf Autherized Thermal Cycler),凝胶成像系统(UVPEC3 Imaging System);荧光定量PCR仪(TaKaRa Code TP700)。
2.2方法
2.2.1总RNA提取与cDNA的合成
口虾蛄总RNA的提取,实验设置3个平行样本,每个样本挑选3只活力好的成体口虾蛄,分别提取血淋巴、眼柄、触角、肌肉、精巢、卵巢、脑和肠道8个组织的总RNA。抽取血液3 mL,采用全血总RNA快速抽提试剂盒提取总RNA;取眼柄6只(约25 mg),剥离色素组织后迅速溶入液氮,按照动物总RNA快速抽提试剂盒提取总RNA,其他组织总RNA的提取同眼柄。采用1.2%琼脂糖凝胶电泳检测各组织总RNA的完整性,并通过紫外分光光度计测定OD260和OD280值,检验总RNA纯度及浓度。眼柄总RNA按照Full RACE Core Setwith PrimeScriptTMRTases试剂盒说明书进行反转录,-20℃保存,用于后续CHH基因cDNA全长序列的克隆;按照PrimeScript RT reagent Kit with gDNA Eraser试剂盒说明书进行反转录,-20℃保存,以备于不同组织的表达荧光定量PCR检测。反转录体系为:总RNA为10 μL、5×PrimeScript buffer 2 (for Real Time) 4 μL、PrimeScript RT Enzyme MixⅠ 1 μL、RT Primer mix 1 μL、RT Primer mix 1 μL、RNase Free dH2O 4 μL。反应条件:37℃ 15 min,85℃ 5 s。
2.2.2口虾蛄CHH基因全长的克隆
通过Blast搜索,利用口虾蛄肌肉组织转录组文库筛选出的CHH基因部分序列,采用Primer 5.0软件设计3′RACE特异性引物(CHH3-1和CHH3-2)并合成(表1)。根据3′-Full RACE试剂盒说明书,以口虾蛄眼柄cDNA为模板扩增CHH基因cDNA的3′端序列。Outer PCR反应条件:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸60 s,20个循环;72℃最后延伸10 min;反应体系25 μL。Inner PCR 反应条件:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸60 s,30个循环;72℃最后延伸10 min;反应体系50 μL。Inner PCR产物经1.2%琼脂糖凝胶电泳检测,切胶回收DNA后,与pEASY-T1载体连接,然后转化到感受态大肠杆菌中,37℃孵育1 h后接种LB固体培养基,37℃过夜培养,随机挑取阳性单克隆菌落于LB液体培养基,37℃摇床中培养9 h,取3个平行菌液各1 mL,送往北京六合华大基因科技股份有限公司测序,并采用NCBI中Blastx软件对3′端cDNA序列进行同源性分析。
根据已得CHH基因3′端cDNA序列结合口虾蛄肌肉组织转录组文库,利用Primer 5.0软件设计5′RACE特异性引物(CHH-5)(表1),并根据5′-Full RACE试剂盒说明书扩增CHH基因cDNA的5′端序列。反应循环数为25,其他条件同上。
2.2.3序列拼接和分析。
应用ContigExpress软件将3′端和5′端序列进行拼接后得到口虾蛄CHH基因全长cDNA序列。在NCBI中ORF寻找开放阅读框并翻译出相应的氨基酸序列,通过GOR方法在线预测对CHH蛋白进行结构域分析;利用SignaP 4.0软件进行信号肽预测;使用ClustalX软件及DNAStar软件包中的MegAlign软件对蛋白序列作比对及同源性分析,并用MAGE4.0软件对甲壳动物CHH氨基酸序列进行NJ(Neighbour-Joining法)系统进化树构建[19—20]。
2.2.4实时荧光定量表达分析
根据获得的CHH基因全长cDNA序列设计荧光定量特异引物CHH-F和CHH-R,由宝生物工程(大连)有限公司设计合成内参引物Actb-F和Actb-R(表1)。分别将3个平行样本反转录得到的cDNA混合作为模板。RT-PCR反应体系为25 μL:上下游引物各1 μL,12.5 μL的SYBR Premix Ex Taq Ⅱ (Tli RNaseH Plus)(2×),8.5 μL的dH2O模板cDNA 2 μL(总量50 ng)。PCR反应条件(两步法):95℃预变性30 s;95℃变性5 s,60℃延伸30 s,40个循环。对各样品的目的基因和管家基因(Actb)分别做3个重复,同时做3个不加cDNA模板的阴性对照重复,反应条件同上。
应用SYBR Green Ⅰ荧光染料嵌合法,将管家基因作为内参基因,分别对各样品的管家基因和目的基因进行定量,将眼柄CHH基因mRNA的表达量设定为1,用2-ΔΔCt法计算目的基因mRNA在不同组织中的相对表达量。

表1 口虾蛄CHH基因克隆和荧光定量PCR所用的引物及其序列
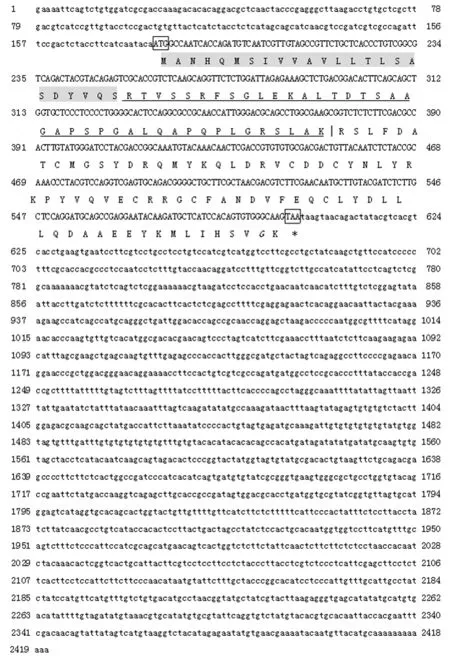
图1 口虾蛄CHH cDNA序列及其编码的氨基酸序列Fig.1 Nucleotide and deduced amino acid sequences of Oratosquilla oratoria CHH cDNAs阴影部分表示信号肽;下划线表示CHH前体相关肽;二盐基切割位点用竖线(|)表示;潜在的酰胺化位点(Gly138)用斜体表示;“*”表示终止密码子Signal peptide is shaded;CHH-precursor related peptide is underlined;the vertical line(|)indicates the dibasic cleavage site(KR);the putative amidation site(Gly138)is italic;the asterisk indicates stop codon
3结果和分析
3.1CHH基因全长cDNA的克隆
采用3′RACE和5′RACE获得1 969 bp的3′端片段以及751 bp的5′端片段,两端重叠部分的碱基包含292 bp。经ContigExpress软件拼接后得到2 421 bp CHH基因cDNA序列全长,包括180 bp 5′UTR,420 bp的ORF和终止密码子,1 821 bp的3′UTR,3′端非编码区没有加尾信号,但具有典型的Poly(A)尾(图1)。
3.2CHH基因序列生物信息学分析
开放阅读框编码129个氨基酸,用DNAMAN软件分析得到该CHH蛋白分子量为15.47 kD,理论等电点pI为7.049,碱性氨基酸15个,酸性氨基酸15个,疏水性氨基酸46个,极性氨基酸44个。GOR方法在线预测CHH蛋白质的二级结构,该蛋白由α-螺旋23.74%,延伸链23.02%,无规则卷曲53.24%组成。
Signal 4.0 Server在线预测,口虾蛄CHH前体信号肽的切割位点在Ser24和Arg25之间,同时发现CHH前体相关肽(CPRP)和成熟肽连接位点即二盐基切割位点是“K64R65”。由此可知,CHH前体包含信号肽(24个Aa)、CPRP(39个Aa)、二盐基切割位点KR和成熟肽(74个Aa),且在成熟肽部分第12个氨基酸位上没有CHH家族Ⅱ型肽所特有的Gly残基。成熟肽包含在CHH家族中6个半胱氨酸Cys残基(Cys72,Cys88,Cys91,Cys104,Cys108,Cys117)和5个保守的氨基酸残基(Arg78,Asp90,Asn93,Arg96,和Phe114),N末端没有焦谷氨酸残基封阻,但C端具有潜在的酰氨化封阻位点Gly138(图2)。

图2 口虾蛄CHH前体与其他十足目甲壳动物CHH前体的氨基酸序列比对Fig.2 Alignment of precursor amino acide sequence of Oratosquilla oratoria CHH with other decapod crustacean prepro-CHHs竖线“┃”表示信号肽和二盐基的切割位点;灰色部分为保守氨基酸The single peptide and dibasic cleavage sites are indicated by the vertical line “┃”;signal with grey is conservative amino acids

图3 口虾蛄CHH成熟肽与其他甲壳动物MIH前体的氨基酸序列比Fig.3 Multiple alignments of Oratosquilla oratoria CHH with MIHs from other crustaceans灰色部分为保守氨基酸;绿色部分是MIH基因特有的氨基酸Signal with grey is conservative amino acid and green is the specific amino acids of MIH
3.3序列比对分析及系统进化树构建
采用RACE技术从口虾蛄眼柄中获得了CHH基因cDNA全长,将该基因及其编码的氨基酸序列与已公布的虾蟹类CHH、MIH和GIH序列(表2)比对,结果表明(图2、图3b和表3):推导的前体与寄居蟹(Pagurusbernhardus)CHH的同源性最高,达到了47%;其次是与日本沼虾CHH和挪威海螯虾(Nephropsnorvegicus)CHHA前体相似(44%);与其他虾蟹的CHH前体、MIH前体和GIH前体同源性相对较低(34%~43%、30%~33%和22%~30%)。口虾蛄CHH成熟肽同样与寄居蟹CHH的同源性最高(59%),而与铠甲虾(Galatheastrigosa)CHH的相似性达到58%;与挪威海螯虾CHHA、挪威海螯虾CHHB和欧洲鳌龙虾(Homarusgammarus)CHHA的成熟肽相似性均达57%,与其他虾蟹类的同源性为46%~55%。
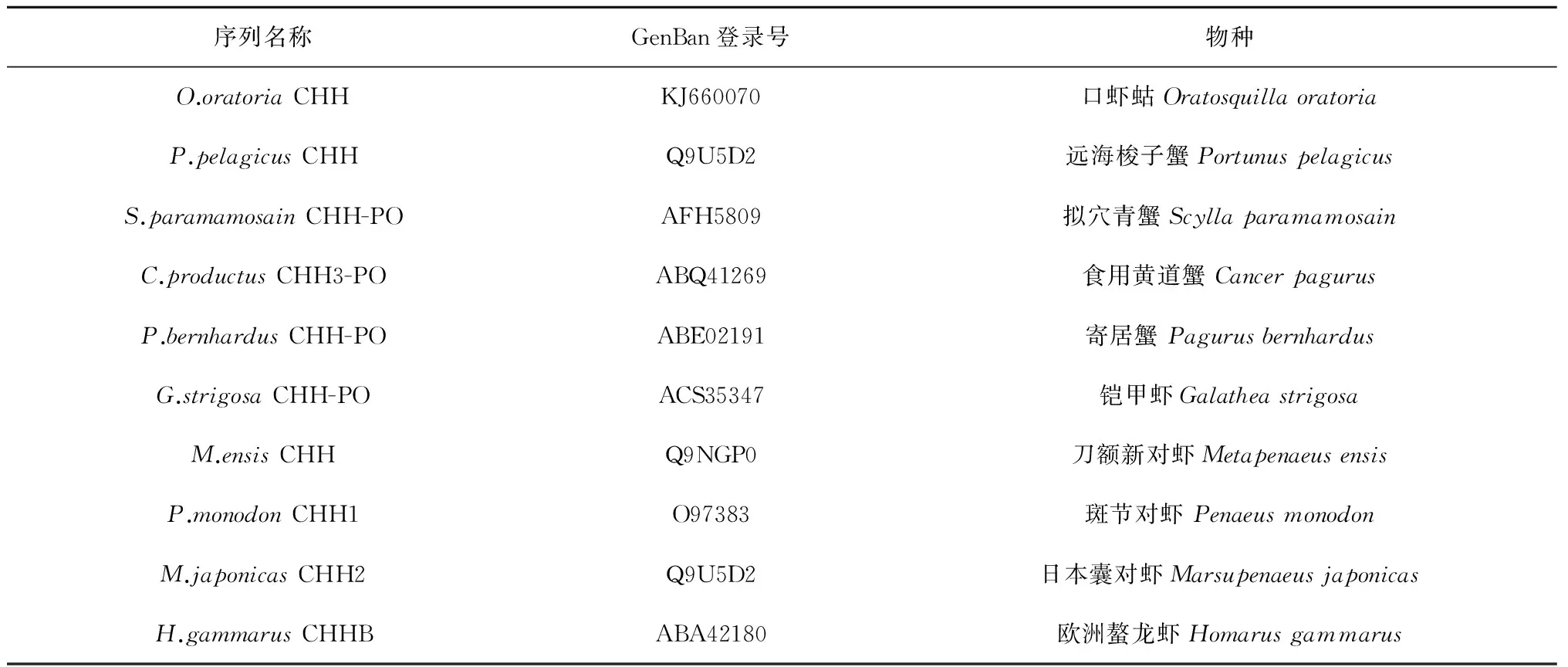
表2 用于比对的甲壳动物CHH/MIH/GIH
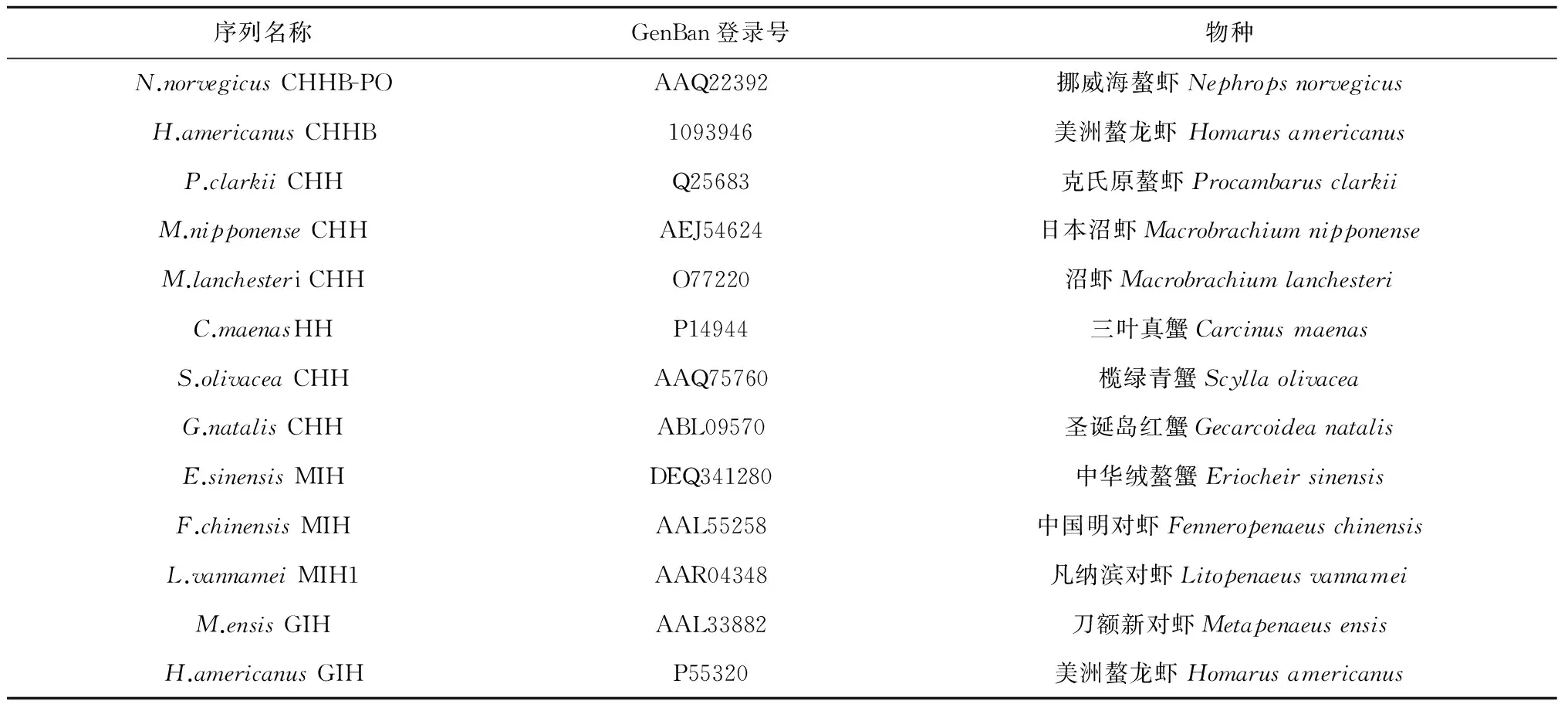
续表2

表3 口虾蛄CHH与其他十足目CHH/MIH成熟肽和前体的相似性
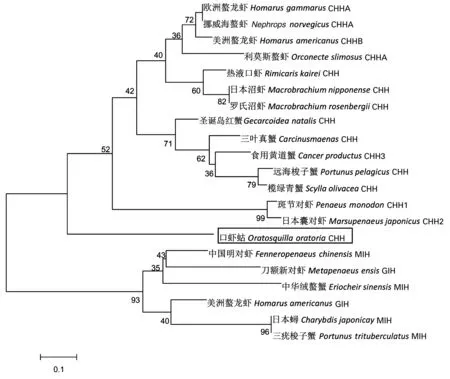
图4 口虾蛄与其他甲壳动物CHH前体的NJ系统进化树Fig.4 Neighbor-Joining phylogenetic tree analysis of Oratosquilla oratoria and other crustaceans preproCHH
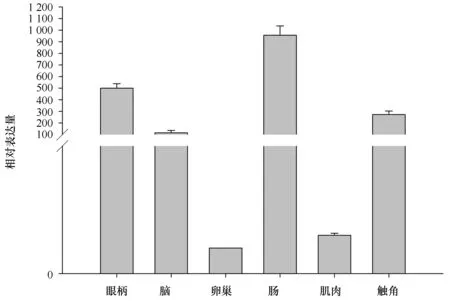
图5 RT-PCR方法检测CHH基因在口虾蛄不同组织内的表达Fig.5 Expressions of CHH mRNA in different tissues of Oratosquilla oratoria by RT-PCR
使用MEGA4.0软件构建NJ系统进化树(图4),结果表明CHH家族中的MIH、CHH和GIH氨基酸序列聚为2个不同的亚类,其中GIH和MIH聚为一亚类,CHH单独聚为一亚类,这与CHH家族成员的分组相一致。另外,CHH组又聚成2个分支,其中口虾蛄CHH为一分支,而十足目虾蟹类的CHH聚为另一分支。
3.4口虾蛄CHH基因的组织表达分析
采用荧光定量 PCR 技术检测CHH基因在口虾蛄体内不同组织的表达情况。实验对于每个组织CHH基因及管家基因分别做3个重复(图5)。结果显示,口虾蛄CHH基因除了在在精巢中没有表达外,在所检测的其它组织中均有表达,其表达量由高到低依次为肠、眼柄、脑、肌肉和卵巢。若将卵巢表达量设为1,肠中含量最高,为卵巢的1 033.67倍;其次眼柄的表达量为卵巢的531.23倍,触角组织的表达量为卵巢的295.07倍;在脑的表达量为卵巢的115.6倍;在肌肉中的表达量较低,仅为卵巢的1.67倍。
4讨论
4.1口虾蛄CHH序列特征
甲壳动物CHH神经肽激素家族的蛋白质组成包括72~78个氨基酸的高度保守序列[21—22]。同源基因序列比对结果表明(图2),口虾蛄CHH前体序列与其他甲壳动物CHH氨基酸序列结构一致,前体包括信号肽的24个氨基酸、成熟肽的74个氨基酸,还有CHH家族Ⅰ型神经肽所特有的CHH前体相关肽,以及二盐基切割位点KR。其信号肽的切割位点在Ser24和Arg25之间,这与其他虾蟹类CHH的信号肽切割位点相对位置一致[9]。成熟肽具有6个保守的Cys残基和5个保守的氨基酸残基(Arg78、Asp90、Asn93、Arg96、Phe114),6个保守的半胱氨酸残基间形成3个二硫键,推测这些高度保守的结构位点可能与其基本生理功能作用密切相关。从以上的序列结构特征分析可以得出该序列为口虾蛄的CHH cDNA序列,口虾蛄CHH成熟肽N末端虽没有焦谷氨酸残基封阻,但具有酰氨化封阻位点GK,推导为ES型CHH基因。
口虾蛄CHH和其他十足目虾蟹MIH的氨基酸序列相比对(图3),结果发现:成熟肽氨基酸序列相似性相对较低,且在成熟肽部分第12个氨基酸位上没有CHH家族Ⅱ型神经肽(MIH,GIH)所特有的Gly残基,但其高度保守的氨基酸都集中在6个半胱氨酸残基周围。系统发育树中也可以看出,CHH与MIH和GIH距离较远,如此表明,它们虽然同处一个家族中,但氨基酸的组成不同,且在序列长度上也存在很大差异的。目前,在黑背陆地蟹(Gecarcinuslateralis)[23]和利莫斯螯虾(Orconecteslimosus)[24]的CHH具有抑制蜕皮的作用,由于CHH分子的空间结构与MIH存在一定的相似性,据此引起CHH与Y器官表面受体发生特异性结合,从而抑制了蜕皮活动。在日本囊对虾MIH基因结构的研究中,Katayama等曾指出,成熟肽第72位点上的氨基酸(Ile)对于MIH的活性至关重要[25],但是在口虾蛄以及十足目虾蟹的CHH成熟肽中第72位点上的氨基酸是Val。经分析可知,Val与Ile都属于非极性氨基酸,因此推测口虾蛄CHH成熟肽72位点上氨基酸(Val)很可能是行使抑制蜕皮功能的重要位点[11]。
4.2口虾蛄 CHH 系统进化
系统进化显示整个CHH系统发育树口虾蛄CHH基因与十足目虾蟹类的CHH为同一个分支的2个亚组,然后与十足目虾蟹类的MIH、GIH聚为一簇,口虾蛄CHH与MIH、GIH进化关系相对较远。由图3可知,十足目虾蟹类的CHH又分为枝鳃亚目(M.ensis,P.monodon)和腹胚亚目2支,其中腹胚亚目虾蟹类的CHH分为2个亚群:螯虾下目(H.gammarus,H.americanus,O.limosus)、龙虾下目(N.norvegicus)、真虾下目(M.lanchesteri,M.nipponense)的CHH属于一个亚群,短尾下目(C.maenas,C.productus,S.olivacea,P.pelagicus,G.natalis)的CHH则属于另一个亚群,这些物种的CHH基因的进化关系与甲壳动物分类系统一致[26]。进化分析表明氨基酸序列同源性较高的物种间CHH基因功能类似[6]。此外,大多数虾蟹的CHH形成各自下目的分支结构,表明CHH基因序列的演变可能随着不同门类甲壳动物的独自进化后产生。
在十足目虾蟹CHH 的进化分支中有5处booststrap值低于50%,这可能是由于参考比对的物种均属于不同下目分类,如日本沼虾、罗氏沼虾、热液口虾属于真虾下目,而螯龙虾、利莫斯螯虾属螯虾下目,挪威海螯虾属于龙虾下目。研究发现,CHH家族神经多肽激素CHH的系统演化与口虾蛄的酚氧化酶(proPO) 氨基酸序列在甲壳动物中聚类分析结果一致[18]。随着越来越多的甲壳动物CHH基因序列全长被克隆,更为全面和准确的系统发育分析将成为可能。
4.3CHH基因组织表达差异
CHH是甲壳动物眼柄器官中含量丰富且研究最多神经肽激素。在斑节对虾[12]和罗氏沼虾[27]的眼柄中均检测到大量的CHH神经肽,而在红斑青蟹眼柄神经节中也检测出很高的CHH基因表达量[14],在其它甲壳动物以眼柄为中心的中枢系统中CHH基因表达量均较高。其他组织中CHH基因的表达情况因物种不同存在差异,如拟穴青蟹和日本蟳肠、肝胰腺组织中CHH基因均有较高表达,而日本沼虾肠、肝胰腺组织中CHH基因表达量均较低[9,28—29]。在对日本沼虾CHH基因表达荧光定量检测中发现,CHH基因在眼柄中的表达量最高,精巢次之,在卵巢中的表达量最低,作者推测CHH基因可能与雄性生殖过程相关[9];在日本蟳CHH基因表达荧光定量检测中,CHH基因在精巢中也有较高表达,作者同样认为CHH可能与甲壳动物雄性发育密切相关[29]。本文研究结果表明,CHH基因在口虾蛄精巢中不表达,分析可能原因有二:一方面与物种本身存在差异有关,如通过半定量检测CHH基因在三疣梭子蟹(Portunustrituberculatus)各组织中表达情况,结果表明,在CHH基因在XO-SG、胸神经节、腹神经节、Y 器和肠中表达,而在视网膜、心、精巢、卵巢、肌肉、脑、腮和肝胰腺等组织中不表达[30]。另一方面与CHH存在多种构型现象有关,如罗氏沼虾眼柄中存在两种CHH cDNA构型,分别为CHH与CHH-Ⅰ。CHH构型含有3个外显子(Ⅰ、Ⅱ和Ⅳ),只在眼柄当中表达;而CHH-Ⅰ构型则含有全部4个外显子,并且可以在心脏、腮、触角腺和胸神经节当中检测到。这一结果表明,CHH基因在转录过程中不同的剪接方式可以导致产生不同的CHH构型,进而翻译成不同构型的CHH多肽,在不同组织发挥多种生理功能[31],比如Choi等[14]克隆了红斑青蟹眼柄的CHH-1基因及类CHH激素源前体基因,发现CHH-1基因仅在眼柄神经中枢中表达,而类CHH激素源前体基因在胸神经节、腹神经节、脑中表达,而在眼柄神经中枢中不表达。在以后的研究中,可对不同繁殖时期口虾蛄CHH基因组进行研究,以分析CHH cDNA不同构型,从而探讨该基因不同组织表达特异性机制。
5结论
本研究首次克隆得到口虾蛄CHH基因全长cDNA序列,并对其氨基酸结构特征进行了同源分析和探讨,结果表明CHH序列相对保守,与其他十足目动物氨基酸序列结构一致。研究结果为口虾蛄CHH多肽相关功能性研究奠定基础,同时也为其他甲壳类动物CHH基因的研究及系统演化提供借鉴。
参考文献:
[1]Liu Lei,Laufer H,Wang Yajun,et al. A neurohormone regulating both methyl farnesoate synthesis and glucose metabolism in a crustacean[J]. Biochemical and Biophysical Research Communications,1997,237(3): 694-701.
[2]Tang Chenhui,Lu Weiqun,Wainwright G,et al. Molecular characterization and expression of mandibular organ-inhibiting hormone,a recently discovered neuropeptide involved in the regulation of growth and reproduction in the crab Cancer pagurus[J]. Biochemical Journal,1999,343(2): 355-360.
[3]Keller R. Crustacean neuropeptides: structures,functions and comparative aspects[J]. Experientia,1992,48(5): 439-448.
[4]蔡生力. 甲壳动物内分泌学研究与展望[J]. 水产学报,1998,22(2): 154-161.
Cai Shengli. A review of crustacean endocrinology[J]. Journal of Fisheries of China,1998,22(2): 154-161.
[5]De Kleijn D P V,Van Herp F. Molecular biology of neurohormone precursors in the eyestalk of Crustacea[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology,1995,112(4): 573-579.
[6]Lacombe C,Grève P,Martin G. Overview on the sub-grouping of the crustacean hyperglycemic hormone family[J]. Neuropeptides,1999,33(1): 71-80.
[7]杨济芬,朱冬发,沈建明,等. 甲壳动物高血糖激素家族生理功能研究进展[J]. 动物学杂志,2009,44(1): 151-158.
Yang Jifen,Zhu Dongfa,Shen Jianming,et al. Physiological significance of crustacean hyperglycemic hormone family[J]. Chinese Journal of Zoology,2009,44(1): 151-158.
[8]Keller R. Crustacean neuropeptides: structures, functions and comparative aspects[J]. Experientia, 1992, 48(5): 439-448.
[9]金舒博,王宁,乔慧,等. 青虾高血糖激素基因全长cDNA序列的克隆及表达分析[J]. 中国水产科学,2013,20(1): 82-92.
Jin Shubo,Wang Ning,Qiao Hui,et al. Molecular cloning and expression of a full length cDNA encoding crustacean hyperglycemic hormone (CHH) in oriental river pawn (Macrobrachiumnipponense)[J]. Journal of Fishery Sciences of China,2013,20(1): 82-92.
[10]De Kleijn D P V,De Leeuw E P H,Van den Berg M C,et al. Cloning and expression of two mRNAs encoding structurally different crustacean hyperglycemic hormone precursors in the lobsterHomarusamericanus[J]. Biochimica et Biophysica Acta (BBA)-Gene Structure and Expression,1995,1260(1): 62-66.
[11]王艳华,张亦陈,孙妍,等. 中华绒螯蟹高血糖激素基因的克隆和分子结构解析[J]. 水产学报,2013,37(7): 987-993.
Wang Yanhua,Zhang Yichen,Sun Yan,et al. Cloning and molecular structure analysis of crustacean hyperglycemic hormone (Ers-CHH) inEriocheirsinensis[J]. Journal of Fisheries of China,2013,37(7): 987-993.
[12]Wiwegweaw A,Udomkit A,Panyim S. Molecular structure and organization of crustacean hyperglycemic hormone genes ofPenaeusmonodon[J]. Journal of Biochemistry and Molecular Biology,2004,37(2): 177-184.
[13]Gu Peili,Yu Keili,Chan S M. Molecular characterization of an additional shrimp hyperglycemic hormone: cDNA cloning,gene organization,expression and biological assay of recombinant proteins[J]. FEBS Letters,2000,472(1): 122-128.
[14]Choi C Y,Zheng Junying,Watson R D. Molecular cloning of a cDNA encoding a crustacean hyperglycemic hormone from eyestalk ganglia of the blue crab,Callinectessapidus[J]. General and Comparative Endocrinology,2006,148(3): 383-387.
[15]王春琳,母昌考,丁爱侠,等. 口虾蛄(Oratosquillaoratoria)同工酶的组织特异性及生化遗传分析[J]. 海洋与湖沼,2004,35(3): 258-263.
Wang Chunlin,Mu Changkao,Ding Aixia,et al. Tissue specificity and biochemical genetic analysis of isozyme on crustaceanOratosquillaoratoria[J]. Oceanologia et Limnologia Sinica,2004,35(3): 258-263.
[16]宋微微,王春琳,母昌考. 用同工酶和RAPD技术分析黑斑口虾蛄的遗传多样性[J]. 水产科学,2006,25(4): 189-193.
Song Weiwei,Wang Chunlin,Mu Changkao. Genetic diversity in mantis shrimpOratosquillakempiby isozyme and RAPD analysis[J]. Fisheries Science,2006,25(4): 189-193.
[17]黄映萍,王莹,苗素英. 粤东海域口虾蛄遗传多样性[J]. 动物学杂志,2011,46(2): 82-89.
Huang Yingping,Wang Ying,Miao Suying. Genetic diversity analysis of mantis shrimps (Oratosquillaoratoria) from the eastern coast of Guangdong province[J]. Chinese Journal of Zoology,2011,46(2): 82-89.
[18]刘海映,刘连为,姜玉声,等. 口虾蛄proPO基因全长cDNA的克隆与组织表达[J]. 生态学报,2013,33(6): 1713-1720.
Liu Haiying,Liu Lianwei,Jiang Yusheng,et al. Full length cDNA cloning and tissue expression of prophenoloxidase fromOratosquillaoratoria[J]. Acta Ecologica Sinica,2013,33(6): 1713-1720.
[19]Tamura K,Dudley J,Nei M,et al. MEGA4: molecular evolutionary genetics analysis (MEGA) software version 4.0[J]. Molecular Biology and Evolution,2007,24(8): 1596-1599.
[20]Thompson J D,Gibson T J,Plewniak F,et al. The CLUSTAL_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Research,1997,25(24): 4876-4882.
[21]Davey M, Duve H, Thorpe A, et al. Characterisation of the helicostatin peptide precursor gene fromHelicoverpaarmigera(Lepidoptera: Noctuidae)[J]. Insect Biochemistry and Molecular Biology, 1999, 29(12): 1119-1127.
[22]Böcking D,Dircksen H,Keller R. The crustacean neuropeptides of the CHH/MIH/GIH family: structures and biological activities[M]//Wiese K. The Crustacean Nervous System. Berlin Heidelberg: Springer,2002: 84-97.
[23]Lee K J,Doran R M,Mykles D L. Crustacean hyperglycemic hormone from the tropical land crab,Gecarcinuslateralis: Cloning,isoforms,and tissue expression[J]. General and Comparative Endocrinology,2007,154(1/3): 174-183.
[24]Kegel G,Reichwein B,Tensen C P,et al. Amino acid sequence of crustacean hyperglycemic hormone (CHH) from the crayfish,Orconecteslimousus: emergence of a novel neuropeptide family[J]. Peptides,1991,12(5): 909-913.
[25]Katayama H,Ohira T,Nagata S,et al. Structure-activity relationship of crustacean molt-inhibiting hormone from the Kuruma prawnMarsupenaeusjaponicus[J]. Biochemistry,2004,43(30): 9629-9635.
[26]刘瑞玉. 《现生甲壳动物(CRUSTACEAN)最新分类系统》简介[C]//中国甲壳动物学会. 甲壳动物学论文集(第四辑). 北京: 科学出版社,2003: 76-86.
Liu Ruiyu. Introduction of 《An updated classification of the recent CRUSTACEAN》[C]//The Chinese Society of Crustaceans. Transactions of the Chinese Crustacean Society(Ⅳ). Beijing: Science Press,2003: 76-86.
[27]Sithigorngul P,Panchan N,Vilaivan T,et al. Immunochemical analysis and immunocytochemical localization of crustacean hyperglycemic hormone from the eyestalk ofMacrobrachiumrosenbergii[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology,1999,124(1): 73-80.
[28]舒妙安,张龙韬,周宇芳,等. 拟穴青蟹(Scyllaparamamosain)两种 Ⅰ 型高血糖激素基因全长cDNA的克隆及组织表达分析[J]. 海洋与湖沼,2012,43(4): 695-701.
Shu Miaoan,Zhang Longtao,Zhou Yufang,et al. Cloning and expression of two genes encoding type Ⅰ crustacean hyperglycemic hormone family from the mud crabScyllaparamamosain[J]. Oceanologia et Limnologia Sinica,2012,43(4): 695-701.
[29]汤洁,朱冬发,崔晓雨,等. 日本蟳高血糖激素基因的克隆与表达分析[J]. 生物学杂志,2014,31(4): 10-14.
Tang Jie,Zhu Dongfa,Cui Xiaoyu,et al. Cloning and expression analysis of crustacean hyperglycemic hormone (CHH) inCharybdisjaponica[J]. Journal of Biology,2014,31(4): 10-14.
[30]杨济芬. 三疣梭子蟹(Portunustrituberculatus)高血糖激素基因的克隆与分析[D]. 宁波: 宁波大学,2010.
Yang Jifen. Molecular cloning and expression analysis of Crustacean Hyperglycemic Hormone from swimming crab (Portunustrituberculatus)[D]. Ningbo: Ningbo University,2010.
[31]Chen S H,Lin C Y,Kuo C M. Cloning of two crustacean hyperglycemic hormone isoforms in freshwater giant prawn (Macrobrachiumrosenbergii): evidence of alternative splicing[J]. Marine Biotechnology,2004,6(1): 83-94.
Molecular cloning and expression of a full length cDNA of encoding crustacean hyperglycemic hormone(CHH)in Oratosquilla oratoria
Liu Haiying1,Zhang Xiuqin1,Sui Youzhen1,Li Hongjun2,Xing Kun1,Jiang Yusheng3,Yang Guifu1,Chen Lei1,Zhang Na1
(1.KeyLaboratoryofMarineBio-resourcesRestorationandHabitatReparationinLiaoningProvince,DalianOceanUniversity,Dalian116023,China; 2.NationalMarineEnvironmentalMonitoringCenter,Dalian116023,China; 3.KeyLaboratoryofMariculture&StockEnhancementinNorthChina’sSea,MinistryofAgriculture,DalianOceanUniversity,Dalian116023,China)
Abstract:Total RNA in eyestalk of Oratosquilla oratoria was extracted and cDNA sequence of crustacean hyperglycemic hormone (CHH) were obtained by RACE for the first time. The result showed that the full length of the CHH gene is 2 421 bp,containing an 180 bp 5′-untranslated region (UTR),and 1 821 bp 3′UTR,and 420 bp open reading flame (ORF) which encoded 139 amino acids. Prediction of protein structure was composed of 23.74% α-helix,23.02% extension chain,53.24% random coil,and its molecular mass is 15 470 Daltons with an estimated pI of 7.049.The mature peptide contained six conserved Cys residues in CHH family. The C-terminus mature peptide was GK which has the same characteristics with ES-CHH. Based on protein similarity comparison,the separated CHH gene was classified into the type I CHH family of peptides. Phylogenetic analysis showed that CHH of O. oratoria and CHH of decapod species formed two subgroups on the same branch of the tree. The relative expression of CHH gene in different organizations was tested by real time fluorescent quantitative PCR,the expression was highest in the intestine,and then the eyestalk,antenna and brain,the expression is negligible in muscle and ovary,and no expression in testis.
Key words:Oratosquilla oratoria; crustacean hyperglycemic hormone; molecular cloning; RT PCR; expression analysis
收稿日期:2015-07-01;
修订日期:2015-11-30。
基金项目:国家海洋局海洋公益项目(200905019-4); 国家自然科学基金资助项目(41006079)。
作者简介:刘海映(1957—),男,辽宁省大连市人,教授,硕士生导师,主要研究方向为渔业资源增殖。E-mail:hyliu@dlou.edu.cn *通信作者:邢坤(1984—),副教授,山东省临沂市人,主要从事海洋生物学与渔业资源学研究。E-mail:xingkun@dlou.edu.cn
中图分类号:Q71
文献标志码:A
文章编号:0253-4193(2016)06-0098-12
刘海映,张秀芹,隋宥珍,等. 口虾蛄高血糖激素基因全长cDNA的克隆及表达分析[J].海洋学报,2016,38(6):98—109,doi:10.3969/j.issn.0253-4193.2016.06.011
Liu Haiying,Zhang Xiuqin,Sui Youzhen,et al. Molecular cloning and expression of a full length cDNA of encoding crustacean hyperglycemic hormone(CHH)inOratosquillaoratoria[J]. Haiyang Xuebao,2016,38(6):98—109,doi:10.3969/j.issn.0253-4193.2016.06.011

