黄、渤海小黄鱼耳石元素指纹分析及其在种群补充群体识别中的应用
王玉堃,黄建生,戴芳群,唐学玺,孙耀*,金显仕
(1.中国水产科学研究院 黄海水产研究所,山东 青岛 266071;2.中国海洋大学 海洋生命学院,山东 青岛 266003)
黄、渤海小黄鱼耳石元素指纹分析及其在种群补充群体识别中的应用
王玉堃1,2,黄建生1,戴芳群1,唐学玺2,孙耀1*,金显仕1
(1.中国水产科学研究院 黄海水产研究所,山东 青岛 266071;2.中国海洋大学 海洋生命学院,山东 青岛 266003)
摘要:利用电感耦合等离子质谱ICP-MS元素分析方法,测定了黄、渤海125尾小黄鱼的耳石元素指纹图谱,共检测到Mg、Al、Mn、Cu、Zn、Sr、Ba、Ca等8种指纹元素。不同采样站位小黄鱼耳石元素含量均存在显著性差异,线性判别分析可以有效识别不同站位的小黄鱼群体,判别成功率为65%~96%,整体判别成功率为86%。基于耳石元素指纹图谱特征进行聚类分析,可以将黄、渤海小黄鱼早期补充群体划分为渤海种群、黄海中部种群和南黄海种群,其中黄海中部种群站位交叉明显。
关键词:耳石;微化学;小黄鱼;群体识别;种群结构;元素指纹图谱
1引言
耳石(otolith) 是位于硬骨鱼类内耳膜迷路内的一种碳酸钙结晶体,主要成分为碳酸钙和有机质,以及低于1%的微量元素,主要生理功能为感觉、听觉以及平衡作用。耳石中的元素主要来自外界水体环境,这些元素经由鳃或消化道吸收,透过血液的传输进入内淋巴系统,最后才沉积在耳石上。虽然不同元素在水体与耳石中的沉积比例有所差异,但耳石中的大多数元素均能够忠实地反应鱼类生活水体中的微化学组成[1]。目前耳石中可以检测到的元素大约有31种[2],虽然这些微量元素含量不到总量的1%,但却能提供很多环境信息,例如Sr被认为与生境盐度有关[3]。因此,耳石元素指纹图谱可以反演鱼类的生活环境,作为一种天然的地理标记分析不同鱼类种群的差异,应用于鱼类种群的识别研究。
小黄鱼(Larimichthyspolyactis)是我国重要的经济鱼类之一,属石首鱼科,为暖温性、近底层洄游性鱼类,广泛分布于中国沿海和朝鲜半岛西部海域。自20 世纪70 年代以来,由于过度捕捞和环境恶化等因素的影响,小黄鱼资源量逐年减少。20世纪90年代因禁渔区、禁渔期和伏季休渔措施的有效实施,小黄鱼资源量又出现了明显上升,但与此同时,其生活史型也发生了个体小型化、性成熟提早、渔获物以幼鱼为主等巨大的变化[4]。鉴于小黄鱼在我国海洋渔业中的重要地位及其资源量的显著变化现象,小黄鱼一直是重点研究鱼种。近年来,国内学者在小黄鱼生物学特性、资源变动、产卵洄游以及分子遗传等方面进行了诸多研究[5—9],但关于小黄鱼耳石元素指纹分析的研究还较少,也尚未见利用耳石元素指纹图谱研究鱼类种群结构的相关报道。本研究在此尝试进行一些该方面的探讨和分析,采用ICP-MS技术对黄、渤海小黄鱼全耳石微化学组成进行测定,研究耳石元素指纹分析对不同采样站位小黄鱼群体的识别能力,并基于耳石元素指纹图谱探讨了小黄鱼早期补充群体的种群结构,以期从多方面了解小黄鱼的种群结构,为小黄鱼种群的研究提供了新的方法和途径,也为小黄鱼的资源保护及合理开发利用积累基础资料。
2材料与方法
2.1样本采集与处理
2012年8—9月在渤海(葫芦岛)和黄海(大鱼岛、青岛、海州湾、大洋港)近岸海域由当地渔船采用单桩张网渔具捕获小黄鱼(图1)。小黄鱼样品冷藏后带回实验室测量其标准体长(0.01 mm),并摘取耳石。本研究中采用的为体积较大的矢耳石,所摘取的矢耳石处理方法参照Correia 等[10],将耳石经30%的H2O2溶液浸泡30 min后,用Milli-Q水超声清洗3次,清除耳石上附着的包膜和其他有机质,自然晾干后置于离心管保存。
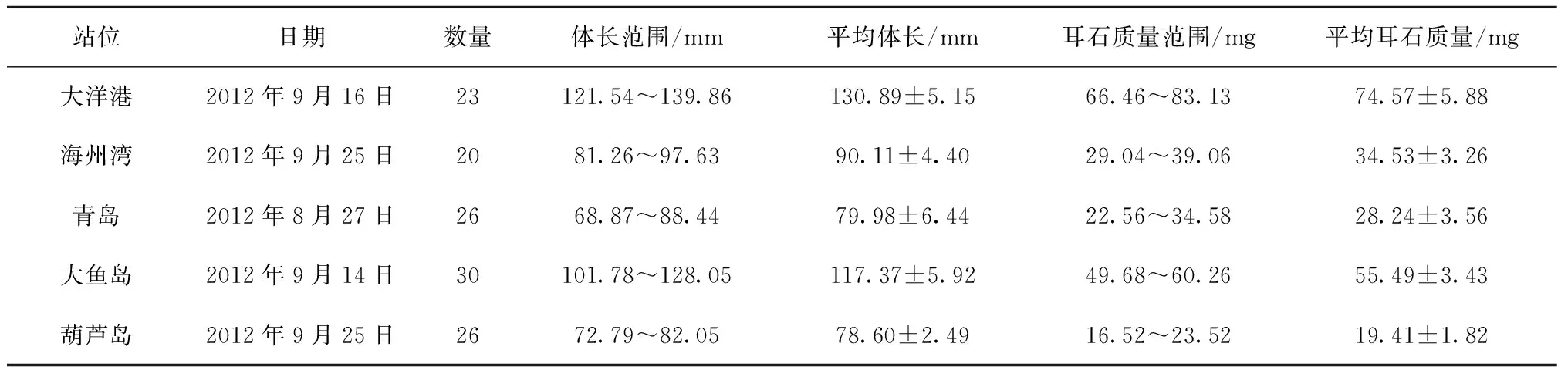
表1 小黄鱼采集样品信息
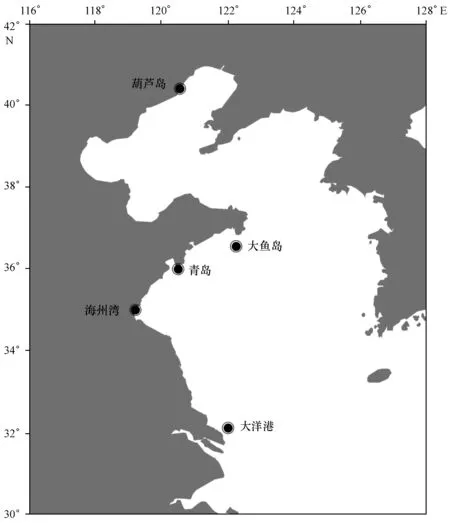
图1 采样站位Fig.1 Sampling sites
2.2耳石元素指纹分析
采用激光溶蚀等离子质谱ICP-MS测定全耳石的元素指纹,采用中国水产科学研究院黄海水产研究所水产品安全与质量检测研究室d Elan DRC Ⅱ型(Perkin-Elmer公司)ICP-MS进行测定。4次重复测定,用外标法进行定量,多元素校正标准溶液由100 mg/L单个元素标准溶液(NSI公司),逐级稀释而成,工作溶液介质为2% HNO3。以In为内标检验仪器的稳定性。内标元素和校正标准溶液元素的相对标准偏差(relative standard deviation,RSD)小于5%,样品元素的RSD小于8%。样品测定方法参照Correia等[10],将耳石用1% HNO3溶液浸泡10 s,以清除耳石表面污染物,用Milli-Q水超声清洗耳石3次,除尽残留酸溶液和其他杂质,将清洗完毕的耳石转移至干净离心管,加入1 mL超纯硝酸溶液(Sigma公司)溶解15 min,用Milli-Q水将溶液稀释至10 mL。根据预实验结果,可以检测耳石样品中24Mg、27Al、42Ca、55Mn、63Cu、66Zn、88Sr和137Ba等8种元素的含量。检测到的Mg、Al、Mn、Cu、Zn、Sr和Ba元素含量均转换为其与钙元素浓度的摩尔比值(trace element/Ca ratios)作进一步的数理统计分析[11]。
2.3数据分析
由于耳石中Ca含量远高于其他元素含量,按国际惯例将各元素含量标准化,即转换为各元素与Ca元素比值(mmol/mol)。
运用R软件对数据进行单变量方差分析(ANOVA)、协方差分析(ANCOVA,耳石质量为协变量)、多变量方差分析(MANOVA)和逐步线性判别分析(stepwiselinear discriminant function analysis,LDFA),并应用多维定标(multidimensional scaling,MDS,Euclidean distance)对5个站位的小黄鱼群体进行聚类分析,P<0.05为有统计学意义。
3结果
3.1不同采样站位小黄鱼耳石元素指纹图谱特征
测定了小黄鱼耳石中8种元素(Mg、Al、Mn、Cu、Zn、Sr、Ba、Ca)的含量,各元素含量检出值均达到ICP-MS检测限水平。各站位小黄鱼耳石中微量元素/Ca比值结果表明,小黄鱼耳石中不同元素含量比值有较大的差异,其中Ba/Ca、Mn/Ca值较高,其次为Sr/Ca、Al/Ca和Zn/Ca值,Cu/Ca和Mg/Ca值较低。各元素在不同采样站位之间也存在显著差异(ANOVA,n=125,P<0.05),葫芦岛的小黄鱼群体其耳石中各元素含量均高于其他站位,而大洋港的小黄鱼群体耳石中元素含量显著低于其他站位(图2),其中,Mg/Ca值以葫芦岛最高;Al/Ca值以海州湾、青岛和葫芦岛较高;Ba/Ca值以葫芦岛最高;Cu/Ca值以海州湾和葫芦岛较高;Mn/Ca值以海州湾、大鱼岛和葫芦岛较高;Zn/Ca值以葫芦岛最高。
以耳石质量作为协变量进行协方差分析,结果显示,小黄鱼耳石中Mg/Ca、Mn/Ca、Cu/Ca、Zn/Ca、Sr/Ca以及Ba/Ca值与耳石质量没有显著相关关系(ANCOVA,n=125,P>0.05)。多变量方差分析(MANOVA)结果显示,各站位小黄鱼群体的耳石多元素特征存在显著差异(Pillai trace,F17.172=1.985,P<0.05),各站位两两比较 (Hotelling’s T-square) 结果随元素种类变化而呈现不同特征(图2),其中Ba/Ca值在5个小黄鱼群体中呈现出的差异性最多,而Sr/Ca值则只在大洋港和葫芦岛两个群体中呈现显著差异(P< 0.05)。
3.2不同采样站位小黄鱼群体的判别函数分析
对元素指标进行逐步线性判别分析(LDFA),结果表明,尽管5个采样站位的小黄鱼耳石中元素/Ca比值在判别函数1和判别函数2二维空间上的分布存在明显重叠(图3),但应用多元素指标进行的LDFA对大洋港、海州湾、青岛、大鱼岛和葫芦岛等5个站位的正确判别率分别为96%、65%、96%、90%和82%,整体的正确判别率可达86%(表2)。
3.3小黄鱼早期补充群体的种群结构分析
以本研究采集的125尾小黄鱼样品为对象,基于耳石元素指标进行聚类分析,分析结果显示小黄鱼样品可以被聚类为3个组别,其中组别2主要为葫芦岛小黄鱼样品,组别3主要由大洋港小黄鱼样品组成,组别1主要为位于黄海中部近岸的大鱼岛、海州湾和青岛的小黄鱼,且交叉明显,还出现了少量的葫芦岛和大洋港小黄鱼。

图2 小黄鱼耳石中微量元素与钙元素的摩尔比值(平均值±SE)Fig.2 Molar elemental concentrations (mean ± SE) in whole otoliths of L. polyactis误差棒之上字母相同的站位,表示组间差异不显著(P>0.05)The locations marked with the same letter above the error bars are not significantly different concerning the elemental concentrations (P>0.05)
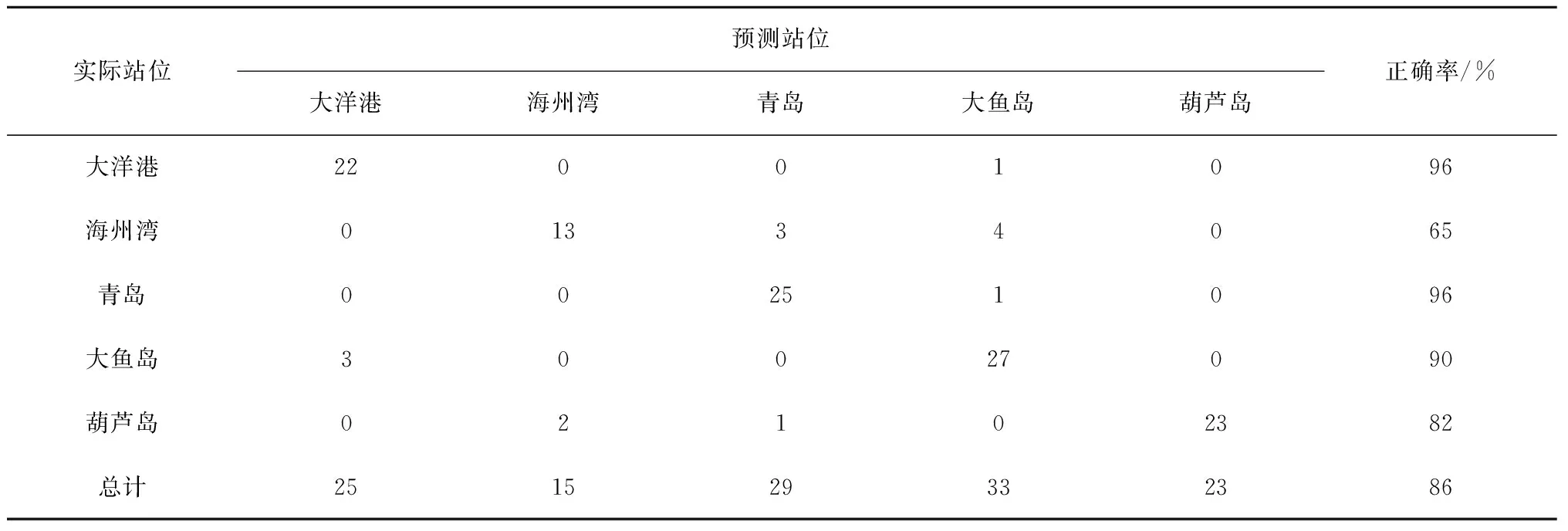
实际站位预测站位大洋港海州湾青岛大鱼岛葫芦岛正确率/%大洋港22001096海州湾01334065青岛00251096大鱼岛30027090葫芦岛02102382总计251529332386

图3 不同站位耳石样品的元素含量在判别函数1和判别函数2的二维散点分布Fig.3 Scatter plot of LD1 and LD2 of multi-elemental tags in otoliths collected from the five sampling locations椭圆表示95%置信区间Ellipses represent 95% confidence intervals around the data
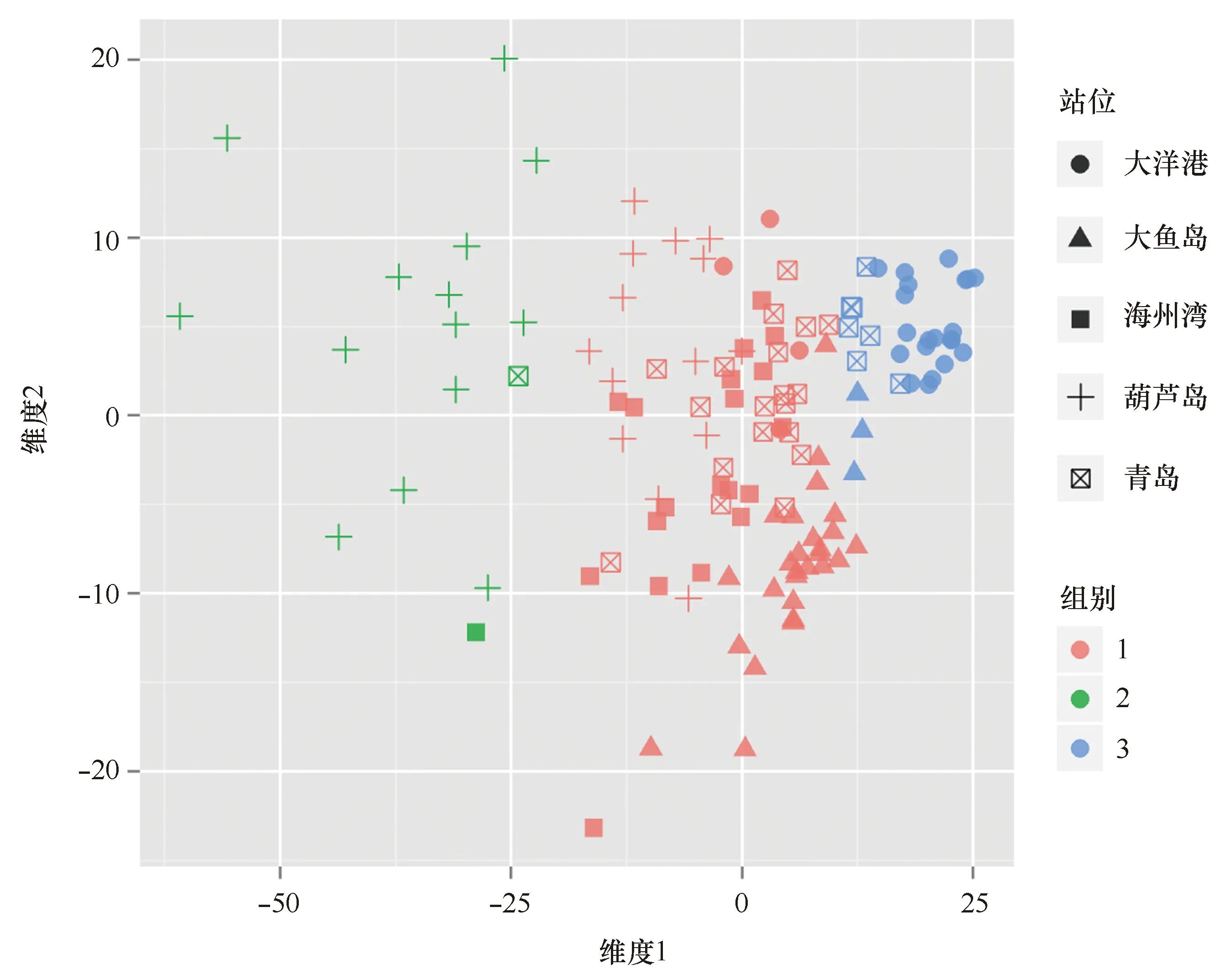
图4 多维定标对5个站位小黄鱼耳石元素的聚类情况Fig.4 Cluster analysis of multi-elemental tags in otoliths collected from the five sam-pling locations by multidimensional scaling
4分析和讨论
4.1耳石元素指纹分析在不同站位小黄鱼群体识别中的应用
元素沉积到耳石的过程中,牵涉到一系列复杂的生物、化学和地质机制。微量元素在耳石中的沉积是一种复杂的生物矿化作用,同时受到鱼类生理效应、环境以及耳石本身结晶状态的影响。到目前为止,对于环境如何影响耳石中的元素沉积,尚未完全了解。有部分研究指出,包括Sr、Ba、Cu、Pb、Mg等元素在内,其环境水体中的元素浓度会直接影响到耳石中该元素的浓度[12—15];Ba、Zn、Cu和Pb等元素则可能反映淡水注入和河川污染等影响;而耳石中Na、K和Mn等元素的浓度则认为可能受到鱼类生理发育的影响要远大于外界环境变化的影响[13,16—17]。本研究中对小黄鱼耳石中的元素组成差异进行分析,检测到7种元素与Ca的比值,其中,Sr与Ba的浓度可以代表近岸淡水注入等所造成的环境水体的盐度变化,对应小黄鱼的洄游习性所经历的不同盐度水体,推测Cu、Zn、Al等与环境污染有关,而Mg和Mn则可能会受到鱼体生理发育的影响[13,18]。经实验检测发现,本研究中的小黄鱼样品均为当年生小黄鱼,且采样时间接近,可以认为本研究中的小黄鱼样品均处于索饵阶段,可以排除因生活史阶段不同而造成的显著差异,即在研究中观察到的耳石中元素组成的差异主要受到外界环境差异的影响。因此,小黄鱼耳石元素指纹图谱能够反映小黄鱼群体的生活环境,而耳石元素指纹图谱之间的差异性就可以表征小黄鱼生境的差异,从而作为一种天然标记来识别不同站位小黄鱼群体。
本研究的小黄鱼样品采自黄、渤海5个不同的站位,这5个采样站位之间的水环境理化特征是存在显著差异的。基于以上理论,这种环境特征差异可以通过耳石元素指纹图谱呈现出来,因此,只要对耳石元素指纹图谱进行差异性分析,就可以识别出不同采样站位的小黄鱼样品。为了检验这种方法是否能够成功识别不同站位的小黄鱼群体,以5个站位的小黄鱼群体为对象进行了逐步线性判别分析(LDFA),虽然不同站位的耳石样品元素含量在判别函数1和判别函数2二维空间上的分布存在明显重叠,但对各站位小黄鱼群体的平均判别正确率高达86%,其中对青岛和大洋港两个站位的判别正确率高达96%。判别分析的结果说明了通过耳石元素的差异分析基本可以区分出不同采样站位的小黄鱼样品,耳石元素指纹图谱作为一种天然标记应用于鱼类群体的识别是有效可行的[19—21]。
虽然耳石元素指纹分析应用于鱼类群体识别这一方法在国际上已经得到了一些学者的认同,也有一些成功的相关研究,但其中也还存在着一些需要讨论和注意的问题。本研究中的小黄鱼样品为同年同时期采集得到,因此可以忽略年代际因素的影响,认为耳石元素的差异是由外界环境差异引起的,但即使是同一水域的同一种鱼类个体,其耳石元素组成也可能存在显著的年间差异[19],因此在对不同年份的鱼类群体进行判别时还需要考虑年间差异在其中的影响。
4.2耳石元素指纹分析在黄、渤海小黄鱼早期补充群体的种群结构识别中的应用
鱼类种群分析是海洋鱼类生态学和渔业资源学研究的重点和难点,小黄鱼作为一种重要的渔业资源,其种群结构和特征一直都是研究的重点。种群是在一定时空中同种个体的集合,是物种存在的基本单位,具有空间特征、数量特征和遗传特征。对于海洋鱼类而言,其并非均匀地分布在物种分布区,而是形成一些被隔离的、相对独立的群体,这种群体是鱼类生存和活动的单位,即种群[22]。在种群内部可以进行充分杂交,而与同种的其他种群相比,则在形态、洄游路线、产卵索饵和越冬等方面存在着差异。目前,对中国近海小黄鱼种群的划分存在多种看法,不同学者的划分依据也有所差异。在鱼类分类上,形态上的性状差异是最为直观,也是最为传统的一种方法,早在上世纪60年代,林新濯等[23—24]就根据小黄鱼的脊椎骨、背鳍、臀鳍、鳃扒、幽门盲囊等特征,结合小黄鱼的分布,将我国近海小黄鱼划分为黄渤海种群、黄海南部种群和东海种群,其后也有学者根据小黄鱼生态学、生物学资料以及产卵场、越冬场和洄游路线,以及遗传多样性分析(RAPD)等得到了相似的结论,支持了以上的划分观点[7,25];刘效舜[26]在1990年对小黄鱼渔场分布、鱼群生物学和洄游路线等特征进行分析后,提出了另一种划分观点,即黄海中部还存在一个独立的种群——黄海中部种群,也有学者认为我国近海小黄鱼仅存在黄海南部和东海种群以及渤海和黄海北部种群两个种群[27]。在此基础上,本研究尝试利用一种新的研究方法,一种新的划分依据——耳石元素指纹分析,对小黄鱼的种群结构进行探讨,在了解种群结构的基础上,对比传统的划分观点,也是对该方法可行性的一种探讨。在本研究中采用的是全耳石进行分析,全耳石记录了鱼类从出生至死亡所经历的全部环境变化,能够反映鱼类整个生命周期的经历。对于本研究中的小黄鱼而言,全耳石记录了其从卵孵化至被捕获的全部经历,包含了产卵场、索饵场以及洄游路线等等所有的环境和生理特征记录。如果两个小黄鱼群体属于同一种群,它们的耳石中会具有相似的元素特征,换言之,如果两个小黄鱼群体属于不同种群,它们耳石中的元素特征会存在差异,通过分析这些差异就可以区分来自于不同种群的小黄鱼样品,进而分析小黄鱼的种群结构特征。
基于全耳石元素指纹图谱的聚类分析结果(图4),小黄鱼样品可以明显的被划分为3个组别,分别对应了渤海种群(组别2)、黄海中部种群(组别1)和南黄海种群(组别3),这一划分结果与上述刘效舜的观点一致,认同了黄海中部种群的存在,这也进一步证实了本文方法的有效可行的。在聚类的3个组别中,组别2(渤海种群)和组别3(南黄海种群)的构成相对比较单一,组别1(黄海中部种群)的构成相对复杂,包括了最多的站位和最多数量的小黄鱼样品。在该组别中,小黄鱼虽然来自不同的采样站位,但却被划分在了同一个种群,这一方面说明了在小黄鱼的洄游过程中,同一种群的个体可能会分散成不同的群体进行活动,另一方面也说明了全耳石元素指纹分析对小黄鱼种群的划分不是依据于其某一生命阶段,而是基于小黄鱼整个生命周期的经历。由于样品的原因,本研究仅对小黄鱼种群早期补充群体进行了分析,在进一步的研究中,也将会对小黄鱼其他生命阶段的种群结构进行研究和探讨,以期更深入、更全面的了解小黄鱼的种群结构。
4.3耳石元素指纹图谱作为鱼类群体识别天然标记的可行性
本研究中应用耳石元素指纹图谱作为小黄鱼不同采样站位群体识别和种群结构分析的天然指标,主要基于耳石中沉积的元素可以反映鱼类生境的理化信息[19]。耳石中可以检测到多种元素的存在,在本研究中,当单独对某一种元素进行分析时,可以发现其并不能很好的识别不同采样站位的小黄鱼样品(图2),本研究中对5个站位小黄鱼样品的高判别正确率是基于多种元素的共同作用。相较单一元素而言,多种元素可以更完整的还原鱼类的生境特征,从而更准确的对鱼类种群和群体进行分析和判别。目前,全耳石元素分析的相关研究已经涉及到种群鉴定[19—20,28],理清种群混合情形以及追踪洄游路径[29—30]等。因此,我们认为耳石元素指纹图谱是一种有效可行的用于鱼类种群生态学研究的天然标记。
与鱼类骨骼、肌肉等组织相比,耳石作为研究材料还具有日沉积规律和代谢惰性的特性[31—32]。耳石的日沉积规律使得耳石与鱼体同步成长,赋予了耳石记录以时间序列信息,提供了更多的研究空间。例如,对耳石核心区元素进行分析可以用于回推鱼类的出生地以及研究其初期生活史,微取样方式结合日轮信息可以分析鱼类生活史中各阶段的元素组成等。耳石的代谢惰性保证了元素一旦沉积到耳石上,就很难被再分解或重吸收。耳石这一特性不仅保证了耳石对于外界环境记录的可信性,通过分析历史耳石样品,也提供了一种分析鱼类种群历史变动的有效方法。
与国外耳石研究发展相比,国内的耳石研究工作开展的较晚。近年来,已经有越来越多的学者关注和运用耳石信息技术探讨鱼类种群生态学问题[33—37]。在本研究中,我们进行了一些尝试和探讨,并取得了一定的结论,希望可以为其他学者的相关工作提供参考。随着海洋生物资源的可持续发展和不断探索,相信耳石信息技术将会引起越来越多的关注,得到更广泛的应用。
参考文献:
[1]曲有为. 利用性比及耳石元素指纹图辨识高屏溪野生与养殖日本鳗(Anguillajaponica) 之研究[D]. 台北: 台湾大学,2005.
Chu Youwei. Using sex ratio and otolith elemental fingerprints to discriminate wild and cultured Japanese eel (Anguillajaponica) in Kaoping River of southern Taiwan[D]. Taipei: National Taiwan University,2005.
[2]Campana S E. Chemistry and composition of fish otoliths: pathways,mechanisms and applications[J]. Marine Ecology Progress Series,1999,188: 263-297.
[3]Arai T. Effect of salinity on strontium: calcium ratios in the otoliths of Sakhalin taimen,Huchoperryi[J]. Fisheries Science,2010,76(3): 451-455.
[4]金显仕. 黄海小黄鱼(Pseudosciaenapolyactis)生态和种群动态的研究[J]. 中国水产科学,1996,3(1): 32-46.
Jin Xianshi. Ecology and population dynamics of small yellow croaker (PseudosciaenapolyactisBleeker) in the Yellow Sea[J]. Journal of Fishery Sciences of China,1996,3(1): 32-46.
[5]蒙子宁,庄志猛,金显仕,等. 黄海和东海小黄鱼遗传多样性的RAPD分析[J]. 生物多样性,2003,11(3): 197-203.
Meng Zining,Zhuang Zhimeng,Jin Xianshi,et al. Genetic diversity in small yellow croaker (Pseudosciaenapolyactis) by RAPD analysis[J]. Biodiversity Science,2003,11(3): 197-203.
[6]林龙山,程家骅,姜亚洲,等. 黄海南部和东海小黄鱼(Larimichthyspolyactis)产卵场分布及其环境特征[J]. 生态学报,2008,28(8): 3485-3494.
Lin Longshan,Cheng Jiahua,Jiang Yazhou,et al. Spatial distribution and environmental characteristics of the spawning grounds of small yellow croaker in the southern Yellow Sea and the East China Sea[J]. Acta Ecologica Sinica,2008,28(8): 3485-3494.
[7]徐兆礼,陈佳杰. 小黄鱼洄游路线分析[J]. 中国水产科学,2009,16(6): 931-940.
Xu Zhaoli,Chen Jiajie. Analysis on migratory routine ofLarimichthyspolyactis[J]. Journal of Fishery Sciences of China,2009,16(6): 931-940.
[8]单秀娟,李忠炉,戴芳群,等. 黄海中南部小黄鱼种群生物学特征的季节变化和年际变化[J]. 渔业科学进展,2011,32(6): 7-16.
Shan Xiujuan,Li Zhonglu,Dai Fangqun,et al. Seasonal and annual variations in biological characteristic of small yellow croakerLarimichthypolyactisin the central and southern Yellow Sea[J]. Progress in Fishery Science,2011,32(6): 7-16.
[9]张国政,李显森,金显仕,等. 黄海中南部小黄鱼生物学特征的变化[J]. 生态学报,2010,30(24): 6854-6861.
Zhang Guozheng,Li Xiansen,Jin Xianshi,et al. Changes of biological characteristics of small yellow croaker in the central and southern Yellow Sea[J]. Acta Ecologica Sinica,2010,30(24): 6854-6861.
[10]Correia A T,Pipa T,Gonçalves J M S,et al. Insights into population structure ofDiplodusvulgarisalong the SW Portuguese coast from otolith elemental signatures[J]. Fisheries Research,2011,111(1/2): 82-91.
[11]Thorrold S R,Jones C M,Swart P K,et al. Accurate classification of juvenile weakfishCyoscionregalisto estuarine nursery areas based on chemical signatures in otoliths[J]. Marine Ecology Progress,1998,173(8): 253-265.
[12]Bath G E,Thorrold S R,Jones C M,et al. Strontium and barium uptake in aragonitic otoliths of marine fish[J]. Geochimica et Cosmochimica Acta,2000,64(10): 1705-1714.
[13]罗军燕,李胜荣,申俊峰. 鱼耳石中锶和钡富集的影响因素及其环境响应[J]. 地学前缘,2008,15(6): 18-24.
Luo Junyan,Li Shengrong,Shen Junfeng. The influential factors of strontium and barium enrichment in otolith and their response to the environment[J]. Earth Science Frontiers,2008,15(6): 18-24.
[14]王茂林,张秀梅,高天翔,等. 水体钙离子质量浓度对褐牙鲆幼鱼鱼体和耳石元素成分的影响[J]. 南方水产科学,2013,3(3): 31-38.
Wang Maolin,Zhang Xiumei,Gao Tianxiang,et al. Effects of Ca2+concentrations in seawater on element content of fish body and otolith of juvenileParalichthysolivaceus[J]. South China Fisheries Science,2013,3(3): 31-38.
[15]Elsdon T S,Gillanders B M. Strontium incorporation into calcified structures: separating the effects of ambient water concentration and exposure time[J]. Marine Ecology Progress,2005,285(1): 233-243.
[16]Elsdon T S,Gillanders B M. Relationship between water and otolith elemental concentrations in juvenile black breamAcanthopagrusbutcheri[J]. Marine Ecology Progress,2003,260(8): 263-272.
[17]Brophy D,Jeffries T E,Danilowicz B S. Elevated manganese concentrations at the cores of clupeid otoliths: possible environmental,physiological,or structural origins[J]. Marine Biology,2004,144(4): 779-786
[18]张美瑜. 利用耳石元素指纹图研究仔稚鱼在河口间的扩散模式——以鱼叚虎与鲷科为例[D]. 台北: 台湾大学,2008.
Chang Meiyu. Use of otolith elemental signature to study the dispersal patterns of fish larvae among esturaries-a case study ofGobioideiandSpandae[D]. Taipei: National Taiwan University,2008.
[19]Campana S E,Chouinard G A,Hanson J M,et al. Otolith elemental fingerprints as biological tracers of fish stocks[J]. Fisheries Research,2000,46(1/3): 343-357.
[20]Campana S E,Fowler A J,Jones C M. Otolith elemental fingerprinting for stock identification of Atlantic Cod (Gadusmorhua) using laser ablation ICPMS[J]. Canadian Journal of Fisheries & Aquatic Sciences,1994,51(9): 1942-1950.
[21]Morat F,Letourneur Y,Dierking J,et al. The great melting pot. Common Sole population connectivity assessed by otolith and water fingerprints[J]. PLoS One,2014,9(1): e86585.
[22]沈国英,施并章. 海洋生态学[M]. 北京: 科学出版社,2002.
Shen Guoying,Shi Bingzhang. Marine ecology[M]. Beijing: Science Press,2002.
[23]林新濯,邓思明,黄正一. 小黄鱼种族生物测定学的研究[G]//海洋渔业资源论文选集. 北京: 农业出版社,1965: 84-108.
Lin Xinzhuo,Deng Siming,Huang Zhengyi. Study of population on biometrics of small yellow croaker (PseudosciaenapolyactisBleeker)[G]//Collections of Marine Fishery Resource. Beijing: China Agricultural Press,1965: 84-108.
[24]林新濯. 中国近海三种主要经济鱼类的生物学特性与资源现状[J]. 水产学报,1987,11(3): 187-193.
Lin Xinzhuo. Biological characteristics and resources status of three main commercial fishes in offshore waters of China[J]. Journal of Fisheries of China,1987,11(3): 187-193.
[25]王贻观,马珍影,尤红宝,等. 小黄鱼分布洄游的初步研究(提要)[G]//朱元鼎,朱树屏. 海洋渔业资源论文选集. 北京: 农业出版社,1965: 9-11.
Wang Yiguan,Ma Zhenying,You Hongbao,et al. Preliminary study on the distribution of small yellow croaker[G]//Zhu Yuanding,Zhu Shuping. Marine Fishery Resources Articles. Beijing: China Agricultural Press,1965: 9-11.
[26]刘效舜. 黄渤海区渔业资源调查与区划[M]. 北京: 海洋出版社,1990.
Liu Xiaoshun. The investigation and regionalization of fishery resource in Yellow Sea and Bohai sea[M]. Beijing: China Ocean Press,1990.
[27]徐兆礼,陈佳杰. 再议中国近海小黄鱼种群的划分问题[J]. 应用生态学报,2010,21(11): 2856-2864.
Xu Zhaoli,Chen Jiajie. Population division ofLarimichthyspolyactisin China Sea[J]. Chinese Journal of Applied Ecology,2010,21(11): 2856-2864.
[28]Edmonds J S,Lenanton R C J,Caputi N,et al. Trace elements in the otoliths of yellow-eye mullet (Aldrichettaforsteri) as an aid to stock identification[J]. Fisheries Research,1992,13(92): 39-51.
[29]Gillanders B M,Kingsford M J. Elements in otoliths may elucidate the contribution of estuarine recruitment to sustaining coastal reef populations of a temperate reef fish[J]. Marine Ecology Progress Series,1996,141(1/3): 13-20.
[30]Kennedy B P,Blum J D,Folt C L,et al. Using natural strontium isotopic signatures as fish markers: methodology and application[J]. Canadian Journal of Fisheries and Aquatic Sciences,2000,57(11): 2280-2292.
[31]Campana S E,Neilson J D. Microstructure of fish otoliths[J]. Canadian Journal of Fisheries and Aquatic Sciences,1985,42(5): 1014-1032.
[32]Pannella G. Fish otoliths: daily growth layers and periodical patterns[J]. Science,1971,173(4002): 1124-1127.
[33]Hart L M,Bond M H,May-McNally S L,et al. Use of otolith microchemistry and stable isotopes to investigate the ecology and anadromous migrations of Northern Dolly Varden from the Egegik River,Bristol Bay,Alaska[J]. Environmental Biology of Fishes,2015,98(6): 1633-1643.
[34]Tanner S E,Reis-Santos P,Vasconcelos R P,et al. Otolith geochemistry discriminates among estuarine nursery areas ofSoleasoleaandS.senegalensisover time[J]. Marine Ecology Progress Series,2012,452: 193-203.
[35]Fairclough D V,Edmonds J S,Jackson G,et al. A comparison of the stock structures of two exploited demersal teleosts,employing complementary methods of otolith element analysis[J]. Journal of Experimental Marine Biology and Ecology,2013,439: 181-195.
[36]张凤侠,张秀梅,覃乐政,等. 基于矢耳石形态的平鲉属(Sebastes)鱼类鉴别及研究方法比较[J]. 海洋学报,2015,37(4): 28-39.
Zhang Fengxia,Zhang Xiumei,Qin Lezheng,et al. Sagittae morphology used in the discrimination of the fish ofSebastesand the comparison of sagittal research method[J]. Haiyang Xuebao,2015,37(4): 28-39.
[37]熊瑛,刘洪波,姜涛,等. 黄海南部野生银鲳和鮸鱼的耳石元素微化学研究[J]. 海洋学报,2015,37(2): 36-43.
Xiong Ying,Liu Hongbo,Jiang Tao,et al. Investigation on otolith microchemistry of wildPampusargenteusandMiichthymiiuyin the southern Yellow Sea,China[J]. Haiyang Xuebao,2015,37(2): 36-43.
Insights into population structure of juvenile small yellow croaker (Larimichthys polyactis) in the Yellow Sea and the Bohai Sea from otolith elemental fingerprints
Wang Yukun1,2,Huang Jiansheng1,Dai Fangqun1,Tang Xuexi2,Sun Yao1,Jin Xianshi1
(1.YellowSeaFisheriesResearchInstitute,ChineseAcademyofFisherySciences,Qingdao266071,China; 2.LaboratoryofEcology,CollegeofMarineLifeSciences,OceanUniversityofChina,Qingdao266003,China)
Abstract:Elemental fingerprints were measured on otolith of 125 Larimichthys polyactis juveniles collected from 5 important fishery regions in the Bohai Sea and the Yellow Sea by inductively coupled plasma mass spectrometry (ICP-MS). Otolith elemental figerprints were used as natural tags to discriminate among different sampling regions and the observed site-specific elemental differences in small yellow croaker otoliths suggest a high level of site-fidelity in relation to the 5 fishery regions. Classification accuracy rates from linear discriminate function analyses (LDFA) of otolith chemistry data were high for each region with a mean accuracy of 86%,ranging from 65%-96%,considering every possible combination of elements. Furthermore,cluster analysis of multi-elemental tags suggest that the populations of juvenile fish could be divided into three groups,the Bohai group,the Central Yellow Sea group and the South Yellow Sea group.
Key words:otolith; microchemistry; small yellow croaker; Larimichthys polyactis;stock discrimination; population structure; elemental fingerprints
收稿日期:2015-11-18;
修订日期:2016-02-26。
基金项目:国家重点基础研究发展计划项目(2015CB453300,2010CB428900)。
作者简介:王玉堃(1987—),女,山东省龙口市人,博士研究生,研究方向为渔业资源生态学。E-mai:wangyukunsun@163.com *通信作者:孙耀,研究员,从事环境化学方向研究。E-mail:sunyao@ysfri.ac.cn
中图分类号:S917.4
文献标志码:A
文章编号:0253-4193(2016)06-0032-09
王玉堃,黄建生,戴芳群,等. 黄、渤海小黄鱼耳石元素指纹分析及其在种群补充群体识别中的应用[J].海洋学报,2016,38(6):32—40,doi:10.3969/j.issn.0253-4193.2016.06.004
Wang Yukun,Huang Jiansheng,Dai Fangqun,et al. Insights into population structure of juvenile small yellow croaker (Larimichthyspolyactis) in the Yellow Sea and the Bohai Sea from otolith elemental fingerprints[J]. Haiyang Xuebao,2016,38(6):32—40,doi:10.3969/j.issn.0253-4193.2016.06.004

