印度尼西亚卡利安达岛近岸热泉微生物和氢酶基因的多样性
何培青, Dewi Seswita Zilda, 李江, 张学雷, 崔菁菁, 白亚之, Gintung Patantis, Ekowati Chasanah
(1.国家海洋局第一海洋研究所 海洋生态研究中心, 山东 青岛 266061; 2. 海洋与渔业局 海洋与渔业研究与发展司 海洋和渔业产品加工和生物技术研究中心,印度尼西亚 雅加达 40115; 3. 国家海洋局第一海洋研究所 海洋沉积与环境地质国家海洋局重点实验室,山东 青岛 266061)
印度尼西亚卡利安达岛近岸热泉微生物和氢酶基因的多样性
何培青1, Dewi Seswita Zilda2, 李江1, 张学雷1, 崔菁菁3, 白亚之3, Gintung Patantis2, Ekowati Chasanah2
(1.国家海洋局第一海洋研究所 海洋生态研究中心, 山东 青岛 266061; 2. 海洋与渔业局 海洋与渔业研究与发展司 海洋和渔业产品加工和生物技术研究中心,印度尼西亚 雅加达 40115; 3. 国家海洋局第一海洋研究所 海洋沉积与环境地质国家海洋局重点实验室,山东 青岛 266061)
摘要:研究对2011年7月采自印度尼西亚卡利安达岛近岸热泉的样品,进行了细菌和古菌16S rRNA基因和细菌氢酶基因克隆文库的构建、序列测定和多样性分析。结果表明:热泉系统的细菌和古菌由16个门组成,Proteobacteria为热液流体和沉积物的优势类群,丰度分别为59.5%和73.3%,Cyanobacteria为菌苔的优势类群(丰度,56.5%);具有氨氧化作用的Crenarchaeota为古菌的优势类群。热泉系统中,70%以上的种类与海洋细菌的亲缘关系最近,说明该系统具有海洋特性;约20%的种类与陆地热泉中嗜热或中等嗜热细菌的亲缘关系最近,这些种类可能来源于高温地层内部,并参与了铁氧化还原、氢氧化、硫氧化和硝酸还原等过程。热泉系统中,NAD(P)-关联的双向NiFe-氢酶基因和FeFe-氢酶基因的组成分布也受到温度和盐度分布变化的影响。研究为揭示浅海热液系统提供理论参考。
关键词:印度尼西亚卡利安达岛;近岸热泉;16S rRNA;氢酶基因
1引言
深海热液系统自20世纪70年代首次发现以来,一直是国际关注的焦点,而浅海热液系统及其微生物的研究在近期才得到重视。浅海热液系统一般位于近海,水深在0~200 m之间,在地形上属于深海热液系统和陆地热泉系统的过渡,陆地和海水中的流体及物质都会对热液活动产生影响。浅海热液系统常位于火山海面下翼部和海底火山顶部,火山活动为其提供热源并驱动热液循环。热液流体来源于大气降水、海水、原生水和岩浆水,其不同的组成比例制约着热液系统的温度、盐度、酸碱度、矿物等地球化学特征[1—3]。由于水深较浅,热液流体还会同时影响到底部至表面水层,从而影响到人类活动。由于可以接受到光照,微生物的初级生产不但可以通过化能自养途径还可以通过光能营养途径[1—3]。目前,国际上对微生物的研究主要集中在高盐度浅海热液系统[4—9],其多样性丰富,在生物矿化、碳、氮、硫等元素循环中扮演重要的角色;其组成和分布还受到地理位置、温度、pH和流体组成等物理化学因子的影响。大气降水为热液流体主要来源的低盐度浅海热液系统中,微生物还经历了盐度的变化,而目前对其研究较少[10]。
印度洋卡利安达岛位于印度尼西亚,是受到喀拉喀托火山影响的区域之一,东海岸分布着一组近岸热泉(5°44′46″N, 105°35′12″E),距离陆地数十米。泉眼以单个或成双分布于相距数米的礁石上,在高潮时没于海水中,低潮露出海面,热泉池直径约1 m,池外周可见绿色菌苔。泉眼水温在58.5~68.5℃之间,盐度接近于淡水,气泡伴随热液流体溢出。本研究选取其中一个热泉,通过PCR扩增热液流体、热泉池沉积物和菌苔的细菌和古菌16S rRNA基因、NAD(P)-关联的双向NiFe-氢酶基因和FeFe-氢酶基因的部分序列并构建克隆文库,进一步测定基因序列并分析其多样性。研究为揭示浅海热液系统微生物的生态功能及其与环境的相互关系提供理论参考。
2材料与方法
2.1样品采集
2011年7月,在印度尼西亚卡利安达岛东海沿岸,在低潮期采集一个热泉的热液流体、表层沉积物和表层菌苔样品,于冰上低温运输至实验室。1 L热液流体经醋酸纤维滤膜(0.22 μm)过滤后,与沉积物和菌苔于-80℃保存,用于DNA提取。现场泉眼水温为65℃,pH为6.0~6.5,盐度约为4,周围海水盐度约为30。沉积物中常量金属元素、总有机碳(TOC)、总氮(TN)和总碳(TC)的含量由国家海洋局第一海洋研究所海洋地质综合实验室完成测试。
2.2基因扩增和基因文库的构建
称取沉积物和菌苔样品各0.5 g,取1 L 热液流体的过滤菌膜,采用FastDNA®土壤DNA提取试剂盒(MPbio公司,美国)提取基因组。细菌16S rRNA基因引物采用Bac27F/Uni1492R[11],古菌16S rRNA基因引物采用Arch20F/Arch958R[12],NAD(P)-关联的双向NiFe-氢酶基因引物采用HoxH-F/HoxH-R[13];FeFe-氢酶基因引物采用FeFe-272F/FeFe-427R[14]。PCR反应采用TransStartTMTaq DNA聚合酶(全式金,北京),PCR反应体系(50 μL)包括:2 μL DNA(约10 ng),各1 μL 引物(0.2 μmol/L 终浓度),5 μL 缓冲液,4 μL dNTP,1 μL DNA 聚合酶(2.5 U),36 μL H2O。细菌16S rRNA基因扩增条件:94℃ 5 min;94℃ 10 s,55℃退火10 s,72℃延伸1.5 min,30个循环;72℃终延伸10 min。古菌16S rRNA基因、NAD(P)-关联的双向NiFe-氢酶基因和FeFe-氢酶基因的退火温度分别为55℃、48℃和52℃,延伸时间为1 min,40个循环,其他条件同细菌16S rRNA基因。
分别取2个重复的PCR产物(100 μL),经1%的琼脂糖电泳后,切下与目的基因分子量大小相近的条带,采用琼脂糖回收试剂盒(天根,北京)进行纯化,pBS-T载体连接后,转化到E.coliDH5α感受态细胞(天根,北京)构建克隆文库,挑取单克隆在LB液体培养基(氨苄浓度50 μg/mL)中,于37℃过夜培养,并采用M13通用引物进行阳性验证后,由上海桑尼公司完成测序。
2.3基因序列的生物信息学分析
分别对细菌的16S rRNA基因扩增片段(正向 800 bp)和古菌的16S rRNA基因扩增片段采用CodonCode Aligner 软件 (CodonCode Corporation,Dedham,Massachusetts,USA)[15]进行比对,相似度高于97%的序列作为一个操作分类单元(OTU)。多样性指数采用Primer 5软件[16]计算。NAD(P)-关联的双向NiFe-氢酶和FeFe-氢酶的基因序列去除载体和引物序列,并翻译成氨基酸序列后,采用DOTUR软件[17],在大于等于99%相似性水平上进行操作分类单元(OTUs)分析,并计算多样性指数。覆盖率计算公式为:C=[1-(n/N)]×100%,其中n为总的OTU数,N为总的序列数。采用BioEdit[18]软件中的Clustal W[19]分别对16S rRNA基因序列和氢酶氨基酸序列与GenBank中近缘序列进行多重比对,并采用MEGA4.0软件[20]的相邻连接法(Neighbor-Joining)构建系统发育树,自举值设为1 000。
2.4基因序列
将获得的基因序列提交到GenBank数据库,细菌16S rRNA基因序列号为:KT239166-KT239341;古菌16S rRNA基因序列号为:KT225015-KT225020;NAD(P)-关联的双向NiFe-氢酶基因序列号为:KT225007-KT2250014;FeFe-氢酶基因序列号为:KT224971-KT225006。
3结果与分析
3.1沉积物的主要化学元素组成
热泉沉积物的化学元素组成如表1所示,其中Fe和P含量高于大陆地壳,而Al、K、Mg和Ti含量低于大陆地壳数据。

表1 印度尼西亚卡利安达岛近岸热泉沉积物化学元素组成
注:“-”表示未提供数据。
3.2细菌的α-多样性
共获得641个含有细菌16S rRNA基因片段的克隆(表2)。热液流体、沉积物和菌苔分别获得90、100和52个OTUs。在沉积物和热液流体中,细菌16S rRNA基因的香农-韦弗多样性指数和辛普森多样性指数差别不大,且均高于菌苔。不同生态类型中的细菌均匀度和物种丰富度的变化趋势与多样性指数一致。
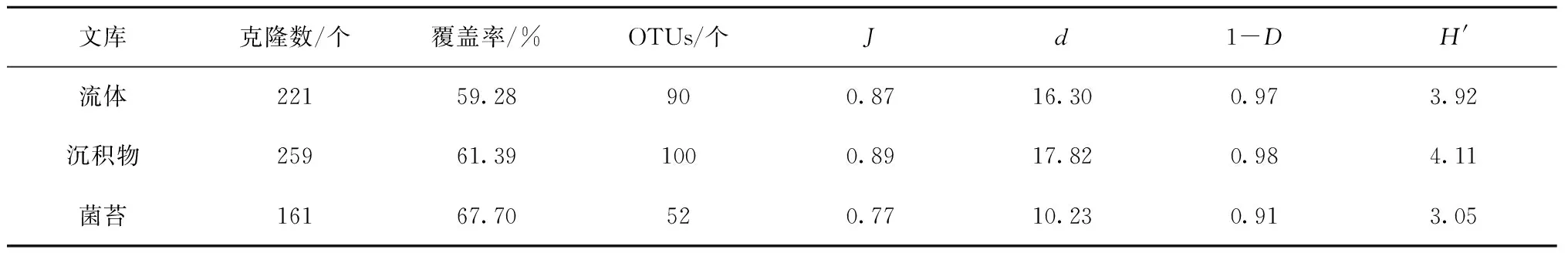
表2 印度尼西亚卡利安达岛近岸热泉细菌16S rRNA基因的α-多样性
注:OTUs:操作分类单元;J:Pielou 均一度指数;d:物种丰富度;1-D:辛普森多样性指数;H′:香农-韦弗多样性指数。
3.3细菌组成
研究共获得14个门(表3)。在热液流体和沉积物中,Proteobacteria的丰度最高,分别为59.5%和73.3%,其中Gammaproteobacteria的丰度分别为43.0%和23.2%。菌苔中Cyanobacteria的丰度最高(56.5%),其次为Bacteroidetes(19.9%)和Proteobacteria(13.0%)。菌苔中Bacteroidetes、Acidobacteria和Chloroflexi的丰度高于热液流体和沉积物。沉积物中Deferribacteres的丰度高于热液流体和菌苔。
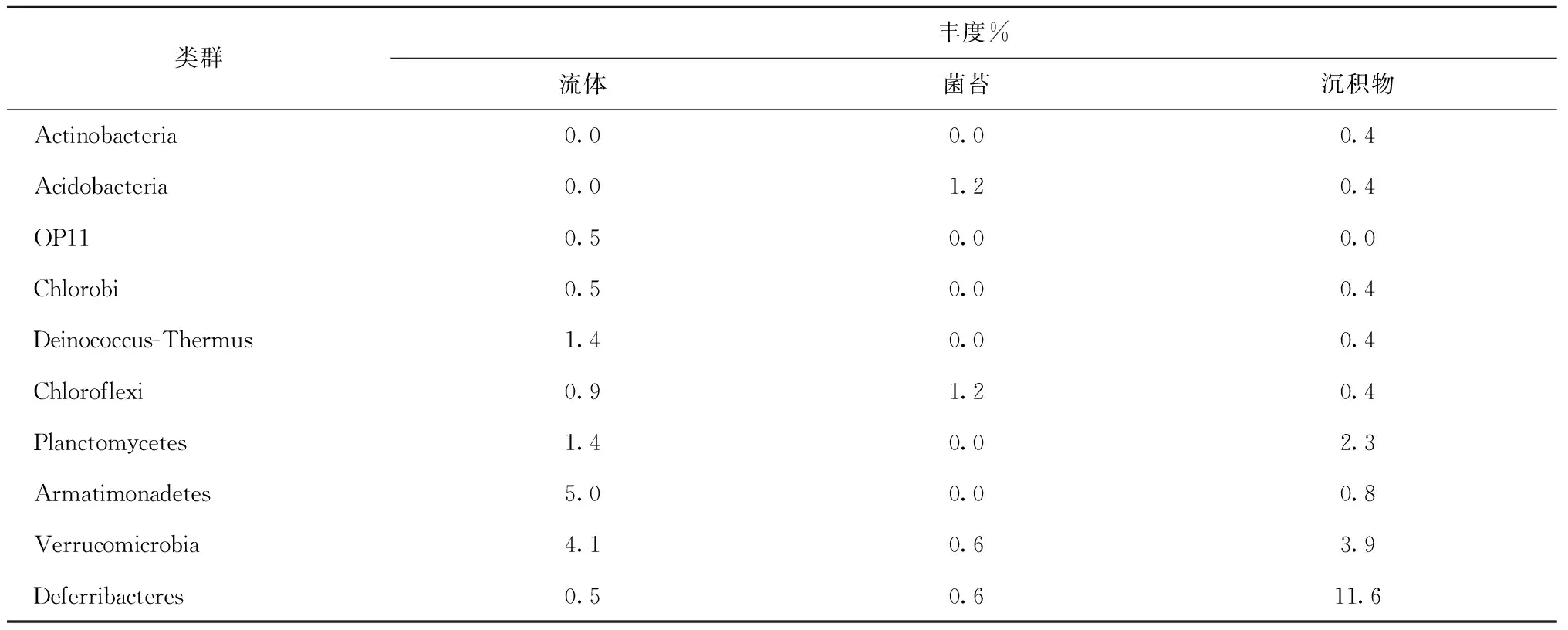
表3 印度尼西亚卡利安达岛近岸热泉的细菌组成
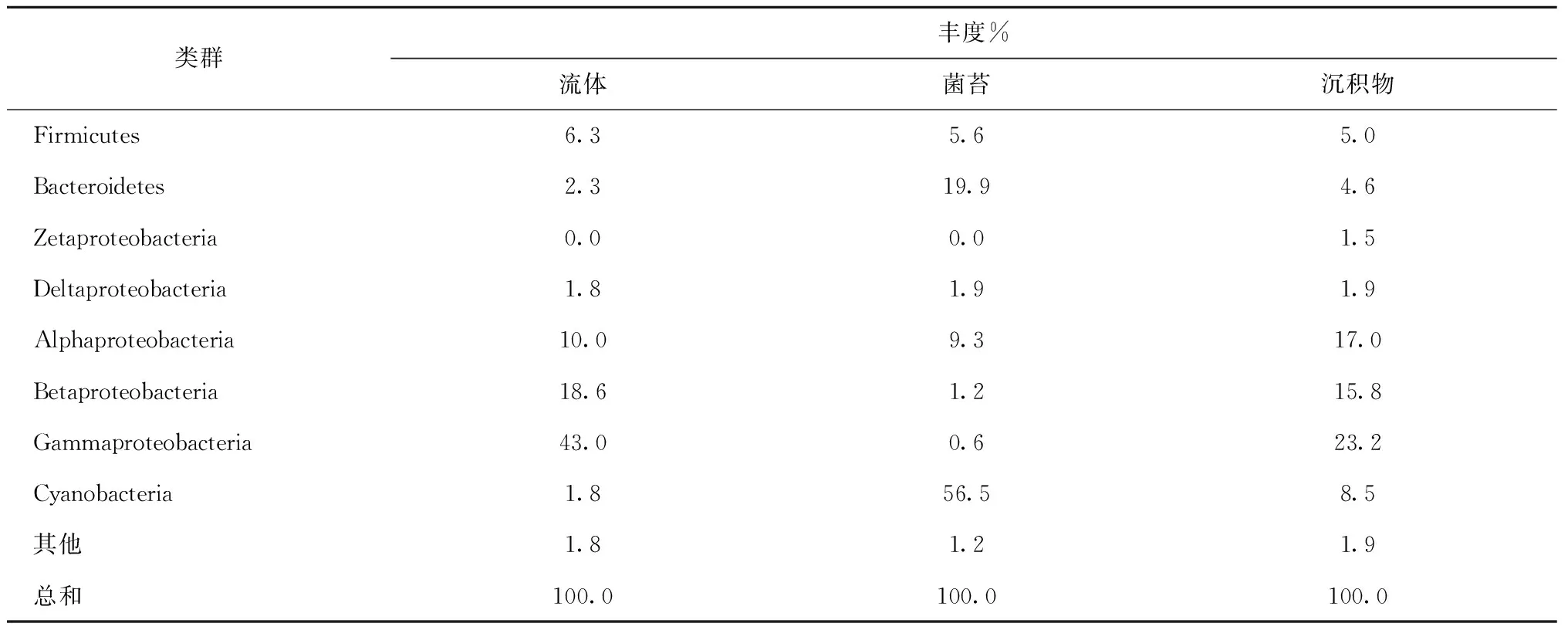
续表3
(1) Gammaproteobacteria
获得Gammaproteobacteria的35个OTUs。热液流体中丰度最高的3个OTUs(总丰度,18.0%)与海洋细菌Acinetobacter的相似度高于97%。沉积物中,丰度最高1个OTU(丰度,5.4%)与反硝化海洋细菌Pseudomonasstutzeri相似度为99.5%[22]。热液流体中获得的1个克隆,与嗜热细菌Thermomonashydrothermalis亲缘关系最近(96.2%),还获得2个克隆,与深层地热环境克隆的相似度高于97%。
(2) Betaproteobacteria
获得Betaproteobacteria的13个OTUs,其中5个OTUs(约占Betaproteobacteria总丰度的50.0%)与热泉环境中硫氧化、铁氧化、氢氧化和甲基氧化细菌的亲缘关系最近。热液流体中,丰度最高的1个OTU(丰度,9.5%)与陆地热泉化能自养的铁氧化细菌Sideroxydanslithotrophicus的相似度为94.6%[23],该OTU在沉积物的丰度为3.6%。1个OTU(丰度,0.9%)与陆地热泉Hydrogenophilushirschii的相似度为97.6%。沉积物中,1个OTU(丰度,0.4%)与热泉中耐热的甲基营养细菌Methyloversatilisthermotolerans的相似度为98.5%[24],2个OTUs(总丰度,0.3%)与高温地下水层化能自养的嗜热硫氧化细菌Thiobactersubterraneus的相似度高于97%[25]。
(3) Alphaproteobacteria
获得Alphaproteobacteria的37个OTUs,其中热液流体中丰度最高的1个OTU(22.0%)与海洋细菌Brevundimonashalotolerans的相似度为99.7%,沉积物中丰度较高的11个OTUs与不产氧光合细菌Rhodospirillales目、固氮细菌Rhizobiales和Brevundimonas属的亲缘关系最近。热液流体中还获得1个OTU,与陆地热泉中等嗜热的不产氧光合细菌Albidovulumxiamenense的相似度为99.0%。
(4) Deltaproteobacteria
获得Deltaproteobacteria的10个OTUs(12个克隆)。热液流体中,1个OTU(1个克隆)与热泉环境克隆的相似度为99.7%;1个OTU(3个克隆)与热泉嗜热氢氧化细菌Hydrogenophilusislandicus[26]的相似度为97.0%,沉积物中也获得该OTU(1个克隆)。沉积物中,1个OTU(1个克隆)与深海热液口嗜热铁还原细菌Deferrisomacamini的相似度为98.5%,1个OTU(2个克隆)与碱性热泉环境克隆的相似度为97.0%。
(5) Cyanobacteria
Cyanobacteria是菌苔的优势类群(丰度,56.5%),其中的28.6%与潮间带Lyngbyaaestuarii的相似度为99.0%,38.5%与淡水环境中Stanieriacyanosphaera相似度约为91.5%。
(6) Bacteroidetes
获得Bacteroidetes的21个OTUs,主要包括Flavobacteriia、Bacteroidia和Sphingobacteria3个目。
(7) Firmicutes
获得Firmicutes的24个OTUs,菌苔和热液流体中各含有1个OTU(共5个克隆),与深海热液区中等嗜热菌Exiguobacteriumprofundum相似度为99.5%。沉积物中有1个OTU(1个克隆)与中等嗜热Bacillusthermoamylovorans的相似度为99.0%,1个OTU(1个克隆)与嗜热Desulfotomaculumthermobenzoicum的相似度为91.4%。
(8) Deferribacteres
Deferribacteres具有铁和硝酸盐还原作用[27],研究获得4个OTUs(共32个克隆),均与陆地热泉嗜热Calditerrivibrionitroreducens[28]亲缘关系最近。沉积物中获得3个OTUs,其中1个(丰度,10.8%)与Calditerrivibrionitroreducens的相似度为97.8%。
稀有门(丰度小于等于1.0%)中,从热液流体和沉积物中各获得Chlorobi的1个克隆,均与陆地热泉中等嗜热的绿硫细菌Ignavibacteriumalbum的亲缘关系最近。获得Chloroflexi的2个OTUs(共5个克隆),分别与高温深部蓄水层嗜热细菌Caldilineatarbellica和浅海热液区铁和硝酸还原细菌Ardenticatenamaritima的亲缘关系最近。热液流体中获得Deinococcus-Thermus的5个克隆,其中1个OTU(2个克隆)与微嗜热的Meiothermuscerbereus的相似度为97.6%。菌苔中获得Acidobacteria的3个克隆,其中1个OTU(2个克隆)与热泉Thermoanaerobaculumaquaticus相似度达92.3%。主要OTUs的系统进化树如图1所示。
3.4古菌组成
古菌仅在沉积物和菌苔中分别获得3个OTUs和5个OTUs。这些OTUs绝大多数与陆地热泉中Crenarchaeota氨氧化细菌的亲缘关系最近(相似度,92.3%~99.1%)。菌苔中还获得2个OTUs(丰度,6.1%),与浅海热液中参与砷和铁循环的Thaumarchaeota的亲缘关系最近(相似度,91.0%和99.2%)。AM3和AM4与CandidatusNitrosocaldusyellowstonii亲缘关系最近。AM4在菌苔(丰度,50.0%)和沉积物中(丰度,60.5%)均为优势类群,AM3在菌苔中的丰度(41.3%)远高于在沉积物中的(4.0%)。AS36与CandidatusNitrososphaeragargensis的亲缘关系最近,为沉积物特有类群(丰度,36.0%)。古菌的系统进化树分析,如图2所示。
3.5氢酶基因的α-多样性
如表4所示,NAD(P)-关联的双向NiFe-氢酶基因和FeFe-氢酶基因仅在沉积物和菌苔中获得。FeFe-氢酶基因编码的氨基酸序列的多样性高于NiFe-氢酶的。菌苔中这两种氢酶的氨基酸序列的多样性均高于沉积物的。
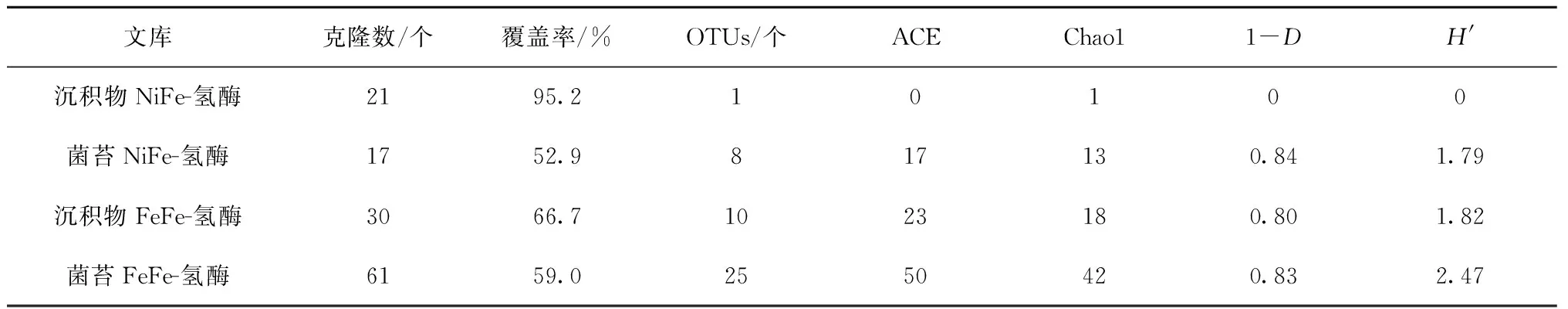
表4 印度尼西亚卡利安达岛沿海热泉NAD(P)-关联的NiFe-氢酶基因和FeFe-氢酶基因编码的氨基酸序列的α-多样性
注:OTUs:操作分类单元;ACE:ACE丰富度指数;Chao1:Chao1丰富度指数;1-D:辛普森多样性指数;H′:香农-韦弗多样性指数。
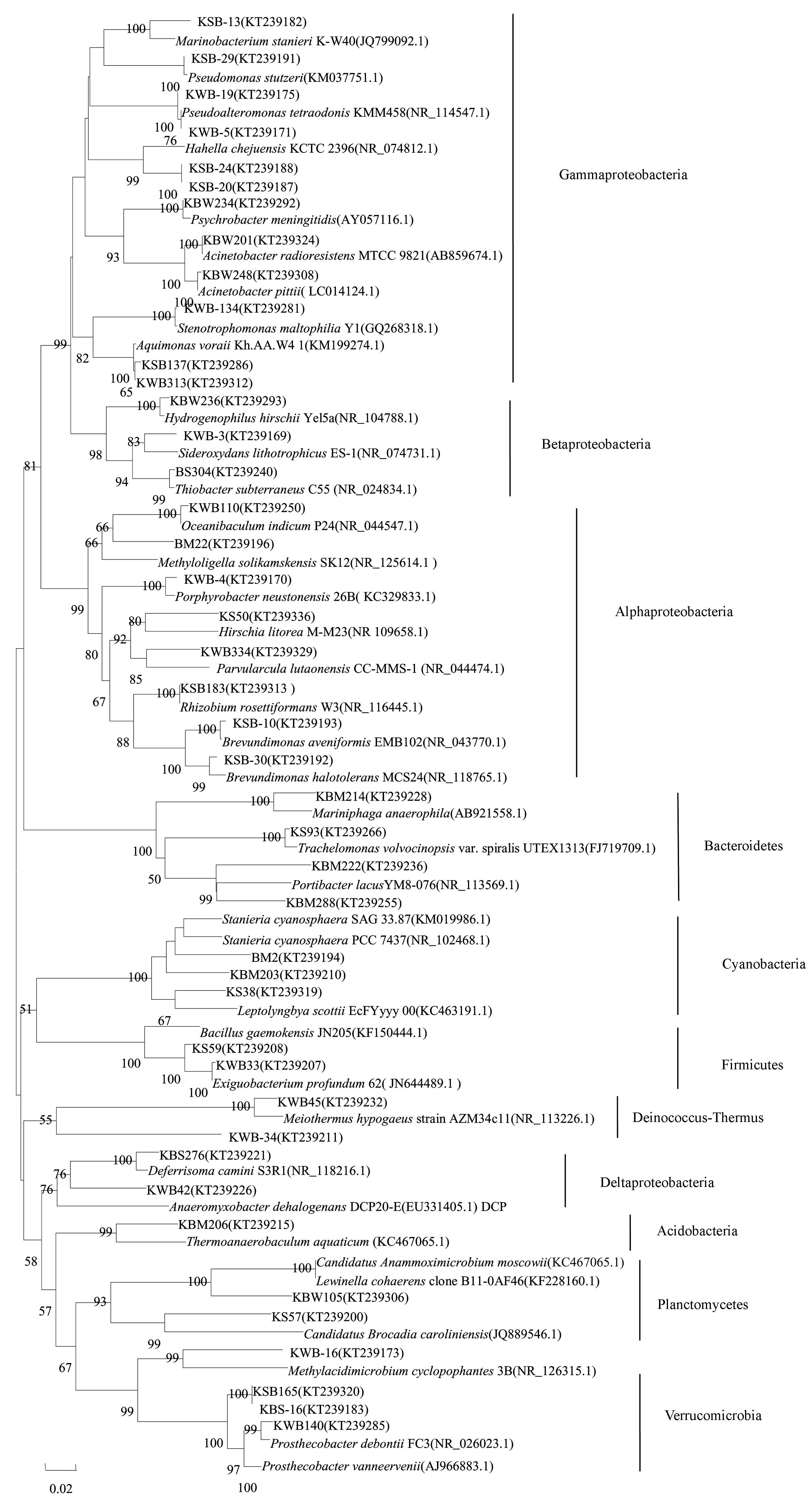
图1 印度尼西亚卡利安达岛近岸热泉细菌16S rRNA基因序列的系统进化树Fig.1 Phylogenetic tree of Bacterial 16S rRNA genes sequences from a coastal hot spring of Kalianda, Indonesia

图2 印度尼西亚卡利安达岛近岸热泉古菌16S rRNA基因序列的系统进化树Fig.2 Phylogenetic tree of archaea 16S rRNA gene sequences from a coastal hot spring of Kalianda, Indonesia
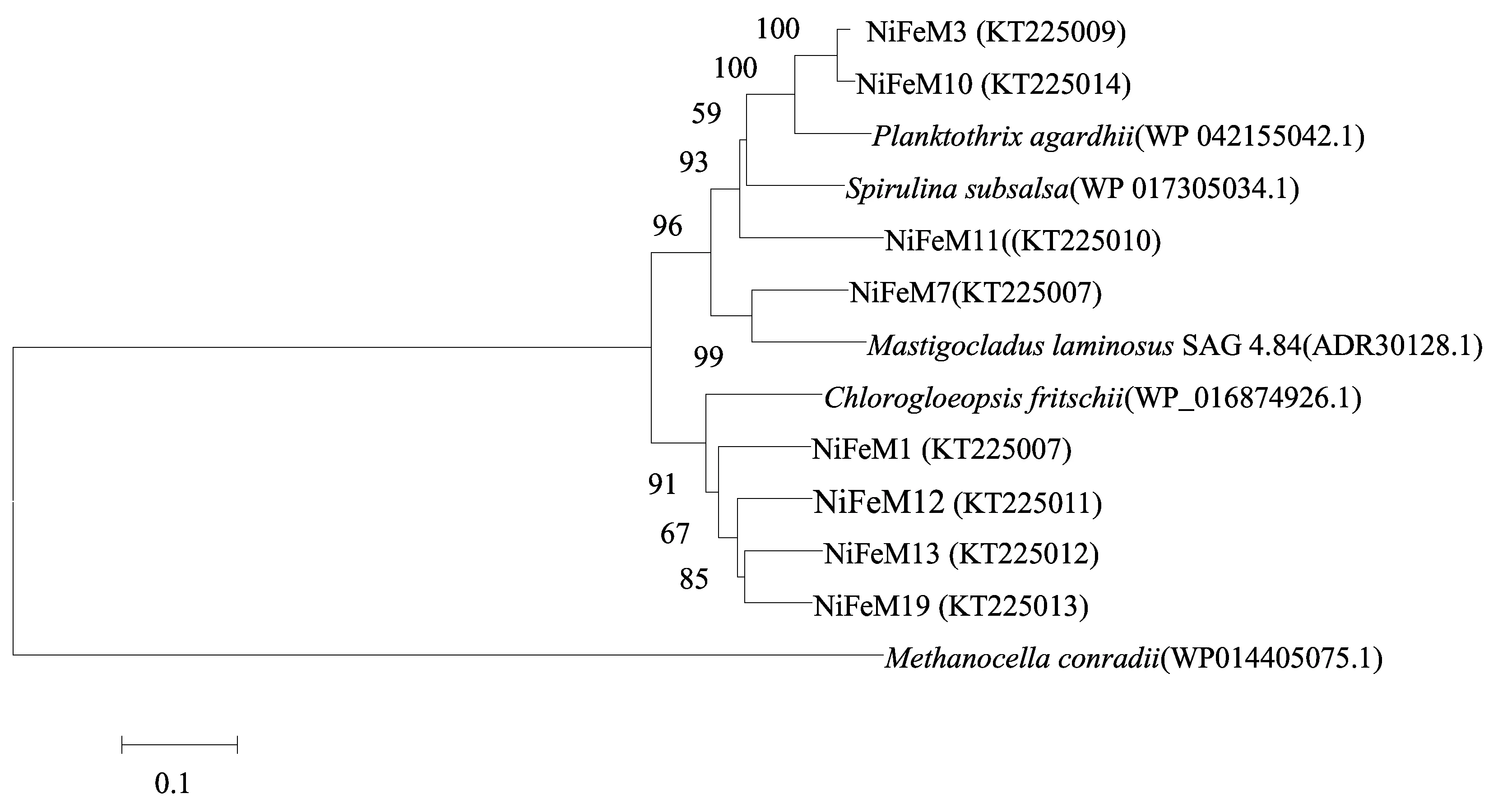
图3 印度尼西亚卡利安达岛近岸热泉NAD(P)-关联的双向NiFe-氢酶基因编码的氨基酸序列的系统进化树Fig. 3 Phylogenetic tree of deduced amino acid sequences of NAD(P)-linked NiFe-hydrogease genes from a coastal hot spring of Kalianda, Indonesia
3.6NAD(P)-关联的双向NiFe-氢酶基因的组成
NAD(P)-关联的双向NiFe-氢酶基因编码的氨基酸序列包括8个OTUs,其中沉积物中仅含有1个OTU,且与菌苔中的NiFeM12的相似度为99.2%。NiFe-氢酶均属于Cyanobacteria(相似度,80.3%~90.2%),其中5个OTUs(总丰度,77.5%)与Stigonematales的相似度最高;3个OTUs(总丰度,22.5%)与Oscillatoriophycideae的相似度最高。NiFe-氢酶氨基酸序列的系统进化树如图3所示。
3.7FeFe-氢酶基因的组成
沉积物中,FeFe-氢酶基因编码的氨基酸序列包括4个门,10个OTUs。其中Firmicutes的1个OTU,以及所有的Spirochaetes(3个OTUs),Ignavibacteriae(2个OTUs)和Thermotogae(1个OTUs)的OTUs均与热泉、油田等高温环境中FeFe-氢酶氨基酸序列的相似度最高。FeS10(丰度,40.0%)与热泉中FervidobacteriumpennivoransFeFe-氢酶氨基酸序列的相似度达97.0%,FeS3(丰度,20.1%)与嗜热SpirochaetathermophilaFeFe-氢酶氨基酸序列相似度达71.2%。这说明热泉中沉积物的产氢菌群具有嗜热特性。
菌苔FeFe-氢酶氨基酸序列与沉积物的完全不同,包括25个OTUs,属于Caldithrix、Spirochaetes、Bacteroidetes、Ignavibacteriae、Firmicute、Alphaproteobacteria和Gammaproteobacteria。其中Bacteroidetes的FeFe-氢酶丰度最高,包括9个OTUs,与海洋或淡水环境的Draconibacteriumorientale(相似度,85.2%~91.5%),Marinilabiliasalmonicolor(相似度,71.0%)和Spirochaetasmaragdinae(相似度,72.0%)的亲缘关系最近。还有一些FeFe-氢酶氨基酸序列与热泉等高温环境的Caldithrix(丰度2.9%)、Ignavibacteriae(丰度11.6%)和Thioclavapacifica(丰度1.5%)的氢酶氨基酸序列相似度最高。FeFe-氢酶氨基酸序列的系统进化树如图4所示。
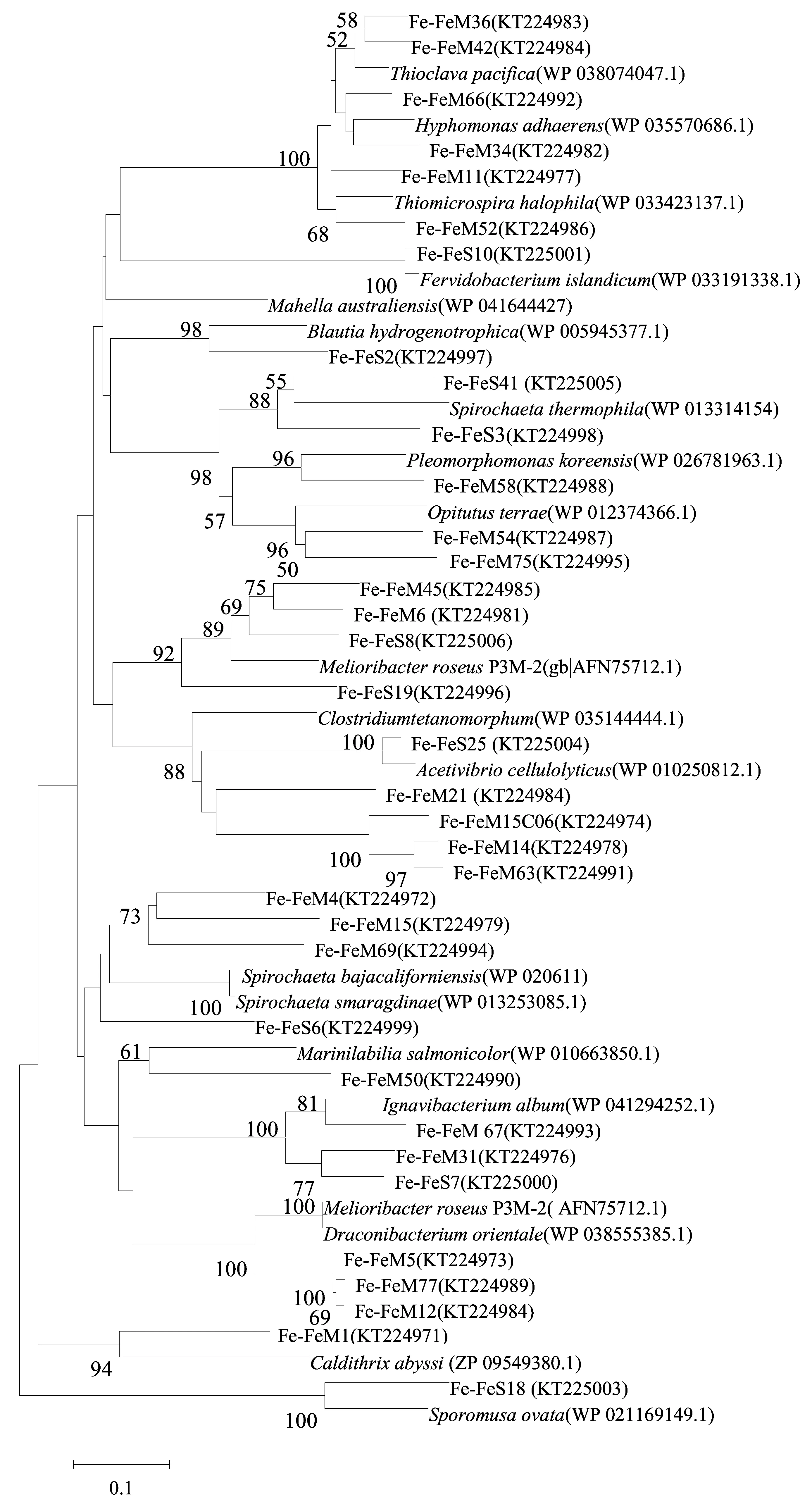
图4 印度尼西亚卡利安达岛近岸热泉FeFe-氢酶基因编码的氨基酸序列的系统进化树Fig.4 Phylogenetic tree of deduced amino acid sequences of FeFe-hydrogease from a coastal hot spring of Kalianda, Indonesia
4讨论
印度洋卡利安达岛近岸热泉发育多样性丰富的微生物,与已知浅海热液系统硫氧化还原细菌占优势不同[4-9],该系统在铁元素和氮元素循环中具有重要作用。如沉积物中与铁还原相关的嗜热细菌的丰度高于10%,这可能与沉积物中铁含量高(约为大陆地壳含量的12倍)有关。古菌包括6个种类,基本由具有氨氧化作用的Crenarchaeota组成。古菌的这种组成特征与阿尔比斯山地下热泉古菌的组成相似[29]。根据亲缘关系最近的种类的生态功能还可以推断,该系统在氢氧化、甲基营养、硫氧化等生态过程也具有重要作用。与16s rRNA结果一致,热泉FeFe-氢酶氨基酸序列也与Firmicutes、Bacteroidetes、Alphaproteobacteria和Gammaproteobacteria相关;但占优势的FeFe-氢酶序列与嗜热的Thermotogae、Spirochaetes和Ignavibacteriae相关,说明热泉中通过FeFe-氢酶产氢的菌群为丰度较小的类群。这些产氢菌群可能为铁还原和硝酸还原等过程提供电子供体和能量。热泉系统中的双向NiFe-氢酶均属于Cyanobacteria,这些Cyanobacteria种类在白天进行光合作用时,通过双向NiFe-氢酶吸收氢气并释放过剩的电子[30—31],在夜晚则通过该酶的可逆反应厌氧产氢,从而使菌体保持稳定的氧化还原态[32]。
温度和盐度是热泉系统微生物组成和分布的控制因素。研究中,丰度高的细菌种类主要与海洋细菌的亲缘关系最近,包括Gammaproteobacteria、Alphaproteobacteria和Bacteroidetes等[33]。这些种类可能来源于海洋环境,在地层内部的热液流体上行时随海水混入热泉系统。古菌、Betaproteobacteria、Deltaproteobacteria和Firmicutes中丰度高的种类,所有Deferribacteres种类,以及Chlorobi、Chloroflexi、Deinococcus-Thermus和Acidobacteria等稀有门的大部分种类,与高温环境微生物的亲缘关系最近,这些种类可能来源于地层内部。这种主要由海洋微生物组成且含有少量嗜热微生物的沿海热泉,不同于Hobel等[10]报道的,温度相对高的潮间带热泉(大于80℃)主要由陆地嗜热细菌组成;温度相对低的热泉(小于等于70℃)主要由中等嗜热的细菌组成,同时存在中温海洋和陆地细菌。这种差异可能由于热泉系统分布于潮下带,且温度相对较低所造成的(65℃)。此外,与嗜热相关的种类主要来源于陆地热泉以及高温地下水层,少量来源于深海热液区,这可能与热泉盐度为4有关。结合淡水属性的潮间带热泉种类与陆地嗜热微生物或陆地热泉微生物的亲缘关系最近[10],而盐度接近海水的浅海热液系统,其种类与深海热液微生物的亲缘关系最近[4—9]的结果,本研究结果也支持了盐度对浅海热液系统微生物组成影响的结论。
研究中不同氢酶氨基酸序列的组成和分布特征,也证实了温度和盐度对功能微生物类群的影响。沉积物中FeFe-氢酶的氨基酸序列主要与嗜热微生物FeFe-氢酶的氨基酸序列相似度最高,这可能与沉积物温度较高有关。Bacteroidetes是近岸优势类群之一[33],菌苔中Bacteroidetes的16s rRNA 基因和FeFe-氢酶氨基酸序列丰度均为最高,说明菌苔中的这些优势细菌和产氢类群可能来源于海洋环境。此外,菌苔中至少有22.5% 的NiFe-氢酶氨基酸序列与海洋或淡水环境Cyanobacteria的NiFe-氢酶氨基酸序列的相似度最高,也说明这些Cyanobacteria可能来源于海水或陆地环境。菌苔细菌的中温属性可能与其更易于与海水混合有关。
参考文献:
[1]Dando P R, Hughes J A, Leahy Y, et al. Gas venting rates from submarine hydrothermal areas around the island of Milos, Hellenic Volcanic Arc[J]. Cont Shelf Res, 1995, 15(8): 913-929.
[2]Hoaki T, Nishijima M, Miyashita H, et al. Dense community of hyperthermophilic sulfur-dependent heterotrophs in a geothermally heated shallow submarine biotope near Kodakara-jima Island, Kagoshima, Japan[J]. Appl Environ Microbiol, 1995, 61(5): 1931-1937.
[3]Tarasov V G, Gebruk A V, Mironov A N, et al. Deep-sea and shallow-water hydrothermal vent communities: two different phenomena?[J]. Chem Geol, 2005, 224(1/3): 5-39
[4]Maugeri T L, Lentini V, Gugliandolo C, et al. Bacterial and archaeal populations at two shallow hydrothermal vents off Panarea Island (Eolian Islands, Italy)[J]. Extremophiles, 2009, 13(1): 199-212.
[5]Zhang Yao, Zhao Zihao, Chen C T A, et al. Sulfur metabolizing microbes dominate microbial communities in andesite-hosted shallow-sea hydrothermal systems[J]. PLoS One, 2012, 7(9): e44593.
[6]Tang Kai, Liu Keshao, Jiao Nianzhi, et al. Functional metagenomic investigations of microbial communities in a shallow-sea hydrothermal system[J]. PLoS One, 2013, 8(8): e72958.
[7]Lentini V, Gugliandolo C, Bunk B, et al. Diversity of prokaryotic community at a shallow marine hydrothermal site elucidated by illumina sequencing technology[J]. Curr Microbiol, 2014, 69(4): 457-466.
[8]Price R E, Lesniewski R, Nitzsche K S, et al. Archaeal and bacterial diversity in an arsenic-rich shallow-sea hydrothermal system undergoing phase separation[J]. Front Microbiol, 2013, 4: 158.
[9]Hirayama H, Sunamura M, Takai K, et al. Culture-dependent and-independent characterization of microbial communities associated with a shallow submarine hydrothermal system occurring within a coral reef off Taketomi island, Japan[J]. Appl Environ Microbiol, 2007, 73(23): 7642-7656.
[10]Hobel C F V, Marteinsson V T, Hreggvidsson G, et al. Investigation of the microbial ecology of intertidal hot springs by using diversity analysis of 16S rRNA and chitinase genes[J]. Appl Environ Microbiol, 2005, 71(2): 2771-2776.
[11]Lane D J. 16S/23S sequencing[M]//Stackbrandt E, Goodfellow M. Nucleic Acid Techniques in Bacterial Systematics. New York: John Wiley & Sons, 1991: 115-176.
[12]DeLong E F. Archaea in coastal marine environments[J]. Proc Natl Acad Sci U S A, 1992, 89(12): 5685-5689.
[13]Barz M, Beimgraben C, Staller T, et al. Distribution analysis of hydrogenases in surface waters of marine and freshwater environments[J]. PLoS One, 2010, 5(11): e13846.
[14]Schmidt O, Drake H L, Horn M A. Hitherto unknown [Fe-Fe]-hydrogenase gene diversity in anaerobes and anoxic enrichments from a moderately acidic fen[J]. Appl Environ Microbiol, 2010, 76(6): 2027-2031.
[15]Codon Code Corporation (2011) Codon code aligner[EB/OL]. http://www.codoncode.com/aligner/.
[16]RIMER-E, multivariate statistics for ecologists[EB/OL]. http://www.primer-e.com/.
[17]Schloss P D, Handelsman J. Introducing DOTUR, a computer program for defining operational taxonomic units and estimating species richness[J]. Appl Environ Microbiol, 2005, 71(3): 1501-1506.
[18]Hall T A. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT[J]. Nucleic Acids Symp Ser, 1999, 41(2): 95-98.
[19]Thompson J D, Higgins D G, Gibson T J. CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice[J]. Nucleic Acids Res, 1994, 22(22): 4673-4680.
[20]Kumar S, Tamura K, Jakobsen I B, et al. MEGA2: molecular evolutionary genetics analysis software[J]. Bioinformatics, 2001, 17(12): 1244-1245.
[21]Staudigel H, Albarède F, Blichert-Toft J, et al. Geochemical Earth Reference Model (GERM): description of the initiative[J]. Chem Geol, 1998, 145(3/4): 153-159.
[22]Chen Ming, Yan Yongliang, Zhang Wei, et al. Complete genome sequence of the type strainPseudomonasstutzeriCGMCC 1.1803[J]. J Bacteriol, 2011, 193(21): 6095.
[23]Beckwith C R, Edwards M J, Lawes M, et al. Characterization of MtoD fromSideroxydanslithotrophicus: a cytochrome c electron shuttle used in lithoautotrophic growth[J]. Front Microbiol, 2015, 6: 332.
[24]Doronina N V, Kaparullina E N, Trotsenko Y A.Methyloversatilisthermotoleranssp. nov., a novel thermotolerant facultative methylotroph isolated from a hot spring[J]. Int J Syst Evol Microbiol, 2014, 64(1): 158-164.
[25]Hirayama H, Takai K, Inagaki F, et al.Thiobactersubterraneusgen. nov., sp. nov., an obligately chemolithoautotrophic, thermophilic, sulfur-oxidizing bacterium from a subsurface hot aquifer[J]. Int J Syst Evol Microbiol, 2005, 55(1): 467-472.
[26]Vésteinsdóttir H, Reynisdóttir D B, Örlygsson J.Hydrogenophilusislandicussp. nov., a thermophilic hydrogen-oxidizing bacterium isolated from an Icelandic hot spring[J]. Int J Syst Evol Microbiol, 2011, 61(2): 290-294.
[27]Slobodkina G B, Reysenbach A L, Panteleeva A N, et al.Deferrisomacaminigen. nov., sp. nov., a moderately thermophilic, dissimilatory iron(III)-reducing bacterium from a deep-sea hydrothermal vent that forms a distinct phylogenetic branch in theDeltaproteobacteria[J]. Int J Syst Evol Microbiol, 2012, 62(10): 2463-2468.
[28]Iino T, Nakagawa T, Mori K, et al.Calditerrivibrionitroreducensgen. nov., sp. nov., a thermophilic, nitrate-reducing bacterium isolated from a terrestrial hot spring in Japan[J]. Int J Syst Evol Microbiol, 2008, 58(7): 1675-1679.
[29]Weidler G W, Gerbl F W, Stan-Lotter H.Crenarchaeotaand their role in the nitrogen cycle in a subsurface radioactive thermal spring in the Austrian Central Alps[J]. Appl Environ Microbiol, 2008, 74(19): 5934-5942.
[30]Vignais P M, Billoud B. Occurrence, classification, and biological function of hydrogenases: an overview[J]. Chem Rev, 2007, 107(10): 4206-4272.
[31]Appel J, Phunpruch S, Steinmüller K, et al. The bidirectional hydrogenase ofSynechocystissp. PCC 6803 works as an electron valve during photosynthesis[J]. Arch Microbiol, 2000, 173(5/6): 333-338.
[32]Troshina O, Serebryakova L, Sheremetieva M, et al. Production of H2by the unicellular cyanobacteriumGloeocapsaalpicolaCALU 743 during fermentation[J]. Int J Hydr Energ, 2002, 27(11/12): 1283-1289.
[33]Zinger L, Amaral-Zettler L A, Fuhrman J A, et al. Global patterns of bacterial beta-diversity in seafloor and seawater ecosystems[J]. PLoS One, 2011, 6(9): e24570.
Diversity of microbe and hydrogenase genes from a coastal hot spring of Kalianda, Indonesia
He Peiqing1, Dewi Seswita Zilda2, Li Jiang1, Zhang Xuelei1, Cui Jingjing3,Bai Yazhi3, Gintung Patantis2, Ekowati Chasanah2
(1.MarineEcologyResearchCenter,TheFirstInstituteofOceanography,StateOceanicAdministration,Qingdao266061,China; 2.ResearchCenterforMarineandFisheriesProductProcessingandBiotechnology,AgencyforMarineandFisheriesResearchandDevelopment,MinistryofMarineandFisheriesAffairs,Jakarta40115,Indonesia; 3.KeylaboratoryofStateOceanicAdministrationforMarineSedimentology&EnvironmentalGeology,TheFirstInstituteofOceanography,StateOceanicAdministration,Qingdao266061,China)
Abstract:During July, 2011, samples were collected from a coastal hot spring of Kalianda, Indonesia. Clone libraries of 16S rRNA genes of bacteria and archaea, and hydrogenase genes were constructed. The sequences were determined, and the diversity were also analyzed. The results demonstrated that the coastal hot spring hosted 16 phyla. Proteobacteria was dominant in hydrothermal fluid and sediment, accounting for 59.5% and 73.3%, respectively. Cyanobacteria was the most abundant in mat with abundance of 56.5%. Ammonia oxidizing Crenarchaeota was predominant in archaea. More than 70% of the species were most related to marine microbes, indicating the marine property of this system. About 20% of the species were most related to the thermophilic or moderate thermophilic microbes from terrestrial hot springs. These species might originate from the hyperthermal subfloor and involve in the process of iron oxidation and reduction, hydrogen oxidation, sulfur oxidation and nitrate reduction. The composition and distribution of NAD(P)-linked bidirectional NiFe-hydrogenase and FeFe-hydrogenase genes were also shaped by temperature and salinity. Our research provided an insight into the shallow-sea hydrothermal system.
Key words:Kalianda Indonesia;coastal hot spring;16S rRNA genes;hydrogenase;diversity
收稿日期:2015-07-07;
修订日期:2016-03-24。
基金项目:中央级公益性科研院所基本科研业务费专项资金项目(2011T04);国家海洋局海洋生物活性物质与现代分析技术重点实验室开放课题(MBSMAT-2015-06,MBSMAT-2011-03,MBSMAT-2012-2)。
作者简介:何培青(1972-),女,山东省济南市人,博士,从事海洋微生物研究。E-mail:hepeiqing@fio.org.cn
中图分类号:Q938
文献标志码:A
文章编号:0253-4193(2016)06-0119-11
何培青, Dewi Seswita Zilda, 李江,等. 印度尼西亚卡利安达岛近岸热泉微生物和氢酶基因的多样性[J].海洋学报,2016,38(6):119—129, doi:10.3969/j.issn.0253-4193.2016.06.013
He Peiqing, Dewi Seswita Zilda, Li Jiang, et al. Diversity of microbe and hydrogenase genes from a coastal hot spring of Kalianda, Indonesia[J]. Haiyang Xuebao,2016,38(6):119—129, doi:10.3969/j.issn.0253-4193.2016.06.013

