南极菲尔德斯半岛可培养土壤微生物多样性及理化性质鉴定
刘春影, 丛柏林, 王能飞, 王波, 尹晓斐, 刘峰
(1.山东大学(威海) 海洋学院, 山东 威海 264209; 2.国家海洋局第一海洋研究所 生态研究中心, 山东 青岛266061)
南极菲尔德斯半岛可培养土壤微生物多样性及理化性质鉴定
刘春影1, 丛柏林2*, 王能飞2, 王波2, 尹晓斐2, 刘峰2
(1.山东大学(威海) 海洋学院, 山东 威海 264209; 2.国家海洋局第一海洋研究所 生态研究中心, 山东 青岛266061)
摘要:为了探索南极可培养土壤微生物的多样性,本研究对中国第31次南极科学考察采集自南极菲尔德斯半岛的5份土壤样品进行了细菌、真菌的分离培养。选择形态差异较大的细菌和真菌进行了16S rDNA和ITS鉴定及系统发育分析。最终共鉴定得到20个属的33株细菌和6个属的8株真菌,其中8株细菌,10株真菌序列相似性较低,可能是新种。该结果表明南极菲尔德斯半岛地区具有丰富的微生物多样性,其中假单胞菌属的细菌居多。对分离得到的细菌和真菌分别进行理化性质和胞外酶活性鉴定,实验结果显示,分离获得的细菌和真菌绝大多数可产生水解酶类并同化多种碳源。初步认定这些微生物在参与南极物质代谢、适应南极极端环境方面发挥作用。本研究丰富了对南极菲尔德斯半岛可培养土壤微生物多样性的认识,并筛选获得了一些产低温酶特性的菌株,这为极地微生物资源的利用研究奠定了基础。
关键词:菲尔德斯半岛;微生物多样性;系统进化分析;生理生化特性
1引言
南极位于地球的最南端,由陆地和海洋两部分构成,终年被冰雪覆盖,气候酷寒干燥、强光辐射,是地球上最冷最干的地区。其独特的地理构成和极端的气候环境,虽然在一定程度上限制了南极动植物、微生物等生物资源的生存及繁衍,但也使得南极地区的动植物及微生物资源的种类和性质有别于世界其他地区,具有耐低温、耐高盐、抗辐射等特点。因此从南极土壤中筛选具有这种特点的微生物,不仅可以为开发利用微生物资源提供重要的参考依据[1],还可以为人类了解低温微生物在南极自然环境下的物质循环、生物地球化学过程等提供重要的线索[2]。
最近许多研究发现,尽管南极自然条件非常恶劣,但是该地区土壤中微生物的数量和种类却非常丰富[3]。如在南极麦克默多干谷(Dry Valleys)地区,Cowan等[4]对土壤中的微生物数量进行统计,发现该地区分布着大量细菌、古菌、真菌和线虫,其中细菌有14个门,数量最大的是酸杆菌(Acidobacteria)、放线菌(Actinobacteria)和拟杆菌(Bacteroidetes)。Teixeira等[5]对金钟湾(Admiralty Bay)维管束植物根际土壤细菌的多样性做了研究,发现厚壁菌(Firmicutes)最为丰富,优势菌类为双歧杆菌(Bifidobacterium),弓形杆菌(Arcobacter)和柔嫩梭菌(Faecalibacterium)。Aislabie等[6]在维多利亚陆地(Victoria Land) 4个站点采样,采用非培养和培养相结合的方法来评估土壤细菌群落的多样性,发现分裂类杆菌(Bacteroidetes)、放线菌(Actinobacteria)、变形杆菌(Proteobacteria)、红热异常球菌(Thermus-Deinococcus)、酸杆菌(Acidobacteria)、厚壁菌(Firmicutes)和蓝细菌(Cyanobacteria)为优势菌类。在南极其他稍微温暖、潮湿地区的土壤,如凯勒半岛(Keller Peninsula)的无冰区中,变形菌(Proteobacteria)大量存在。大量研究表明南极土壤中具有较丰富的微生物多样性,它们在基础研究和实际应用方面都有着广阔的前景[7]。
由于南极独特的地理位置和气候特点,在这个区域也发现了一些新的菌种,如Hirsch等[8]从南极麦克默多干谷土壤中分离得到3株抗干旱、抗紫外线的异常球菌新种;Reddy等[9]从南极McMurdo站附近的湖泊中分离到13株橙色产生菌,属于Planococcuspsychrophilusspp.和Planococcusantarcticusspp.,并利用16S rDNA序列、细菌形态、脂肪酸组成等方面证明它们属于新的种;董宁[10]从格罗夫山土壤中共分离得到 5 株与现有菌种相似度低于 96.5%的菌株,属于Rhizobiumpseudoryzae、Bacillusmethanolicus、Scopulibacillusdarangshiensis、Bacillusmethanolicus和Deinococcusficus,为潜在的细菌新种(属);丁壮[11]从南极半岛的10个样品中分离得到真菌136株,并对65株真菌采用ITS序列进行分子鉴定,其中有7株菌株其ITS序列与已知序列相似度均较低,属于Mortierellaparvisporastrain、Mortierellaelongatulastrain、Acremoniumluzulae、Pyriculariasp.、Lecythophorasp.、Helotialessp.、Hyphodiscussp.可能为真菌新种甚至新属。大量的研究成果表明南极地区不仅是个潜在、重要的微生物资源库,也是一块有待认知的大陆,因此这个区域还有很多不为人知的微生物新菌种需要我们去探寻。
近年来从低温微生物中筛选产低温酶的研究已成为许多专家学者的研究热点。在低温酶中,对蛋白酶和脂肪酶的研究较多[12]。脂肪酶可应用于许多方面,如作为食品风味改变剂、去污添加剂或立体特异性催化剂等;蛋白酶可应用于奶酪成熟、牛奶加工、洗涤剂等[13],均具有相当大的市场潜力。Ray等[14]从南极Schirmacher Oasis 土壤中筛选到1株分泌酸性蛋白酶的耐冷型酵母Candidahumicola,其在低温条件下具有较高的产酶能力;Vazquez等[15]在南极乔治王岛土壤中分离到了3株产胞外蛋白酶的低温假单胞菌,在20℃时具有最高的蛋白水解活性。因此合理开发利用南极的低温微生物资源,不仅可以丰富人类利用的微生物种类,将其应用于医药、食品、日化及环保等诸多领域,将会给人们的生活带来巨大的方便[16]。
菲尔德斯半岛是南极洲的半岛,位于南设得兰群岛的乔治王岛西南端,东南面是马克斯韦尔湾,长7 km,取名自邻近的菲尔德斯海峡,具体位置见图1。菲尔德斯半岛属无冰区,中国南极长城站就在其附近。本研究以中国第31次南极科学考察采自南极菲尔德斯半岛5个站位的土壤样品为研究对象,通过细菌16S和真菌ITS基因序列扩增进行系统进化分析,初步揭示了南极菲尔德斯半岛可培养土壤微生物的多样性。对分离的可培养细菌进行理化性质研究,为进一步研究筛选产低温酶(脂肪酶、蛋白酶、淀粉酶和纤维素酶等)特性的极地微生物奠定了基础。
2材料与方法
2.1样品采集站位
研究样品来自中国第31次南极科学考察所取得的菲尔德斯半岛的部分土壤样品,样品采集站位见表1。土壤样品用无菌铲取0~5 cm深度植物根茎处的土样,装入无菌样品袋中4℃低温无菌保存,回实验室进行菌株的分离培养。
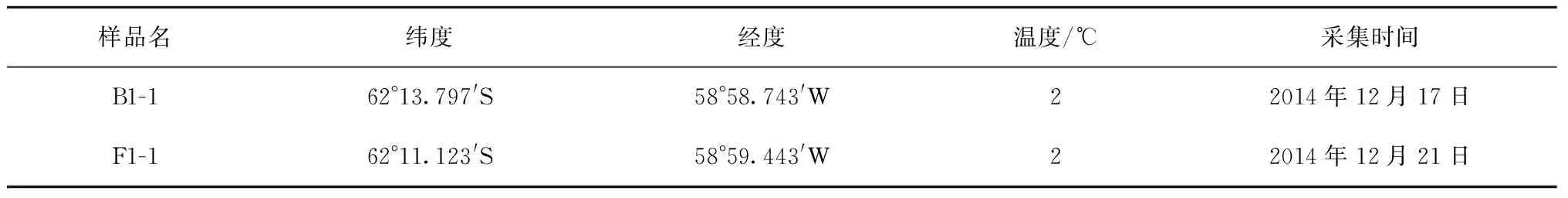
表1 样品采集站位

续表1
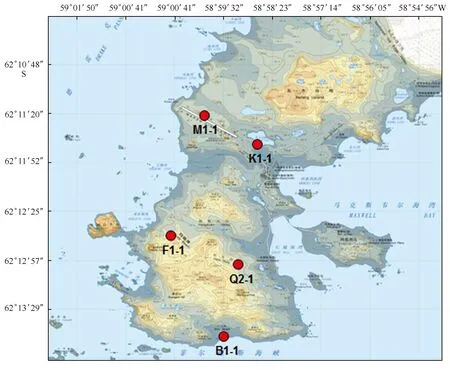
图1 菲尔德斯半岛地理位置Fig.1 The location of Fildes Peninsula
2.2分离培养基
(1)细菌培养基
2216E培养基:蛋白胨5 g,酵母粉1 g,琼脂18 g,陈海水1 000 mL,121℃(98.1 kPa)高压灭菌20 min,加终浓度为100 μg/mL制霉菌素以抑制真菌生长。
(2)真菌培养基
土豆培养基(PDA):土豆200 g,葡萄糖10 g,琼脂17 g,蒸馏水l 000 mL,121℃下高压湿热灭菌20 min,加终浓度为100 μg/mL的氨苄以抑制细菌生长。
(3)产酶培养基
产淀粉酶培养基:淀粉20 g,KNO31 g,K2HPO40.5 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,纯化琼脂17 g,蒸馏水1 000 mL。
产纤维素酶培养基:羧酸纤维素钠10 g,KNO31 g,K2HPO40.5 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,纯化琼脂17 g,蒸馏水1 000 mL。
产酪蛋白酶培养基:酪蛋白4 g,KNO31 g,K2HPO40.5 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,纯化琼脂17 g,蒸馏水1 000 mL。
2.3可培养菌株的筛选纯化及保种
将采集的土壤样品在8℃冰箱中自然晾干后,称取约1 g置于10 mL无菌水中,振荡混匀后静置过夜。将预处理后的样品悬液系列稀释至10-1、10-2、10-3、10-4、10-5,分别取100 μL涂布2216E和PDA培养基平板,于12℃培养。培养1~2周后,根据菌落形态、色素、干燥等特征,挑取形态差异较大的菌株进行划线纯化。挑取纯化后的单菌落,分别在4℃下用2216E、PDA培养基斜面和-80℃下用30%甘油保种。
2.4分子鉴定及系统发育分析
2.4.1细菌16S rRNA扩增
细菌总DNA的提取按细菌总DNA提取试剂盒(Tiangen)操作手册进行。采用通用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′及1492R:5′-GGTTACCTTGTTACGACTT-3′,进行16S rRNA基因的扩增。50μL PCR反应体系:2×Taq PCR MasterMix(Tiangen) 25 μL,引物各2 μL,模板DNA 1 μL,ddH2O 20 μL。扩增程序为:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸1.5 min,共30个循环;最后72℃延伸10 min。
2.4.2真菌ITS基因序列扩增
将筛选纯化的真菌在PDA培养基上培养1周后,刮取约50 mg菌苔,于研钵中液氮研磨,参照Tiangen新型植物基因组DNA提取试剂盒(CB3型离心柱)操作说明提取真菌DNA。采用引物ITSl:5′-TCCGTAGGTGAACCTGCGG-3′和ITS4:5′-TCCTCCGCTTATTGATATGC-3′进行ITS基因序列的扩增。50 μL PCR反应体系:2×Taq PCR MasterMix (Tiangen) 25 μL,引物各2 μL,模板DNA 3 μL,ddH2O 18 μL。扩增程序为:94℃DNA双链预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸40 s,共30个循环;最后72℃延伸10 min。
2.4.3系统发育树的构建
各取5 μL PCR扩增产物经1%琼脂糖凝胶电泳检测,有特异明亮条带的PCR产物交由上海桑尼公司测序。将所测定的细菌的 16S rDNA和真菌ITS rDNA基因序列与 GenBank 数据库进行Blast分析(http://www.ncbi.nlm.nih.gov/blast/blast.cgi),选取与实验菌株亲缘关系较近的菌株及南极常见菌株用软件ClustalX进行序列比对,采用 MEGA4.0 软件的邻接法(neighbor-joining method)进行系统发育分析,构建系统发育树。与模式菌株的基因序列相似性比较利用 EzTaxon-e Database进行(http://eztaxon-e.ezbiocloud.net)。
2.5细菌理化性质鉴定
细菌的理化性质采用非苛养非肠道革兰氏阴性杆菌鉴定试剂盒API NE20(NE20)。根据分子鉴定结果选取细菌每个种属的代表性菌株进行测定,培养温度设为12℃。具体操作步骤按API 20 NE说明书进行。
2.6真菌活性鉴定
筛选产淀粉酶、纤维素酶和酪蛋白酶的菌株参照靳永轩[17]的方法进行。
(1)淀粉酶活性测定
用灭菌竹签点种,每个平板点7株菌,12℃培养,待菌种生长良好时,在菌落周围滴加新鲜配置的碘液数分钟后,用清水冲去多余碘液检测透明圈。如有淀粉酶产生,遇到碘液不变为蓝色,形成透明圈,圈的大小表示淀粉酶活性强弱;如不产生淀粉酶,则菌落周围部位遇到碘液呈蓝色。
(2)纤维素酶活性测定
用灭菌竹签点种,每个平板点7株菌,12℃培养,待菌种生长良好时,在长出菌落的培养基上,覆盖 1 mg/mL 的刚果红溶液,10~15 min 后,倒去刚果红溶液,加入 1 mol/L的 NaCl 溶液,15 min后倒掉NaCl溶液,菌落周围出现无色透明圈者为阳性。
(3)酪蛋白酶活性测定
用灭菌竹签点种,每个平板点7株菌,12℃培养培养 1 至 2 周。在长出菌落的培养基上,覆盖 40%的三氯乙酸 10~15 min 后,倒去三氯乙酸溶液,菌落周围出现透明圈者为阳性。
3结果
3.1可培养菌株的分子鉴定
从南极菲尔德斯半岛采集的5份土壤样品中分离的微生物,根据菌落大小、颜色、形态等特征的不同共分离获得83株细菌和29株真菌。分别进行16S和ITS鉴定,共鉴定得到4个门20个属的33株细菌和4个纲6个属的8株真菌,具体见表2和表3。33 株细菌中变形菌门 (Proteobacteria) 23株,厚壁菌门(Firmicutes) 1株,放线菌门(Actinobacteria) 5株,拟杆菌门(Bacteroidetes) 4株。变形菌门中属假单胞菌属(Pseudomonas)最多,有7株。5份土壤样品中细菌种属的分布也有差别,分布较广的为变形菌门(Proteobacteria)中的假单胞菌属(Pseudomonas)和Massilia以及放线菌门(Actinobacteria)中的节细菌属(Arthrobacter)。其中假单胞菌属(Pseudomonas)和Massilia在样品F1-1、K1-1、M1-1和Q2-1中均有分布,节细菌属(Arthrobacter)在样品B1-1、F1-1、K1-1和M1-1中均有分布。一般16S rDNA序列相似性小于98%则可认为属于潜在新种[18],33株细菌中1EF2、2M1lan、2PK12、2PK1、2PK6、2PK8、2PM12和2PM7的16S rDNA序列最高相似性均小于98%,推测这8株菌可能为6个潜在细菌新种(表4)。所有菌种序列均已提交至Gene Bank,Accession No.为 KT991031-KT991142。
真菌鉴定结果表明筛选得到的真菌属于4个纲6个属:Mortierellomycotina的被孢霉属(Mortierella),锤舌菌纲(Leotiomycetes)中的地丝菌属(Geomyces)、假散囊菌属(Pseudeurotium)及Hymenoscyphus,粪壳菌纲(Sordariomycetes)中的油瓶霉属(Lecythophora),微球黑粉菌纲(Microbotryomycetes)的红酵母属(Rhodotorula),其优势真菌为地丝菌属菌株。其中菌株2PQ42、W2-1、2PM2、1PM5、1EK4-8、1PM4、2EB6、2EK5、2PK2和2PK13的ITS序列最高相似性均小于97%,一般ITS序列相似性小于97%则可认为属于不同种,序列相似性小于95%则可认为属于不同属[19],因此推测这10株菌可能为3个新种,2个新属(表4)。由以上结果可以看出,南极菲尔德斯半岛土壤中的微生物具有较丰富的多样性,这为以后筛选具有特殊功能的菌株和发现新菌种提供了基础。

表2 菲尔德斯半岛土壤中可培养细菌的分离鉴定

表3 菲尔德斯半岛土壤中可培养真菌的分离鉴定
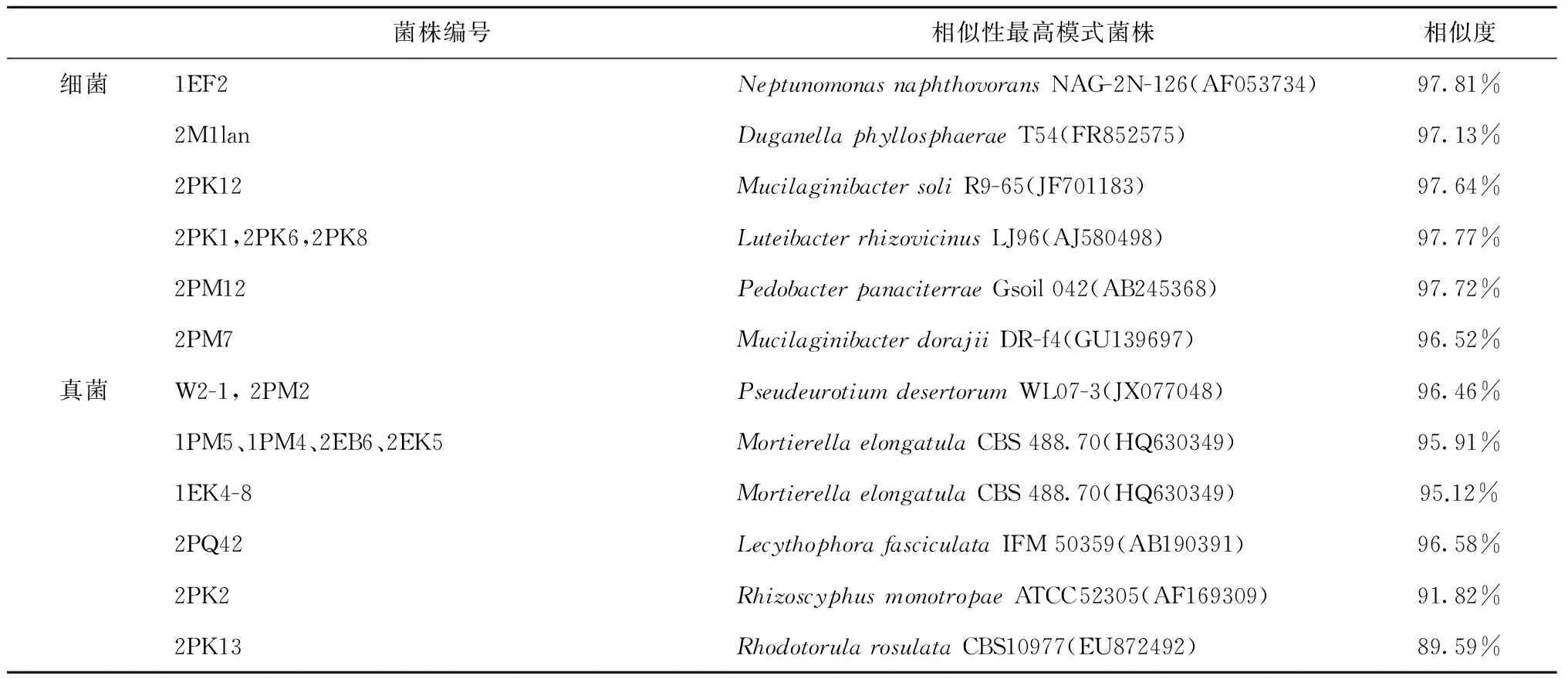
表4 所有疑似新种菌株序列相似性比较结果
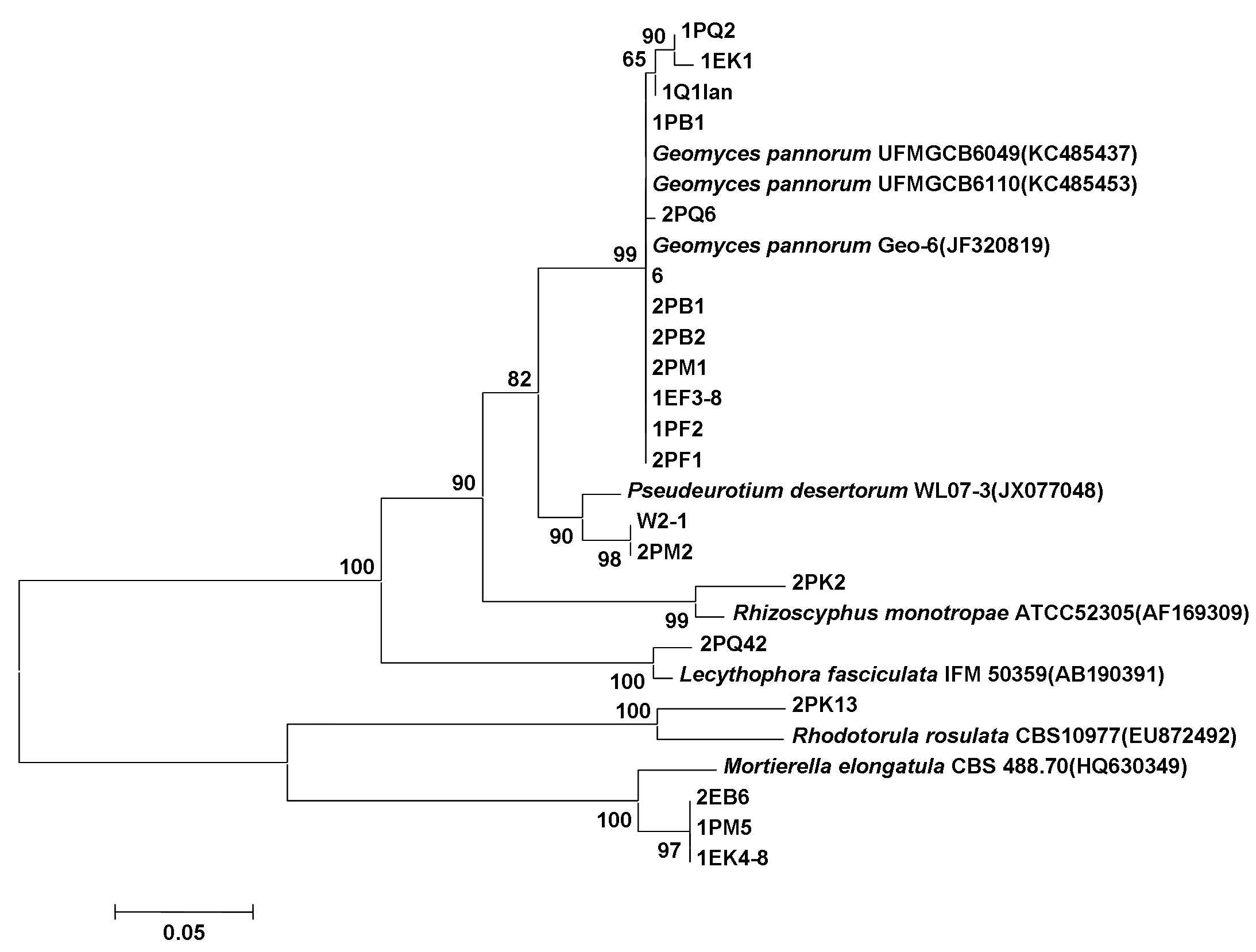
图3 真菌ITS基因序列构建的菌株系统进化树Fig.3 The Antarctica fungus Phylogenetic trees based on ITS sequences
3.2可培养土壤微生物系统发育分析
根据细菌16S rDNA和真菌ITS基因序列,使用NJ法建树,各分支上的数值为经l 000次bootstrap后的置信度值,构建的菌株系统进化树分别如图2、图3所示。
3.3可培养细菌的理化性质测定
从第31次南极科考样品中分离到的细菌中选取不同种属的代表性菌株各1株,采用非苛养非肠道革兰氏阴性杆菌鉴定试剂盒API NE20测定其理化性质(表5)。结果表明测定的33株菌中,90.91%的菌株可产生α-葡萄糖苷酶,69.70%的菌株可以产生蛋白酶,72.73%的菌株可产生脲酶,8株产β-半乳糖苷酶。实验菌株具有代谢各种有机物和转化硝酸盐的能力,如菌株2EK2能将硝酸盐还原成亚硝酸盐和氮气,能产生精氨酸双水解酶、脲酶、α-葡萄糖苷酶和蛋白酶,同化葡萄糖、甘露醇、葡萄糖酸钾、羊蜡酸、己二酸、苹果酸和枸橼酸钠;菌株2PM3lan能将硝酸盐还原成氮气,产生α-葡萄糖苷酶和蛋白酶,全部同化测定的12种物质;菌株2PF3lan能产生精氨酸双水解酶、脲酶、α-葡萄糖苷酶、蛋白酶和β-半乳糖苷酶,同化葡萄糖、甘露糖、甘露醇、乙酰葡萄糖胺、麦芽糖、葡萄糖酸钾、苹果酸、枸橼酸钠和苯乙酸。

表5 可培养细菌API生理生化测定结果
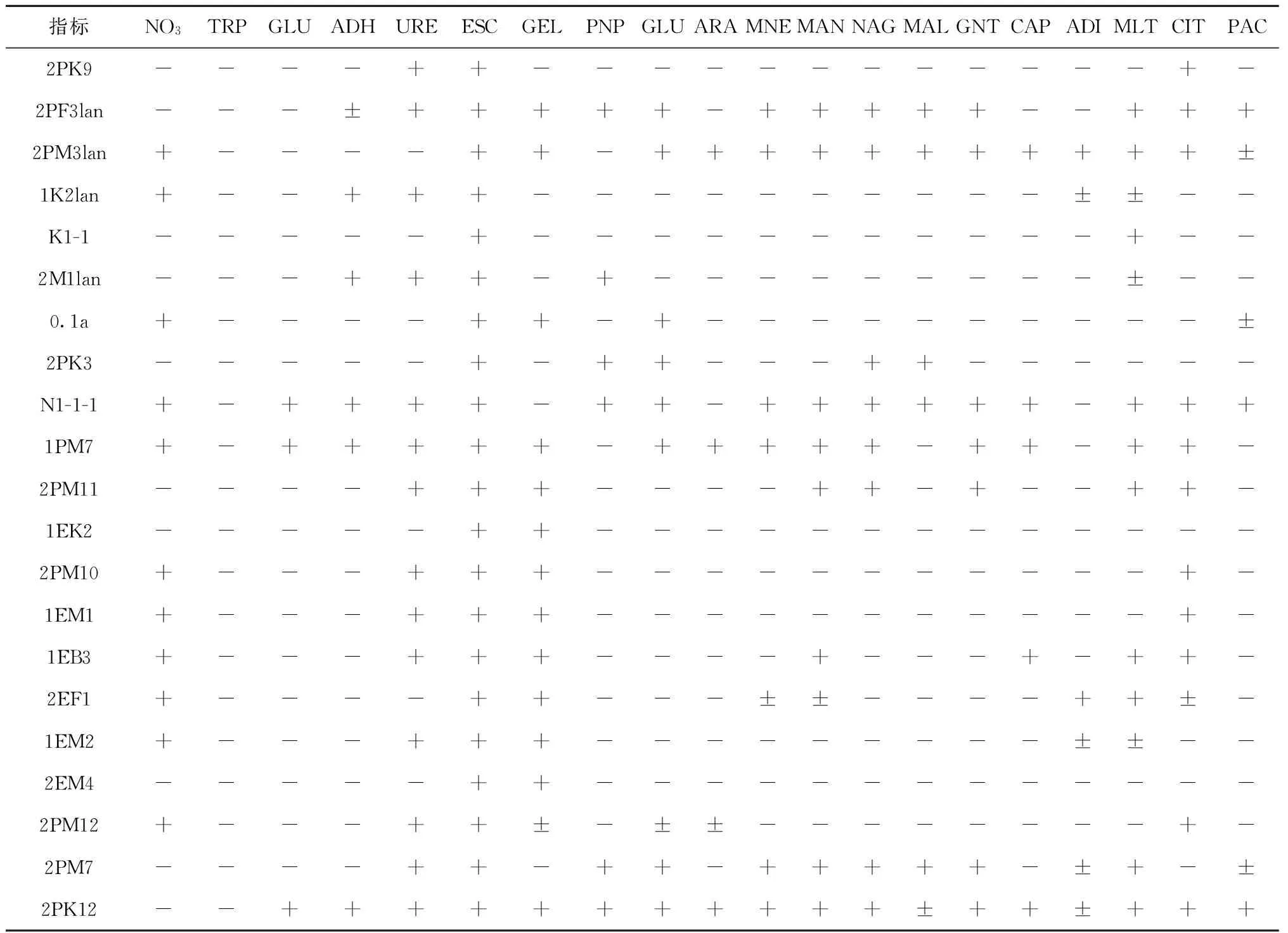
续表5
注:(1) 传统生化及酶反应指标N03、TRP、GLU、ADH、URE、ESC、GEL、PNG分别代表硝酸盐还原、吲哚产生、葡萄糖发酵、精氨酸双水解、脲酶、水解α-葡萄糖苷酶、水解(蛋白酶)和β-半乳糖苷酶反应;
(2) 同化作用指标GLU、ARA、MNE、MAN、NAG、MAL、GNT、CAP、ADI、MLT、CIT、PAC分别代表葡萄糖、阿拉伯糖、甘露糖、甘露醇、乙酰葡萄糖胺、麦芽糖、葡萄糖酸钾、羊蜡酸、己二酸、苹果酸、枸橼酸钠、苯乙酸;
(3)+为阳性反应,-为阴性反应,±为弱生长。
3.4可培养真菌产胞外酶活性测定
根据分子鉴定结果选取可培养真菌每个种属的代表性菌株和疑似新种属的菌株进行胞外酶活性测定,结果表明:13株真菌中,有7株产生淀粉酶,6株产纤维素酶,10株产酪蛋白酶;6株菌同时产3种酶,具体见表6。淀粉酶、纤维素酶和酪蛋白酶产生菌分别占供试菌株的53.85%、46.15%、76.92%。
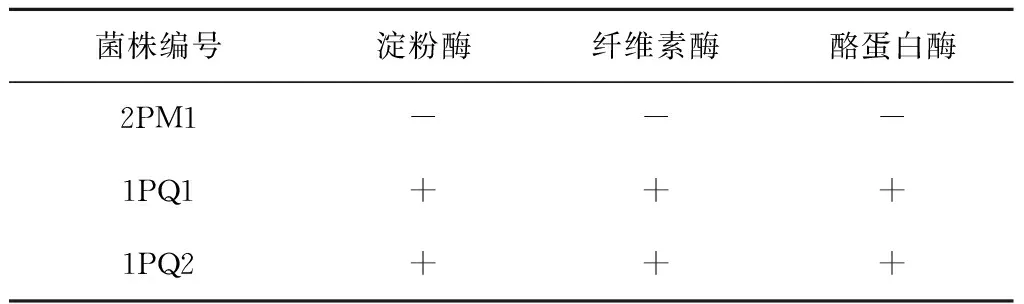
表6 可培养真菌产胞外酶活性测定结果
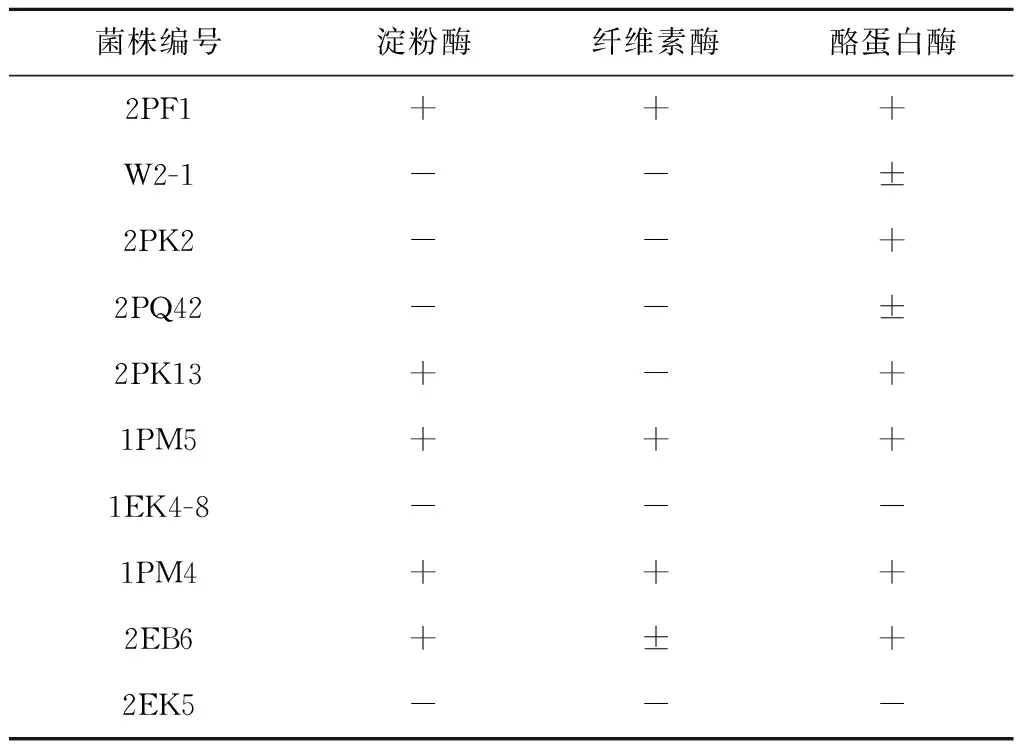
续表6
注:“+”代表具有产酶活性;“-”代表物产酶活性;“±”代表产酶活性较弱。
4讨论
为更加深入了解南极土壤微生物的多样性和评价微生物资源,本研究对南极菲尔德斯半岛土壤中的细菌和真菌进行分离培养。并对可培养细菌进行理化性质鉴定和真菌产胞外低温酶活性初步测定,获得了较丰富的可培养极地微生物资源,为筛选产生新型生物活性物质和低温酶等提供潜在种源库。
Tanner 等曾报道在南极分离到144株低温菌中,主要为弧菌属(占55%)、气单胞菌属(占22%)和产碱菌属(占4%),也有一些假单胞菌属(占2%)和黄杆菌属(占2%)。董宁[10]从东南极格罗夫山土壤中分离得到细菌归属于厚壁菌门、变形菌门、放线菌门、拟杆菌门、蓝细菌、Candidate division TM7等类群,且以厚壁菌门(Firmicutes)所占比例最高。而本实验从菲尔德斯半岛4份土壤样品中分离得到的细菌为变形菌门、放线菌门、拟杆菌门和厚壁菌门4大类群,其中主要为假单胞菌属,其次是节杆菌属。与Tanner和董宁的研究相比,在细菌门类水平和优势菌种方面均有差别,这可能是由取样地点、季节等因素造成菌类的不同。但我们的结果与Aislabie等[21]报道的从南极维多利亚公主地4 个位点的土壤样品中分离得到放线菌门、拟杆菌门、变形菌门、厚壁菌门4大类群菌株和以假单胞菌属为主的现象相一致。Fan等[22]对南极菲尔德斯半岛和长城站地区的土壤微生物种类进行过调查研究,初步鉴定细菌有7个属:微球菌属、葡萄球菌属、节细菌属、黄杆菌属、产碱菌属、假单胞菌属、芽孢杆菌属。我们的结果与之相比在细菌属种上有较大的差别,本实验分离到较多的细菌属(20个),其中紫色杆菌属、嗜冷杆菌属、土杆菌属、吉莉斯氏菌属、鞘氨醇单胞菌属、亚硫酸盐杆菌属、动性微菌属、伯克氏菌属、杜檊氏菌属、Luteibacter、Massilia和Mucilaginibacter在之前的研究中未被发现过。这可能与采样时间、地点和样品处理方法等不同有关,但细菌优势属均为假单胞菌属。
我国极地微生物学家对南极不同地域不同时段真菌多样性的研究也取得了一定的成果。陈皓文等[23]系统研究了菲尔德斯半岛地区微生物主要类别,分离到真菌有5个属:青霉菌属、金孢霉菌属、枝孢霉菌属、曲霉菌属、散子囊菌属;孔华忠和齐祖国[24]在乔治王岛采集的样品中分离到8 个属的真菌,包括青霉、曲霉、枝孢霉、散囊菌、布鲁迪帚霉、梅林瓶霉、金孢霉和大毛霉。而本实验从4份土壤样品中分离到的真菌有6个属:地丝霉属、假散囊菌属、Hymenoscyphus、被孢霉属、油瓶霉属和红酵母属,其优势属为地丝菌属菌株。由于陈皓文和孔华忠等人仅采用传统形态学鉴定,因而与本研究所得到的结果并不一致;另外由于采样的季节特征、样品处理和培养方法等都有所不同,因而有可能导致真菌多样性存在一定差异。我们鉴定得到的6个属的真菌归属于子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和门地位未定的被孢毛霉亚门 (Mortierellomycotina),这与董宁[10]报道的从格罗夫山土壤中分离到的真菌主要归属于担子菌门(Basidiomycota)和子囊菌门(Ascomycota)两大类群有相同之处。综上所述,南极菲尔德斯半岛地区广泛存在着各种类型的低温微生物,且分布很广、数量也大,这无疑为进一步探讨它们在该地区自然环境以及物质循环过程中所起的作用提供了有效的科学依据。
本研究发现了6株细菌,5株真菌与其他菌种的16S rDNA和ITS相似性较低,Devereux等[25]和Fry等[26]认为16S rDNA和ITS序列相似性分别低于98%、97%可以认为是新种。本研究发现的这11种南极微生物是否为新种还需要进一步鉴定,这也将丰富对南极微生物多样性认知。Hirsch等[8]在南极麦克默多干谷土壤中分离到的3株新菌种属于异常球菌,具有抗干旱、抗紫外的特性;Reddy等[9]从南极McMurdo站附近的湖泊中分离到13株新种,属于Planococcuspsychrophilusspp.和Planococcusantarcticusspp.的橙色产生菌;董宁[10]从格罗夫山土壤中共分离到的5 株潜在的细菌新种(属),其中菌株G3-6-20最显著的特征为对干燥、紫外和 γ-辐射等极端环境具有一定的耐受能力。本实验分离的6株细菌新种属于Neptunomonasnaphthovorans、Duganellaphyllosphaerae、Mucilaginibactersoli、Luteibacterrhizovicinus、Pedobacterpanaciterrae、Mucilaginibacterdorajii,这与Hirsch、Reddy和董宁分离的细菌新种不同,且在之前的研究中尚未被发现过。丁壮[11]从南极半岛10个样品中分离得到7株真菌新种(属),属于Mortierellaparvispora、Mortierellaelongatula、Acremoniumluzulae、Lecythophorasp.、Helotialessp.、Hyphodiscussp.。本实验分离到的5株真菌新种与丁壮的有所不同,都有Lecythophorasp.和Mortierellaelongatula,此外还有以前未被发现过的Pseudeurotiumdesertorum、Rhizoscyphusmonotropae和Rhodotorularosulata。由此看来,南极地区不仅是微生物新种的资源库,还可能是筛选产生新型生物活性物质和酶、抗生素等菌株的潜在种源地,目前南极微生物还有很多未知的区域,需要我们进一步去探索。
迄今为止,各国的科学家从极地土壤、沉积物和水样等发现了许多嗜冷、适冷微生物可以产生多种低温降解酶类。β-半乳糖苷酶在纤维素彻底降解为单糖的过程中占重要地位[29],本研究的实验菌株2PK7、2PK8、2PF3lan、2M1lan、2PK3、N1-1-1、2PM7和2PK12能产生β-半乳糖苷酶,国内外的研究结果表明极地其他种属的菌株也能够产生β-半乳糖苷酶,如丁新彪等[30]从南极普里兹湾及邻近海域沉积物中分离出2株产β-半乳糖苷酶的细菌,分别为微杆菌属(Microbacterium)和需盐杆菌属(Salegentibacter);俞勇等[31]从北极加拿大海盆和格陵兰海的高纬度海域筛选出2个属的菌株能够产生β-半乳糖苷酶,分别为黄杆菌属(Flavobacterium)和冰居杆菌属(Glaciecola);Turkiewica等[32]从南极磷虾消化道内分离出一株能够产β-葡萄糖苷酶的假交替单胞菌。这些能够产β-半乳糖苷酶的菌株,在工业发酵中将可能有潜在的应用价值。α-葡萄糖苷酶通过水解α-1,4糖苷键,可以从淀粉和其他有关多糖的非还原端水解葡萄糖[33],在生物对淀粉、蔗糖等碳水化合物的吸收利用方面具有重要作用。菌株1PF3、1PQ2、2PK7、1PM2、2PB1lan、2PF3lan、2PM3lan、2PM11和1EB3等能够产生α-葡萄糖苷酶,因此在糖类的降解作用中具有重要意义。蛋白酶是可水解蛋白质的一系列工业用生物催化剂,筛选出的绝大多数菌株都能够产生蛋白酶,这为蛋白质的降解提供潜在利用资源。一些实验菌株具有碳源利用的广谱性,能够同化利用多种碳源,如菌株N1-1-1能够同化葡萄糖、甘露糖、甘露醇、乙酰葡萄糖胺、麦芽糖、葡萄糖酸钾、羊蜡酸、苹果酸、枸橼酸钠、苯乙酸10种碳源;1PQ2、2PM3lan和2PK12能够同化测定的所有碳源(12种)。以上结果表明筛选得到的极地微生物在低温酶处理和碳源转化中有着广阔的应用潜力。此外,本研究还对筛选得到的部分可培养的真菌进行胞外酶活性测定,其中53.85%的菌株产生淀粉酶,46.15%的菌株产纤维素酶,76.92%的菌株产酪蛋白酶;6株菌同时产3种酶。对这些酶活检测时温度为12℃,说明供试的菌株具有低温酶活性,这为南极资源的开发利用奠定了基础。
近年来对环境样品中的微生物调查研究大多采用分子生物学技术,如高通量测序等,这种方法能够获取较为全面的微生物信息,而传统的人工培养方法因受到培养基成分和培养条件等限制而较少应用[27]。但是开发南极,利用南极的关键是获得可培养的功能菌株,所以传统培养方法获得的微生物不但能够反映生态环境特征的类群,可以更好地了解样品中处于活体状态的优势菌种类群,评估微生物与环境的关系[28],还可以为开发利用南极微生物资源奠定基础。因此,本实验对南极菲尔德斯半岛土壤样品中可培养微生物的多样性、理化性质和初步活性进行研究,结果说明南极菲尔德斯半岛土壤中可培养微生物具有极好的多样性和丰富性,并可能存在我们还未发现过的菌种。这为南极微生物资源的利用和低温酶的开发积累了资源、打下了基础。
参考文献:
[1]屈建航, 李宝珍, 袁红莉. 沉积物中微生物资源的研究方法及其进展[J]. 生态学报, 2007, 27(6): 2636-2641.
Qu Jianhang, Li Baozhen, Yuan Hongli. Methodology in studies of microbial resource in sediment[J]. Acta Ecologica Sinica, 2007, 27(6): 2636-2641.
[2]杨思忠, 金会军, 魏智, 等. 微生物对冻土生境的适应以及对全球变化和寒区工程扰动的响应: 进展与展望[J]. 冰川冻土, 2007, 29(2): 279-285.
Yang Sizhong, Jin Huijun, Wei Zhi, et al. Microbial adaptation to the habitat of permafrost and their responses to global change and engineering disturbance in cold regions: advances and prospects[J]. Journal of Glaciology and Geocryology, 2007, 29(2): 279-285.
[3]Zeng Yinxin, Yu Yong, Qiao Zongyun, et al. Diversity of bacterioplankton in coastal seawaters of Fildes Peninsula, King George Island, Antarctica[J]. Archives of Microbiology, 2014, 196(2): 137-147.
[4]Cowan D A, Khan N, Pointing S B, et al. Diverse hypolithic refuge communities in the McMurdo Dry Valleys[J]. Antarctic Science, 2010, 22(6): 714-720.
[5]Teixeira L C R S, Peixoto R S, Cury J C, et al. Bacterial diversity in rhizosphere soil from Antarctic vascular plants of Admiralty Bay, maritime Antarctica[J]. The ISME Journal, 2010, 4(8): 989-1001.
[6]Aislabie J M, Chhour K L, Saul D J, et al. Dominant bacteria in soils of Marble Point and Wright Valley, Victoria Land, Antarctica[J]. Soil Biology & Biochemistry, 2006, 38(10): 3041-3056.
[7]Wang Nengfei, Zhang Tao, Zhang Fang, et al. Diversity and structure of soil bacterial communities in the Fildes Region (maritime Antarctica) as revealed by 454 pyrosequencing[J]. Frontiers in Microbiology, 2015, 6: 1188.
[8]Hirsch P, Gallikowski C A, Siebert J, et al.Deinococcusfrigenssp. nov.,Deinococcussaxicolasp. nov., andDeinococcusmarmorissp. nov., Low temperature and draught-tolerating, UV-resistant bacteria from continental Antarctica[J]. Systematic & Applied Microbiology, 2004, 27(6): 636-645.
[9]Reddy G, Prakash J, Vairamani M, et al.PlanococcusantarcticusandPlanococcuspsychrophilusspp. nov. isolated from cyanobacterial mat samples collected from ponds in Antarctica[J]. Extremophiles, 2002, 6(3): 253-261.
[10]董宁. 东南极格罗夫山土壤微生物多样性及其可培养细菌的产酶和抗菌活性筛选[D]. 青岛: 中国海洋大学, 2014.
Dong Ning. Microbial diversity, extracellular enzyme activity and antimicrobial activity of culturable bacteria of soil from Grove Mountains, East Antarctica[D]. Qingdao: Ocean University of China, 2014.
[11]丁壮. 南极真菌物种多样性及次级代谢产物研究[D]. 青岛: 中国海洋大学, 2013.
Ding Zhuang. Biodiversity and Secondary metabolite of Antarctic Fungi[D]. Qingdao: Ocean University of China, 2013.
[12]林学政, 侯旭光, 李光友. 南极微生物低温酶的研究进展[J]. 海洋科学, 2002, 26(10): 38-42.
Lin Xuezheng, Hou Xuguang, Li Guangyou. Advances in research of cold-adapted enzymes from Antarctic bacteria[J]. Marine Sciences, 2002, 26(10): 38-42.
[13]林影, 卢溁德. 极端酶及其工业应用[J]. 工业微生物, 2000, 30(2): 51-53.
Lin Ying, Lu Rongde. Extreme enzymes and their industrial applications[J]. Industrial Microbiology, 2000, 30(2): 51-53.
[14]Ray M K, Devi K U, Kumar G S, et al. Extracellular protease from the Antarctic yeast Candida humicola[J]. Applied & Environmental Microbiology, 1992, 58(6): 1918-1923.
[15]Vazquez S C, Merino L N R, Maccormack W P, et al. Protease-producing psychrotrophic bacteria isolated from Antarctica[J]. Polar Biology, 1995, 15(2): 131-135.
[16]曾胤新, 陈波. 南极低温微生物研究及其应用前景[J]. 极地研究, 1999, 11(2): 143-152.
Zeng Yinxin, Chen Bo. Progress and application prospects in the study on Antarctic cold-adapted microorganisms[J]. Chinese Journal of Polar Research, 1999, 11(2): 143-152.
[17]靳永轩. 产木质纤维素酶南极真菌的筛选及菌株AspergillussydowiiMS-19的转录组测序分析[D]. 青岛:国家海洋局第一海洋研究所, 2013.
Jin Yongxuan. Screening of Antarctic lignocellulose enzyme-producing fungi and transcriptome sequencing ofAspergillussydowiiMS-19[D]. Qingdao: First Institute of Oceanography, State Oceanic Administration,2013.
[18]朱凤玲. 海洋细菌新属种的分类鉴定及解磷菌解磷特性的分析[D]. 青岛: 国家海洋局第一海洋研究所, 2011.
Zhu Fengling. Taxonomic analysis of marine novel bacteria and phosphate-solubility of a phosphate-dissolving bacterium[D]. Qingdao: The First Institute of Oceanography, State Oceanic Administration, 2011.
[19]程晓丽. 黄渤海沉积物真菌分子多样性及新种鉴定[D]. 青岛: 中国海洋大学, 2014.
Cheng Xiaoli. Fungal molecular diversity in marine sediments collected from the Yellow and Bohai sea and new species identification[D]. Qingdao: Ocean University of China, 2014.
[20]肖辉川, 李术惠, 德玮. 微生物在不同培养基上生长情况的研究[J]. 实用医技杂志, 2006, 13(10): 1638-1640.
Xiao Huichuan, Li Shuhui, De Wei. Study on the growing states of some microbes on different mediums[J]. Journal of Practical Medical Techniques, 2006, 13(10): 1638-1640.
[21]Aislabie J, McLeod M, Fraser R. Potential for biodegradation of hydrocarbons in soil from the Ross Dependency, Antarctica[J]. Applied Microbiology & Biotechnology, 1998, 49(2): 210-214.
[22]Fan Jingfeng, Li Lili, Han Junli, et al. Diversity and structure of bacterial communities in Fildes Peninsula, King George Island[J]. Polar Biology, 2013, 36(10): 1385-1399.
[23]陈皓文, 袁峻峰, 曹俊杰, 等. 南极菲尔德斯半岛环境微生物含量估计[J]. 黄渤海海洋, 2001, 19(1): 49-54.
Chen Haowen, Yuan Junfeng, Cao Junjie, et al. Estimation on environmental microbial content in the area of Fildes Peninsula, Antarctica[J]. Journal of Oceanography of Huanghai & Bohai Seas, 2001, 19(1): 49-54.
[24]孔华忠, 齐祖同. 南极乔治王岛的丝状真菌[J]. 真菌学报, 1991, 10(1): 57-60.
Kong Huazhong, Qi Zutong. Some filamentous fungi isolated from the materials of King George Island in Antarctica[J]. Acta Mycologica Sinica, 1991, 10(1): 57-60.
[25]Devereux R, He S H, Doyle C L, et al. Diversity and origin ofDesulfovibriospecies: phylogenetic definition of a family[J]. Journal of Bacteriology, 1990, 172(7): 3609-3619.
[26]Fry N K, Warwick S, Saunders N A, et al. The use of 16S ribosomal RNA analyses to investigate the phylogeny of the familyLegionellaceae[J]. Journal of General Virology, 1991, 137(5): 1215-1222.
[27]王桢, 李阳, 车帅, 等. 北极海洋沉积物中可培养细菌及其多样性分析[J]. 海洋学报, 2014, 36(10): 116-123.
Wang Zhen, Li Yang, Che Shuai, et al. Diversity analysis of culturable bacteria isolated from marine sediments of Arctic[J]. Haiyang Xuebao, 2014, 36(10): 116-123.
[28]Sait M, Hugenholtz P, Janssen P H. Cultivation of globally distributed soil bacteria from phylogenetic lineages previously only detected in cultivation-independent surveys[J]. Environmental Microbiology, 2002, 4(11): 654-666.
[29]孟宪文, 宋小红, 陈历俊, 等. β-葡萄糖苷酶的研究进展[J]. 中国乳业, 2009(10): 42-44.
Meng Xianwen, Song Xiaohong, Chen Lijun, et al. Some research advance of β-glucosidase[J]. Dairy Industry, 2009(10): 42-44.
[30]丁新彪, 丛柏林, 张扬, 等. 南极普里兹湾及邻近海域沉积物微生物多样性与生理生化研究[J]. 海洋科学进展, 2014, 32(2): 209-218.
Ding Xinbiao, Cong Bailin, Zhang Yang, et al. Biodiversity, physiolocal and biochemical characteristics of microorganisms in the sediments surface from the Prydz Bay, Antarctica[J]. Advances in Marine Science, 2014, 32(2): 209-218.
[31]俞勇, 李会荣, 陈波, 等. 北极高维度海域海冰嗜冷菌系统发育多样性及其低温水解酶分析[J]. 微生物学报, 2006, 46(2): 184-190.
Yu Yong, Li Huirong, Chen Bo, et al. Phylogenetic diversity and cold-adaptive hydrolytic enzymes of culturable psychrophilic bacteria associated with sea ice from high latitude ocean, Arctic[J]. Acta Microbiologica Sinica, 2006, 46(2): 184-190.
[32]Turkiewica M, Kur J, Bialkowska A, et al. Antarctic marine bacteriumPseudoalteromonassp. 22b as a source of cold-adapted β-galactosidase[J]. Biomolecular Engineering, 2003, 20(4/6): 317-324.
[33]寇彤, 孟晓敏, 常建涛, 等. 何首乌对α-葡萄糖苷酶活性的抑制作用[J]. 大连轻工业学院学报, 2006, 25(4): 239-241.
Kou Tong, Meng Xiaomin, Chang Jiantao, et al. Inhibition ofPolygonummultiflorumThunb on α-glucosidase activity[J]. Journal of Dalian Institute of Light Industry, 2006, 25(4): 239-241.
Biodiversity, physiological and biochemical identification of culturable microorganisms from the soil of Fildes Peninsula,Antarctica
Liu Chunying1, Cong Bailin2, Wang Nengfei2, Wang Bo2, Yin Xiaofei2, Liu Feng2
(1.OceanCollege,ShangdongUniversity(Weihai),Weihai264209,China; 2.EcologicalResearchCenter,FirstInstituteofOceanography,StateOceanicAdministration,Qingdao266061,China)
Abstract:In order to explore culturable microbial diversity,we separated bacteria and fungi from 5 different soil samples collected from the Fildes Peninsula during Chinese 31thAntarctic Scientific Expedition. The bacteria and fungi with great morphological differences were chosen to identify by 16S rDNA and ITS sequence. A total of 33 strains of bacteria belong to 20 genera and 8 strains of fungi belong to 6 genera. Among them,there are 8 strains of bacteria and 10 strains of fungi with low similarity. So we suspected that they were potential novel species. The results suggested that there is a relatively rich microbial diversity in Fildes Peninsula of Antarcticand, the majority of bacteria was Pseudomonas sp. Biochemical identification and enzymatic activity of culturable bacteria and fungi demonstrated that most of microorganism can produce hydrolytic enzymes and assimilate multiple carbon sources, which also proved that they could participate in substance metabolism and play a role to adapt to extreme environment of the Antarctic. This study enriched the soil culturable microbial diversity of Fildes Peninsula and some producing low temperature enzyme strains were screened,which may lay the foundation for resources utilization of polar microorganism.
Key words:Fildes Peninsula;microbial diversity;phylogenetic analysis;physiological-biochemical characteristic
收稿日期:2015-11-27;
修订日期:2016-01-29。
基金项目:中央级公益性科研院所基本科研业务费专项资金基本科研业务费(2011G25,0215P07);极地专项(CHINARE2015-01-06,CHINARE2015-01-04)。
作者简介:刘春影(1991-),山东省菏泽市人,主要从事鱼类免疫和极地微生物学研究。E-mail: liuchunying521@126.com * 通信作者:丛柏林,助理研究员,主要从事海洋微生物及经济鱼类免疫研究。E-mail:biolin@fio.org.cn
中图分类号:S154.36
文献标志码:A
文章编号:0253-4193(2016)06-0069-13
刘春影, 丛柏林, 王能飞,等. 南极菲尔德斯半岛可培养土壤微生物多样性及理化性质鉴定[J].海洋学报,2016,38(6):69—81, doi:10.3969/j.issn.0253-4193.2016.06.008
Liu Chunying, Cong Bailin, Wang Nengfei, et al. Biodiversity, physiological and biochemical identification of culturable microorganisms from the soil of Fildes Peninsula, Antarctica[J]. Haiyang Xuebao,2016,38(6):69—81, doi:10.3969/j.issn.0253-4193.2016.06.008

