外周血循环肿瘤DNA基因突变检测在非小细胞肺癌中的应用价值
徐敏 何婉 李岚 朱美琴 陈亦欣 许瑞莲
外周血循环肿瘤DNA基因突变检测在非小细胞肺癌中的应用价值
徐敏何婉李岚朱美琴陈亦欣许瑞莲
518020 深圳,暨南大学第二临床医学院深圳市人民医院肿瘤内科 深圳市肿瘤研究所
【摘要】目的探讨高通量基因测序技术检测外周血循环肿瘤DNA(ctDNA)基因突变在非小细胞肺癌(NSCLC)中的应用价值。方法用高通量测序技术同时检测32例晚期NSCLC患者的外周血ctDNA和组织石蜡切片DNA(tDNA)的基因突变情况,并以tDNA为金标准,评价ctDNA诊断NSCLC基因突变的效能。结果32例NSCLC患者中,ctDNA检出基因突变9种42例次,tDNA检出基因突变11种40例次。以tDNA检出的基因突变结果为金标准,外周血ctDNA诊断NSCLC基因突变的敏感度为75%~100%,特异度达95%~100%,与tDNA结果的总体符合率为91%~100%。结论高通量基因测序技术检测NSCLC患者外周血ctDNA,可代替肿瘤组织切片了解基因突变情况。
【关键词】非小细胞肺癌;高通量测序;循环肿瘤脱氧核糖核酸
全球肺癌的发病率和病死率高居各类恶性肿瘤之首,严重威胁人类健康。肺癌患者中约80%~85%为非小细胞肺癌(NSCLC),约50%的患者确诊时已为晚期,预后差。准确获知肿瘤的生物学信息,从而在基因分型指导下进行个体化治疗对于指导临床用药至关重要。目前临床常规采用组织DNA(tDNA)检测基因分型,但此检测有创且对标本获取有较高的要求。循环肿瘤DNA(ctDNA)是特指肿瘤细胞体细胞DNA经脱落或者当细胞凋亡后释放进入循环系统的小片段DNA,ctDNA来自肿瘤细胞的体细胞突变,可以出现与原发肿瘤DNA相同的特征或基因改变[1]。外周血ctDNA可以被定性、定量和追踪,将有可能为临床肿瘤的早期诊断、预后判定及跟踪随访等提供一系列方便、快捷、特异、无创或微创的分子生物学检测手段[2-5]。但外周血ctDNA是否可以替代tDNA成为常规基因检测手段应用于临床尚未可知。为此,笔者通过高通量基因测序技术检测32例晚期NSCLC患者的外周血ctDNA中的基因突变情况,并以组织tDNA作金标准,评价其诊断效能,现报告如下。
对象与方法
一、研究对象
2014年10月至2015年12月我院收治的晚期(ⅢB期以上)无法手术的NSCLC患者32例,所有患者均有原发组织的石蜡切片及血液样本。其中男18例、女14例,年龄37~72岁、中位年龄55岁,腺癌23例、鳞癌9例。血浆样本DNA提取后与组织切片送南京世和基因生物技术有限公司行基因检测。
二、方法
1. 标本采集、血浆分离
入院次日清晨采集患者肘静脉血5 ml,立即在室温下以2 000×g离心10 min,分离血浆和血细胞,小心收集上层血浆,避免触及白细胞或血小板及红细胞下层。
2. 血浆样本DNA提取
采用Qiagen DNA提取试剂盒,取血浆样本,室温下3 500×g离心15 min,弃上清,沉淀中加入1 ml试剂1裂解缓冲液;匀浆液37℃水浴静置60 min后,加入10 μl试剂2, 50℃水浴消化3 h;按步骤分次吸取水相,加入1 ml试剂3~5,轻柔颠倒混匀约50次,室温5 000×g 离心15 min;弃上清,向沉淀中加入1 ml 70%乙醇,重悬沉淀后,室温5 000×g 离心10 min;弃上清,吸干乙醇并晾干,加入试剂6溶解DNA,37 ℃溶解12~14 h,直至DNA完全溶解;测量DNA浓度后备用。
3. ctDNA分离
采用薄膜柱吸附试剂盒从血浆中分离ctDNA:DNA定量后按照试剂盒说明取20 ng以上进行DNA文库构建,具体步骤包括ctDNA大片段分离、ctDNA小片段回收、DNA末端修复和A接头连接、将DNA两端加上Illumina测序试剂盒的专用接头、根据所需DNA片段大小进行磁珠筛选、使用PCR法扩增文库用于后续的探针杂交捕获和测序实验。
4. 生物素标记探针捕获基因
使用Geneseeq杂交富集探针对已建好的DNA文库进行目标基因靶标富集及扩增,包括:DNA捕获探针与文库杂交;捕获文库产物的清洗和回收;捕获文库与链霉亲和素磁珠结合;磁珠捕获文库清洗,去除非特异结合的文库。
5. 高通量测序
捕获后的文库按照Illumina试剂盒说明书的操作步骤,在Illumina HiSeq 4000高通量测序平台上样,DNA在试剂盒Flow cell上形成DNA簇,测序平台通过单个碱基合成后暂停、荧光检测、合成恢复的循环完成DNA高通量测序。
6. 数据分析
将高通量测序结果与中国人种hg19基因组数据对比,完成基因Mapping工作;同步分析多种基因突变类型;分析生成肿瘤特有突变和种系突变。
7. tDNA提取与检测
肿瘤组织采用Qiagen DNA提取试剂盒提取后应用超声破碎成300~350 bp,采用96 rxn xGen®Exome Research Panel v1.0试剂盒富集后建立高通量测序文库,通过Illumina Hiseq 4000高通量测序平台进行600倍深度测序,下机数据通过生物信息学平台整理成样本突变信息。
三、统计学处理
以tDNA结果为金标准,分析各病例外周血ctDNA对NSCLC基因突变的诊断效能,计算外周血ctDNA诊断NSCLC基因突变的敏感度、特异度及总体符合率。
结果
一、总体结果
32例NSCLC患者中,ctDNA检出基因突变9种42例次,tDNA检出基因突变11种40例次。
二、外周血ctDNA基因对NSCLC基因突变的诊断效能评价
以组织石蜡切片tDNA检出的基因突变结果为金标准,外周血ctDNA对NSCLC基因突变的敏感度为75%~100%,特异度达95%~100%,与tDNA结果的总体符合率为91%~100%,见表1。其中,有2例患者tDNA中未检出突变,但相应外周血ctDNA中分别检测出EGFR exon 19缺失和ERBB2突变。
讨论
目前临床上用于NSCLC患者基因突变检测的主要是经纤维支气管镜或肺穿刺活组织检查获取的tDNA,但是NSCLC在确诊时超过70%的患者已为ⅢB 期、Ⅳ期,大部分不能手术,难以获取肿瘤组织,而且肿瘤的生物学特性在经过一系列治疗后可能已经发生改变,故每次治疗前实时获得肿瘤信息才能较准确地反映肿瘤细胞特性,疾病进展后再次获取组织标本可谓难上加难。因此,仅仅通过tDNA进行NSCLC基因检测为临床治疗、研究带来很多不便,人们希望通过一些无创手段来获取患者的基因信息。
表1
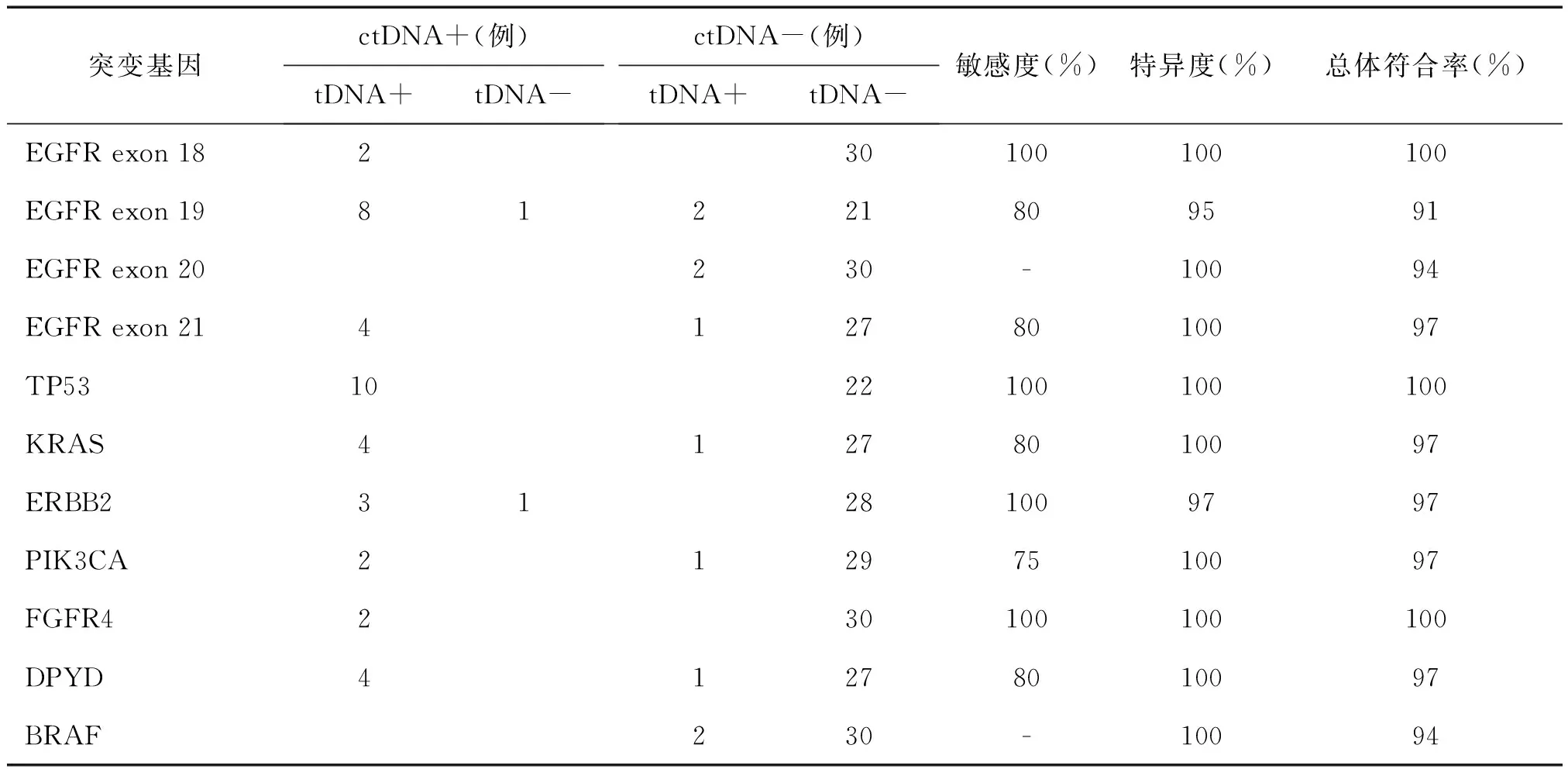
外周血ctDNA对NSCLC基因突变的诊断效能评价
注:EGFR为表皮生长因子受体,exon为外显子,TP53为肿瘤抑制蛋白P53,KRAS为鼠肉瘤病毒原癌同源体,ERBB2为表皮生长因子受体2,PIK3CA为磷脂酰肌醇-3-激酶,FGFR4为成纤维生长因子受体4,DPYD为二氢嘧啶脱氢酶编码基因,BRAF为鼠肉瘤滤过性毒菌致癌同源体B1
血液ctDNA的释放被认为与肿瘤细胞的自行分泌或凋亡、坏死有关[6]。同时由于检测的无创性,可以作为“液体活检”,成为良好的预后和预测分子指标。早在1948年,法国学者Mandel等便发现了人类血液中存在循环DNA。而直到30年后,Leon等首次报道肿瘤患者ctDNA水平高于正常人,且与患者的预后及疗效有关。随后人们发现血清ctDNA水平升高与肿瘤转移、临床分期和患者生存有关,根据血清ctDNA水平可判断患者的预后[7-8]。
2013年Dawson等[9]研究了30例接受了系统治疗的转移性乳腺癌女性患者,连续采集血浆标本,采用定向或全基因组测序分析识别体内基因改变,对ctDNA进行个体化定量分析。与同期检测的CA15-3及CTC相比,ctDNA水平呈现更广的动态范围及与肿瘤负荷变化更强的相关性。在检测中,ctDNA为19例中的10例女性提供较早的治疗反应检测信息。他们认为ctDNA是一种具有提示性、遗传特性和高敏感度的转移性乳腺癌生物标记。
然而,由于循环中存在的ctDNA极其微量,对其替代tDNA成为肿瘤分子检测的“金标准”造成障碍。2014年Newman等[10]将高通量测序技术应用于NSCLC患者血浆ctDNA检测,发现对Ⅱ~Ⅳ期的NSCLC患者检测敏感度达100%,Ⅰ期的NSCLC呈中敏感度(50%);对各期肺癌的特异度均为96%。研究还表明,当ctDNA比例低至0.019%的时候仍能够被检测到。有学者分别对10例样本进行活组织检查和癌症个体化深度测序(CAPP-Seq)检测EGFR和KRAS,结果显示CAPP-Seq并不比金标准肿瘤活组织检查的诊断效能差,其也能准确测定肺癌的基因型。高通量测序技术能一次对几十万至几百万条DNA分子进行序列测定,可以检测到低于0.5%的基因突变,是对传统测序革命性的改变,且其所需的DNA样本量较少,适用于ctDNA这种微量DNA的检测[11]。
本研究通过高通量测序技术,分离外周血ctDNA并进行多基因联合检测。结果显示,以组织石蜡切片检测出的tDNA作金标准,血浆ctDNA的敏感度为75%~100%,特异度为95%~100%,与tDNA结果的总体符合率为91%~100%。其中,有2例患者组织切片中未检出突变,但相应的血液中却分别检测出EGFR exon 19缺失和ERBB2突变,提示治疗过程中肿瘤的基因突变可能发生了变化,组织切片无法反映治疗前的实际基因突变情况。或者由于肿瘤具有异质性,组织标本因为取材受限无法反映真实的基因表达情况。
外周血ctDNA是一种特征性的肿瘤生物标记物,可实时反映肿瘤发生、发展或治疗过程中的信息,且与传统的组织活检标本相比具有取材方便、无创、患者依从性好等优点。通过本研究,我们发现用高通量测序技术能够检出极微量的外周血ctDNA基因突变,且与tDNA有较高的符合率。因而通过外周血检测NSCLC基因突变代替肿瘤组织是切实可行的,有望替代受到标本采集以及无法连续监测和随访追踪等诸多限制的组织切片。希望将来经过更多临床验证后,高通量测序技术能够得到临床推广,并将肺癌分子诊断和个体化治疗提高到一个新的水平。
参考文献
[1]Diaz LA Jr, Bardelli A.Liquid biopsies: genotyping circulating tumor DNA. J Clin Oncol,2014,32(6):579-586.
[2]Rolfo C, Castiglia M, Hong D, Alessandro R, Mertens I, Baggerman G, Zwaenepoel K, Gil-Bazo I, Passiglia F, Carreca AP, Taverna S, Vento R,Santini D, Peeters M, Russo A, Pauwels P.Liquid biopsies in lung cancer: the new ambrosia of researchers.Biochim Biophys Acta,2014,1846(2):539-546.
[3]Lebofsky R, Decraene C, Bernard V, Kamal M, Blin A, Leroy Q, Rio Frio T, Pierron G, Callens C, Bieche I, Saliou A, Madic J, Rouleau E, Bidard FC, Lantz O, Stern MH, Le Tourneau C, Pierga JY.Circulating tumor DNA as a non-invasive substitute to metastasis biopsy for tumor genotyping and personalizedmedicine in a prospective trial across all tumor types. Mol Oncol,2015,9(4):783-790.
[4]Madic J, Kiialainen A, Bidard FC, Birzele F, Ramey G, Leroy Q, Rio Frio T, Vaucher I, Raynal V, Bernard V, Lermine A, Clausen I, Giroud N, Schmucki R, Milder M, Horn C, Spleiss O, Lantz O, Stern MH, Pierga JY, Weisser M, Lebofsky R.Circulating tumor DNA and circulating tumor cells in metastatic triple negative breast cancer patients. Int J Cancer,2015,136(9):2158-2165.
[5]Bidard FC, Madic J, Mariani P, Piperno-Neumann S, Rampanou A, Servois V, Cassoux N, Desjardins L, Milder M, Vaucher I, Pierga JY, Lebofsky R, Stern MH, Lantz O. Detection rate and prognostic value of circulating tumor cells and circulating tumor DNA in metastatic uvealmelanoma. Int J Cancer,2014,134(5):1207-1213.
[6]Schwarzenbach H, Hoon DS, Pantel K.Cell-free nucleic acids as biomarkers in cancer patients.Nat Rev Cancer, 2011,11(6):426-437.
[7]Avraham A, Uhlmann R, Shperber A, Birnbaum M, Sandbank J, Sella A, Sukumar S, Evron E.Serum DNA methylation for monitoring response to neoadjuvant chemotherapy in breast cancer patients.Int J Cancer,2012,131(7):E1166-E1672.
[8]Perrone F, Lampis A, Bertan C, Verderio P, Ciniselli CM, Pizzamiglio S, Frattini M, Nucifora M, Molinari F, Gallino G, Gariboldi M, Meroni E, Leo E, Pierotti MA,Pilotti S. Circulating free DNA in a screening program for early colorectal cancer detection. Tumori, 2014,100(2): 115-121.
[9]Dawson SJ, Tsui DW, Murtaza M, Biggs H, Rueda OM, Chin SF, Dunning MJ, Gale D, Forshew T, Mahler-Araujo B, Rajan S, Humphray S, Becq J, Halsall D,Wallis M, Bentley D, Caldas C, Rosenfeld N.Analysis of circulating tumor DNA to monitor metastatic breast cancer.N Engl J Med,2013,368(13):1199-1209.
[10]Newman AM, Bratman SV, To J, Wynne JF, Eclov NC, Modlin LA, Liu CL, Neal JW, Wakelee HA, Merritt RE, Shrager JB, Loo BW Jr, Alizadeh AA,Diehn M.An ultrasensitive method for quantitating circulating tumor DNA with broad patient coverage.Nat Med,2014,20(5):548-554.
[11]Couraud S, Vaca-Paniagua F, Villar S, Oliver J, Schuster T, Blanché H, Girard N, Trédaniel J, Guilleminault L, Gervais R, Prim N, Vincent M, Margery J, Larivé S, Foucher P, Duvert B, Vallee M, Le Calvez-Kelm F, McKay J, Missy P, Morin F, Zalcman G, Olivier M, Souquet PJ; BioCAST/IFCT-1002 investigators.Noninvasive diagnosis of actionable mutations by deep sequencing of circulating free DNA in lung cancer fromnever-smokers: a proof-of-concept study from BioCAST/IFCT-1002.Clin Cancer Res,2014,20(17):4613-4624.
The value of detection of gene mutations in peripheral circulating tumor DNA in non-small cell lung cancer
XuMin,HeWan,LiLan,ZhuMeiqin,ChenYixin,XuRuilian.
DepartmentofMedicalOncology,ShenzhenPeople’sHospital,theSecondClinicalMedicalCollegeofJi’nanUniversity,ShenzhenCancerInstitute,Shenzhen518020,China
【Abstract】ObjectivesTo investigate the value of gene mutations in peripheral circulating tumor DNA(ctDNA)in non-small cell lung cancer(NSCLC)by next-generation sequencing. MethodsThe gene mutations in peripheral ctDNA and tDNA of tissued paraffin sections in 32 advanced patients with NSCLC were simultaneously detected by next-generation sequencing, and regarded the tissue tumor DNA as the correct standard to evaluate the efficiency of ctDNA diagnosing the gene mutations in NSCLC. ResultsAmong 32 patients with NSCLC, 42 samples of gene mutations in 9 types were detected in terms of ctDNA and 40 samples of gene mutations in 11 types were detected in tDNA. The result of tDNA gene mutations was regarded as the correct standard. Sensitivity of detection of gene mutations in peripheral circulating tumor DNA was 75%~100%, and specificity was 95%~100%. The concordance rate between result of tDNA and ctDNA was 91%~100%. ConclusionTo test mutations in NSCLC patients, detection of ctDNA is possible to replace tumor tissue paraffin sections by NGS.
【Key words】Non-small cell lung cancer; Next-generation sequencing; Circulating tumor DNA
DOI:10.3969/j.issn.0253-9802.2016.06.008
基金项目:深圳市科技计划项目(JCYJ20150403101146278)
通讯作者,许瑞莲,E-mail:xuruilian@126.com
Corresponding author, Xu Ruilian, E-mail: xuruilian@126.com
(收稿日期:2016-02-24)(本文编辑:林燕薇)
·临床研究论著·

