PAQR3及与其相关疾病关系研究进展
吴水梅 郑 燕 刘茂生 李腾政 万 倩 张吉翔
(南昌大学第二附属医院消化内科,江西 南昌 330006)
PAQR3及与其相关疾病关系研究进展
吴水梅郑燕刘茂生李腾政万倩张吉翔
(南昌大学第二附属医院消化内科,江西南昌330006)
〔关键词〕PAQR3;Raf;高尔基体;肿瘤
Tang等〔1〕第一次描述了PAQR3基因,它位于染色体4q21.21上,在大多数物种中编码一种蛋白质,具有高度保守性。虽然PAQR3基因在原核生物中首次发现,但已被证实存在于真核生物中〔2〕。与其他PAQR家庭成员不同,PAQR3相当早从家庭中发脱离出来并显示出相对独立的分化〔1,2〕。人类PAQR3蛋白含有311个氨基酸残基。RT-PCR评估人体组织PAQR3的mRNA表达水平显示,在人的脑、睾丸、小肠、皮肤、胸腺中高表达,而小鼠的肾脏、脑、睾丸和肝中PAQR3 mRNA的表达量更高〔1,3〕。
内源性和异位表达的PAQR3免疫荧光分析表明其定位与高尔基标记物Golgin-97和GM130重叠,因此确认PAQR3定位于高尔基体〔3〕。类似于PAQR家族的其他成员,PAQR3最初预测具有七次跨膜结构域(7-TMDS),包含位于高尔基体膜内N末端和高尔基体膜外C末端〔1,3〕,其中第一、三、五环面向高尔基腔,第二、四、六环朝向胞质〔4〕。Luo等〔4〕进行的研究还发现,至少有4个独立片段与PAQR3的高尔基体定位有关,包括TMDS之间的第一个及第三个环和位于N末端的膜近端10个氨基酸(氨基酸61-71),位于C-末端的膜近端5个氨基酸(氨基酸299-303)。由于Raf-1激酶在高尔基体上的空间调控作用,PAQR3又获得了新的名字——RKTG,而N-末端序列和第三个环对于PAQR3与Raf-1之间的相互作用都是必需的〔5〕。
1PAQR3参与的信号通路
PAQR3主要调控细胞增生的Ras/Raf/MEK/ERK信号通路,通过与该通路成员Raf的相互结合将胞质中分布的Raf锚定在高尔基体上,削弱Raf激酶的活化,干扰了Raf与其上游的Ras以及下游的MEK蛋白的结合,从而阻碍了Ras将信号向下游分子传递,最终抑制ERK信号。在PAQR3敲除小鼠中ERK活性增强,并且在受到生长因子刺激时表现出更强、持续时间更长的ERK激活〔3,6,7〕。在HEK293T细胞中,PAQR3的过表达导致Raf-1的丝氨酸338明显减少,在表皮生长因子(EGF)诱导下ERK和P90RSK(细胞质中ERK的基板)发生磷酸化;此外,PAQR3过表达阻滞了Ras和Raf-1刺激的ELK-1(ERK的核目标)反式激活,并强烈地抑制刺了PC12细胞神经生长因子(NGF)诱导的分化〔3〕。B-Raf是Raf激酶家族中最频繁突变的基因,肿瘤的发展过程中PAQR3也与降低缺氧诱导因子(HIF)-1α的反式激活活性,负向调节血管内皮生长因子(VEGF)的表达,因此阻断了自分泌VEGF信号,见图1〔8〕。
PAQR3也可以通过将GPCR Gβγ亚基螯合至高尔基体调节GPCR信号,从而抑制Gβγ功能和阻断Gβγ与下游靶蛋白的相互作用,如GRK2和AKT(图1)〔9〕。有证据表明,肿瘤的发生和上皮-间质转化(EMT)期间PAQR3和p53之间存在功能上的相互作用。在生理条件下,PAQR3的缺少,通过改善PAQR3依赖的GPCR的Gβγ亚基信号,增强了GPCR介导的AKT和其基板糖原合成酶激酶-3(GSK3β)的激活,并伴随的p53 Ser15磷酸化增加和p53及其靶基因的积累,p21和p16。在病理生理条件下,PAQR3和p53的损失会导致EMT和肿瘤〔10〕。在最近的一项研究中,发现PAQR3通过分流磷脂酰肌醇3-激酶(PI3K)的P110α亚基至高尔基体和改变PI3K活性从而负向调节胰岛素信号〔11〕。PAQR3与p110α的p85结合域相互作用,过表达PAQR3剂量依赖性地降低PI3K调节亚基p85α和p110α的结合,从而进一步调节下游通路〔12〕。
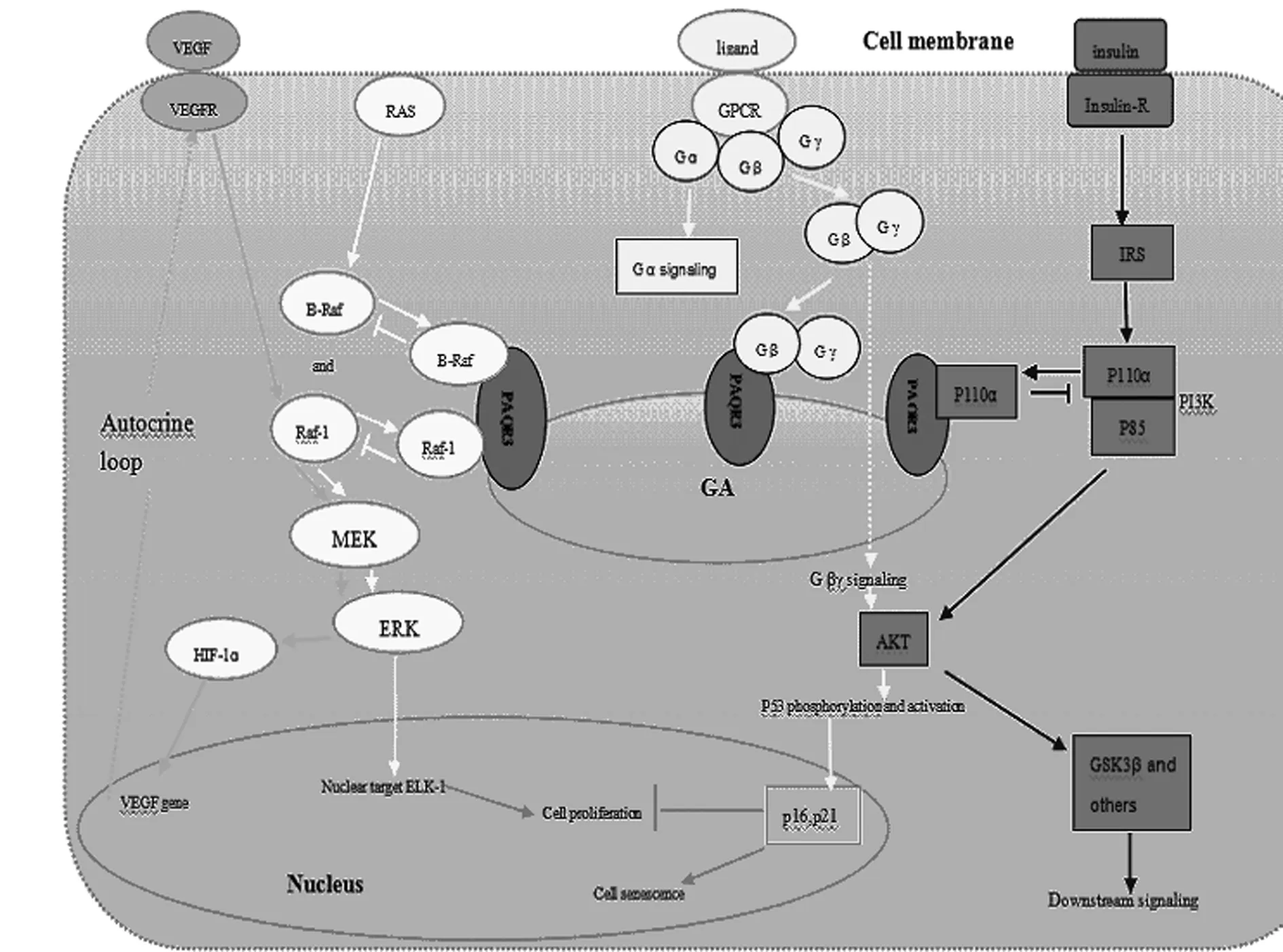
图1 PAQR3参与的信号通路
2与PAQR3相关的疾病
2.1消化系统肿瘤
2.1.1结直肠癌大肠癌是男性中第三个大最常见的癌症,女性中排名第二,2008年新发生的病例超过1 200 000例,估计死亡的有608 700例〔13〕。虽然在一些西方国家,大肠癌的死亡率一直在下降,但在许多国家,由于资源和健康基础设施有限,大肠癌的死亡率仍然在继续增加〔14〕。王笑等〔12,15〕对PAQR3在结直肠癌发生发展过程中的作用进行研究,发现PAQR3在人结肠直肠癌患者样本的癌组织中表达量显著低于癌旁组织。PAQR3敲除后的ApcMin/+小鼠生存时间缩短,小肠中腺瘤数目和负荷增加。此外,在结肠癌细胞系SW-480中,过表达PAQR3抑制细胞的增殖。相反,敲减内源性的PAQR3促进SW-480细胞增殖和克隆形成。首次揭示了PAQR3具有抑制结肠直肠癌发生发展的作用,这或许给结直肠癌的靶向治疗带来了新的方向和策略。
2.1.2胃癌胃癌是最常见的消化道恶性肿瘤之一,其发病率和死亡率高,5年生存率低〔16,17〕。胃癌的特点是不同的地理分布,70%以上的情况下发生在某些发展中国家和东亚,如中国,日本和韩国〔16〕。最近的一项研究显示,在胃癌患者中存在五个特征性的基因改变,包括FGFR2(9%的肿瘤),KRAS(9%),EGFR(8%),ErBB2(7%)和 MET(4%)〔18〕。总的来说,这项研究显示,受体酪氨酸激酶家族(RTK)及其下游Ras介导的信号通路的基因,包括胃癌发生发展中相关的主要基因发生了改变,表明某些胃癌患者可能可以通过改善RTK和/或RAS而被治愈〔18〕。而前面我们提到PAQR3主要调控控制细胞增生的Ras/Raf/MEK/ERK信号通路,通过与该通路成员Raf的相互结合将胞质中分布的Raf锚定在高尔基体上,削弱Raf激酶的活化,干扰了Raf与其上游的Ras以及下游的MEK蛋白的结合,从而阻碍了Ras将信号向下游分子传递,最终使ERK信号受到抑制。Ling等〔19〕则对PAQR3与胃癌之间的关系进行研究,对大量的胃癌患者癌及癌旁组织临床样本(300对)研究发现,与癌旁组织相比,胃癌组织中PAQR3蛋白及mRNA的表达量显著下调,且与胃癌的进展和转移密切相关。体外实验也证实了PAQR3抑制胃癌细胞的生长和迁移能力〔20〕。
2.1.3肝癌Wu等〔21〕采用实时荧光定量RT-PCR、免疫印迹和免疫组化检测了原发性肝癌中 PAQR3的表达水平,结果显示,在大多数肝癌组织中PAQR3 mRNA和蛋白表达水平下调,而PAQR3表达低可能表明HCC患者的预后较差。临床病理分析表明,PAQR3的表达水平与血清α甲胎蛋白(AFP)表达显著相关,此外,体外细胞实验发现PAQR3抑制肝癌细胞生长和集落形成。PAQR3可能是一种新的HCC预后的生物标志物,也为肝癌的治疗提供新的策略。
2.2其他肿瘤与PAQR3相关肿瘤中最早被发现的即是恶性黑色素瘤,Fan等〔7〕首次发现当人类恶性黑色素瘤A375细胞株过度表达 B-Raf(V600E),PAQR3将B-Raf转运至高尔基体,从而阻断ERK信号通路,抑制了 ERK激活、细胞增殖和转化,此外,表达PAQR3 的A375细胞抑制了裸鼠成瘤性,这些结果说明,PAQR3通过拮抗B-Raf,负向调节ERK信号,在致癌基因B-Raf突变的人恶性黑色素瘤中起着抑癌作用。当然,之后Jiang等〔10〕发现PAQR3缺陷小鼠皮肤肿瘤的发生率也远高于PAQR3正常的小鼠,但不同的是,他们认为这是因为PAQR3缺少,改善了PAQR3依赖的GPCR Gβγ亚基信号,增强了GPCR介导的AKT和其基板GSK3β的激活,这种改善伴随的p53 Ser15磷酸化增加和p53及其靶基因的积累,p21和p16,在病理生理条件下,PAQR3和p53的损失会导致EMT和肿瘤。
自分泌VEGF信号用于维持血管的动态平衡。失调的血管生成牵涉到许多人类癌症的发展,特别是在富含血管的肾透明细胞癌(RCC)。同时,抗血管生成治疗已成为治疗人类癌症的一种有效策略。姜晓萌和 Zhang等〔8,22〕通过一系列实验,发现PAQR3对内皮细胞的增殖、迁移、和血管的生成起负调控作用,通过抑制丝裂原活化蛋白激酶信号,进而抑制HIF-1α/P300复合体的形成和抑制VEGF的转录负调控转录激活HIF-1α,从而减少缺氧诱导的VEGF生成。临床样本结果分析显示肾透明细胞癌较癌旁组织PAQR3表达水平显著下调,并且与VEGF表达水平呈负相关。这些研究结果说明,PAQR3抑制肾透明细胞癌的发生发展。
近年来,越来越多的证据表明PAQR3与多种肿瘤的发生发展有关,包括膀胱癌〔23〕、喉鳞状细胞癌〔24〕、乳腺癌病〔25〕、骨肉瘤〔26〕,且目前倾向认为PAQR3是肿瘤发生发展过程中的抑制基因,这对于多种肿瘤的靶向治疗提供了一个新的思路。
2.3肥胖胰岛素抵抗和代谢性疾病的发病密切相关,尤其是2型糖尿病〔27〕。磷酸肌醇3-激酶(PI3K)/Akt通路是胰岛素代谢行动中心。研究发现,PAQR3能够与PI3K的催化亚基p110α相互作用将p110α锚定在高基体上从而影响其活性。过表达PAQR3抑制胰岛素刺激的PI3K的活性以及下游靶基因AKT和GSK3β的活化;而缺失PAQR3增加PI3K的活性和下游基因的磷酸化水平〔11,28〕。在体内实验中,敲除PAQR3的小鼠能够增加胰岛素刺激的葡萄糖转运蛋白(GLUT4)向细胞膜的转运和葡萄糖吸收,增加胰岛素的敏感性。此外,PAQR3还可以通过调控内质网应激,影响瘦素信号通路,从而影响肥胖〔11,28〕。
3展望
近年来,PAQR3成了研究热点,因为它不仅与多种肿瘤发生发展之间存在联系,还与糖尿病引起的肥胖相关〔11,28〕,那么PAQR3到底参与了哪些信号通路调节了这些病理生理过程?位于高尔基体膜上的七次跨膜蛋白PAQR3主要通过捕获Raf激酶调控Ras/Raf/MEK/ERK信号通路,当然,它也可以通过将GPCR Gβγ亚基螯合至高尔基体调节GPCR信号,从而负调节Gβγ功能和阻断Gβγ与下游靶蛋白的相互作用及与PI3K的催化亚基p110α相互作用将p110α锚定在高基体上从而影响其活性,但是PAQR3是否还参与其他的通路还不是很清楚。目前大量肿瘤研究都显示PAQR3是一个抑癌基因,该基因是否能成为肿瘤治疗的靶点,仍需要未来进一步的研究。
4参考文献
1Tang YT,Hu T,Arterburn M,etal.PAQR proteins:a novel membrane receptor family defined by an ancient 7-transmembrane pass motif〔J〕.J Mol Evol,2005;61(3):372-80.
2Thomas P,Pang Y,Dong J,etal.Steroid and G protein binding characteristics of the seatrout and human progestin membrane receptor alpha subtypes and their evolutionary origins〔J〕.Endocrinology,2007;148(2):705-18.
3Feng L,Xie X,Ding Q,etal.Spatial regulation of Raf kinase signaling by RKTG〔J〕.Proc Natl Acad Sci USA,2007;104(36):14348-53.
4Luo X,Feng L,Jiang X,etal.Characterization of the topology and functional domains of RKTG〔J〕.Biochem J,2008;414(3):399-406.
5Jin T,Ding Q,Huang H,etal.PAQR10 and PAQR11 mediate Ras signaling in the Golgi apparatus〔J〕.Cell Res,2012;22(4):661-76.
6冯琳.RKTG调控ERK信号通路的功能研究〔D〕.上海:中国科学院上海生命科学研究院,2007.
7Fan F,Feng L,He J,etal.RKTG sequesters B-Raf to the Golgi apparatus and inhibits the proliferation and tumorigenicity of human malignant melanoma cells〔J〕.Carcinogenesis,2008;29(6):1157-63.
8Zhang Y,Jiang X,Qin X,etal.RKTG inhibits angiogenesis by suppressing MAPK-mediated autocrine VEGF signaling and is downregulated in clear-cell renal cell carcinoma〔J〕.Oncogene,2010;29(39):5404-15.
9Jiang Y,Xie X,Zhang Y,etal.Regulation of G-protein signaling by RKTG via sequestration of the G betagamma subunit to the Golgi apparatus〔J〕.Mol Cell Biol,2010;30(1):78-90.
10Jiang Y,Xie X,Li Z,etal.Functional cooperation of RKTG with p53 in tumorigenesis and epithelial-mesenchymal transition〔J〕.Cancer Res,2011;71(8):2959-68.
11Wang X,Wang L,Zhu L,etal.PAQR3 modulates insulin signaling by shunting phosphoinositide 3-kinase p110alpha to the Golgi apparatus〔J〕.Diabetes,2013;62(2):444-56.
12王笑.PAQR3在结肠直肠癌发生过程中的功能以及对PI3K的空间调控研究〔D〕.北京:中国科学院,2012.
13Jemal A,Bray F,Center MM,etal.Global cancer statistics〔J〕.CA Cancer J Clin,2011;61(2):69-90.
14Center MM,Jemal A,Smith RA,etal.Worldwide variations in colorectal cancer〔J〕.CA Cancer J Clin,2009;59(6):366-78.
15Wang X,Li X,Fan F,etal.PAQR3 plays a suppressive role in the tumorigenesis of colorectal cancers〔J〕.Carcinogenesis,2012;33(11):2228-35.
16Jemal A,Center MM,Desantis C,etal.Global patterns of cancer incidence and mortality rates and trends〔J〕.Cancer Epidemiol Biomarkers Prev,2010;19(8):1893-907.
17Kamangar F,Dores GM,Anderson WF.Patterns of cancer incidence,mortality,and prevalence across five continents:defining priorities to reduce cancer disparities in different geographic regions of the world〔J〕.J Clin Oncol,2006;24(14):2137-50.
18Deng N,Goh LK,Wang H,etal.A comprehensive survey of genomic alterations in gastric cancer reveals systematic patterns of molecular exclusivity and co-occurrence among distinct therapeutic targets〔J〕.Gut,2012;61(5):673-84.
19Ling ZQ,Guo W,Lu XX,etal.A Golgi-specific protein PAQR3 is closely associated with the progression,metastasis and prognosis of human gastric cancers〔J〕.Ann Oncol,2014;25(7):1363-72.
20Qiao S,Guo W,Liao L,etal.DDB2 is involved in ubiquitination and degradation of PAQR3 and regulates tumorigenesis of gastric cancer cells〔J〕.Biochem J,2015;469(3):469-80.
21Wu HG,Zhang WJ,Ding Q,etal.Identification of PAQR3 as a new candidate tumor suppressor in hepatocellular carcinoma〔J〕.Oncol Rep,2014;32(6):2687-95.
22姜晓萌.RKTG&PAQR11基因在肿瘤中的功能研究〔D〕.上海:中国科学院上海生命科学研究院,2011.
23Xiu Y,Liu Z,Xia S,etal.MicroRNA-137 upregulation increases bladder cancer cell proliferation and invasion by targeting PAQR3〔J〕.PLoS One,2014;9(10):e109734.
24Wu Q,Zhuang K,Li H.PAQR3 plays a suppressive role in laryngeal squamous cell carcinoma〔J〕.Tumour Biol,2016;37(1):561-5.
25Li Z,Ling ZQ,Guo W,etal.PAQR3 expression is downregulated in human breast cancers and correlated with HER2 expression〔J〕.Oncotarget,2015;6(14):12357-68.
26Ma Z,Wang Y,Piao T,etal.The tumor suppressor role of PAQR3 in osteosarcoma〔J〕.Tumour Biol,2015;36(5):3319-24.
27Kahn SE,Hull RL,Utzschneider KM.Mechanisms linking obesity to insulin resistance and type 2 diabetes〔J〕.Nature,2006;444(7121):840-6.
28王玲娣.PAQR3在肥胖和胰岛素抵抗中的功能研究〔D〕.北京:中国科学院大学,2012.
〔2016-01-27修回〕
(编辑李相军)
基金项目:国家自然科学基金资助项目(No.81360074)
通讯作者:张吉翔(1950-),男,教授,主要从事消化系统方面的研究。
〔中图分类号〕R-1
〔文献标识码〕A
〔文章编号〕1005-9202(2016)11-2784-03;
doi:10.3969/j.issn.1005-9202.2016.11.105
第一作者:吴水梅(1989-),女,硕士,主要从事消化系统方面的研究。

