戴氏绿僵菌多糖对衰老小鼠免疫功能的影响
肖代敏 张志敏 吕纯莉 曹 喻 易祯禛
(遵义医学院附属医院检验科,贵州 遵义 563099)
戴氏绿僵菌多糖对衰老小鼠免疫功能的影响
肖代敏张志敏1吕纯莉曹喻易祯禛
(遵义医学院附属医院检验科,贵州遵义563099)
〔摘要〕目的探讨戴氏绿僵菌多糖对衰老模型小鼠免疫功能的影响。方法建立D-半乳糖诱导的亚急性衰老模型小鼠,同时灌胃不同剂量的戴氏绿僵菌多糖,6 w后,观察模型小鼠体重变化,免疫器官(胸腺、脾脏)指数,腹腔巨噬细胞吞噬及血清中IgG含量等免疫功能的影响。结果戴氏绿僵菌多糖能够改善模型小鼠体重;3种不同剂量的多糖均能提高模型小鼠T淋巴细胞的增殖能力,高剂量虫草多糖能提高B淋巴细胞增殖能力;同时能够显著提高小鼠脾脏、胸腺指数及腹腔巨噬细胞吞噬能力及显著提高血清中IgG的含量。结论戴氏绿僵菌多糖可增强亚急性衰老模型小鼠的细胞和体液免疫功能。
〔关键词〕戴氏绿僵菌;多糖 D-半乳糖;衰老;免疫功能
虫草(Cordyceps)是一种特殊类型的药用真菌,属真菌门(Eulnycota),子囊菌亚门(Aseomyeotina),在生物医药领域具有重要应用价值的真菌资源。我国虫草资源分布是世界上最多最广的国家。研究表明,虫草及其发酵菌丝体具有抗肿瘤、抗氧化、抗突变、降血糖、镇静镇痛等广泛的药理作用〔1~3〕,其中多糖是目前最具开发利用的活性成分之一。戴氏虫草及其无性型-戴氏绿僵菌是由我国学者梁宗琦等在贵州省首次发现〔4〕。前期研究表明具有抗肿瘤、抗氧化及抗突变活性,作为新种的戴氏绿僵菌,其胞内多糖的免疫调节活性研究还鲜见报道。衰老是由多方面因素造成的,本实验以小剂量连续多次注射D-半乳糖诱导亚急性衰老模型〔5〕,并从衰老发生的免疫学角度探讨戴氏绿僵菌多糖的抗衰老的免疫学活性。
1材料与方法
1.1药品及器材虫草多糖由本实验室提取、分离,并经紫外、红外光谱、葡聚糖凝胶柱和GC-MS联用仪分析鉴定〔6〕。全自动生化分析仪(日本,Olympus,AU2700);CO2培养箱、全自动酶标仪、MTS细胞繁殖定量检测试剂盒(上海杰美基因医药科技有限公司 GMS10043);EZ-SepTMMouse 1X 淋巴细胞分离液(深圳,达科为生物技术有限公司);刀豆蛋白(美国Sigma公司),脂多糖(LPS,美国Sigma公司),胎牛血清(杭州四季清生物公司);5%鸡红细胞混悬液(自制)。
1.2样品配制D-半乳糖:0.9%NS 200 ml、D半乳糖0.96 g、配制成4.8 mg/ml溶液。多糖溶液:按400 mg·kg·d剂量,灌胃0.5 ml/只计算(高剂量)。按200 mg·kg·d剂量,灌胃0.5 ml/只计算(中剂量)。按100 mg·kg·d剂量,灌胃0.5 ml/只计算(低剂量)。3种浓度的多糖液用生理盐水配制,1次/w,4℃保存。
1.3实验动物SPF级昆明种小鼠,4~6周龄,18~22 g,雄性。由第三军医大学大平医院动物中心提供。许可证号:scxk(渝)20070003。
1.4实验方法
1.4.1动物分组及建模将小鼠随机分为五组:空白组、模型组、多糖高剂量组、多糖中剂量组、多糖低剂量组,每组10只,适应性喂养1 w,除空白组外,其他每组每日颈部皮下注射D-半乳糖溶液120 mg·kg-1·d-1,空白组注射同剂量的生理盐水,为期6 w,从注射第2周开始,多糖3个剂量组每日灌胃相应剂量的多糖液进行干预,连续4 w。测定各生化指标和计算脾脏、胸腺指数。并于开始灌胃前及灌胃后每隔3 d称量1次各组小鼠体重。
1.4.2小鼠腹腔巨噬细胞吞噬鸡红细胞能力的实验〔7〕模型建成后,小鼠处理前30 min注射5%鸡红细胞生理盐水悬液0.8 ml,0.5 h后,用乙醚将老鼠麻醉至昏迷,摘除眼球取血于2 ml的EP管中,备用。颈椎脱臼处死,经腹腔注射生理盐水2 ml,吸出腹腔洗液0.5~1 ml,滴于载玻片上,于37℃孵化箱中温孵30 min,然后用生理盐水漂洗、晾干,用甲醛溶液固定,瑞氏染液染色5 min,用蒸馏水漂洗、晾干,在显微镜下镜检,计数。记录100个巨噬细胞中吞噬了鸡红细胞的数量和吞有鸡红细胞的巨噬细胞数目,并按下式求出巨噬细胞吞噬率及吞噬指数:吞噬百分率(%)= 吞噬鸡红细胞的巨噬细胞数/计数的巨噬细胞数× 100%。
1.4.3小鼠脾脏、胸腺的称量方法小鼠末次给药24 h后,将小鼠颈椎脱臼处死,解剖小鼠,取其脾脏、胸腺,吸干表面血污,精密称量,将称量所得的质量换算成各脏器对应的指数,脾脏(胸腺)指数=脾脏(胸腺)重量(mg)/体重(g)。
1.4.4小鼠淋巴细胞增殖实验断颈处死小鼠,浸入75%的乙醇中浸泡5~10 min。在超净台中无菌取出小鼠脾脏。放入装有5 ml EZ-SepTMMouse 1×淋巴细胞分离液的一次性平皿中。用镊子固定尼龙网,然后用注射器活塞轻轻研磨小鼠脾脏,使得分散的单细胞透过尼龙网(200目)进入淋巴细胞分离液中。把悬有脾脏细胞的分离液立即转移到离心管中,离心前再覆盖上大约 200 μl的1640培养基。2 500 r/min离心30 min。吸出淋巴细胞层(培养基层下,分离液上),用10 mlPBS洗涤2 500 r/min离心10 min。倾倒上清液,加入1 ml完全1640悬液,计数调节制成1.0×107/ml的脾细胞悬液,细胞培养采用96孔培养板,每孔加入脾细胞悬液100 μl,平行3个复孔,然后加入使得孔最终浓度为5 μlg/ml的LPS和刀豆蛋白液10 μl,同时做不加刀豆蛋白和LPS的阴性对照孔(用10 μl 1640代替),空白对照只加完全1640,37℃,5%CO2培养箱中培养48 h,于培养结束前4 h加入MTS,每孔10 μl(按MTS使用说明书进行),在490 nm处测OD值。
1.4.5血清IgG的测定小鼠眼眶取血,离心取血清,用全自动生化分析仪对血清IgG含量进行测定。
1.5统计学方法组间比较行t检验。
2结果
2.1衰老模型小鼠体重变化在灌胃的前3 d,体重均有下降趋势,尤其以高剂量组较为明显,其原因可能是开始灌胃后,各组小鼠适应性问题导致食欲减退,体重下降。之后各组小鼠体重均逐渐增加,但模型组小鼠体重增加的程度明显低于其他各组。体重增长最快的是高剂量组。其他各组与空白组基本一致。见图1。
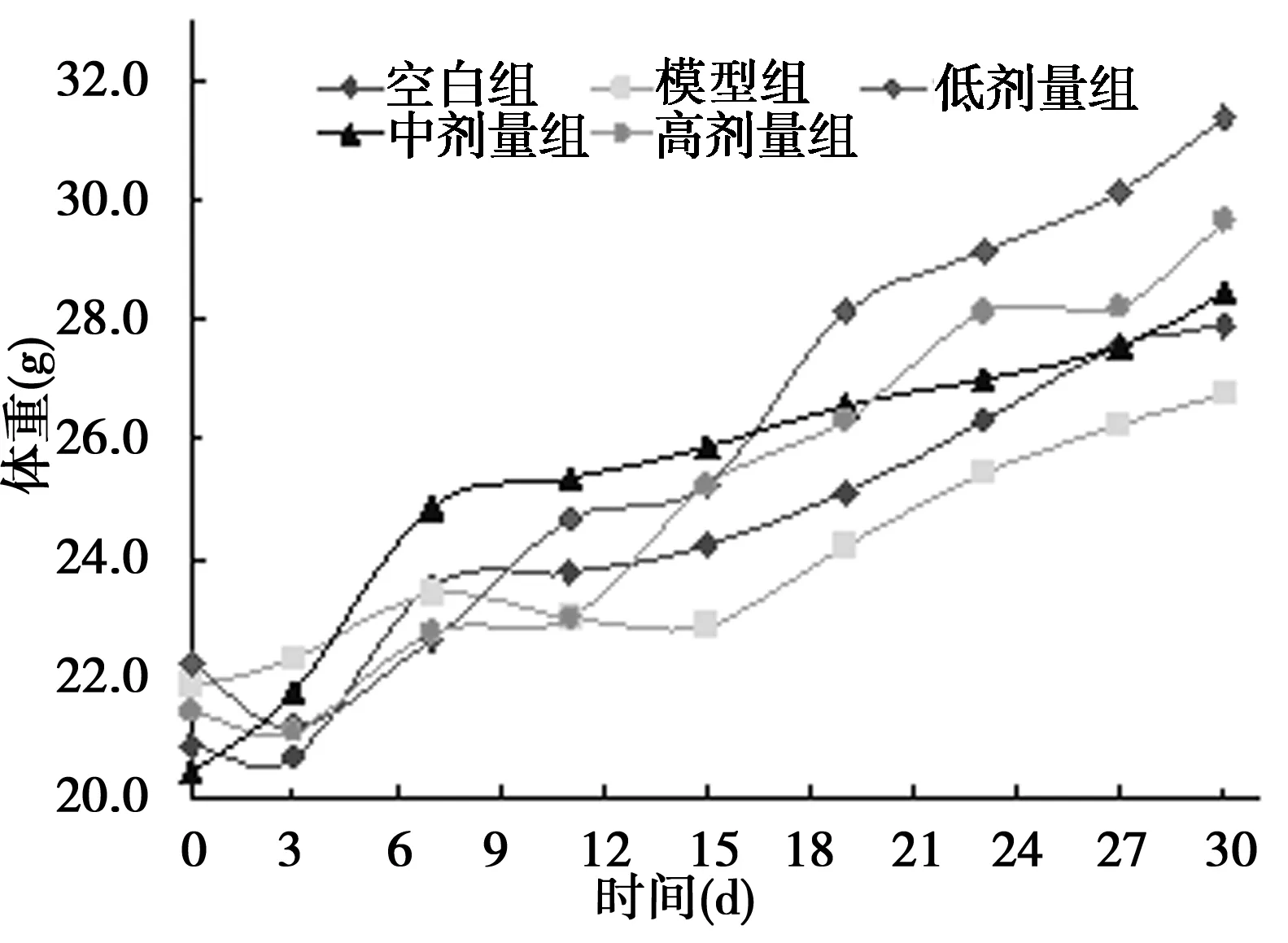
图1 衰老模型各组小鼠体重随时间变化
2.2腹腔巨噬细胞吞噬能力实验 模型组小鼠腹腔巨噬细胞吞噬鸡红细胞的能力较低,给予不同剂量的多糖后,各组小鼠腹腔巨噬细胞的吞噬百分数和吞噬指数均高于模型组,其中高剂量组与模型组比较有显著差异(P<0.05)。见表1。

表1 多糖对小鼠腹腔巨噬细胞吞噬能力的影响±s)
与模型组比较:1)P<0.05,下表同
2.3衰老模型各组脾脏和胸腺指数结果高剂量组和中剂量组脾脏指数显著高于模型组(P<0.05)。其他两组脾脏指数也较模型组高,但无统计学差异(P>0.05),其可能原因是样本例数较少或者是实验时间较短所致。除高剂量组和的中剂量组胸腺指数与模型组比较有显著差异外(P<0.05),其余两组均无显著差异(P>0.05),但胸腺指数均较模型组高。见表2。
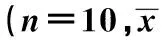
表2 衰老模型各组小鼠脾脏、胸腺指数比较±s)
2.4淋巴细胞增殖实验3种不同剂量的多糖均能提高模型小鼠T淋巴细胞的增殖能力,呈梯度增加(P<0.05,P<0.01)。而对B淋巴细胞的影响,只有高剂量组与模型组相比有显著差异(P<0.05),中剂量组和高剂量组无明显影响。见表3。
2.5血清IgG含量通过测定小鼠血清中IgG的含量,各多糖剂量组小鼠的血清IgG含量与模型组相比,其值表现出非常明显的差异,随剂量的增加含量呈梯度增加(P<0.05,P<0.01),见表3。
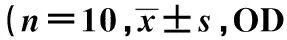
表3 多糖对小鼠脾淋巴细胞增殖及
与模型组比较:1)P<0.05,2)P<0.01
3讨论
随着年龄的增长,机体的免疫器官逐渐萎缩,免疫细胞及亚细胞因子降低,机体的免疫功能逐渐减弱,对外界病原体的抵抗能力明显减弱〔8〕。随着年龄的增长,免疫器官老化,感染性疾病、癌症等发病率、死亡率逐渐增高。免疫衰老与个体寿命之间的联系也得到了证据支持〔9〕。
D-半乳糖致衰老模型是基于衰老的代谢学说而复制的一种衰老模型,具有与自然衰老相似的自由基代谢紊乱特征,其衰老反应接近或相当于自然衰老。本实验建模成功,所测的实验数据稳定、可靠。机体中的免疫系统是由免疫器官和免疫细胞组成,免疫器官有许多,如:胸腺、脾脏、肝脏等,这些免疫器官的重量,尤其是免疫器官的重量指数可比较客观地反映机体免疫器官的发育情况,当机体的免疫功能增强时,其重量有所增加。本研究中的高剂量多糖组和中剂量多糖组的小鼠的脾脏和胸腺重量较空白组都明显增加,故戴氏绿僵菌多糖达到一定剂量就能够对糖尿病小鼠的免疫功能进行提高。
本研究结果表明戴氏绿僵菌多糖能够对亚急性衰老小鼠体重的保护及免疫器官的老化具有一定的缓解作用,且随着剂量的增加而增加,并能明显改善衰老模型小鼠T细胞和B细胞的增殖能力,增强其对外来抗原的反映性,提高模型小鼠血清中IgG含量,在一定程度上反映了机体体液免疫的调节能力。同时具有增强小鼠腹腔巨噬细胞吞噬鸡红细胞的能力,从而增强机体的细胞及体液免疫功能。但它增强衰老机体免疫功能发生的分子机制还有待于进一步研究探讨。
4参考文献
1Xiao JH,Zhong JJ.Secondary metabolites from Cordyceps species and their antitumor activity studies 〔J〕.Recent Patents Biotechnol,2007;1(2):123-7.
2Li SP,Zhang GH,Zeng Q,etal.Hypoglycemic activity of polysaccharide,with antioxidation,isolated from cultured Cordyceps mycelia 〔J〕.Phytomed,2006;13(6):428-33.
3Xiao JH,Liang ZQ,Liu AY,etal.Immunosuppressive activity of polysaccharides from Cordye- ps gunnii mycelia in mice in vivo/vitro〔J〕.J Food Agric Environ,2004;2(3&4):69-74.
4梁宗琦,刘爱英,刘杰麟.虫草一新种及其绿僵菌无性型〔J〕.真菌学报,1991;10(4):257-64.
5秦红兵,杨朝晔,范忆江,等.D-半乳糖诱导衰老小鼠模型的建立与评价〔J〕.中国组织工程研究与临床康复,2009;7(13):1275-8.
6肖代敏.戴氏绿僵菌多糖的抗氧化功能及化学组成〔D〕.遵义:遵义医学院,2010.
7付润芳,冯国清,吕文戈,等.高本底放射性饮水对小鼠免疫功能的影响〔J〕.河南预防医学杂志,1998;9(4):189-91.
8单颖,姜东,潘兴瑜,等.玉竹多糖对衰老模型鼠免疫功能的影响〔J〕.中国老年医学杂志,2007;27(1):20-2.
9Ginali L,De Martinis M,D’ Ostilio A,etal.The immune system in the elderly〔J〕.Immunol Res,1999;20(2):101-8.
〔2014-12-31修回〕
(编辑赵慧玲/曹梦园)
基金项目:贵州省科技厅基金(黔科合J字〔2009〕2148号);贵州省科技厅联合基金(黔科合J字LKZ〔2011〕35号)
通讯作者:张志敏(1979-),女,硕士,教授,主要从事分子生物学研究。
〔中图分类号〕R285.5
〔文献标识码〕A
〔文章编号〕1005-9202(2016)11-2625-03;
doi:10.3969/j.issn.1005-9202.2016.11.026
1遵义医学院细胞生物学与遗传学教研室
第一作者:肖代敏(1975-),男,硕士,副教授,主要从事药用真菌与生化药学研究。

