SIRT1抑制剂sirtinol对前列腺癌DU145细胞凋亡的影响及可能机制
张大田 石建国 张 强 刘 岩
(辽宁医学院附属第一医院泌尿外科,辽宁 锦州 121001)
SIRT1抑制剂sirtinol对前列腺癌DU145细胞凋亡的影响及可能机制
张大田石建国张强刘岩
(辽宁医学院附属第一医院泌尿外科,辽宁锦州121001)
〔摘要〕目的观察SIRT1抑制剂sirtinol对前列腺癌DU145细胞系细胞凋亡和细胞凋亡关键调控因子(Bcl-2、Bax、Cytochrome C和Caspase-3)表达变化的影响,探讨SIRT1在前列腺癌发生的可能机制。方法体外培养DU145细胞,实验分对照组(DMSO组)和sirtinol组(终浓度为10,25和50 μmol/L),Western 印迹检测DU145细胞SIRT1蛋白表达水平;流式细胞术检测细胞凋亡;Western 印迹检测DU145细胞中细胞凋亡关键调控因子Bcl-2、Bax、Cytochrome C和Caspase-3的蛋白表达。结果与对照组相比,随着sirtinol浓度的增加,SIRT1蛋白表达水平逐渐降低,细胞凋亡比例增加,诱导细胞发生凋亡。不同浓度sirtinol作用DU145细胞后Bcl-2蛋白表达减少,且随剂量增加表达越低;Bax蛋白表达增加,Bcl-2/Bax比率降低;伴随Cytochrome C的释放和Caspase-3的激活。结论下调SIRT1表达诱导前列腺癌细胞DU145细胞凋亡,其机制可能与改变细胞凋亡关键调控因子Bcl-2、Bax、Cytochrome C和Caspase-3的蛋白表达相关。
〔关键词〕SIRT1;sirtinol;前列腺癌;DU145;细胞凋亡
前列腺癌发生是一个多因素和多阶段的复杂过程,随着与前列腺癌密切相关的癌基因和抑癌基因的发现,前列腺癌的发病机制逐渐阐明〔1,2〕;前列腺在体内位置比较表浅,基因治疗药物可直接安全通过腔内注射到病灶使前列腺癌的基因治疗成为研究热点〔3〕。沉默信息调节因子1(SIRT1)是依赖烟酰胺腺嘌呤二核苷酸(NAD+)的组蛋白去乙酰化酶〔4〕,它通过去乙酰化修饰组蛋白和众多的非组蛋白(STAT3、p53、FOXO家族等)维持染色质的沉默和基因组稳定并参与调控细胞的能量代谢、凋亡、衰老、肿瘤和神经退行性病变等体内多种生物学过程〔5~7〕。SIRT1在不同的肿瘤类型中表达相差甚远,SIRT1在人前列腺癌、结肠癌、急性髓细胞白血病等肿瘤中高表达,而在膀胱癌、恶性胶质瘤和卵巢癌中的表达明显受抑制〔8,9〕。前列腺癌中SIRT1的作用在国内外的报道也不尽相同〔2,3〕,因此本研究使用不同浓度的SIRT1抑制剂sirtinol作用前列腺癌细胞DU145,探讨下调SIRT1表达对人前列腺癌细胞系凋亡的影响。
1材料与方法
1.1主要试剂与仪器sirtinol〔S8825,≥98% (HPLC),Sigma公司〕;DMEM培养液(Corning公司);Annexin V-FITC/PI双染法细胞凋亡检测试剂盒(Mbchem公司);SIRT1和Bcl-2(鼠单克隆抗体,Merck Millipore公司)、Bax、Caspase-3(兔单克隆抗体,CST公司)、Cytochrome C(兔单克隆抗体,Abcam公司)、β-actin抗体(兔多克隆抗体,Santacruz公司);HRP标记的山羊抗兔,抗鼠IgG(北京中杉金桥生物技术有限公司);ECL化学发光试剂盒(Piece Biotechnology公司);Western细胞裂解液、BCA蛋白浓度测定试剂盒(北京碧云天生物技术公司);BB16UV CO2培养箱(Heraeus);水浴式电转印槽DYY-Ⅲ 40B型(北京六一仪器厂);电泳仪(Bio-Rad,美国);流式细胞仪(美国贝克曼库尔特有限公司)。
1.2 细胞培养及实验分组人前列腺癌细胞DU145购自上海生命科学院细胞和生物化学研究所,培养于含10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的DMEM培养基中,饱和湿度、37℃和5%CO2孵箱中培养,当细胞汇合至培养瓶底面积80%左右时0.25%胰蛋白酶消化传代。当细胞处于对数生长期时,以1×105/ml浓度接种于25 cm2的培养瓶中或96孔培养板中。待细胞贴壁后给药,sirtinol组终浓度分别为10、25和50 μmol/L,对照组加入5 μl DMSO〔DMSO浓度小于0.1%(V/V),此浓度对细胞生长无影响〕。
1.3倒置显微镜观察细胞形态不同浓度sirtinol作用DU145细胞24 h或48 h后取出培养瓶,于倒置显微镜下观察各组细胞形态特征。
1.4流式细胞术检测细胞凋亡DU145细胞接种于细胞培养瓶中,待细胞贴壁后加入不同浓度的sirtinol干预SIRT1的活性,上述细胞在10%胎牛血清的DMEM培养液继续培养48 h,换用无血清培养基继续培养24 h。胰酶-EDTA消化,离心各种处理的细胞,无菌PBS液洗涤2次;加入FITC-annexin和100 μg/ml PI染液重悬细胞至单细胞悬液,室温孵育 15 min,各组细胞行流式细胞术检测,CellQuest 分析软件分析各组细胞早期凋亡和晚期凋亡的比例。
1.5Western 印迹检测Bcl-2、Bax、Cytochrome C和Caspase-3蛋白表达蛋白裂解液提取各实验组细胞总蛋白, BCA法测定蛋白浓度,-20℃或-80℃保存备用。电泳前,加入5×SDS样品缓冲液,100℃煮沸5 min,离心后上样,10%SDS-PAGE电泳分离后将蛋白转至硝酸纤维素膜上,含5%BSA的TBST(pH7.4)室温摇动2 h封闭滤膜,取出后的滤膜分别与SIRT1,Bcl-2、Bax、Cytochrome C、Caspase-3及β-actin(稀释比为1∶1 000) 4℃温育过夜。TBST洗涤3次,HRP耦联的IgG作为二抗(稀释比为1∶5 000)室温温育2 h,洗膜后, ECL发光显色。
1.6统计学方法应用Graphpad prism 5软件,行方差分析。
2结果
2.1sirtinol对DU145细胞形态特征的影响对照组的细胞贴壁生长,长梭形,大小较均一,细胞呈半透明状,生长速度较快;经sirtinol作用后,细胞皱缩,细胞内有空泡形成,大小不一,折光性变差,悬浮细胞及细胞碎片增加。
2.2SIRT1蛋白表达水平的检测与对照组相比,随着sirtinol浓度的增加,SIRT1蛋白表达水平逐渐降低(图1)。
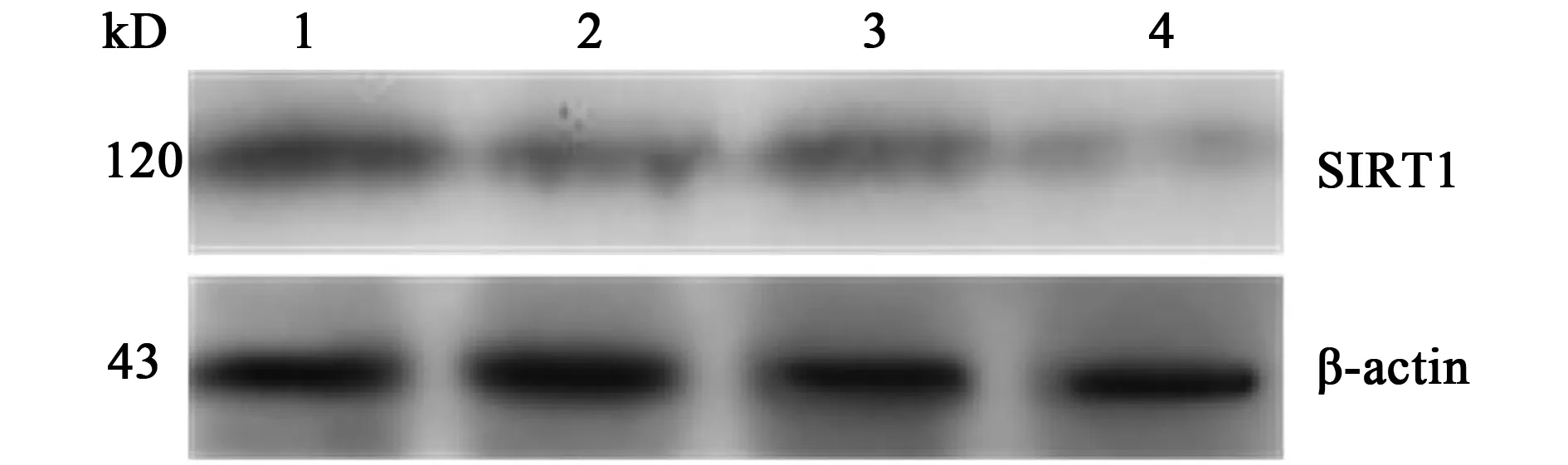
1~4:0、10、25、50 μmol/L sirtinol图1 不同浓度sirtinol处理 DU145细胞后SIRT1蛋白表达水平
2.3sirtinol对DU145细胞凋亡影响对照组有大量活细胞,不同浓度sirtinol作用DU145细胞后,随着药物浓度的升高,凋亡细胞所占比例逐渐增加(P<0.01),但sirtinol浓度增加到50 μmol/L时,坏死细胞也明显增加。10~25 μmol/L sirtinol处理后大量活细胞出现不同程度的凋亡,但死亡细胞的数量变化不大。而细胞经50 μmol/L sirtinol作用后,坏死细胞增加明显。见表1。
表1 不同浓度sirtinol处理 DU145细胞后
与0 μmol/L sirtinol组比较:1)P<0.01
2.4细胞凋亡相关蛋白Bcl-2、Bax、Cytochrome C和Caspase-3蛋白表达水平与对照组比较,各sirtinol浓度组DU145细胞Bcl-2蛋白表达减少,且随剂量增加表达减少;Bax蛋白表达增加,Bcl-2/Bax比率降低;伴随大量Cytochrome C的释放和Caspase-3的激活(图2)。
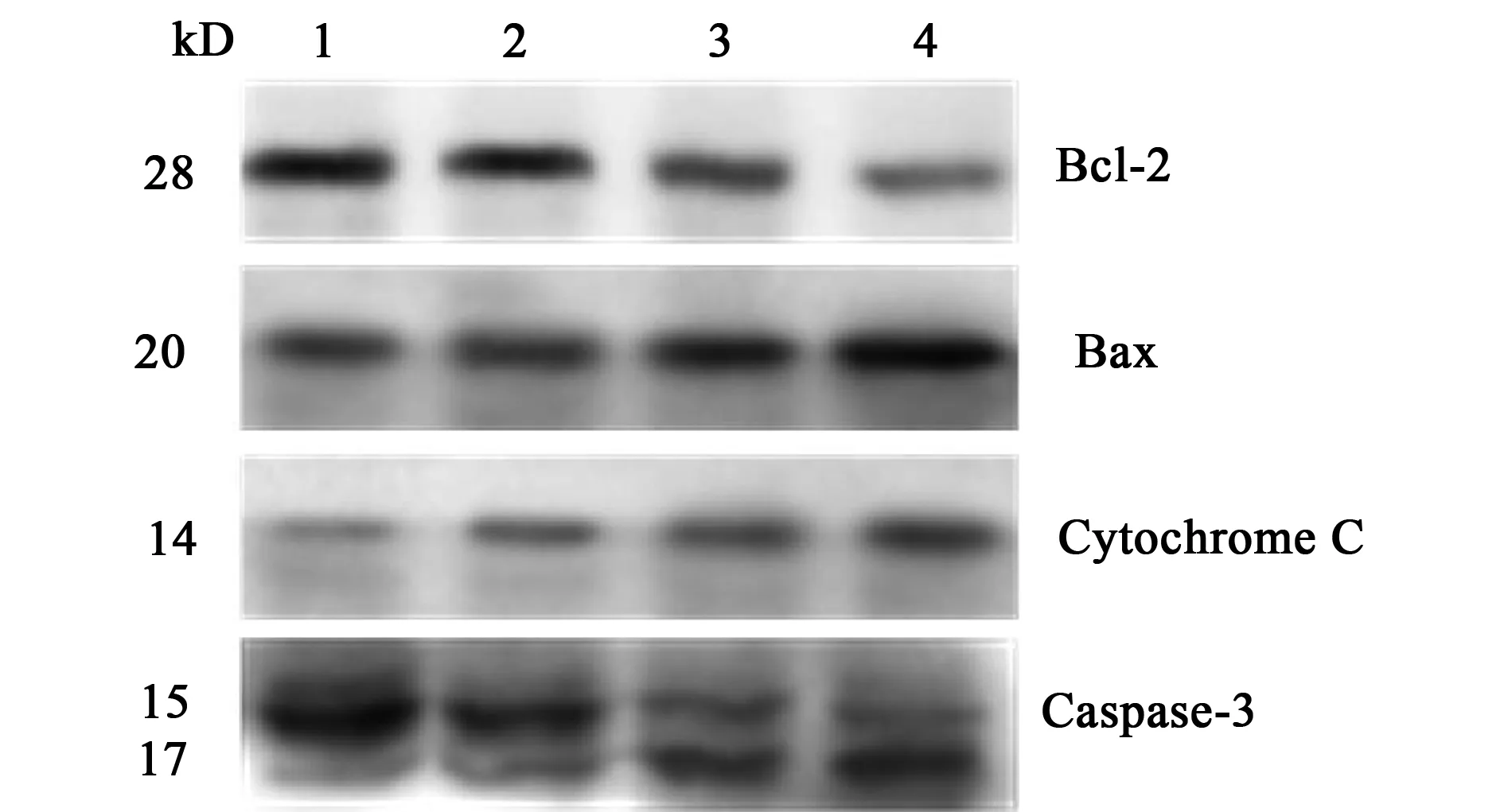
1~4:0、10、25、50 μmol/L sirtinol图2 不同浓度sirtinol作用DU145细胞后Bcl-2、Bax、Cytochrome C和Caspase-3的蛋白表达
3讨论
本研究结果说明sirtinol可以改变内源性SIRT1表达,表明SIRT1与DU145细胞增殖密切相关。
细胞凋亡也称细胞程序性死亡,是各种因素触发细胞死亡程序而引起的细胞主动性死亡。细胞凋亡在胚胎发育、器官生成、肿瘤发生、自身免疫性疾病等多种病理生理过程中发挥重要作用。本文结果表明,活细胞仅有很低的荧光强度(PI/AV),早期凋亡细胞开始出现绿色荧光(PI/AV+),晚期凋亡细胞出现极强的绿色荧光(PI+/AV+),坏死细胞有绿色和红色荧光双重染色(PI+/AV)。和对照组相比,sirtinol处理后增加细胞凋亡比例,诱导细胞发生凋亡。线粒体凋亡途径是哺乳动物细胞中重要的细胞凋亡信号〔10〕。Bcl-2家族参与线粒体凋亡途径的起始引发,其中Bcl-2,Bcl-XL和Mcl-1是主要的抗凋亡因子,且均能抑制Cytochrome C的释放,使其无法激活下游Caspase,保护细胞不发生凋亡。而Bcl-2家族中的Bax,Bak,Bik和 Bid是促凋亡蛋白,引起Cytochrome C的释放,诱发细胞凋亡〔11〕。本文结果表明Bcl-2 家族中凋亡蛋白和抗凋亡蛋白的比率变化是sirtinol作用DU145细胞后引发的凋亡。同时也发现sirtinol作用DU145细胞后有大量Cytochrome C的释放和caspase-3的激活,这与Lee等〔12〕人的报道相一致。以上结果表明,sirtinol引起的DU145细胞凋亡可能是通过线粒体信号转导通路介导的。
综上,本研究证实下调内源性SIRT1的表达促进细胞凋亡,其机制可能与改变细胞凋亡关键调节蛋白Bcl-2、Bax、Cytochrome C和Caspase-3的表达相关,提示SIRT1在前列腺癌的发生中可能扮演癌基因的角色。
4参考文献
1赵琛,李冬严,张振文.多项肿瘤标志物检测在前列腺肿瘤鉴别诊断中的意义〔J〕.中国老年学杂志,2012;32(24):6137-8.
2Kojima K,Ohhashi R,Fujita Y,etal. A role for SIRT1 in cell growth and chemoresistance in prostate cancer PC3 and DU145 cells〔J〕. Biochem Biophys Res Commun,2008;373(3):423-8.
3Baptista T,Graca I,Sousa EJ,etal. Regulation of histone H2A.Z expression is mediated by sirtuin 1 in prostate cancer〔J〕.Oncotarget,2013;4(10):1673-85.
4Lin Z,Fang D. The roles of SIRT1 in cancer〔J〕. Genes Cancer,2013;4(3-4):97-104.
5Brooks CL,Gu W. How does SIRT1 affect metabolism,senescence and cancer 〔J〕?Nat Rev Cancer,2009; 9(2):123-8.
6Finkel T,Deng CX,Mostoslavsky R.Recent progress in the biology and physiology of sirtuins〔J〕.Nature,2009; 460(7255):587-91.
7Bernier M,Paul RK,Martin-Montalvo A,etal. Negative regulation of STAT3 protein-mediated cellular respiration by SIRT1 protein〔J〕. J Biol Chem,2011; 286(22):19270-9.
8Deng CX.SIRT1,is it a tumor promoter or tumor suppressor 〔J〕? Int J Biol Sci,2009; 5(2):147-52
9Liu T,Liu PY,Marshall GM. The critical role of the class Ⅲ histone deacetylase SIRT1 in cancer〔J〕. Cancer Res,2009;69(5):1702-5.
10Waxman DJ,Schwartz PS. Harnessing apoptosis for improved anticancer gene therapy〔J〕. Cancer Res,2003;63(24):8563-72.
11Kim H,Rafiuddin-Shah M,Tu HC,etal. Hierarchical regulation of mitochondrion-dependent apoptosis by BCL-2 subfamilies〔J〕. Nat Cell Biol,2006;8(12):1348-58.
12Lee HJ,Auh QS,Lee YM,etal. Growth inhibition and apoptosis-inducing effects of cudraflavone B in human oral cancer cells via MAPK,NF-κB,and SIRT1 signaling pathway〔J〕. Planta Med,2013;79(14):1298-306.
〔2014-10-17修回〕
(编辑赵慧玲/曹梦园)
基金项目:辽宁省科技厅科学计划项目资助课题(2011225015)
通讯作者:刘岩(1976-),男,副教授,硕士,主要从事泌尿系统肿瘤生物学研究。
〔中图分类号〕R581.3
〔文献标识码〕A
〔文章编号〕1005-9202(2016)11-2599-03;
doi:10.3969/j.issn.1005-9202.2016.11.013
第一作者:张大田(1969-),男,副主任医师,硕士,主要从事泌尿肿瘤生物学研究。

